一种基于咔唑的双光子极性荧光探针及其制备方法和用途与流程
本发明涉及一种双光子荧光探针及其制备方法和用途,具体地说是一种基于咔唑的双光子极性荧光探针及其制备方法和用途。
背景技术:
极性是化学和生物学中重要的参数。在化学领域,极性是影响化学反应的关键参数。在生物学领域中,细胞的极性是细胞操作和调节机制的反馈,许多细胞活动,如脂肪形成分化,免疫反应激活,细胞迁移和死亡,以及分子跨细胞层转运,可能导致细胞极性的变异。因此,极性的异常变化与生物学障碍和疾病高度相关(例如,糖尿病,肝硬化等)。另外,细胞不同区域的极性是不相同的,各个亚细胞器中,极性也不一样。在细胞凋亡过程中,溶酶体极性可作为反应因子来观察细胞微环境变化。因此,极性敏感的荧光探针是研究体外和体内生物分子极性变化的强大化学工具。
溶酶体是大多数动/植物细胞中常见的亚细胞器,包含多种水解酶,它是一种动态细胞器,在膜融合过程中利用膜运输途径接受大分子。溶酶体中的一系列酸性水解酶可通过酶促反应降解这些大分子。它在维持细胞稳态方面发挥着重要作用,包括重新粘附受损细胞器,消化大分子,以及参与细胞内信号传导和质膜修复等。据报道,溶酶体的功能障碍与许多疾病相关,在溶酶体功能中起重要作用的膜流动性和酶促反应可以通过极性的变化来确定。
荧光探针由于具有灵敏度高、选择性好、易合成、廉价以及良好的生物应用等特点,已成为化学、环境和生命科学中重要的检测工具。迄今为止,检测溶剂以及细胞中极性的荧光探针相继被报道,然而大多数的探针是基于单光子激发的,单光子荧光探针一般具有自荧光干扰大,短波长激发对细胞的光毒性大,容易发生荧光自淬灭等缺点。与单光子荧光探针相比,双光子荧光探针具有很多明显的优点,如:细胞光毒性小,光稳定性强,时间空间分辨率高和组织渗透深度大。因而双光子荧光探针已经作为科研工作者研究的一个重要课题。
咔唑作为一种经典的荧光团,不仅具有大的共轭体系和共平面结构,而且具有良好的光稳定性和低毒性。到目前为止,以咔唑为荧光团的双光子极性荧光探针用于细胞凋亡过程中溶酶体极性监测的文献报道非常少见。
技术实现要素:
本发明旨在提供一种基于咔唑的双光子极性荧光探针及其制备方法和用途,所要解决的技术问题是通过分子设计得到一种合适的荧光探针结构,使其具有较大的共轭体系和共平面结构,双光子吸收性能优异,高选择性和透膜性,低细胞毒性,高光稳定性和生物相容性等优点,以实现定量检测溶液的极性变化和双光子共聚焦成像检测细胞凋亡过程中溶酶体的极性变化。
本发明基于咔唑的双光子极性荧光探针,简记为pct,以咔唑为母体,其结构式如下:
本发明基于咔唑的双光子极性荧光探针的制备方法,包括如下步骤:
步骤1:化合物1的合成
在500ml圆底烧瓶内,将koh(260mmol,14.63g)溶解在适量丙酮(200ml)中,室温下搅拌30分钟,再加入丙酮溶解的3-溴咔唑(52mmol,2.80g),室温下搅拌4个小时,最后缓慢加入丙酮溶解的溴乙烷(78mmol,6ml),室温下搅拌过夜;反应结束后过滤掉koh固体,旋转蒸发仪旋干,焦油状液体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:二氯甲烷(pe:dcm,v/v,50:1)为淋洗剂,提纯得到化合物1,白色絮状固体,产物:11.12g,产率为:78%。
步骤2:化合物2的合成
用ch2cl2溶解化合物1(33mmol,9.05g)于500ml圆底烧瓶中,在搅拌的状态下,急速地加入alcl3(72.2mmol,9.63g),然后冷却到0℃,再滴加ch2cl2溶解的乙酸酐(36mmol,3.68g),大约十分钟,加大搅拌力度,撤去冰盐浴装置,室温下反应过夜;反应结束后,用大量的h2o和hcl加入混合溶液中二氯甲烷萃取两次以上,再用1mol/lnahco3水溶液水洗,接着用水和二氯甲烷萃取两次,有机相用无水mgso4干燥再过滤,有机溶剂通过旋转蒸发仪除去,剩余的固体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:乙酸乙酯(pe:ea,v/v,20:1)为淋洗剂,提纯得到化合物2,白色固体粉末4.38g,产率为:42%。
步骤3:化合物3的合成
称取化合物2(10mmol,3.162g)和叔丁醇钾(10mmol,1.12g)于250ml圆底烧瓶中,加入适量的四氢呋喃(100ml)溶解,常温下搅拌均匀后,用恒压滴液漏斗缓慢滴加四氢呋喃溶解的二苯氨基-4-苯甲醛(12mmol,3.28g),滴加完后,温度设定为50℃,反应过夜;反应结束后,用旋转蒸发仪除去四氢呋喃,剩余的混合物再用二氯甲烷和水萃取三次除去无机盐,收集有机相,有机相用无水mgso4干燥再过滤,有机溶剂通过旋转蒸发仪除去,剩余的固体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:乙酸乙酯(pe:ea,v/v,15:1)为淋洗剂,提纯得到化合物3,淡黄色固体粉末4.34g,产率为:76%。
步骤4:目标产物pct的合成
称取干燥的化合物3(2.9mmol,1.65g),三(邻甲基苯基)膦(0.87mmol,0.264g),醋酸钯(0.29mmol,0.06g)于100ml施兰克瓶中,玻璃塞密封后,使用双排管充放氩气三次,除去瓶中的空气和少量的水,在充氩气的状态中,再用玻璃注射器注入适量的n,n-二甲基甲酰胺(dmf)以及dmf溶解的四乙烯基吡啶(5.78mmol,0.61g),室温下搅拌30分钟,最后注入三乙胺(5.8ml),在温度为110℃下,反应两天;反应结束后,使用减压蒸馏装置除去高沸点的dmf及少量的三乙胺,再萃取除去无机盐,收集有机相,有机相用无水mgso4干燥再过滤,有机溶剂通过旋转蒸发仪除去,剩余的固体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:乙酸乙酯(pe:ea,v/v,2:1)为淋洗剂,提纯得到化合物pct,亮黄色固体粉末0.67g,产率为:39%。
本发明双光子荧光探针pct的合成过程如下:
本发明基于咔唑的双光子极性荧光探针的用途,是在检测细胞凋亡过程中极性变化时作为检测试剂使用,检测方法如下:
将本发明的双光子荧光探针溶dmso中配制2mm的母液,各取15μl母液于3ml不同极性的溶剂中,检测到其紫外吸收峰在410nm附近。在410nm波长激发下,其荧光强度随着测试体系极性的增大逐渐减弱,变化明显,且荧光发射峰随之红移大约了60nm。荧光寿命数据显示随着极性增大,寿命时间减小。为了进一步验证本发明双光子荧光探针的极性响应特性,在410nm波长激发下,测试了探针在不同体积比的水/四氢呋喃和甲醇/四氢呋喃混合溶剂体系中的紫外吸收和荧光发射光谱、量子产率和荧光寿命等光物理性质,发现探针对极性变化有良好的响应,且量子产率和荧光寿命与极性大小之间具有一定的线性关系。此外,利用本探针分子测试了茶多酚诱导hela细胞凋亡过程的极性变化,发现随着细胞的凋亡,溶酶体的极性增大。
本发明双光子荧光探针分子在各种极性溶剂中,表现出不同的荧光强度和荧光发射峰位置,具有良好的“溶致变色效应”。通过调节水/四氢呋喃和甲醇/四氢呋喃混合溶剂体系的体积比改变极性,测试本荧光探针分子在不同混合溶剂体系中的紫外吸收和荧光发射光谱、荧光量子产率和荧光寿命等光物理性质。结果表明,探针的荧光量子产率和荧光寿命对极性响应具有良好的线性关系。此外,该荧光探针分子具有优秀的双光子吸收性能。细胞毒性测试表明该探针对于hela细胞几乎没有毒副作用,双光子共聚焦成像实验表明该探针具有很好的溶酶体定位能力和细胞渗透性,光稳定性好,适用于细胞溶酶体极性变化的长时间实时双光子荧光成像和可视化研究。
本发明的双光子荧光探针结构简单,易于合成。该分子的基本骨架是咔唑,在咔唑母体上3位引入四乙烯吡啶基和6位引入4-二苯氨基苯丙烯酮基,形成强的ict体系,致使该分子对极性有响应,由于3位的碱性吡啶取代基,使分子具有好的溶酶体定位能力。
附图说明
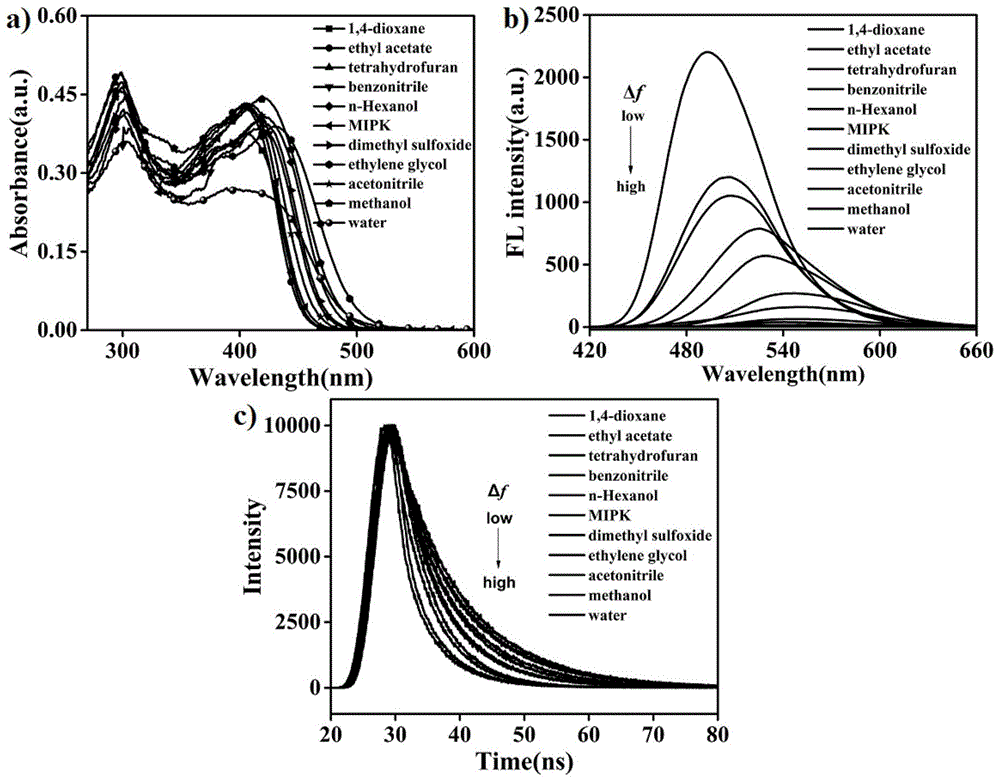
图1是10μm探针在不同极性有机溶剂中的(a)紫外吸收光谱图;(b)荧光发射光谱图;(c)荧光寿命图。
图2是10μm探针在不同体积比水/四氢呋喃混合溶剂中的(a)紫外吸收光谱图;(b)荧光发射光谱图;(c)溶剂极性和荧光强度线性关系图;(d)溶剂极性和荧光量子产率线性关系图。
图3是10μm探针在不同体积比水/四氢呋喃混合溶剂中的(a)荧光寿命图;(b)溶剂极性和荧光寿命线性关系图。
图4是10μm探针在不同体积比甲醇/四氢呋喃混合溶剂中的(a)紫外吸收光谱图;(b)荧光发射光谱图;(c)溶剂极性和荧光强度线性关系图。
图5是10μm探针在纯水和水/四氢呋喃(v/v,1:1)的ph稳定性图。
图6是0.1mm探针在不同体积比水/四氢呋喃混合溶剂中的(a)有效双光子吸收截面图;(b)相对双光子荧光强度(iout)与输入功率(iin)的对数关系图。
图7是在不同浓度(0μm、10μm、20μm、30μm)的探针分子的作用下的hela细胞存活率图。
图8是10μm探针和5μmlysotrackerred同时共染hela细胞溶酶体定位验证共聚焦荧光成像图。
图9是10μm探针在1μm茶多酚诱导的hela细胞凋亡共聚焦荧光成像随时间变化图。
具体实施方式
下面通过实施例对本发明做进一步说明。
实施例1:化合物1的合成
在500ml圆底烧瓶内,将koh(260mmol,14.63g)溶解在适量丙酮(200ml)中,室温下搅拌30分钟,再用丙酮溶解的3-溴咔唑(52mmol,2.80g)加入到上述溶液,室温下搅拌4个小时,最后将丙酮溶解的溴乙烷(78mmol,6ml)缓慢加入,室温下搅拌过夜,反应结束后过滤掉koh固体,旋转蒸发仪旋干,焦油状液体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:二氯甲烷(pe:dcm,v/v,50:1)为淋洗剂,提纯得到化合物1,白色絮状固体,产物:11.12g,产率为:78%。1hnmr(400mhz,dmso-d6,ppm)δ8.40(d,j=1.5hz,1h),8.21(d,j=7.7hz,1h),7.65–7.54(m,3h),7.49(ddd,j=8.3,7.2,1.2hz,1h),7.25–7.18(m,1h),4.44(q,j=7.1hz,2h),1.30(t,j=7.1hz,3h).13cnmr(151mhz,dmso-d6,ppm)δ140.34,138.69,128.42,126.99,124.56,123.38,121.63,121.38,119.60,111.61,111.26,109.85,37.56,14.10.
实施例2:化合物2的合成
用ch2cl2溶解化合物1(33mmol,9.05g)于500ml圆底烧瓶中,在搅拌的状态下,急速地加入alcl3(72.2mmol,9.63g),然后冷却到0℃,再用ch2cl2溶解的乙酸酐(36mmol,3.68g)逐滴地加入到上述溶液中,大约十分钟,加大搅拌力度,撤去冰盐浴装置,室温下反应过夜,反应结束后,用大量的h2o和hcl加入混合溶液中二氯甲烷萃取两次以上,再用1mol/lnahco3水溶液水洗,接着用水和二氯甲烷萃取两次。有机相用无水mgso4干燥再过滤,有机溶剂通过旋转蒸发仪除去,剩余的固体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:乙酸乙酯(pe:ea,v/v,20:1)为淋洗剂,提纯得到化合物2,白色固体粉末4.38g,产率为:42%。1hnmr(400mhz,cdcl3)δ8.69(d,j=1.4hz,1h),8.28(d,j=1.8hz,1h),8.16(dd,j=8.7,1.7hz,1h),7.60(dd,j=8.6,1.9hz,1h),7.43(d,j=8.7hz,1h),7.33(d,j=8.6hz,1h),4.38(q,j=7.3hz,2h),2.72(s,3h),1.45(t,j=7.3hz,3h).13cnmr(151mhz,dmso-d6,ppm)δ197.45,142.94,139.52,129.27,129.24,126.96,125.01,123.97,123.48,121.36,112.45,112.26,109.77,37.94,27.12,14.16.
实施例3:化合物3的合成
称取化合物2(10mmol,3.162g)和叔丁醇钾(10mmol,1.12g)于250ml圆底烧瓶中,加入适量的四氢呋喃(100ml)溶解,常温下搅拌均匀后,用恒压滴液漏斗缓慢滴加四氢呋喃溶解的二苯氨基-4-苯甲醛(12mmol,3.28g),滴加完后,温度设定为50℃,反应过夜,反应结束后,用旋转蒸发仪除去四氢呋喃,剩余的混合物再用二氯甲烷和水萃取三次除去无机盐,收集有机相,有机相用无水mgso4干燥再过滤,有机溶剂通过旋转蒸发仪除去,剩余的固体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:乙酸乙酯(pe:ea,v/v,15:1)为淋洗剂,提纯得到化合物3,淡黄色固体粉末4.34g,产率为:76%。1hnmr(400mhz,dmso-d6,ppm)δ9.19(d,j=1.3hz,1h),8.61(d,j=1.7hz,1h),8.26(dd,j=8.7,1.6hz,1h),8.01(d,j=15.4hz,1h),7.91–7.54(m,6h),7.46–7.32(m,4h),7.24–7.05(m,6h),6.97(d,j=8.7hz,2h),4.51(q,j=7.0hz,2h),1.34(t,j=7.1hz,3h).13cnmr(151mhz,dmso-d6,ppm)δ188.05,149.82,146.84,143.08,142.94,139.53,130.67,130.27,130.13,129.22,128.60,127.42,125.64,125.13,124.75,123.90,123.48,121.45,120.29,112.49,112.36,110.17,37.99,14.23.
实施例4:化合物pct的合成
称取干燥过的化合物3(2.9mmol,1.65g),三(邻甲基苯基)膦(0.87mmol,0.264g),醋酸钯(0.29mmol,0.06g)于100ml施耐兰瓶中,玻璃塞密封后,使用双排管充放氩气三次,除去瓶中的空气和少量的水,在充氩气的状态中,再用玻璃注射器注入适量的n,n-二甲基甲酰胺(dmf)以及dmf溶解的四乙烯基吡啶(5.78mmol,0.61g),室温下搅拌30分钟,最后注入三乙胺(5.8ml),在温度为110℃下,反应两天。反应结束后,使用减压蒸馏装置除去高沸点的dmf及少量的三乙胺,再萃取除去无机盐,收集有机相,有机相用无水mgso4干燥再过滤,有机溶剂通过旋转蒸发仪除去,剩余的固体用适量的二氯甲烷溶解,硅胶制样,柱层色谱分离,用石油醚:乙酸乙酯(pe:ea,v/v,2:1)为淋洗剂,提纯得到化合物pct,亮黄色固体粉末0.67g,产率为:39%。1hnmr(400mhz,dmso-d6,ppm)δ9.13(d,j=1.4hz,1h),8.69(d,j=1.0hz,1h),8.55(d,j=6.0hz,2h),8.28(dd,j=8.7,1.6hz,1h),8.02(d,j=15.5hz,1h),7.89–7.79(m,3h),7.79–7.67(m,4h),7.58(d,j=6.1hz,2h),7.50–7.26(m,5h),7.24–7.01(m,6h),6.97(d,j=8.7hz,2h),4.53(q,j=7.0hz,2h),1.37(t,j=7.1hz,3h).13cnmr(151mhz,dmso-d6,ppm)δ188.22,150.51,149.83,146.84,145.21,143.19,143.10,141.11,134.27,130.70,130.28,130.13,128.83,128.59,127.24,126.79,125.65,124.76,124.09,123.65,122.83,122.59,121.43,121.06,120.44,119.91,110.62,110.02,37.99,14.33.
实施例5:荧光探针分子的光谱测试
将本发明荧光探针pct溶于dmso中制得2mm的母液,配得5ml,取15μm母液于3ml样品管,配制检测液为10μm,测试其不同极性溶剂中光谱数据。在不同溶剂中,紫外光谱显示其在300nm和410nm处均有吸收峰,但吸收峰位移不明显(图1a);从荧光光谱可以看出,在410nm波长激发下,随着极性的增加荧光减弱且逐渐红移,位移了60nm(图1b);荧光寿命数据可知,随着极性的增加,荧光寿命减小(1c)。上述数据表明荧光探针分子pct对极性有响应,为了进一步证明探针pct的极性响应特性,测试了该探针分子在不同体积比水/四氢呋喃和甲醇/四氢呋喃混合溶剂中光谱数据。当水/四氢呋喃混合溶剂的含水量从10%增加到80%的过程中,极性也同时增加,其紫外光谱不变化,吸收峰在300nm和410nm处(图2a);但其荧光发射峰位置表现出缓慢的红移现象,红移了18nm,且在红移的过程中荧光强度呈一定规律性下降,具有一定的的线性关系(图2b和图2c);其荧光量子产率随着极性的增加线性减小(图2d);另外,荧光寿命随着极性的增加也逐渐减小,且呈一定的线性关系(图3a和3b)。探针分子在不同体积比甲醇/四氢呋喃混合溶剂中光谱与不同体积比水/四氢呋喃混合溶剂中光谱性质类似(图4)。为了排除ph的影响,测试其ph稳定性,在各ph值纯水中,探针pct的荧光强度都相对较稳定,在水/四氢呋喃(v/v=1:1)混合体系中,其ph值在4-9范围内,荧光强度数值变化不大(图5),此实验结果表明ph值对探针pct的影响较小,探针pct对ph的变化不敏感。
实施例6:荧光探针分子的双光子性能测试
利用双光子诱导荧光测量技术,我们测量了探针pct在不同体积比水/四氢呋喃混合体系的有效双光子吸收截面大小。当混合体系的水含量从10%有规律地增加到80%时,探针pct的最大有效双光子吸收截面值从245.4gm减小到60.2gm(图6a)。在同样的测试条件下,波长设定为820nm,改变入射激发光的能量,输入功率(iin=0.3~0.8mw)与相对荧光输出能量(iout)成对数关系,斜率为2.0014,符合双光子性质的规律(图6b)。在双光子波长的激发下,pct依然对溶剂的极性变化呈现良好的响应。
实施例7:细胞培养和细胞毒性测试
细胞培养:将hela细胞在添加90%dmem(糖分和氨基酸)和10%fcs(胎牛血清)中培养,加1%青链霉素混合液阻止细菌污染,恒温37℃含5%co2恒温箱培养。
细胞毒性:使用mtt(5-二甲基噻唑-2-基-2,5-二苯基四唑溴化物)测定pct的细胞毒性。将hela细胞传代至96孔板中,控制70%细胞密度。分别用浓度为0,5,10,20和30μm的pct在培养箱中孵育hela细胞一天,再用5mg/mlmtt处理细胞,并再孵育4小时。然后吸取培养液于dmso(150μl/孔)中,记录570nm处的吸光度。根据以下等式计算细胞活力(%):细胞活力%=od570(样品)/od570(对照)×100,可算得细胞存活率(图7)。从图7中我们可以看出,当探针浓度达到30μm时,细胞存活率仍然有约84%,说明了本发明荧光探针分子对细胞无明显毒性作用,因此可以用来检测细胞溶酶体极性。
实施例8:细胞定位测试
hela细胞由deme(invitrogen)培养液培养,成像前一天,hela细胞放于激光共聚焦皿中,再向hela细胞中加入10μmpct置于37℃、含5%co2的细胞培养箱中孵育0.5小时,用中性的pbs缓冲溶液洗涤3次后,再往培养皿中加入0.5μm商品化溶酶体染色剂lysotrackerredfm(ltr)溶液继续孵育0.5小时,用中性的pbs缓冲溶液洗涤3次后,用双光子荧光共聚焦成像,设置商品化溶酶体染色剂lysotrackerredfm(ltr)为红色通道(570±20nm,λex=480nm);探针pct为绿色通道((520±20nm,λex=820nm)。从图8可以看出,pct和lysotrackerredfm(ltr)强度的相关性分布图,重叠系数为0.87,pct绝大多数定位在溶酶体内,表明其可用于检测细胞溶酶体极性。
实施例9:细胞凋亡过程中溶酶体极性变化的长时间实时双光子荧光成像
茶多酚可诱导溶酶体凋亡使其功能紊乱。为了研究细胞凋亡过程中溶酶体极性的变化并验证pct对溶酶体极性成像的有效性,我们使用茶多酚来诱导细胞凋亡。将10μmpct加入到培养皿中置于37℃、5%co2的hela细胞培养0.5小时,用灭菌的缓冲溶液洗涤3次,再加1μm茶多酚培养,加入后立即成像,培养1个小时继续成像,pct为绿色通道((520±20nm,λex=820nm)。从图9可以看出,刚加入茶多酚荧光成像,有相对强的绿色荧光信号,随着培养时间的增加(0,20,40和60分钟),绿色荧光信号逐渐减弱,说明hela细胞凋亡过程中,溶酶体极性逐渐增大,验证了pct可以长时间的实时双光子荧光检测溶酶体极性的变化。
- 还没有人留言评论。精彩留言会获得点赞!