基于偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针及应用的制作方法
本发明涉及一种聚合物生物材料,尤其涉及基于偶氮还原酶响应的药物控释聚合物载体,并且本发明是一种在偶氮还原酶作用下既能实现药物释放又同时能实现近红外荧光探针作用的两亲性嵌段聚合物。
背景技术:
为了使材料具有更加通用的动态变化性能,在过去几十年中,智能响应型材料应运而生并呈现不断增长的趋势。响应型材料是一类在外界环境微小刺激因素作用下,自身的某些物理或化学性质会发生相应的可逆或不可逆变化的材料(参见:lu,c.andurban,m.w.stimuli-responsivepolymernano-science:shapeanisotropy,responsiveness,applications.progressinpolymerscience2018,78:24-46.)。常见的刺激因素有光、温度、ph、离子强度、氧化还原、酶、电场和磁场等,基于这些多样的响应性而设计的智能材料已广泛地应用于各个领域,尤其一些生物响应性材料已经被广泛地应用于药物可控释放,成像造影剂,基因和生物活性分子的载体等领域。
众所周知,人类结肠内有多种微生物和细菌,其中大多数是厌氧菌(人体内含量:1010-1012/每克消化道内容物),这些菌群能够分泌出大量的酶液,如β-糖苷酶、β-葡萄糖醛酸酶、硝基还原酶、硝酸还原酶和偶氮还原酶。酶在生命体中发挥着重要的作用,典型的用于药物输送响应的酶有蛋白酶、磷脂酶、氧化还原酶等。在病变细胞和组织内,许多酶的含量比正常情况下要高的多并且有非常高的活性。根据这一特征,可以利用特定位点的酶响应来实现药物的传输与可控释放。近年来,有关酶响应和控制的药物传输及释放研究引起了广大科研工作者的关注(参见:hu,q.,katti,p.s.andgu,z.enzyme-responsivenanomaterialsforcontrolleddrugdelivery.nanoscale2014,6(21):12273-12286.)。
荧光探针作为一种高效灵敏的生物光学探测器,在生物成像和生物传感应用领域显示了重要地位。而基于酶响应的荧光探针的出现又为酶的识别、细胞分类、跟踪新陈代谢历程及细胞调控/繁殖、药物传送与生物成像提供了一种有力的研究手段并具有广泛的应用前景。
现有技术公开的报道了一个偶氮还原酶响应的两亲性嵌段聚合物作为荧光探针,由于其结构限制导致胶束无法被偶氮还原酶彻底解离,药物释放率较低,并且其吸收及发射波长位于可见光区域,这大大限制了其在生物体中的应用,许多生物体及其组织在可见光的激发下自身会发射荧光,严重干扰生物样品的荧光检测和造影,使得可见光区荧光分析的灵敏度和准确性受到了很大的影响。因此需要研发更多的聚合物以解决现有聚合物荧光探针不能作为近红外荧光探针的问题,同时研发的聚合物还需要具有偶氮还原酶响应性能。
技术实现要素:
综合上述情况,本发明公开了一种偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针,该聚合物可用作药物载体,同时具有荧光探针功能,可实现监测药物在生物体内的释放过程。
本发明公开的基于偶氮还原酶响应的两亲性聚合物作为近红外荧光探针的最大吸收波长和发射波长为600~900nm,可避免背景干扰,并且能渗透到组织内部而获得较高的分析灵敏度,在生物样品分析中有明显的优越性;解决了现有技术中只有近红外荧光染料作为近红外荧光探针而没有基于偶氮苯还原酶响应的药物控释聚合物近红外荧光探针的问题;并且本发明的偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针利用近红外荧光基团与偶氮苯相连,将其作为连接亲疏水链段的桥梁,该嵌段聚合物通过自组装形成球状胶束,在偶氮还原酶以及辅酶的作用下偶氮键被还原打断,胶束解离,药物随之释放,伴随着近红外荧光的逐渐增强;大大扩展了其在生物体中的应用。
本发明采用如下技术方案:
一种偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针(peg-alab6azo-pla),所述偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针的结构通式如下:
式中,50≤m≤200,40≤n≤400。
本发明偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针的制备方法包括合成含偶氮苯及近红外荧光探针的小分子引发剂;然后反应制备两亲性聚合物,即偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针。具体包括以下步骤:
(1)将化合物a与al6azo化合物反应得到化合物b;
(2)将化合物b与丙炔化合物反应,得到alab6azo化合物;
(3)利用alab6azo化合物引发丙交酯开环聚合反应,得到alab6azo-pla;
(4)将alab6azo-pla与mpeg-n3反应,得到偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针,记为peg-alab6azo-pla。
本发明公开了聚合物胶束,所述聚合物胶束的制备方法,包括以下步骤:
(1)将化合物a与al6azo化合物反应得到化合物b;
(2)将化合物b与丙炔化合物反应,得到alab6azo化合物;
(3)利用alab6azo化合物引发丙交酯开环聚合反应,得到alab6azo-pla;
(4)将alab6azo-pla与mpeg-n3反应,得到偶氮还原酶响应的两亲性嵌段聚合物;
(5)搅拌下,将缓冲液滴加入偶氮还原酶响应的两亲性嵌段聚合物溶液中,得到混合液;滴加完成后继续搅拌,最后透析得到聚合物胶束。
本发明公开了载药聚合物胶束,所述载药聚合物胶束的制备方法,包括以下步骤:
(1)将化合物a与al6azo化合物反应得到化合物b;
(2)将化合物b与丙炔化合物反应,得到alab6azo化合物;
(3)利用alab6azo化合物引发丙交酯开环聚合反应,得到alab6azo-pla;
(4)将alab6azo-pla与mpeg-n3反应,得到偶氮还原酶响应的两亲性嵌段聚合物;
(5)搅拌下,将缓冲液滴加入含有偶氮还原酶响应的两亲性嵌段聚合物以及药物的溶液中,得到混合液;滴加完成后继续搅拌,最后透析得到载药聚合物胶束。
本发明中,所述丙炔化合物为溴丙炔;缓冲液为pbs缓冲液;药物为阿霉素;所述偶氮还原酶响应的两亲性嵌段近红外聚合物溶液中,溶剂为dmf;所述含有偶氮还原酶响应的两亲性嵌段聚合物以及药物的溶液中,溶剂为dmf;所述混合液中,水含量为80wt%。优选的,所述偶氮还原酶响应的两亲性嵌段聚合物溶液中,偶氮还原酶响应的两亲性嵌段聚合物中,亲水链段与疏水链段的分子量比为4.5~5.5∶6;所述含有偶氮还原酶响应的两亲性嵌段聚合物以及药物的溶液中,偶氮还原酶响应的两亲性嵌段聚合物中,亲水链段与疏水链段的分子量比为4.5~5.5∶6。本发明的偶氮还原酶响应的两亲性嵌段聚合物中,亲水链段为peg链段,疏水链段为pla链段。
本发明的方法,首先制备出含偶氮苯与化合物a的小分子引发剂(alab6azo),用其开环聚合la,得到疏水链段,再通过cuaac点击反应,将分子中的alab6azo基团连接到peg和pla中间,得到偶氮苯与近红外荧光探针桥连的两亲性嵌段聚合物peg398-alab6azo-pla144。将聚合物和模拟抗癌药物通过溶液自组装形成包裹药物的纳米粒子。模拟人体环境,在偶氮还原酶(dt-diaphorase,human)作用下,处于peg和pla连接处的偶氮键断开,导致组装体解离,聚合物被分离成peg链段和pla链段,pla形成聚集体,化合物a则连于peg溶于溶液得以分散而实现荧光释放。因此,加入偶氮还原酶后胶束溶液产生荧光并随着时间逐渐增强,包裹的药物也逐渐被释放。通过用荧光光谱测试在偶氮还原酶作用下荧光强度的变化可以监测药物释放过程。偶氮还原酶主要存在人体的结肠中,因此,此两亲性嵌段聚合物是一种潜在的结肠定位药物控释载体。
本发明还公开了上述偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针在制备近红外荧光探针和/或抗癌药物中的应用;或者上述偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针在制备偶氮还原酶响应的药物载体中的应用。
本发明中,步骤(1)中,化合物a与al6azo化合物的摩尔比例为1∶1;所述反应在碳酸钾、dmf存在下进行;所述反应的温度为60℃,时间为24小时;优选的,碳酸钾的用量与化合物a等当量;
步骤(2)中,化合物b与丙炔化合物的摩尔比例为1∶4;所述反应在碳酸钾、dmf存在下进行;所述反应的温度为50℃,时间为4小时;优选的,碳酸钾的用量与化合物b等当量;
步骤(3)中,开环聚合反应在氮气中、dmap存在下进行;alab6azo化合物、dmap、丙交酯的摩尔比为0.05:0.20:2.5~10,优选为0.05∶0.2∶10;开环聚合反应的温度为40oc,时间为24~48小时;
步骤(4)中,反应在甲苯、cubr和pmdeta存在下,氮气中进行;反应的温度为65℃,时间为24小时;alab6azo-pla、mpeg-n3、cubr、pmdeta的摩尔比为1.0~1.2:1.0:7.5:15。
本发明中,步骤(1)中,反应结束后,反应液经过乙酸乙酯萃取、饱和氯化铵水溶液洗,然后将有机层用无水硫酸钠干燥,柱层析提纯得到化合物b,柱层析时洗脱剂为二氯甲烷和乙酸乙酯;
步骤(2)中,反应结束后,反应液经过乙酸乙酯萃取、饱和氯化铵水溶液洗,然后将有机层用无水硫酸钠干燥,柱层析提纯得到alab6azo化合物;柱层析时洗脱剂为二氯甲烷和乙酸乙酯;
步骤(3)中,反应结束后,反应液用二氯甲烷稀释后逐滴加入到乙醚中沉淀,得到草绿色絮状产物;将草绿色絮状产物真空干燥至恒重,得到alab6azo-pla。
本发明中,化合物a的化学结构式如下:
化合物b的化学结构式如下:
al6azo化合物的化学结构式如下:
alab6azo化合物的化学结构式如下:
alab6azo-pla的化学结构式如下:
mpeg-n3的化学结构式如下:
本发明中,用对氨基苯甲醇重氮盐与苯酚在冰水中进行偶联反应得到alazo化合物;具体为将含有浓盐酸、对氨基苯甲醇、冰水的混合溶液滴加入亚硝酸钠水溶液中;然后于搅拌下滴加含有苯酚、碳酸钾的水溶液,继续搅拌;然后调节ph为4~5,得到沉淀,然后经过抽滤、清洗、烘干,为alazo化合物;优选的,对氨基苯甲醇、浓盐酸、亚硝酸钠、苯酚、碳酸钾的摩尔比为16.2∶40.8∶17∶17∶22.7。alazo化合物的化学结构式如下:
本发明中,用alazo化合物与6-溴己烷反应得到al6azo化合物;具体为将alazo化合物、6-溴己烷、碳酸钾溶于丙酮中;于65℃搅拌16小时;然后冷却至室温,反应液经过乙酸乙酯萃取、水洗,得到的有机层用无水硫酸钠干燥,再利用石油醚/乙酸乙酯过柱提纯,最后真空干燥得到橙黄色固体,为al6azo化合物。
上述反应示意如下:
本发明中,用聚乙二醇单甲醚(mpeg)将其端基修饰为叠氮基团,得到mpeg-n3;具体为,冰水浴条件下,将含有聚乙二醇单甲醚、三乙胺的二氯甲烷溶液滴加入含有对苯甲磺酰氯的二氯甲烷溶液中;然后于55℃反应24小时,得到对甲苯磺酰氯封端的peg-ots;然后将peg-ots、nan3加入dmf中,然后于85℃反应24小时,得到mpeg-n3。反应示意如下:
本发明用对氨基苯甲醇重氮盐与苯酚在冰水中进行偶联反应得到偶氮苯alazo(产率:92%),再与6-溴己烷反应得到al6azo(产率77%)。化合物a依次与al6azo和3-溴丙炔发生反应,得到末端一端带炔基,一端带苄醇的小分子化合物b(两步总产率49%)。以化合物b为引发剂,在dmap催化下,以二氯甲烷为溶剂引发丙交酯(la)开环聚合,得到alab6azo-pla。选用聚乙二醇单甲醚(mpeg)将其端基修饰为叠氮基团,得到mpeg-n3。将alab6azo-pla与mpeg-n3在cubr催化剂作用下进行cuaac反应得到两亲性嵌段聚合物peg-alab6azo-pla。
本发明的偶氮还原酶响应的两亲性嵌段近红外聚合物(peg-alab6azo-pla)的合成路线如下:
作为优选的例子,本发明选用亲疏水链段比(mpeg/pcl)约为5:6的嵌段聚合物peg398-alab6azo-pla144研究溶液自组装,过程如下:聚合物溶于无水dmf中,制成浓度为8mg/ml的溶液,并且在使用前通过0.22μm的滤膜除尘。随后,用注射泵将pbs溶液(ph7.4)缓慢滴加到上述溶液中直至水质量含量为80%,滴加期间持续稳定搅拌,滴加完毕后再搅拌6h,即得到稳定的胶束结构。用透析法(mwco3500)在pbs溶液中透析24h,将有机溶剂除去,起初每4h更换一次透析液,至少更换6次透析液,从而使胶束稳定分散在pbs缓冲溶液中。最终定容成浓度为1mg/ml的胶束溶液。
将上述胶束溶液与偶氮还原酶(dt-diaphorase,human)和辅酶(nadph)混合,在37℃恒温厌氧环境下培育24h。在偶氮还原酶作用下,偶氮键被打断,聚合物分离成peg段(溶于溶液)和pla段,导致胶束解离,荧光被激活。这一过程可通过荧光分光光度计便捷有效地检测荧光特征峰的变化来证明。同时使用透射电子显微镜(tem)观察组装体在还原前后形貌的变化,动态光散射(dls)测试组装体粒径尺寸和分布,紫外-可见光谱监测偶氮苯的吸收峰强度变化进一步证明偶氮键断裂。结果证明,空白胶束溶液与偶氮还原酶以及辅酶共存培养24h可以将聚合物中的偶氮苯基本完全还原,胶束完全裂解,荧光得到极大的增强。表明本发明聚合物是偶氮还原酶响应的近红外荧光聚合物探针。
进一步将上述两亲性嵌段聚合物和模拟药物阿霉素共同溶解在dmf中,配成一定浓度的溶液,通过上述相同的自组装方法,制备得到1mg/ml的聚合物载药胶束pbs溶液。
将上述载药胶束溶液保持避光与偶氮还原酶(dt-diaphorase,human)和辅酶(nadph)混合,在37℃恒温厌氧环境下培育。处于胶束核壳界面的偶氮键被逐渐打断,胶束逐渐解离,聚合物逐渐分离成peg段(溶于溶液)和pla段,荧光逐渐被激活。通过荧光分光光度计便捷有效地检测荧光特征峰和模拟药物dox荧光特征峰的变化有效地监测药物释放情况。同时使用透射电子显微镜(tem)观察组装体在还原过程中形貌的变化,动态光散射(dls)测试组装体粒径尺寸和分布,紫外-可见光谱监测偶氮苯的吸收峰强度变化对药物释放过程作进一步证明。
目前,基于偶氮还原酶的近红外荧光聚合物探针以及药物缓释监测体系还未见报道,本发明设计合成了一种偶氮还原酶响应的聚合物近红外荧光探针,为两亲性嵌段共聚物,由偶氮苯连接的近红外荧光探针(激发波长650nm)作为桥梁,连接亲水链段聚乙二醇(peg)和疏水链段聚丙交酯(pla)。此两亲性聚合物在pbs缓冲液溶液中(ph=7.4)能组装成纳米粒子并包裹药物。此时化合物a由于被包裹在胶束核内而导致荧光猝灭,当在胶束溶液中加入偶氮还原酶后,偶氮键(-n=n-)被还原断开,组装体发生解离,聚合物被离解成peg链和pla链,偶氮键断开后化合物a连接在peg链段上溶于水中,荧光恢复。因此,该聚合物具有偶氮还原酶检测的灵敏性和高选择性。同时,通过组装将药物包裹在胶束内,制备载药胶束。由于胶束的解离药物逐渐释放,而且在药物释放过程中荧光不断增强,因此可以通过荧光强度的变化监测药物释放过程。因此,该聚合物具有近红外检测和药物缓释监控双重功能。偶氮还原酶主要存在人体的结肠中,因此,此聚合物可用于结肠定位药物控释载体,在医学上具有实际应用前景。
本发明的基于偶氮还原酶的近红外荧光聚合物探针具有以下优点:(1)染料具有高的荧光量子产率,甚至在水中的荧光量子产率可以达到1.0;(2)荧光信号对溶剂的极性和ph不敏感;(3)具有相对较好的光热稳定性;(4)荧光光谱半峰宽较窄,作为荧光标识时有很好的灵敏度;(5)高的摩尔消光系数,通常大于80,000l·mol-1·cm-1,吸光效率比较高;(6)结构易于修饰,发射波长可调变至近红外区域。
本发明至少具有以下优点:
本发明首次公开了基于偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针。两亲性聚合物能够自组装形成胶束,含偶氮苯两亲性聚合物胶束在偶氮还原酶的作用下可发生解离导致药物释放,同时又能实现荧光从无到有的荧光响应。
到目前为止,基于偶氮苯的酶响应聚合物的近红外荧光探针还未见报道。本发明利用化学的高效反应将连接了偶氮苯的近红外荧光探针引入到结构精致的两亲性聚合物中间,高效地制备一种基于偶氮还原酶刺激响应型近红外聚合物荧光探针。
基于上述所获聚合物,进一步对聚合物的应用性能展开以下研究:通过溶液自组装制备结构稳定的聚合物胶束;利用聚合物胶束能在偶氮还原酶作用下被破坏分解并且荧光被激活和逐渐增强的特点,进一步地将聚合物作为包裹药物的载体进行药物包裹和释放,通过荧光变化跟踪药物释放过程。
本发明旨在通过上述研究,设计并构建新颖和高效的基于酶响应的近红外聚合物荧光探针检测体系和药物释放体系,拓展偶氮苯类聚合物在生物传感、载药和细胞标记等领域中的应用,为结肠定位药物控释载体和疾病诊断提供必要的理论依据,填补该研究领域的空白。
附图说明
图1是本发明中的alazo的核磁共振氢谱(1hnmr)图;
图2是本发明中的al6azo的核磁共振氢谱(1hnmr)图;
图3是本发明中的alab6azo的核磁共振氢谱(1hnmr)图;
图4是本发明中的alab6azo-pla的核磁共振氢谱(1hnmr)图;
图5是本发明中peg-alab6azo-pla的核磁共振氢谱(1hnmr)图;
图6是本发明中peg-n3,alab6azo-pla和peg-alab6azo-pla的凝胶色谱(gpc)流出曲线;
图7是本发明中peg-n3和peg-alab6azo-pla的红外光谱(ft-tr)图;
图8是本发明中peg-alab6azo-pla组装体在pbs溶液中的临界胶束浓度(cmc值);
图9是本发明中peg-alab6azo-pla的空白胶束pbs溶液(浓度为0.3mgml-1)在偶氮还原酶还原前后紫外/可见吸收光谱图;
图10是本发明中peg-alab6azo-pla的空白胶束pbs溶液(浓度为0.3mgml-1)在偶氮还原酶还原前后荧光发射图谱荧光强度变化图谱(激发波长为650nm);
图11是本发明中peg-alab6azo-pla的空白胶束pbs溶液(浓度为0.3mgml-1)在偶氮还原酶还原前后透射电子显微镜(tem)图像;
图12是本发明中peg-alab6azo-pla的空白胶束pbs溶液(浓度为0.3mgml-1)在偶氮还原酶还原前后动态光散射(dls)粒径变化图;
图13是本发明中包载了dox的peg-alab6azo-pla组装体pbs溶液(浓度为0.3mgml-1)在偶氮还原酶还原过程中紫外/可见吸收光谱图;
图14是本发明中包载了dox的peg-alab6azo-pla组装体pbs溶液(浓度为0.3mgml-1)在偶氮还原酶还原过程中荧光发射图谱荧光强度变化图谱(激发波长为650nm);
图15是本发明中包载了dox的peg-alab6azo-pla组装体(浓度为0.3mgml-1)在偶氮还原酶存在下药物释放结果;
图16是本发明中包载了dox的peg-alab6azo-pla组装体(浓度为0.3mgml-1)在偶氮还原酶还原过程中的透射电子显微镜(tem)图像;
图17是本发明中包载了dox的peg-alab6azo-pla组装体(浓度为0.3mgml-1)在偶氮还原酶还原前后动态光散射(dls)粒径变化图;
图18是本发明中偶氮还原酶还原24h前后的peg-alab6azo-pla空白胶束pbs溶液的细胞毒性测试结果。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方法作进一步详细描述。
本发明所合成的小分子结构通过核磁表征;所合成的聚合物结构通过核磁、凝胶色谱、红外光谱表征;所制备的聚合物胶束和包裹药物的聚合物胶束的形貌和尺寸以及还原过程中变化通过透射电镜(tem)及动态光散射(dls)详细表征;还原过程中聚合物胶束的荧光变化通过荧光光谱跟踪测试;还原过程中聚合物的结构变化通过紫外-可见光谱表征。
具体实施例中性能测试方法如下:
1.核磁氢谱(1hnmr)是通过bruker300mhz核磁仪,四甲基硅烷(tms)为内标,将测试样品以cdcl3(或氘代dmso)为溶剂溶解后进行测试;
2.聚合物数均分子量(mn)、重均分子量(mw)和分子量分布指数(mw/mn)使用装配有示差折光检测器和紫外检测器tosohhlc-8320凝胶色谱仪(gpc)上测定,采用两根tskgelsupermutiporehz-n(3μmbeadssize)柱子串联,分子量范围为500至190,000g/mol,选用色谱纯dmf作为流动相,流速为0.35ml/min,40℃下进行测试,以聚苯乙烯(窄分布)为标样对聚合物分子量进行校正;
3.傅里叶红外变换光谱(ft-tr)测试是用brukertensor-27ft-ir测试,kbr压片法测试;
4.透射电子显微镜(tem)采用hitachiht7700tem,工作加速电压为120kv。
5.紫外−可见吸收光谱在uv-2600紫外可见光谱仪(shimadzu,(nakagyo-ku,kyoto,japan))25℃下进行测定;
6.荧光发射光谱采用hitachif-4600型荧光光度计测试得到。
实施例一
基于偶氮还原酶响应的两亲性嵌段聚合物近红外荧光探针的制备方法,包括以下步骤:
1.alazo的合成:
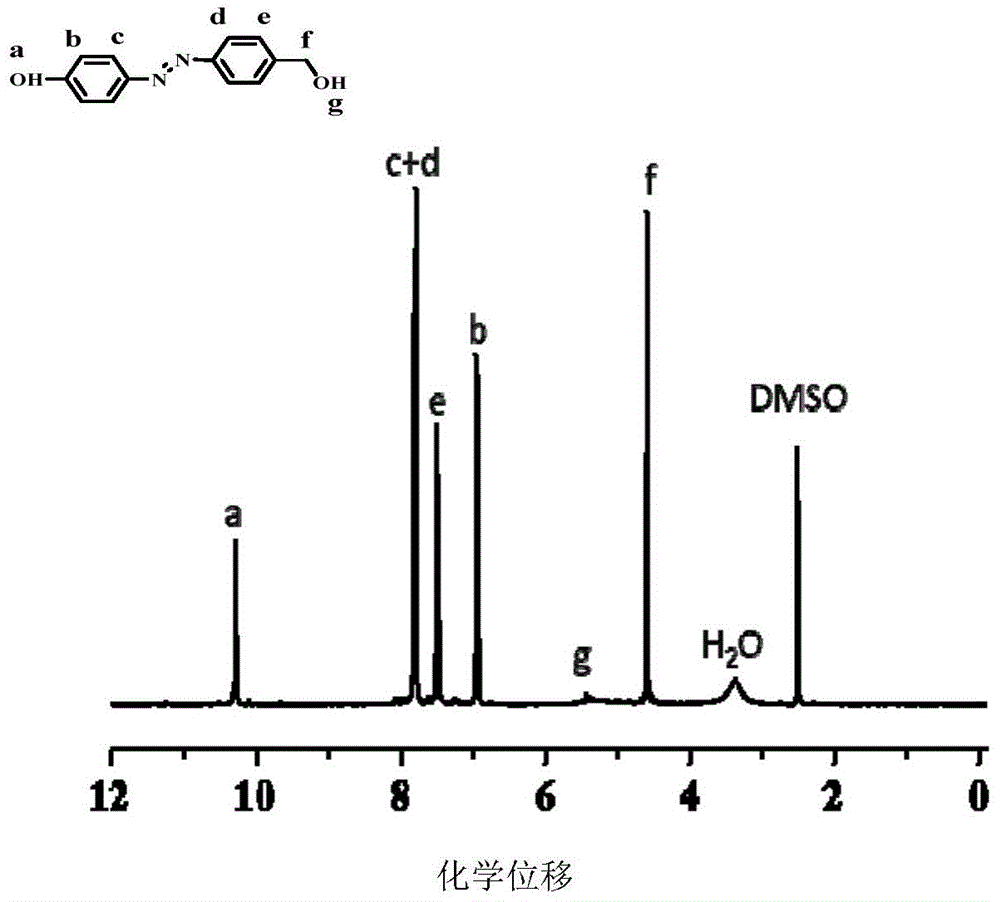
2.0g(16.2mmol,1eq)对氨基苯甲醇溶于30ml冰水,加入3.4ml37%的浓盐酸搅拌。称取1.17g(17.0mmol,1.05eq)亚硝酸钠溶于8ml水,冷却至0oc后逐滴加入对氨基苯甲醇溶液,搅拌1h。称取1.6g(17.0mmol,1eq)苯酚及3.14g(22.7mmol,1.4eq)碳酸钾溶于25ml水中,冷却至0oc,逐滴加入上述溶液中,过程保持0-5oc。搅拌2小时,用稀释的乙酸水溶液调节ph至4-5,直至生成橙红色沉淀。抽滤,少量甲醇冲洗,滤饼烘干,得到橙红色固体,3.4g,产率92%;附图1是本发明alazo的核磁共振氢谱(1hnmr)图。
2.al6azo的合成:
912.4mg(4mmol,1eq)alazo,1.94g(8mmol,2eq)6-溴己烷,552mg(4mmol,1eq)碳酸钾,溶于干燥的8ml丙酮中。65oc搅拌16小时,冷凝回流。冷却至室温,乙酸乙酯萃取,水洗三次,有机层用无水硫酸钠干燥,石油醚,乙酸乙酯过柱提纯,真空干燥得到橙黄色固体,1.2g,产率77%;附图2是本发明al6azo的核磁共振氢谱(1hnmr)图。
3.alab6azo的合成:
中间体alb6azo的合成:392.4mg(1mmol,1eq)al6azo,529.17mg(1mmol,1eq)现有化合物a,138mg(1mmol,1eq)碳酸钾溶于8.5ml干燥的dmf,60oc搅拌24小时。乙酸乙酯萃取,饱和氯化铵水溶液洗去dmf,有机层用无水硫酸钠干燥,柱层析提纯去掉小极性杂质,洗脱剂为二氯甲烷和乙酸乙酯,产物alb6azo与剩余化合物a一起投入下一步反应。化合物a的化学结构式如下:
alab6azo的合成:150mg(0.18mmol,1eq)alb6azo,84mg(0.72mmol,4eq)溴丙炔,24.6mg(0.18mmol,1eq)碳酸钾溶于10ml干燥的dmf,50oc搅拌5小时。乙酸乙酯萃取,饱和氯化铵溶液洗去dmf,有机层用无水硫酸镁干燥。柱层析,洗脱剂为二氯甲烷和乙酸乙酯得到墨绿色固体,70mg,两步总产率:49%;附图3是本发明alab6azo的核磁共振氢谱(1hnmr)图。
4.alab6azo-pla的合成:
用开环聚合的方法制备alaz6azo-pla。以alab6azo为引发剂,dmap为催化剂,丙交酯(la)为单体进行开环聚合。将5ml安瓿瓶一边抽真空一边用热风枪加热烘烤瓶身20分钟,冷却后通入氮气。在手套箱中称取la(1.44g,10mmol),dmap(24.4mg,0.2mmol),alab6azo(43.87mg,0.05mmol)置于干燥的安瓿瓶中,加入1ml二氯甲烷溶解,取出手套箱后封管。ika搅拌器中40℃搅拌48小时。反应结束后用适量二氯甲烷稀释粗产物,将其逐滴加入到过量的乙醚中沉淀,得到草绿色絮状产物。将产物置于40oc真空烘箱中干燥至恒重,得到alab6azo-pla;836mg,产率:58%,mn,sec=28300g/mol,mw/mn=1.05。附图4是本发明alab6azo-pla的核磁共振氢谱(1hnmr)图。
5.peg-alab6azo-pla的合成:
peg-ots的合成:2.5g(0.125mmol)聚乙二醇单甲醚20000,溶于10ml干燥的二氯甲烷中,加入1.01g(10mmol,80eq)三乙胺,冰浴冷却至0oc。将0.19g(1mmol,8eq)对甲苯磺酰氯溶于5ml干燥的二氯甲烷,逐滴加入peg溶液,过程保持0oc。升温至55oc,磁力搅拌24小时。用饱和碳酸氢钠水溶液洗三遍,二氯甲烷萃取。有机层用无水硫酸钠干燥,抽滤后浓缩,滴入冰乙醚沉降。抽滤,40oc真空烘箱烘至恒重。得到对甲苯磺酰氯封端的peg-ots,2.4g,产率:95%。
peg-n3的合成:称取1.015g(0.05mmol,1eq)peg-ots,牛角勺挖取260mg(4mmol,80eq)nan3,溶解于15ml干燥的dmf中,85oc搅拌24h。抽滤除去过量nan3,二氯甲烷萃取,饱和氯化铵水溶液洗去dmf及残留的nan3,有机层用无水硫酸钠干燥,抽滤后浓缩,滴入冰乙醚沉降。抽滤,40℃真空烘箱烘至恒重。产物为白色晶状固体,936mg,产率:93%。
peg-alab6azo-pla的合成:称取peg-n3和alab6azo-pla于10ml聚合瓶中,加6ml无水甲苯溶解,并加入cubr和pmdeta,冷冻抽气除氧重复三次,封管。65℃搅拌,反应24小时。反应完成后加入少量二氯甲烷稀释,并加入适量吸铜树脂室温搅拌过夜。抽滤除去吸铜树脂,旋蒸浓缩后逐滴加入乙醚。经过制备级sec纯化得到所需要分子量的peg-alab6azo-pla,产率:53%,mn,sec=37600g/mol,mw/mn=1.09;附图5是本发明peg-alab6azo-pla的核磁共振氢谱(1hnmr)图,其中亲疏水链段的重复单元个数(m,n)可通过peg-alab6azo-pla的核磁氢谱图采用下列计算公式得到:
m=(i5.06-5.35/2)/(i7.38-7.51/8)公式1
n=(i3.47-3.85/4)/(i7.38-7.51/8)公式2
i5.06-5.35:谱图中5.06-5.35ppm对应的聚乳酸重复单元-ch-片段的质子峰;
i3.47-3.85:谱图中3.47-3.85ppm处对应的聚乙二醇单甲醚上重复单元-och2ch2o-片段的质子峰;
i7.38-7.51:谱图中7.38-7.51ppm处对应的pegn-alab6azo-plam中化合物a上的质子峰(c,d,e,h)。
通过gpc流出曲线(图6)可以看出,所得到聚合物peg-alab6azo-pla的分子量较alab6azo-pla和peg-n3明显变化。同时从附图7看出,在peg-n3的红外图中可以观察到在2098cm-1出现叠氮特征峰,对应于叠氮基团n≡n的伸缩振动。而在peg-alab6azo-pla红外光谱图中,可以直接的观察到该特征峰的消失,说明peg-n3已反应完全。通过核磁共振氢谱分析得到的peg-alab6azo-pla分子量为39100g/mol,其中亲疏水的聚合物链段比例根据上述计算方法计算为5/6,m=144,n=398,符合所用的亲疏水聚合物的分子量比例。由此可以得出结论:peg398-alab6azo-pla144成功制得。
图6是本发明中peg-n3,alab6azo-pla和peg-alab6azo-pla的排阻色谱(sec)流出曲线;图7是本发明中peg-n3和peg-alab6azo-pla的红外光谱(ft-tr)图。
对上述得到的聚合物的性能做如下测试:
1.聚合物在dmf/pbs溶液中的自组装和表征
将聚合物peg398-alab6azo-pla144溶于无水dmf中,制成浓度为8mg/ml的溶液,并且将该溶液通过0.22μm的滤膜除尘。随后,用注射泵将pbs溶液(ph7.4)滴加到上述溶液中直至水含量为80%,滴加期间持续稳定搅拌,滴加完毕后再搅拌6h,滴加及搅拌期间保持25oc,即得到稳定的胶束结构。然后用透析袋(mwco3500)在pbs溶液中透析一天,将有机溶剂全部除去,刚开始每4h换一次透析液,至少更换6次透析液,从而使胶束稳定分散在pbs缓冲溶液中。最终配制成浓度为1mg/ml的组装体溶液。
两亲性聚合物临界胶束浓度(cmc)测定。疏水荧光染料尼罗红(nilered),是典型的分子内扭转电荷转移(tict)探针,对环境变化极为敏感,并且其最大发射波长与聚合物近红外荧光探针的最大发射波长无重叠,因此可以作为测试两亲性聚合物的cmc的荧光探针。测试过程如下:取30μl的尼罗红溶液(二氯甲烷为溶剂)分别加到8个容量瓶中。待溶剂挥发干净后,分别加入浓度1.0×10−3~2.0×10−1mg/ml的聚合物组装体pbs溶液2ml,加入搅拌子,在25oc下搅拌16h后进行荧光测试(每个样品中尼罗红的最终浓度为5×10−6m)。样品的荧光光谱以550nm为激发波长,扫描范围为580-700nm。采用630nm处的荧光强度与胶束溶液的浓度作图。图中低浓度区的拐点处浓度即为聚合物临界胶束浓度(图8)。
2.酶解前后空白胶束的表征以及荧光测试
首先,将空白胶束(未载药)pbs溶液冷冻-抽气-充氩气重复4次以除去氧气,在2ml反应管中加入0.6ml的除氧后的空白胶束溶液,以及0.4mg偶氮还原酶(dt-diaphorase,human)和1mg辅酶(nadph),加入通氩气除氧后的pbs(ph=7.4)缓冲液稀释至2ml,密闭反应管。然后在37oc恒温振荡器中振荡24h,通过荧光光谱在650nm的激发波长下测试荧光变化;用紫外分光光度计uv-vis,表征偶氮苯结构变化;用透射电镜tem以及动态光散射dls表征组装体形貌以及尺寸的变化。
将溶液滴在铜网上使用磷钨酸溶液染色一分钟,用透射电子显微镜(tem)图像表征组装体的形貌和尺寸。如图11(a)所示,该两亲性嵌段聚合物在pbs缓冲溶液(ph7.4)中可得到稳定的球形纳米粒子,动态光散射dls(图12)显示该组装体直径约为35nm,pdi为0.130。结合紫外光谱以及荧光光谱可以发现酶解24h后体系中的偶氮苯紫外吸收基本完全消失(图9),体系荧光得到大幅增强(图10),结合透射电镜(图11b)和动态光散射(图12)可以发现胶束形貌以及粒径发生了极大的变化,由此判断偶氮还原酶能成功还原该组装体中的偶氮苯并成功解离胶束,释放荧光。
图9是本发明中peg398-alab6azo-pla144空白胶束溶液加入偶氮还原酶前后的偶氮苯紫外监测图谱,可以发现在350cm-1和460cm-1左右的偶氮苯吸收峰基本消失,证明偶氮键被打断。
图10是peg398-alab6azo-pla144空白胶束溶液还原前后在650nm激发波长下的荧光测试结果。从图中可以看出,加入偶氮还原酶前仅有微弱的荧光;而加入偶氮还原酶培育24h后,荧光强度大幅增强。还原过程中作为连接亲疏水链段桥梁的n=n键被打断后,聚合物被分离成亲水peg链段和疏水pcl链段,荧光探针连接在亲水peg链段上分散于溶液中导致荧光释放。图11是本发明中peg398-alab6azo-pla144空白胶束溶液在加入偶氮还原酶前(a)后(b)的tem图像,图12是本发明中peg398-alab6azo-pla144空白胶束溶液在加入偶氮还原酶前后的dls表征;结合图11及图12可看出,组装体在还原后由规则的球状纳米粒子变为不规则的聚集体,其粒径以及分散度也有所增加(dh=227nm,pdi=0.288)。
3.组装体对阿霉素(dox)的包载
为了包载疏水性药物分子阿霉素(dox),将盐酸阿霉素(dox·hcl)(5.0mg)与三乙胺(2.4μl)加入到1.0ml的二甲亚砜中,避光搅拌过夜,并将过量三乙胺旋蒸除去,即得到dox的dmso溶液。随后,将60μl的dox溶液与聚合物的dmf溶液(1ml,8mg/ml,使用前通过0.22μm的滤膜除尘)混合均匀,用注射泵缓慢加入5ml的pbs缓冲液(ph7.4),滴加期间持续稳定搅拌,滴加完毕后再搅拌6h。使用透析袋(mwco3500)在pbs缓冲液(ph7.4)中透析24h,将有机溶剂及未包载的dox除去,刚开始每4h换一次透析液,至少更换6次透析液,全程避光进行。最终定容成浓度为1mg/ml的载药组装体溶液。
为了测定dox的含量,将100μl包载dox的胶束溶液经过冷冻干燥后加入3mldmso溶解,破坏胶束释放dox。测定不同浓度dox/dmso溶液的590nm处的荧光强度得到标准曲线(激发波长为480nm)。根据包载dox胶束的dmso溶液在590nm处的荧光强度从标准曲线上确定其载药量和包封率。
载药量(dlc)和包封率(dle)可根据以下的公式计算得到
载药量(w.t%)=(装载药物的重量/聚合物与装载药物的总重量)×100%
包封率(w.t%)=(装载药物的重量/药物总投入量)×100%
两亲性聚合物peg398-alab6azo-pla144对dox的载药量为0.69w.t%,包封率为18.37%。
4.包载阿霉素(dox)组装体的药物释放及其荧光检测
首先,将包药胶束溶液冷冻-抽气-充氩气重复4次以除去氧气,在若干个2ml反应管中分别加入0.6ml的除氧后的包药胶束溶液,以及0.4mg偶氮还原酶(dt-diaphorase,human)和1mg辅酶(nadph),加入通氩气除氧后的pbs(ph=7.4)缓冲液稀释至2ml,密闭反应管。然后37oc恒温振荡器中振荡反应,定时取管,通过荧光光谱分别在480nm和650nm的激发波长下测试荧光变化以监测其还原响应的荧光及药物释放过程。
将溶液滴在铜网上使用磷钨酸溶液染色一分钟,用透射电子显微镜(tem)图像(图16a)及动态光散射dls(图17)表征组装体的形貌和尺寸。该两亲性嵌段聚合物在pbs缓冲溶液(ph7.4)中可得到稳定的球形纳米粒子,直径约为36nm,pdi为0.142,与空白胶束相比没有明显差异。
图13是本发明中peg398-alab6azo-pla144包药组装体在加入偶氮还原酶后对偶氮苯的紫外监测图谱,可以发现在350cm-1和460cm-1左右的偶氮苯吸收峰随反应时间的延长逐渐减弱,证明n=n键逐步被打断。
图14是peg398-alab6azo-pla144包药组装体溶液还原过程中在650nm激发波长下的荧光测试结果,从图中可以看出,加入偶氮还原酶前仅有微弱的荧光;而加入偶氮还原酶后,荧光强度随着时间的变化逐渐增强。还原过程中作为连接亲疏水链段桥梁的n=n键逐渐断开后,聚合物被分离成亲水peg链段和疏水pcl链段,荧光探针连接在亲水peg链段上逐渐分散于溶液中导致荧光释放,而且随着还原时间增加荧光逐渐增强,当还原24h小时荧光强度达到最大。从图16及17可看出,组装体在还原过程中逐渐由规则的球状纳米粒子变为不规则的聚集体,还原后粒径及分散度也有较大改变(dh=279nm,pdi=0.318)。
图15是peg398-alab6azo-pla144包药组装体溶液还原过程中在480nm激发波长下的药物释放情况。从图中可以看出,加入偶氮还原酶后药物逐渐释放,12h以后基本达到最大释放量(约54%)。同时做了空白实验进行对比,考察包药组装体在没有偶氮还原酶37oc的药物释放情况,结果表明只有极少的药物释放(<6%),说明该包药组装体在无刺激作用时具有较好的稳定性。同时比较可以发现,本发明聚合物近红外荧光探针的偶氮苯位阻较小,偶氮还原酶还原程度高,导致胶束解离的较为彻底,药物释放性能优于现有技术四苯乙烯连接的聚合物可见光波段荧光探针。
图16是本发明中peg398-alab6azo-pla144包药组装体在加入偶氮还原酶后,胶束形貌随时间变化的tem表征(a)0h(b)3h(c)6h(d)9h(e)12h(f)24h。
图17是本发明中peg398-alab6azo-pla144包药组装体在加入偶氮还原酶前后的动态光散射(dls)表征。
5、细胞毒性测试
为了测试聚合物peg398-alab6azo-pla144胶束以及酶解后聚合物片段是否有毒性,采用不同浓度的聚合物pbs空白胶束溶液和酶存在下酶解24h的peg398-alab6azo-pla144pbs胶束溶液(50、100、150、200μg/ml)与两种细胞:正常细胞l929以及癌细胞hela共存培养72小时,使用mtt比色法进行细胞毒性测试。图18是本发明中的细胞毒性测试结果,如图18所示,不同浓度的聚合物胶束或酶解24h后的胶束溶液在两种细胞中均显示出较低的细胞毒性,细胞存活率都在90%以上。
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
相对于小分子,聚合物大的分子尺寸可以有效减少探针分子的吸收,并且聚合物具有较高的负载量。因此,开发基于酶响应的大分子荧光探针具有广阔的应用前景。到目前为止,基于偶氮苯还原酶响应的药物控释聚合物近红外荧光探针鲜有报道。本发明获得的基于偶氮还原酶响应的两亲性聚合物,通过溶液自组装可制备结构稳定的聚合物胶束并进一步用来作为包裹药物的载体;包裹药物的聚合物组装体在偶氮还原酶作用下被破坏分解,因而释放药物;同时随着药物释放荧光被激活并逐渐增强。因此,此聚合物不仅可以用作药物载体,同时具有荧光探针功能,可以有效地监测药物释放的过程,从而实现药物在结肠中可控和靶向释放,是一种潜在的结肠定位药物控释载体。
- 还没有人留言评论。精彩留言会获得点赞!