一种光敏剂前药化合物及其制备方法和应用与流程
本发明涉及医药技术领域,具体涉及一种光敏剂前药化合物及其制备方法和应用。
背景技术:
光动力疗法(Photodynamic Therapy,PDT)是利用光敏药物和激光活化治疗肿瘤疾病的一种新方法。其过程是,用特定波长照射肿瘤部位,能使选择性聚集在肿瘤组织的光敏药物活化,引发光化学反应破坏肿瘤。新一代光动力疗法(PDT)中的光敏药物会将能量传递给周围的氧,生成活性很强的单态氧,单态氧能与附近的生物大分子发生氧化反应,产生细胞毒性进而杀伤肿瘤细胞。与传统肿瘤疗法相比,PDT的优势在于能够精确进行有效的治疗,副作用小。
光敏剂(photosensitizer)是在光化学反应中,把光能转移到一些对可见光不敏感的反应物上以提高或扩大其感光性能的物质。5-氨基乙酰丙酸(5-ALA)是第二代光敏剂,是哺乳动物血红素合成的中间产物,其可在线粒体中代谢产生原卟啉(protoporphyrin IX,PpIX)。在波长为405nm左右的光激发下,PpIX可产生单重态氧以及635nm的荧光。目前,5-ALA已被广泛的应用于皮肤肿瘤、泌尿系统肿瘤、神经肿瘤、鼻咽肿瘤以及胃肠肿瘤等疾病等领域。
由于5-ALA是一种两性离子,亲水性非常高,导致其不容易进入细胞。为此,人们设计多种5-ALA酯类衍生物以增强其亲脂性,以期增强5-ALA的跨膜能力。当5-ALA酯类衍生物进入细胞后,细胞内的酯酶可以水解其酯键,释放出5-ALA。目前,已有两种酯类衍生物获得批准上市,分别是5-ALA的甲酯和己酯衍生物。在临床上常被用来治疗光化性角化病和基底细胞癌,而则常用于膀胱癌的诊断检测。
5-ALA及其酯类衍生物的稳定性严重制约了其疗效。研究表明,5-ALA及其酯类衍生物在生理条件下不稳定,很容易发生二聚而失活。这是因为其5-胺基基团具有很高的亲核性,在中性或碱性条件下,5-胺基基团可进攻另一5-ALA分子中的羰基基团而形成二聚物。对5-胺基进行修饰可明显提高5-ALA及其酯类衍生物的稳定性,但是胺基修饰常常会降低5-ALA转化为PpIX的能力。这是由于N端修饰后的5-ALA衍生物在细胞内往往无法通过代谢作用释放出5-ALA分子。设计一种稳定性强,具有肿瘤响应能力的N端修饰5-ALA衍生物是解决这一问题的有效途径。
技术实现要素:
因此,本发明要解决的技术问题在于克服现有技术中的5-ALA及其酯类衍生物容易发生二聚而失活,稳定性差,制约其疗效的缺陷,从而提供了一种光敏剂前药化合物及其制备方法和应用。
本发明提供一种光敏剂前药化合物,具有式(I)所示的结构,
其中,R1、R2彼此独立地选自氢、烷基、烯基、炔基、环烷基、环烯基、环炔基、烷氧基、烯氧基、炔氧基、氧杂烷基、氧杂环烷基、苯烷基、芳基、杂芳基、芳胺基、芳氧基。
进一步的,R1、R2彼此独立地选自氢、C1-C10的取代或未取代的烷基、C1-C10的取代或未取代的烯基、C1-C10的取代或未取代的炔基、C3-C10的取代或未取代的环烷基、C4-C10的取代或未取代的环烯基、C5-C10的取代或未取代的环炔基、C1-C10的取代或未取代的烷氧基、C1-C10的取代或未取代的烯氧基、C1-C10的取代或未取代的炔氧基、C2-C10的取代或未取代的氧杂烷基、C3-C10的取代或未取代的氧杂环烷基、C7-C10的取代或未取代的苯烷基、C4-C10的取代或未取代的芳基、C3-C10的取代或未取代的杂芳基、C4-C10的取代或未取代的芳胺基、C4-C10的取代或未取代的芳氧基。
进一步的,上述的光敏剂前药化合物,R1、R2彼此独立地选自氢或下述任一基团:
进一步的,上述的光敏剂前药化合物,具有如下所示分子结构:
一种上述的光敏剂前药化合物的制备方法,所述式(I)所示化合物的合成步骤如下所示:
以2-羟乙基二硫化物为起始原料,经DSC活化得到中间体1;中间体1和式(A)所示的化合物经偶合反应1得到中间体2;中间体2和式(B)所示的化合物经偶合反应2得到式(I)所示的化合物;
所述式(I)所示化合物的合成路径如下所示:
进一步的,所述的光敏剂前药化合物的制备方法,所述偶合反应1为:将所述中间体1和式(A)所示的化合物的盐酸盐分散于THF中,滴加DIPEA发生偶合反应。
进一步的,所述的光敏剂前药化合物的制备方法,所述偶合反应2为:将所述中间体2和式(B)所示的化合物的盐酸盐分散于THF中,滴加DIPEA发生偶合反应。
一种药物组合物,包括上述的光敏剂前药化合物和药学上可接受的载体。
进一步的,所述药物组合物的剂型包括散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、注射剂、冻干粉针剂。
上述的光敏剂前药化合物在制备用于光动力诊疗的药物中的应用。
本发明技术方案,具有如下优点:
1.本发明提供的光敏剂前药化合物,在5-ALA或其酯类衍生物的N端引入二硫键,由于二硫键是一种GSH响应基团,在二硫键的β位连接氨酯键的条件下,这一含二硫键的基团在GSH作用发生自毁作用(self-immolative),从而释放出其所连接的5-ALA或其酯类衍生物,再通过细胞内代谢途径生成原卟啉,在光动力诊疗中发挥光敏剂作用,一方面避免了5-ALA发生二聚而失活,增加了药物稳定性;另一方面基于GSH在多种肿瘤细胞中过表达和该前药化合物对GSH的响应作用,增强了药物的肿瘤靶向性,具体地,式(I)所示的化合物的二硫键在GSH作用下被切断,生成式(C-1)和(C-2)所示的基团,上述基团通过分子内环化反应释放出式(D-1)和(D-2)所示的化合物,上述化合物在细胞内酯酶的作用下释放出5-ALA,再通过细胞内代谢途径生成PpIX。
式(I)所示的化合物的作用机理如下所示:
2.本发明提供的光敏剂前药化合物,优选采用5-ALA的酯类衍生物制备,增强了该前药化合物的亲脂性,有利于增强该化合物的跨膜运输能力,促进其进入肿瘤细胞发挥疗效。
3.本发明提供了前述光敏剂前药化合物的制备方法,在偶合反应中为了抑制5-ALA或其酯类衍生物发生二聚反应,反应在THF中进行,5-ALA或其酯类衍生物的盐酸盐不溶于THF,缓慢加入DIPEA中和盐酸以缓慢释放出5-ALA或其酯类衍生物,使其在反应溶液中的实时浓度很低,更倾向于发生偶合反应而非二聚反应,提高反应效率。
4.本发明还提供了该光敏剂前药化合物在制备用于光动力诊疗的药物中的应用,该光敏剂前药化合物在中性、酸性及碱性条件下均具有良好的稳定性;在肿瘤细胞内过量GSH的作用下,该化合物可释放出5-ALA或其酯类衍生物,具有GSH响应能力,在肿瘤细胞中可更有效地诱导产生PpIX,因此在细胞中具有更强的PpIX荧光;光照下,该化合物对不同肿瘤细胞也表现出很强的杀伤能力,因此是一种潜在的光动力诊疗药物。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
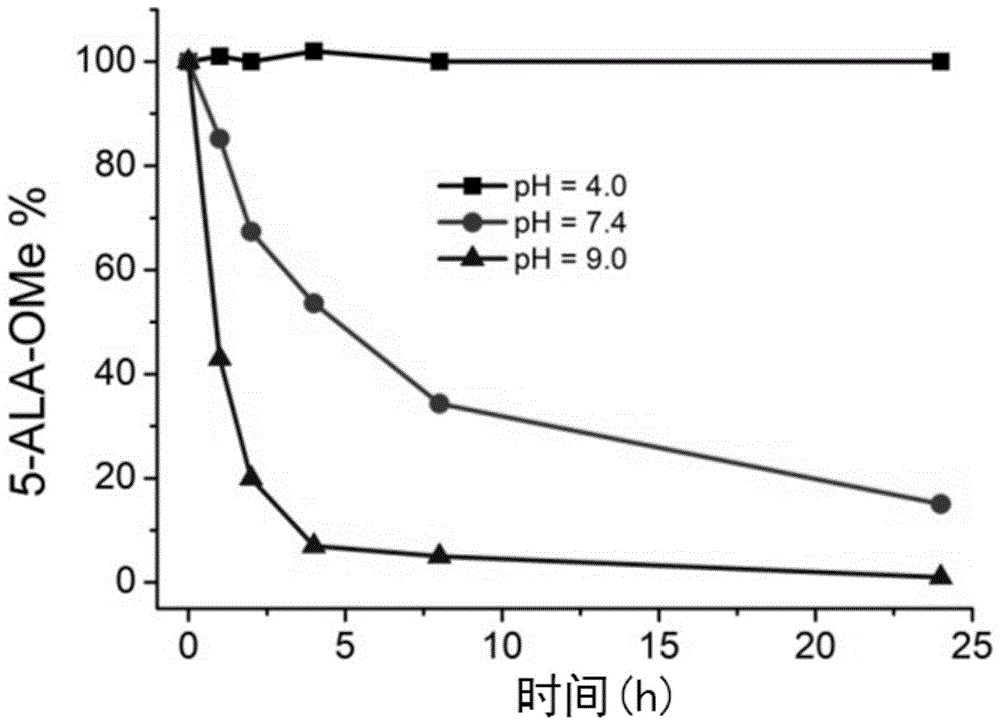
图1为在不同pH条件下5-ALA-OMe含量随时间变化的示意图;
图2为在pH=4.0条件下化合物P-1含量随时间变化的示意图;
图3为在pH=7.4条件下化合物P-1含量随时间变化的示意图;
图4为在pH=9.0条件下化合物P-1含量随时间变化的示意图;
图5为化合物P-1与GSH共培养1h后的质谱图;
图6为化合物P-1与GSH共培养6h后的质谱图;
图7为化合物P-0与GSH共培养6h后的质谱图;
图8为5-ALA-OMe、化合物P-0、化合物P-1在Hela细胞中诱导产生PpIX的检测结果;
图9为化合物P-1诱导产生PpIX在Hela细胞中的相对水平;
图10为化合物P-1处理Hela细胞的荧光成像图;
图11为化合物P-1处理经DEM预处理的Hela细胞的荧光成像图;
图12为5-ALA-OMe处理Hela细胞的荧光成像图;
图13为化合物P-0处理Hela细胞的荧光成像图;
图14为不同浓度5-ALA-OMe在黑暗和光照条件下的细胞活性;
图15为不同浓度化合物P-1在黑暗和光照条件下的细胞活性;
图16为不同浓度化合物P-0在黑暗和光照条件下的细胞活性;
图17为化合物P-1和5-ALA-OMe在三种不同种类细胞中诱导产生PpIX的荧光;
图18为化合物P-1对三种不同肿瘤细胞的光毒性和暗毒性检测结果;
图19为5-ALA-OMe对三种不同肿瘤细胞的光毒性和暗毒性检测结果;
图20为化合物P-0对三种不同肿瘤细胞的光毒性和暗毒性检测结果。
具体实施方式
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
试剂来源
5-ALA及其酯类衍生物的盐酸盐(5-ALA-OR·HCl)购自上海毕得公司;1,6-己二醇、2-羟乙基二硫化物、N,N'-二琥珀酰亚胺基碳酸酯(DSC)、二异丙基乙胺(DIPEA)、三乙胺(Et3N)、超干乙腈、超干四氢呋喃(THF)均购自安耐吉试剂公司;细胞培养试剂均购自Bioind(BI)公司;乙酸缓冲液(pH=4.0)、硼酸缓冲液(pH=9.0)、磷酸缓冲液(pH=7.4)均新鲜配制,浓度为25mM。
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
实施例1
本实施例提供一种光敏剂前药化合物(dimethyl 4,7,16,19-tetraoxo-8,15-dioxa-11,12-dithia-6,17-diazadocosanedioate),具有下述式(P-1)所示的结构:
式(P-1)所示化合物的合成路径如下所示:
式(P-1)所示化合物的制备方法具体包括以下步骤:
(1)合成中间体1-1
将2-羟乙基二硫化物(1.3mmol)溶于超干乙腈(5mL),氮气保护下,按顺序加入DSC(5.2mmol)和Et3N(7.8mmol),室温反应6小时后,旋干溶剂,将残渣溶于二氯甲烷(20mL),并用饱和碳酸氢钠、饱和氯化铵以及饱和食盐水溶液各洗一次,有机相用无水硫酸钠干燥,旋干后得到中间体1-1;
(2)合成化合物P-1
将中间体1-1、5-ALA-OMe·HCl(2.6mmol)分散于超干THF,氮气保护下,缓慢滴加DIPEA(3.9mmol),室温反应过夜后,旋干溶剂,将残渣溶于二氯甲烷(20mL),并用饱和氯化铵、饱和碳酸氢钠以及饱和食盐水溶液各洗一次,有机相用无水硫酸钠干燥,旋干后用硅胶柱色谱分离,得到化合物P-1(产率76%)。
化合物确认:
1HNMR(400MHz,CDCl3),δ(ppm):5.65(2H,s),4.35(4H,t,J=8.0),4.15(4H,d,J=4.0),3.69(6H,s),2.95(4H,t,J=6.0),2.76(4H,t,J=6.0),2.67(4H,t,J=6.0);13CNMR(100MHz,CDCl3),δ(ppm):203.93,172.84,156.01,63.00,51.93,50.59,37.74,34.37,27.60。
ESI-Ms:m/z[M+Na+]理论值:519.1;实测值:519.2。
实施例2
本实施例提供一种光敏剂前药化合物,具有下述式(P-2)所示的结构:
式(P-2)所示化合物的合成路径同实施例1,其不同之处在于,用5-ALA代替化合物A-1,用如下式(B-2)所示的化合物代替化合物B-1。
式(P-2)所示化合物的制备方法具体包括以下步骤:
合成中间体1-1的步骤同实施例1;
将中间体1-1(1.3mmol)、5-ALA的盐酸盐(1.3mmol)和化合物B-2的盐酸盐(1.3mmol)分散于超干THF,氮气保护下,缓慢滴加DIPEA(3.9mmol),室温反应过夜后,旋干溶剂,将残渣溶于二氯甲烷(20mL),并用饱和氯化铵、饱和碳酸氢钠以及饱和食盐水溶液各洗一次,有机相用无水硫酸钠干燥,旋干后用硅胶柱色谱分离,得到化合物P-2(产率70%)。
化合物确认:
1HNMR(400MHz,CDCl3),δ(ppm):5.65(2H,s),4.12(6H),3.96(4H),2.84(6H),2.72(4H),2.62(2H),2.60(2H),1.43(4H),0.91(6H);13CNMR(100MHz,CDCl3),δ(ppm):206.7,177.3,173.1,156.2,60.3,49.9,47.2,36.5,34.2,29.9,29.5,27.7。
ESI-Ms:m/z[M+H+]理论值:553.18;实测值:553.24。
实施例3
本实施例提供一种光敏剂前药化合物,具有下述式(P-3)所示的结构:
式(P-3)所示化合物的合成路径同实施例1,其不同之处在于,用如下式(A-3)所示的化合物代替化合物A-1,用如下式(B-3)所示的化合物代替化合物B-1。
式(P-3)所示化合物的制备方法具体包括以下步骤:
合成中间体1-1的步骤同实施例1;
将中间体1-1(1.3mmol)、化合物A-3的盐酸盐(1.3mmol)和化合物B-3的盐酸盐(1.3mmol)分散于超干THF,氮气保护下,缓慢滴加DIPEA(3.9mmol),室温反应过夜后,旋干溶剂,将残渣溶于二氯甲烷(20mL),并用饱和氯化铵、饱和碳酸氢钠以及饱和食盐水溶液各洗一次,有机相用无水硫酸钠干燥,旋干后用硅胶柱色谱分离,得到化合物P-3(产率79%)。
1HNMR(400MHz,CDCl3),δ(ppm):7.23–7.19(5H),5.65(2H,s),4.41(2H),4.20(2H),4.12(4H),3.96(4H),3.63(2H),3.46(2H),2.96(2H),2.84(8H),2.62(4H),1.05(3H);13CNMR(100MHz,CDCl3),δ(ppm):206.7,173.1,156.2,138.2,128.6-125.9,66.9,65.2,60.3,49.9,36.5,34.5,29.9,29.5,27.7,15.2。
ESI-Ms:m/z[M+H+]理论值:645.21;实测值:645.39。
对比例
本对比例提供一种化合物(dimethyl4,7,16,19-tetraoxo-8,15-dioxa-6,17-diazadocosanedioate),具有下述式(P-0)所示的结构:
式(P-0)所示化合物的合成路径如下所示:
式(P-0)所示化合物的制备方法同实施例1,不同之处在于,在步骤(1)中用1,6-己二醇替代2-羟乙基二硫化物,得到式(P-0)所示的化合物(产率73%)。
化合物确认:
1HNMR(400MHz,CDCl3),δ(ppm):5.39(2H,s),4.13(4H,d,J=8.0),4.07(4H,t,J=8.0),3.68(6H,s),2.74(4H,t,J=6.0),2.66(4H,t,J=6.0),1.63(4H,m),1.37(4H,m);13CNMR(100MHz,CDCl3),δ(ppm):204.05,172.82,156.50,65.21,51.90,50.56,34.35,28.77,27.58,25.47。
ESI-Ms:m/z[M+Na+]理论值:483.2,实测值483.2。
实验例化合物P-1的药物活性检测实验
一、化合物P-1在不同pH条件下的稳定性检测实验:
将10μL 5-ALA-OMe和化合物P-1的DMF溶液(1.0M)分别与不同pH值(4.0、7.4、9.0)的缓冲液混合,并在37℃下孵育,用HPLC法分别检测孵育1h、2h、4h、8h和24h时混合溶液中的剩余化合物量,如图1-5所示。
如图1所示,5-ALA-OMe在酸性条件下(pH=4.0)非常稳定,这是由于在酸性条件下,5-胺基基团会发生质子化,从而失去其亲核进攻能力,无法发生二聚反应,但是随着pH值的增加,5-ALA-OMe的稳定性逐渐变差,在pH=7.4时,6小时后有约50%的5-ALA-OMe失活,pH=9.0时,失活速率更快,这是由于随着pH值的增加,5-胺基基团逐渐去质子化,恢复其亲核能力。
如图2-4所示,化合物P-1在酸性、碱性以及中性条件下都表现出了很好的稳定性,24小时后几乎未发现化合物P-1分解,证明化合物P-1具有非常优异的稳定性。
二、化合物P-1对GSH的响应能力检测实验:
将GSH溶于PBS缓冲液(25mM)中得到浓度为10mM的GSH溶液,将化合物P-0、P-1的DMF溶液分别与GSH溶液混合,并在37℃下孵育,用ESI-MS法分别检测孵育1h和6h后混合溶液中物质的活性情况。
如图5所示,化合物P-1与GSH共培养1h后,利用质谱可以检测到5-ALA-OMe(m/z=146[M+H+])和剪切产物C-P-1(m/z=272[M+Na+])的分子量。这些分子量的检出证明,化合物P-1对GSH具有响应能力。如图6所示,化合物P-1与GSH共培养6h后,质谱中几乎检测不到C-P-1的分子量,只能检测出5-ALA-OMe的分子量,说明化合物P-1几乎全部转化为5-ALA-OMe。以上结果均说明,化合物P-1具有响应GSH释放出5-ALA-OMe的能力。在同样的处理条件下,化合物P-0几乎无法释放出5-ALA-OMe,如图7所示,化合物P-0与GSH共培养6h后,也没有检测出5-ALA-OMe的分子量,说明化合物P-0不具备GSH响应能力。
三、化合物P-1在肿瘤细胞中诱导产生PpIX的能力检测实验:
1.肿瘤细胞培养
人宫颈癌细胞Hela在含有10%胎牛血清(FBS)的DMEM(dulbecco's modified eagle medium)中培养。
2.PpIX产生检测
将化合物P-1、化合物P-0、5-ALA-OMe分别溶于DMF,获得浓度为100mM的母液;将母液溶于培养基(含0.01%Cremophor EL)得到浓度为500μM的次母液;次母液再根据实验要求用培养基稀释到相应浓度。
肿瘤细胞按1×104的浓度种到96孔板(3603,Corning)中,生长24h后,弃去原培养基;分别加入含不同浓度的化合物P-1、化合物P-0、5-ALA-OMe(10–500μM)的培养基,继续培养4h;培养结束后,弃去培养基,冷PBS洗2遍;利用酶联免疫监测仪(Bio-Rad microplate reader)测定细胞中PpIX的荧光强度(激发波长:405nm,发射波长:635nm)。
如图8所示,由于化合物P-0不具备GSH响应能力,因此几乎不能产生PpIX,也就检测不到PpIX的荧光;而5-ALA-OMe、化合物P-1在细胞内都有诱导产生PpIX,但是化合物P-1诱导产生PpIX的能力要大大强于5-ALA-OMe,分析原因如下:
(1)一个化合物P-1分子可以释放出两个5-ALA-OMe分子;
(2)5-ALA-OMe在生理pH条件下稳定性较差,从而降低了它的活性;
(3)脂水分配系数比较:
取化合物P-1和5-ALA-OMe分别溶解在正辛醇-水1:1的混合溶剂中,超声30分钟使其在两相之间平衡,离心后,用吸收光谱测定化合物在两相之间的浓度,P=正辛醇中化合物的浓度/水中化合物物的浓度,测得5-ALA-OMe的logP=-0.94,化合物P-1的logP=0.84,可见化合物P-1相对于5-ALA-OMe具有较高的脂水分配系数,也就意味着化合物P-1具有更高的细胞摄取量。
通过下述实验进一步验证化合物P-1在肿瘤细胞中诱导产生PpIX的能力与分子内GSH水平的依赖关系:
利用马来酸二乙酯(DEM,1.0mM)处理Hela细胞,以耗竭胞内的GSH,作为实验组,取未处理Hela细胞作为对照组。胞内GSH水平用GSH/GSSH检测试剂盒检测(试剂购自碧云天公司,检测方法依照厂家提供说明书进行)。通过检测,DEM处理后,胞内GSH水平只相当于未处理细胞的25%。
通过前述方法验证化合物在实验组和对照组Hela细胞中诱导产生PpIX的能力,如图9所示。化合物P-1在DEM预处理细胞中产生PpIX的能力大大降低,其PpIX荧光强度(F)仅仅为相对于未处理细胞的PpIX荧光强度(F0)的30%。这一结果进一步说明,化合物P-1具有响应GSH释放出5-ALA的能力。
考虑到肿瘤细胞中大多过表达GSH,化合物P-1应在肿瘤细胞中具有更高的活性,从而表现出对肿瘤的选择性,通过Hela细胞荧光成像方法进一步验证了化合物P-1诱导产生PpIX与分子内GSH水平的依赖关系:
将Hela细胞以5×104的浓度种在1cm玻璃培养皿中,生长24h后,分别加入100μM的化合物P-0、化合物P-1和5-ALA-OMe,并以经DEM(1.0mM)预处理的Hela细胞加入100μM的化合物P-1作为对照,在37℃下共同培养4h,成像前,细胞用PBS漂洗三次。细胞成像在Olympus Xcellence cell活细胞工作站下获得。
通过荧光显微镜观察了这三种化合物诱导产生PpIX在Hela细胞中的荧光。如图10-13所示(左图为细胞明场图;右图为细胞荧光图),化合物P-1诱导产生的PpIX的荧光最强,通过DEM预处理显著降低了荧光强度,5-ALA-OMe所产生的荧光相对弱的多,而化合物P-0几乎不能产生荧光。以上结果进一步说明,化合物P-1具有较高的产生PpIX的活性,且其诱导产生PpIX与细胞内GSH水平正相关。
四、化合物P-1的细胞毒性检测实验:
细胞以1×104每孔的浓度接种于96孔板中,生长24h后,分别加入含有不同浓度化合物P-1、化合物P-0、5-ALA-OMe(10-500μM)的培养基,继续培养4h后,弃去培养基,PBS洗2遍,重新加入含10%FBS的培养基。用LED灯(λ≈405nm)照射细胞10min,黑暗对比实验同时进行,培养24h后,加入噻唑蓝(MTT),继续培养4h,弃去培养基,加入DMSO,选择490nm波长,在酶联免疫监测仪(Bio-Radmicroplatereader)读数。
由图14-16所示,5-ALA-OMe的暗毒性较小,也具有一定的光毒性,但其光毒性较弱;化合物P-1在低浓度(<200μM)条件下几乎没有暗毒性,但在较高浓度(>250μM)条件下,化合物P-1显示出了一定的暗毒性,半抑制浓度为62±3μM;在测试浓度下,化合物P-0几乎没有表现出任何暗毒性和光毒性,这与其不具有GSH响应能力是相符的。
五、化合物P-1在不同肿瘤细胞中的活性检测实验:
1.肿瘤细胞培养
人宫颈癌细胞Hela、人皮肤黑色素瘤细胞A375和人结肠癌细胞HCT116在含有10%胎牛血清(FBS)的DMEM(dulbecco's modified eagle medium)中培养;人肺癌细胞A549在RPMI-1640完全培养基(含10%FBS)中培养,培养温度37℃,CO2浓度为5%。
2.PpIX产生检测
检测方法参照实施例3。
如图17所示,在HCT116细胞中,化合物P-1诱导产生PpIX的荧光强度是5-ALA-OMe的28倍;在A549和A375细胞中,则分别是84和43倍。
3.细胞毒性
检测方法参照实施例4。
如图18所示,对这三种细胞,化合物P-1均表现出了很强的光毒性,光照后,化合物P-1使HCT116细胞的存活率降至13%,对于A549和A375细胞则分别降至16%和14%;如图19所示,相比于化合物P-1,5-ALA-OMe的光毒性要弱的多,光照后,三种细胞的存活率都高于90%;如图20所示,在这三种细胞中,化合物P-0均没有表现出任何毒性。
经实验验证,实施例2和实施例3均体现出上述与化合物P-1相似的性质。
综上所述,本申请合成了一种GSH响应型5-ALA衍生物,相比于其母体化合物(5-ALA或其酯类衍生物),新合成的化合物在酸性、中性及碱性条件下均具有很好的稳定性;在肿瘤细胞内过量GSH的作用下,本申请提供的化合物可释放出5-ALA-OMe,具有GSH响应能力,在肿瘤细胞中可更有效地诱导产生PpIX,因此在细胞中具有更强的PpIX荧光;光照下,本申请提供的化合物对不同肿瘤细胞也表现出很强的杀伤能力。由于GSH在大多肿瘤细胞中过表达,故本申请合成的化合物是一种潜在的肿瘤靶向的光动力诊疗用光敏剂前药。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!