改性生物聚合物和其在3D打印中的应用的制作方法
本发明属于生物材料技术领域,具体涉及一种改性生物聚合物及其制备方法、生物墨水和其应用。
背景技术:
在三维打印技术的基础上,三维生物打印通过负载细胞和生长因子,在制备人造器官与组织、实现个性化治疗和药物筛选等领域上具有很大的发展潜力。微挤出打印作为最为广泛应用的生物打印方式,限制其快速发展和临床应用的最重要问题之一是缺乏兼具优异打印性能和生物活性的生物墨水。通常,用于三维生物打印的生物墨水需具备以下性能:
a).生物活性:保证细胞具有高的存活率,良好的铺展、增殖和分化能力;
b).快速成型能力:快速成型能力是保证高精度打印的基础;
c).可控的降解性能:保证生物打印类器官良好地应用于组织工程领域。
胶原广泛地存在于动物组织中,作为细胞外基质的主要成分之一。从胶原中获取的生物聚合物具有和胶原类似的结构,保证了良好的细胞相容性,同时也具有成本低,利于获取等优点。因此,胶原被广泛地用于生物墨水的基础材料,其中最具代表性的即是甲基丙烯酸改性的生物聚合物生物墨水。然而,此类生物聚合物基的墨水粘度非常低,不适合用于精确三维结构的构建,而且后续的交联需要加入有毒的引发剂和进行对细胞有伤害的紫外光照射。
目前为了改进生物聚合物基生物打印墨水打印性能和温和条件下成型的问题,已公开的有研究者在生物聚合物墨水中加入增稠剂从而实现生物聚合物墨水的可打印性。但是光交联体系对细胞的后续功能发挥带来了不确定因素,生物活性依然不足。针对交联方式的生物活性问题,研究者通过在生物聚合物上接枝酪胺,在室温下通过温和的酶交联方式,实现了交联过程中细胞活性良好的维持,但是仅靠这种交联方式难以实现材料的可打印性。
由上述可知,现有技术生物墨水依然会导致如下的一些弊端:
a).无法同时解决生物聚合物基生物墨水良好打印性和后续良好的生物活性;
b).无法打印复杂的生物聚合物生物支架;
c).无法包载不同的细胞进行精确打印,用于进一步的组织工程应用。
因此,如何研发一种能够有效解决该些弊端的生物墨水是本领域技术人员一直努力解决的技术问题。
技术实现要素:
本发明的目的在于克服现有技术的所述不足,提供一种改性生物聚合物及其制备方法,以解决现有生物聚合物作为生物墨水基材导致的墨水粘度非常低不适合用于精确三维结构的构建和交联过程中降低生物活性的技术问题。
本发明的另一目的在于提供一种改性生物聚合物生物墨水和其应用,以克服现有生物聚合物基墨水无法同时解决生物聚合物基生物墨水良好精确打印性和后续良好的生物活性的技术问题。
为了实现所述发明目的,本发明一方面,提供了一种改性生物聚合物。所述改性生物聚合物包括生物聚合物本体的主链,在所述主链上接枝有脲基嘧啶酮基团和酪胺基团。
本发明另一方面,提供了一种改性生物聚合物的制备方法。所述改性生物聚合物的制备方法包括如下步骤:
将含带异氰酸基团的脲基嘧啶酮与含有胺基和/或羧基的生物聚合物本体于第一反应溶剂中进行脲基化反应,生成脲基嘧啶酮接枝的生物聚合物;
将所述脲基嘧啶酮接枝的生物聚合物与含酪胺基团的化合物在含催化剂的第二反应溶剂中进行缩合反应,获得脲基嘧啶酮基团和酪胺基团修饰的改性生物聚合物。
本发明又一方面,提供了一种生物墨水。所述生物墨水包括溶剂和溶解于所述溶剂中的生物聚合物,所述生物墨水还包括由所述生物聚合物负载的生物功能成分,其中,所述生物聚合物为本发明改性生物聚合物。
同时,本发明还提供了本发明生物墨水的应用方法。具体的所述生物墨水在3d打印中的应用。
本发明再一方面,提供了一种生物支架。所述生物支架是由本发明生物墨水制备而成。
同时,本发明还提供了一种生物支架的制备方法。所述生物支架的制备方法包括如下步骤:
以本发明生物墨水为原料进行3d打印处理。
与现有技术相比,本发明改性生物聚合物通过采用脲基嘧啶酮基团和酪胺基团改性,使得所述改性生物聚合物具有良好的粘度,并且具有粘度随温度可调特性,同时所述改性生物聚合物还具有直接在室温下进行自身凝固特性,且凝固形成的凝胶有良好的力学性能。因此,所述改性生物聚合物特别适于作为生物墨水用于3d打印,有效避免了额外添加对生物活性成分有害的引发剂和进行有害的紫外光照射,有效提高了所述改性生物聚合物的生物相容性和生物活性成分活性。
本发明改性生物聚合物制备方法能够实现在生物聚合物本体的主链上有效接枝脲基嘧啶酮基团和酪胺基团,实现对生物聚合物本体的修饰改性,从而赋予生成的改性生物聚合物良好的粘度和自身凝固特性以及凝固形成的凝胶良好的力学性能。而且所述明改性生物聚合物制备方法能够保证生成的改性生物聚合物性能稳定,而且条件易控,效率高。
本发明生物墨水由于含有本发明改性生物聚合物,因此,所述生物墨水具有良好的粘度,而且粘度随温度可调,同时还具有自身凝固特性,因此,所述生物墨水同时具有良好的粘度和生物相容性,特别适于3d打印,可以直接打印成型,避免了额外添加对生物组分有害的如交联剂等成分。
本发明生物支架由于是采用本发明生物墨水采用3d直接打印成型,因此,所述生物支架精度高,而且负载的生物活性成分活性高,因此,所述生物支架的生物活性高。
附图说明
图1为本发明实施例改性生物聚合物制备方法的工艺流程示意图;
图2为本发明实施例改性生物聚合物制备方法中含有异氰酸基团的脲基嘧啶酮与生物聚合物进行脲基化反应、所述脲基嘧啶酮接枝的生物聚合物与含酪胺基团的化合物进行缩合反应的化学式示意图;
图3为本发明实施例生物墨水打印的生物支架以及对所述生物支架进行交联反应后的生物支架结构示意图;其中,图3a为本发明实施例生物墨水打印的生物支架结构示意图和生物支架中改性生物聚合物分子结构示意图;图3b为图3a所示打印的生物支架经交联处理中改性生物聚合物分子发生交联结构示意图;图3c为图3a所示打印的生物支架经交联处理后的发生交联后的改性生物聚合物分子结构示意图;
图4为本发明实施例11提供的改性生物聚合物的溶液的温敏感应性能和力学性能图;其中,图4a为改性生物聚合物的溶液凝固后形成的凝胶力学性能图,图4b为改性生物聚合物的溶液的温敏感应性能图;
图5为本发明实施例21-23提供的生物墨水的照片和各自可打印性结论图;其中,图5a为实施例21-23提供的生物墨水的照片,图5b为实施例21-23提供的生物墨水在相应温度下可打印性结论图;
图6为实施例31打印成的二维结构生物支架结构示意图;其中,图6b为图6a中a局部放大图,图6d为图6c中b局部放大图,图6e为图6c所示二维结构生物支架进行活性细胞染色图;
图7为实施例31打印成的三维结构生物支架结构示意图;其中,图7b为图7a的局部放大图,图7c为图7a所示三维结构生物支架进行活性细胞染色图;
图8为实施例31打印成的三维仿生器官模型支架结构示意图;
图9为实施例32提供的三维生物支架中细胞进行活死染色后的存活、铺展和增殖情况表征图。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
一方面,本发明实施例提供一种改性生物聚合物。所述改性生物聚合物分子结构示意图如图2中的化合物b所示,其包括生物聚合物本体的主链1,在所述主链1上接枝有脲基嘧啶酮基团2和酪胺基团3。
在一实施例中,所述脲基嘧啶酮基团2是通过所述脲基嘧啶酮基团2所含的脲基(-nh-co-nh-)接枝在所述生物聚合物本体的主链1上。在具体实施例中,所述脲基嘧啶酮基团2是通过将含有异氰酸基团的脲基嘧啶酮与生物聚合物本体进行反应接枝于所述生物聚合物本体的主链1上。通过设计所述脲基嘧啶酮基团2与生物聚合物本体的主链1的连接基团,使得所述脲基嘧啶酮基团2能够稳定接枝在生物聚合物本体的主链1上,从而实现对生物聚合物进行改性,能够提高生物聚合物水溶液的粘度,从而赋予所述改性生物聚合物水溶液具有相对高的粘度,增加了所述改性生物聚合物的应用范围,特别是在三维精度打印中的应用。一实施例中,所述脲基嘧啶酮基团2在所述改性生物聚合物中的含量为0.1-0.2mmg-1,具体可以是0.14mmg-1。通过控制脲基嘧啶酮基团2的接枝量,从而实现对所述改性生物聚合物的水溶液粘度的控制,提高其应用范围特别是提高其在三维精度打印中的应用性。
在一实施例中,所述酪胺基团3是通过酰亚胺基(-co-nh-)接枝在所述生物聚合物主链1上。在具体实施例中,所述脲基嘧啶酮基团3是通过将接枝有所述脲基嘧啶酮基团2的生物聚合物与含酪胺基团3的化合物进行缩合反应接枝于所述生物聚合物本体的主链1上。通过设计所述酪胺基团3与生物聚合物本体的主链1的连接基团,使得所述酪胺基团3能够稳定接枝在生物聚合物本体的主链1上,实现所述酪胺基团3与所述脲基嘧啶酮基团2对生物聚合物本体的协同改性,在赋予所述改性生物聚合物的水溶液具有相对高的粘度的同时,使得所述改性生物聚合物水溶液的粘度具有随温度可调特性,而且具有常温自动凝固特性,且凝固形成的凝胶力学性能得到明显的改善。这样,所述改性生物聚合物的生物相容性得到了明显的改善与提高,从而提高了所述生物聚合物的应用范围,特别是在三维精度打印中的应用。一实施例中,所述酪胺基团3在所述改性生物聚合物中的含量为可以是0.1-0.5mmg-1,优选为0.11mmg-1。通过控制酪胺基团3的接枝量,赋予所述改性生物聚合物进行进一步酶交联的特性和提高其在温和条件下进行酶交联的能力,这样使得含有所述改性生物聚合物的打印支架进行进一步的酶交联提供可能,使得包载了细胞包载支架在温和的条件下进行交联,提高所述包载支架也即是生物支架在生理条件下的稳定性。
一实施例中,上述各实施例中所述改性生物聚合物所含的生物聚合物本体的主链可以为含有胺基和/或羧基的生物聚合物提供。如在具体实施例中,所述所述生物聚合物本体包括明胶、聚乙烯醇、海藻酸、透明质酸、羧甲基壳聚糖中的至少一种。该些生物聚合物含有丰富的胺基和/或羧基,这样,含有异氰酸基团的脲基嘧啶酮与该些生物聚合物本体所含的胺基进行反应生成脲基嘧啶酮基团2,并接枝于所述生物聚合物本体的主链1上。含酪胺基团3的化合物与该些生物聚合物本体所含的羧基进行反应生成脲基嘧啶酮基团3,并接枝于所述生物聚合物本体的主链1上。
因此,所述改性生物聚合物通过脲基嘧啶酮基团2和酪胺基团3的协同改性作用,其溶液具有良好的粘度和具有粘度具有随温度可调特性,而且其具有常温凝固特性,凝固形成的凝胶力学性能优异,生物相容性优异,并且可以在细胞存在的条件下进行温和的酶交联反应,提高材料在生理条件下的热稳定性。因此,所述改性生物聚合物特别适于作为生物墨水用于3d(三维)精度打印中。
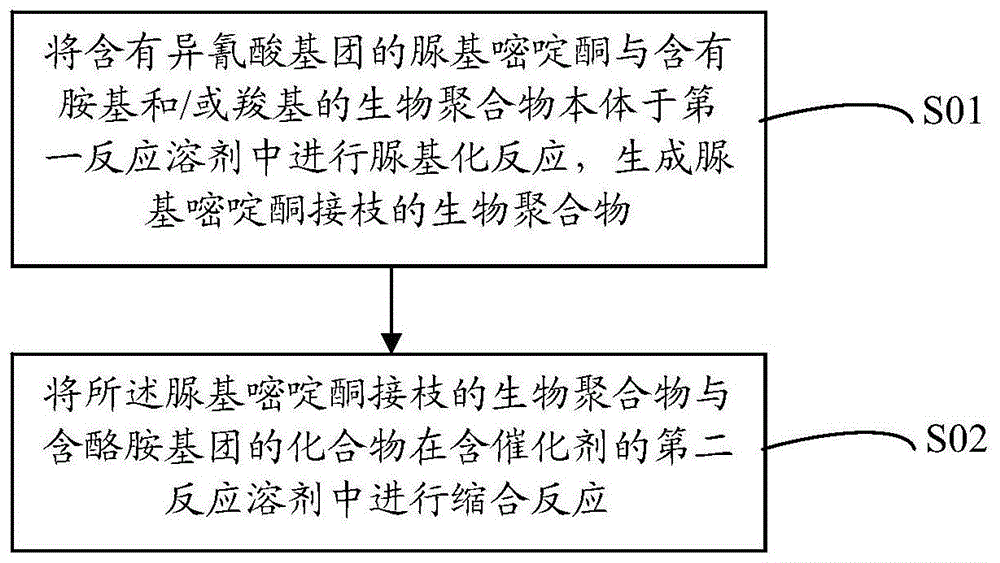
相应地,本发明实施例还提供了上文所述改性生物聚合物的一种制备方法。所述改性生物聚合物的制备方法的工艺流程如图1所示,其包括如下步骤:
s01:将含有异氰酸基团的脲基嘧啶酮与含有胺基和/或羧基的生物聚合物本体于第一反应溶剂中进行脲基化反应,生成脲基嘧啶酮接枝的生物聚合物;
s02:将所述脲基嘧啶酮接枝的生物聚合物与含酪胺基团的化合物在含催化剂的第二反应溶剂中进行缩合反应,获得脲基嘧啶酮基团和酪胺基团修饰的改性生物聚合物。
其中,所述步骤s01中的含有异氰酸基团的脲基嘧啶酮与所述生物聚合物本体于第一反应溶剂中进行脲基化反应式如图2中所示。所述生物聚合物本体与含有异氰酸基团的脲基嘧啶酮进行脲基化反应过程中,是含有异氰酸基团的脲基嘧啶酮反应物所含的异氰酸基团与所述生物聚合物本体主链上的胺基进行反应,生成脲基(-nh-co-nh-),也即是脲基嘧啶酮基团2通过脲基接枝在所述生物聚合物本体的主链1上,具体如图2中化合物a。
一实施例中,所述步骤s01中的反应体系中,所述含有异氰酸基团的脲基嘧啶酮与所述生物聚合物本体可以按照质量比1:(10-30),具体的如为1:20的比例进行混合于所述第一反应溶剂中。通过控制两者的反应浓度比,实现含有异氰酸基团的脲基嘧啶酮充分与所述生物聚合物本体进行化反应,具体的是进行脲基化反应,从而在所述生物聚合物本体的主链1上接枝脲基嘧啶酮基团2,实现对生物聚合物进行改性。另外,还可以进一步通过控制反应物在所述第一反应溶剂中的浓度和所述第一反应溶剂种类来提高所述脲基化反应速率,提高目标所述化合物a的得率,如在一实施例中,所述生物聚合物本体与所述第一反应溶剂的质量比为1:(15-20),具体的如1:17;所述第一反应溶剂可以选用二甲基亚砜。另外,基于所述步骤s01中的脲基化反应,优选地,所述脲基化反应是在保护的气氛中进行,如氮气保护的气氛中进行,以保证目标产物的得率。
该所述步骤s01中脲基化反应可以在室温等温和条件下进行,反应时间应该是成分的,如24小时。待所述步骤s01中脲基化反应结束后,还包括生成脲基嘧啶酮接枝的生物聚合物进行纯化处理的步骤。具体实施例中,对生成脲基嘧啶酮接枝的生物聚合物进行纯化处理采用沉淀分离的方法对所述脲基嘧啶酮接枝的生物聚合物进行沉淀处理,后对所述沉淀进行干燥,获得纯的脲基嘧啶酮接枝的生物聚合物。
另外,步骤s01中所述的含有胺基和/或羧基的生物聚合物本体如上文所述的包括明胶、聚乙烯醇、海藻酸、透明质酸、羧甲基壳聚糖中的至少一种。所述含有异氰酸基团的脲基嘧啶酮可以是但不仅仅是2(6-异氰酸基己基氨基羰基氨基)-6-甲基-4[1h]吡啶酮,只要是能够为生物聚合物主链的氨基反应生成脲基嘧啶酮基团的化合物均在本发明公开的范围之内。
所述步骤s02中的所述脲基嘧啶酮接枝的生物聚合物也即是所述化合物a与含酪胺基团的化合物中进行缩合反应式如图2中所示。所述化合物a与含酪胺基团的化合物进行缩合反应过程中,是含酪胺基团的化合物所含的胺基与所述生物聚合物本体的主链上的羧基进行反应,生成酰亚胺基(-co-nh-),也即是酪胺基团3通过酰亚胺基接枝在所述生物聚合物本体的主链1上,具体如图2中化合物b。
一实施例中,所述步骤s02中的反应体系中,所述脲基嘧啶酮接枝的生物聚合物与含酪胺基团的化合物可以按照质量比为1:(0.3-0.6),具体的如1:0.43的比例进行混合于所述第二反应溶剂中。通过控制两者的反应浓度比,实现含酪胺基团的化合物充分与所述化合物a进行化反应,具体的是进行缩合化反应,从而在生物聚合物本体的主链1上接枝酪胺基团3,实现对所述生物聚合物本体进行改性。另外,还可以进一步通过控制反应物在所述第二反应溶剂中的浓度和所述第二反应溶剂种类来提高所述缩合化反应速率,提高目标所述化合物b的得率,如在一实施例中,所述含脲基嘧啶酮接枝的生物聚合物与所述第二反应溶剂的质量比为1:(15-20);所述第二反应溶剂可以选用水(优选双蒸水)。在另一实施例中,所述催化剂为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐与n-羟基丁二酰亚胺的混合物(edc/nhs)、4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐中的至少一种。另外,所述催化剂的添加量可以根据不同催化的类型按照相应催化剂常规的用量进行添加,如在具体实施中,所述催化剂为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐与n-羟基丁二酰亚胺的混合物(edc/nhs)时,所述edc/nhs与含酪胺基团的化合物的质量比为(0.35-0.5):1。所述含酪胺基团的化合物可以但不仅仅是酪胺盐酸盐,只要是能够为生物聚合物主链的羧基反应生成酰亚胺基(-co-nh-)的化合物均在本发明公开的范围之内。
该所述步骤s02中缩合反应可以在室温等温和条件下进行,反应时间应该是成分的,如6小时。待所述步骤s02中缩合反应结束后,还包括生成脲基嘧啶酮基团和酪胺基团修饰的改性生物聚合物进行纯化处理的步骤。具体实施例中,对生成脲基嘧啶酮基团和酪胺基团修饰的改性生物聚合物进行纯化处理可以采用透析方法进行纯化,待透析收集的截留物进行冷冻干燥,获得纯的脲基嘧啶酮基团和酪胺基团修饰的改性生物聚合物。
另外,上述步骤s01和步骤s02中的反应物之间的质量比或反应物在溶液中的浓度除了如上文所述的比值和浓度之外,还可以根据反应目标对反应物的用量比值和反应物在溶液中的浓度做适应性的调节,那么在本发明公开的技术方案前提下做任何的适应性调节均在本发明技术方案能够给出的技术启示范围之内,也即是均在本发明技术方案公开的范围之内。
因此,所述改性生物聚合物制备方法能够实现在生物聚合物本体的主链1上有效接枝脲基嘧啶酮基团2和酪胺基团3,实现对生物聚合物本体的修饰改性,从而赋予生成的改性生物聚合物良好的粘度以及凝固形成的凝胶良好的力学性能,还可以进一步进行酶交联反应。另外,所述明改性生物聚合物制备方法能够保证生成的改性生物聚合物性能稳定,而且条件易控,效率,从而降低所述改性生物聚合物的生产成本。
另一方面,基于上文所述改性生物聚合物及其制备方法,本发明实施例还提供了一种生物墨水。所述生物墨水包括溶剂和溶解于所述溶剂中的生物聚合物,还包括由所述生物聚合物负载的生物功能成分。
其中,所述生物墨水所含的所述溶剂可以是用于生物墨水的溶剂,如可以为磷酸缓冲溶液、细胞培养基中的至少一种。选用的该溶剂一方面能够有效溶解所述生物聚合物形成均匀稳定的分散体系;另一方面能够有效保证负载的生物功能成分的活性。
所述生物墨水所含的所述生物聚合物为上文所述改性生物聚合物。所述改性生物聚合物作为所述生物墨水的基质组分,赋予所述生物墨水良好的粘度,使得所述生物墨水良好的3d(三维)精度打印特性,而且赋予所述生物墨水常温凝固特性和凝固形成的凝胶良好的力学性能。在一实施例中,所述改性生物聚合物在所述生物墨水中的质量浓度为15%-25%;通过控制所述改性生物聚合物基质在所述生物墨水中的含量,优化所述生物墨水的粘度,提高所述生物墨水的3d(三维)精度打印特性和提高3d(三维)精度打印器件的质量。
所述生物墨水所含的所述生物功能赋予所述生物墨水相应的生物活性。所述生物功能成分可以根据需要进行选择,如一实施例中,所述生物功能成分可以是包括细胞、生长因子、药物中的至少一种。另外,所述生物功能成分在所述生物墨水的负载量可以是有效剂量的。所述“有效剂量”是指所述生物墨水打印形成的器件能够有效发挥相应的目标生物活性的有效量。本领域技术人员将会理解,所述“有效剂量”还应该取决于负载所述生物功能成分的种类和相应器件类型。如在一实施例中,所述生物功能成分在所述生物墨水中的含量可以但不仅仅为2.1×105cellsml-1。
因此,所述生物墨水由于是以上文所述改性生物聚合物作为基质,因此,所述生物墨水具有良好的粘度,粘度随温度可调,而且还具有常温自身凝固特性。
正是由于所述生物墨水同时具有良好的粘度和生物相容性,因此,所述生物墨水可以在打印中的应用,特别是在3d精度打印中的应用。这样,将所述生物墨水直接打印成型,并可以在常温如生理温度(37℃左右)下进行自行交联固化,从而有效避免了额外添加对生物组分有害的如交联剂等成分,有效保证了负载的所述生物功能成分的活性,从而有效提高了所述生物墨水的生物相容性。同时固化后的所述生物墨水具有良好的力学性能,从而有效保证了打印形成的生物器件的稳定性。
再一方面,基于所述生物墨水的特性和应用,本发明实施例还提供了一种生物支架。所述生物支架是由上文所述生物墨水制备而成。具体是由上文所述生物墨水经过打印如3d精度打印形成。这样,所述生物支架生物活性高,而且结构稳定,另外精度高。在具体实施例中,所述生物支架可以是仿生器官结构,并能实现仿生器官结构的功能。在具体实施例中,所述生物支架可以是如图5所示的二维结构,也可以是如图6所示的三维多孔结构,还可以是如图7所示的三维仿生器官模型。
同时,本发明实施例还提供了上文所述生物支架的一种制备方法。所述生物支架的制备方法包括如下步骤:
以上文生物墨水为原料进行3d打印处理,如图3中a所示。
其中,一实施例中,所述生物支架制备方法中的所述3d打印的条件如下:
打印温度为10-43℃;和/或打印速率为4-15mm/s。具体的打印温度为37℃,打印速率为8mm/s。通过对打印温度和速率的控制,能够有效提高生物支架的精度和质量以及生物活性。
在进一步实施例中,待采用上文生物墨水为原料进行3d打印处理的步骤之后,还包括将打印形成的生物支架于含有双氧水的辣根过氧化酶的溶液中进行酶交联反应处理的步骤。这样,将所述生物支架在所述含有双氧水的辣根过氧化酶的溶液中进一步酶交联反应处理,提高所述生物支架的交联稳定性。具体地,经打印形成的生物支架中所含的所述改性生物聚合物在所述含有双氧水的辣根过氧化酶的溶液中进行酶交联反应处理过程中,所述改性生物聚合物主链上接枝的脲基嘧啶酮基团(如图2中所示的脲基嘧啶酮基团2)发生交联反应,所述改性生物聚合物主链上接枝的酪胺基团(如图2中所示的酪胺基团3)发生交联反应,具体图3中b所示,从而生成图3中c所示交联生物支架。
现结合具体实例,对本发明进行进一步详细说明。
1.改性生物聚合物及其制备方法实施例
实施例11
本实施例提供一种改性生物聚合物及其制备方法。所述改性生物聚合物包括明胶主链,在所述明胶主链上接枝有脲基嘧啶酮基团和酪胺基团。
所述改性生物聚合物的制备方法包括如下步骤:
步骤s11:在氮气保护下,将6g明胶通过磁力搅拌溶解于55℃的100ml二甲基亚砜中,然后冷却至室温;称取0.3g2(6-异氰酸基己基氨基羰基氨基)-6-甲基-4[1h]吡啶酮加入所述明胶溶液中并在室温下反应24h;反应后的溶液通过1l的乙醇溶液沉淀3次,然后再真空干燥24小时,得到5.1g淡黄色固定,也即是生成脲基嘧啶酮接枝的明胶,其产率计算为85%;
步骤s12:称取步骤s11中得到的淡黄色固体1.5g溶解于100ml的去离子水中,然后逐步加入1.3g酪胺盐酸盐,0.45g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和0.7gn-羟基丁二酰亚胺(nhs);将溶液的ph调制4.7并反应过夜,获得脲基嘧啶酮基团和酪胺基团修饰的改性明胶;
步骤s13:将含有脲基嘧啶酮基团和酪胺基团修饰的改性明胶的溶液经过截留分子量为7000的透析袋透析3天,经过冷冻干燥得到的白色海绵状固体即为脲基嘧啶酮/酪胺修饰的明胶。
实施例12
本实施例提供一种改性生物聚合物及其制备方法。所述改性生物聚合物包括明胶主链,在所述明胶主链上接枝有脲基嘧啶酮基团和酪胺基团。
所述改性生物聚合物的制备方法包括如下步骤:
步骤s11:在氮气保护下,将6g明胶通过磁力搅拌溶解于55℃的100ml二甲基亚砜中,然后冷却至室温;称取0.15g2(6-异氰酸基己基氨基羰基氨基)-6-甲基-4[1h]吡啶酮加入所述明胶溶液中并在室温下反应24h;反应后的溶液通过1l的乙醇溶液沉淀3次,然后再真空干燥24小时,得到5.1g淡黄色固定,也即是生成脲基嘧啶酮接枝的明胶,其产率计算为85%;
步骤s12:称取步骤s11中得到的淡黄色固体1.5g溶解于100ml的去离子水中,然后逐步加入1.3g酪胺盐酸盐,0.45g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和0.7gn-羟基丁二酰亚胺(nhs);将溶液的ph调制4.7并反应过夜,获得脲基嘧啶酮基团和酪胺基团修饰的改性明胶;
步骤s13:将含有脲基嘧啶酮基团和酪胺基团修饰的改性明胶的溶液经过截留分子量为7000的透析袋透析3天,经过冷冻干燥得到的白色海绵状固体即为脲基嘧啶酮/酪胺修饰的明胶。
实施例13
本实施例提供一种改性生物聚合物及其制备方法。所述改性生物聚合物包括明胶主链,在所述明胶主链上接枝有脲基嘧啶酮基团和酪胺基团。
所述改性生物聚合物的制备方法包括如下步骤:
步骤s11:在氮气保护下,将6g明胶通过磁力搅拌溶解于55℃的100ml二甲基亚砜中,然后冷却至室温;称取0.6g2(6-异氰酸基己基氨基羰基氨基)-6-甲基-4[1h]吡啶酮加入所述明胶溶液中并在室温下反应24h;反应后的溶液通过1l的乙醇溶液沉淀3次,然后再真空干燥24小时,得到5.1g淡黄色固定,也即是生成脲基嘧啶酮接枝的明胶,其产率计算为85%;
步骤s12:称取步骤s11中得到的淡黄色固体1.5g溶解于100ml的去离子水中,然后逐步加入1.3g酪胺盐酸盐,0.45g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和0.7gn-羟基丁二酰亚胺(nhs);将溶液的ph调制4.7并反应过夜,获得脲基嘧啶酮基团和酪胺基团修饰的改性明胶;
步骤s13:将含有脲基嘧啶酮基团和酪胺基团修饰的改性明胶的溶液经过截留分子量为7000的透析袋透析3天,经过冷冻干燥得到的白色海绵状固体即为脲基嘧啶酮/酪胺修饰的明胶。
实施例14
本实施例提供一种改性生物聚合物及其制备方法。所述改性生物聚合物包括明胶主链,在所述明胶主链上接枝有脲基嘧啶酮基团和酪胺基团。
所述改性生物聚合物的制备方法包括如下步骤:
步骤s11:在氮气保护下,将6g明胶通过磁力搅拌溶解于55℃的100ml二甲基亚砜中,然后冷却至室温;称取1.2g2(6-异氰酸基己基氨基羰基氨基)-6-甲基-4[1h]吡啶酮加入所述明胶溶液中并在室温下反应24h;反应后的溶液通过1l的乙醇溶液沉淀3次,然后再真空干燥24小时,得到5.1g淡黄色固定,也即是生成脲基嘧啶酮接枝的明胶,其产率计算为85%;
步骤s12:称取步骤s11中得到的淡黄色固体1.5g溶解于100ml的去离子水中,然后逐步加入1.3g酪胺盐酸盐,0.45g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和0.7gn-羟基丁二酰亚胺(nhs);将溶液的ph调制4.7并反应过夜,获得脲基嘧啶酮基团和酪胺基团修饰的改性明胶;;
步骤s13:将含有脲基嘧啶酮基团和酪胺基团修饰的改性明胶的溶液经过截留分子量为7000的透析袋透析3天,经过冷冻干燥得到的白色海绵状固体即为脲基嘧啶酮/酪胺修饰的明胶。
实施例15
本实施例提供一种改性生物聚合物及其制备方法。所述改性生物聚合物包括透明质酸主链,在所述透明质酸主链上接枝有脲基嘧啶酮基团和酪胺基团。
所述改性生物聚合物的制备方法包括如下步骤:
步骤s11:在氮气保护下,将1g透明质酸通过磁力搅拌溶解于25℃的100mldmso中,然后冷却至室温;称取0.05g2(6-异氰酸基己基氨基羰基氨基)-6-甲基-4[1h]吡啶酮加入所述透明质酸溶液中并在室温下反应24h;反应后的溶液通过1l的乙醇溶液沉淀3次,然后再真空干燥24小时,得到0.9g白色固体,也即是生成脲基嘧啶酮接枝的透明质酸,其产率计算为88.6%;
步骤s12:称取步骤s11中得到的淡黄色固体3g溶解于100ml的去离子水中,然后逐步加入1.3g酪胺盐酸盐,0.45g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和0.65n-羟基丁二酰亚胺(nhs);将溶液的ph调制4.7并反应过夜,获得脲基嘧啶酮基团和酪胺基团修饰的透明质酸;
步骤s13:将含有脲基嘧啶酮基团和酪胺基团修饰的透明质酸的溶液经过截留分子量为7000的透析袋透析3天,经过冷冻干燥得到的白色海绵状固体即为脲基嘧啶酮/酪胺修饰的透明质酸。
实施例16
本实施例提供一种改性生物聚合物及其制备方法。所述改性生物聚合物包括羧甲基壳聚糖主链,在所述羧甲基壳聚糖主链上接枝有脲基嘧啶酮基团和酪胺基团。
所述改性生物聚合物的制备方法包括如下步骤:
步骤s11:在氮气保护下,将1g羧甲基壳聚糖通过磁力搅拌溶解于25℃的100mldmso中,然后冷却至室温;称取0.05g2(6-异氰酸基己基氨基羰基氨基)-6-甲基-4[1h]吡啶酮加入所述羧甲基壳聚糖溶液中并在室温下反应24h;反应后的溶液通过1l的乙醇溶液沉淀3次,然后再真空干燥24小时,得到0.9g淡黄色固定,也即是生成脲基嘧啶酮接枝的羧甲基壳聚糖,其产率计算为89%;
步骤s12:称取步骤s11中得到的淡黄色固体1.5g溶解于100ml的去离子水中,然后逐步加入0.65g酪胺盐酸盐,0.23g1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和0.3n-羟基丁二酰亚胺(nhs);将溶液的ph调制4.7并反应过夜,获得脲基嘧啶酮基团和酪胺基团修饰的羧甲基壳聚糖;
步骤s13:将含有脲基嘧啶酮基团和酪胺基团修饰的羧甲基壳聚糖的溶液经过截留分子量为7000的透析袋透析3天,经过冷冻干燥得到的白色海绵状固体即为脲基嘧啶酮/酪胺修饰的羧甲基壳聚糖。
对实施例11至实施例16提供的改性生物聚合物相关性能测试:
将实施例11至实施例16提供的改性生物聚合物分别进行溶解性测试、温敏感应性能和力学性能进行测试。其中实施例13、14所得的改性生物聚合物不溶解于水溶液中。实施例11提供的改性生物聚合物的温敏感应性能和力学性能如图4所示。其中,实施例11提供的改性生物聚合物的溶液的温敏感应性能如图4b所示,由图4b可知,其溶液粘度随着温度的升高显著提高,具有良好的温敏感应的性能。实施例11提供的改性生物聚合物的溶液的凝固后形成的凝胶力学性能如图4a所示,由图4a可知,其凝胶的力学性能也得到了显著的提升。
另外,对其他实施例提供的改性生物聚合物分别进行温敏感应性能和力学性能进行测试结果分别与图4b和图4a所示性能接近,因此,本发明实施例提供的改性生物聚合物具有稳定且优异的粘度,其凝胶具有稳定且优异的力学性能。
2.生物墨水及其制备方法实施例
实施例21-23
本实施例21-23分别提供一种生物墨水及其制备方法。所述生物墨水包括磷酸缓冲液(pbs)溶剂和溶解于所述pbs溶剂中的改性生物聚合物和具有生物活性的细胞组分;所述改性生物聚合物与所述pbs的质量体积比分别为2g:8ml(实施例21)、2g:10ml(实施例22)、2g:13.3ml(实施例23);所述生物活性的细胞在所述生物墨水的含量为2.1×105cellsml-1。其中,所述改性生物聚合物为实施例11提供的改性生物聚合物。所述实施例21-23提供的生物墨水如图5a所示。
所述生物墨水制备方法包括如下步骤:
称取2g实施例11提供的脲基嘧啶酮/酪胺修饰的改性生物聚合物固体在50℃下溶解在8ml的pbs中并降温至37℃,然后加入所需要的细胞混合均匀即得到细胞包载的生物墨水。
实施例24
本实施例提供一种生物墨水及其制备方法。所述生物墨水包括pbs溶剂和溶解于所述pbs溶剂中的改性生物聚合物和具有生物活性的细胞组分;所述改性生物聚合物与所述pbs的质量体积比为2g:11.3ml;所述生物活性的细胞在所述生物墨水的含量为2.1×105cellsml-1。其中,所述改性生物聚合物为实施例12提供的改性生物聚合物。
所述生物墨水制备方法包括如下步骤:
称取g实施例12提供的脲基嘧啶酮/酪胺修饰的改性生物聚合物固体在50℃下溶解在11.3ml的pbs溶液中并降温至37℃,然后加入所需要的细胞混合均匀即得到细胞包载的生物墨水。
实施例25-28
本实施例25-28分别提供一种生物墨水及其制备方法。所述生物墨水包括pbs溶剂和溶解于所述pbs溶剂中的改性生物聚合物和具有生物活性的细胞组分;所述改性生物聚合物与所述pbs溶剂的质量体积比为2g:6ml;所述生物活性的细胞在所述生物墨水的含量为2.1×105cellsml-1。其中,所述改性生物聚合物分别为实施例13-16提供的改性生物聚合物。
所述生物墨水制备方法包括如下步骤:
称取g实施例13-18提供的脲基嘧啶酮/酪胺修饰的改性生物聚合物固体在50℃下分别溶解在6ml的细胞培养液中并降温至37℃,然后分别加入所需要的细胞混合均匀即得到细胞包载的生物墨水。
对实施例21至实施例28提供的生物墨水进行打印性能测试:
将实施例21至28提供的生物墨水分别在34℃、37℃、40℃、43℃下进行打印性能测试。其中,实施例21至23获得的生物墨水随温度的打印性如图5b所示。由图5b可知,所述生物墨水的打印性受到改性生物聚合物含量和打印温度的影响。其它实施例提供生物墨水的打印性测试结果如图5b近似。
3.生物支架及其制备方法实施例
实施例31
本实施例提供了一种生物支架及其制备方法。所述生物支架是利用实施例21提供的改性生物聚合物生物墨水采用3d打印形成。
所述生物支架制备方法包括如下步骤:
s11:取10ml实施例21提供的改性生物聚合物生物墨水加入3d打印机的料筒并固定在打印轴上,通过恒温加热器控制料筒温度在37℃;
s12:三维打印机通过指定的模型进行打印,打印时所用枪头直径为300μm,打印压力为60kpa,打印速度为8mm/s。
实施例32
本实施例提供了一种生物支架及其制备方法。所述生物支架是利用实施例21提供的改性生物聚合物生物墨水采用3d打印之后,采用辣根过氧化物酶反应溶液进行酶交联反应处理形成。
所述生物支架制备方法包括如下步骤:
s11:取10ml实施例24提供的改性生物聚合物生物墨水加入3d打印机的料筒并固定在打印轴上,通过恒温加热器控制料筒温度在37℃;
s12:三维打印机通过指定的模型进行打印,打印时所用枪头直径为300μm,打印压力为60kpa,打印速度为8mm/s;
s13:用磷酸缓冲液配制20unitsml-1的辣根过氧化物酶反应溶液;将步骤s12中打印后的活性支架浸泡在10ml的酶溶液中并加入6μl30%的双氧水水溶液,室温下反应10min;将反应后的支架取出用磷酸缓冲液冲洗后放入培养基中,在培养箱中进行培养。经过长期培养,三维支架的孔径结构仍然保持完好。
实施例33
本实施例提供了一种生物支架及其制备方法。所述生物支架是利用实施例21提供的改性生物聚合物生物墨水采用3d打印之后,采用辣根过氧化物酶反应溶液进行酶交联反应处理形成。
所述生物支架制备方法包括如下步骤:
s11:取10ml实施例25提供的改性生物聚合物生物墨水加入3d打印机的料筒并固定在打印轴上,通过恒温加热器控制料筒温度在37℃;
s12:三维打印机通过指定的模型进行打印,打印时所用枪头直径为300μm,打印压力为60kpa,打印速度为8mm/s;
s13:用磷酸缓冲液配制20unitsml-1的辣根过氧化物酶反应溶液;将步骤s12中打印后的活性支架浸泡在10ml的酶溶液中并加入6μl30%的双氧水水溶液,室温下反应10min;将反应后的支架取出用磷酸缓冲液冲洗后放入培养基中,在培养箱中进行培养。经过长期培养,三维支架的孔径结构仍然保持完好。
对实施例31至实施例33提供的生物支架相关性能测试:
将实施例31至实施例33分别打印成的二维结构生物支架、三维多孔结构和三维仿生器官模型。其中实施例31打印成的二维结构生物支架如图6所示。图6b为图6a中a局部放大图,图6d为图6c中b局部放大图。由图6a至图6d可知,实施例31打印形成的二维结构生物支架结构稳定。将图6c所示二维结构生物支架进行活性细胞染色处理,染色处理后的显微图片如图6e所示,由图6e可知,所述二维结构生物支架中负载的细胞活性高,具有良好的生物相容性和生物活性。
实施例31打印成的三维结构生物支架如图7所示。图7b为图7a中局部放大图。由图7a至图7b可知,实施例31打印形成的三维结构生物支架结构稳定。将图7a所示三维结构生物支架进行活性细胞染色处理,染色处理后的显微图片如图7c所示,由图7c可知,所述三维结构生物支架中负载的细胞活性高,具有良好的生物相容性和生物活性。
实施例31打印成的三维仿生器官模型支架如图8所示。由图8可知,实施例31打印形成的三维仿生器官模型支架结构稳定,而且力学性能优异。
另外,其他实施例打印形成的二维结构生物支架、三维多孔结构和三维仿生器官模型性能均如实施例31中的生物支架相关性能近似。因此,本发明实施例提供的生物支架结构稳定、力学性能优异,而且生物相容性优异。
进一步地,将实施例32提供的三维生物支架进行活死细胞染色,观察打印后的细胞存活率,并在培养箱中进行培养的支架每两天换一次培养基,并观察细胞在支架内部的存活情况和铺展、增殖情况。细胞实验结果如图9所示,由图9表明打印的三维生物支架负载的细胞存活率高,并且细胞在后期的培养过程中表现出很好的铺展和增殖。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!