一种环金属铱配合物及其制备方法和应用与流程
本发明涉及有机电致发光材料领域,尤其涉及一种环金属铱配合物及其制备方法和应用。
背景技术:
有机电致磷光的发光机理不同于有机电致荧光的发光机理,前者可以同时利用三重态和单重态激子发光,内量子效率理论上可达100%,突破了荧光材料的最大内量子效率25%的理论限制(Adv.Mater.,2002,14,701;Phys.Rev.B,1999,60,14422;Chem.Soc.Rev.,2012,41:4797)。尤其是重金属Ir具有很强的自旋-轨道耦合,使原本禁阻的三线态跃迁变为允许,重金属和配体之间强烈的相互作用使含有过渡金属的配合物能够使单重态和三重态得到混杂,破坏了三重态激子的对称性,衰减加快,减少瘁灭;与此同时,单重态也带有某些三重态的性质,衰减减慢,使单重态到三重态的系间窜越效率提高,从而获得高效的电致磷光(J.Am.Chem.Soc.,2001,123,4304;Adv.Mater.,2003,15,224;Chem.Mater.,2013,25,1013)。
一般来说,有机电致磷光器件的制作方法有两种:小分子电致磷光器件和聚合物电致磷光器件。其中小分子电致磷光器件通常采用的是真空蒸镀的方法;而聚合物电致磷光器件采用的是旋涂或喷墨打印的方法。小分子有机电致磷光材料由于其容易合成和纯化,并且OLED的制作采用的是真空蒸镀的方法,可以实现复杂的多层器件的制作,因此其拥有很好的器件性能。但是由于真空蒸镀需要在高真空环境下操作,使得其制作成本大大增加(Chem.Mater.,2015,27,1100;J.Mater.Chem.C,2014,2,8191;J.Phys.Chem.C,2012,116,15041)。旋涂或喷墨打印可以实现大面积,并且成本低廉的器件制作。聚合物磷光材料一般采用旋涂或喷墨打印的方法,但是因为聚合物材料的纯化困难,致使聚合物电致发光器件的效率不高,寿命较短(Nat Commun.,2013,4,1;Chem.Mater.,2010,23,326)。克服彼此的缺点的最好方法就是合成可以采用旋涂或喷墨打印方法制作的小分子磷光材料,但是小分子磷光材料由于其成膜性差以及在成膜过程中容易晶华,因此限制了其在此方法中的应用。
小分子磷光材料要能够实现溶液处理,一般需要满足两个条件:一是,良好的溶解性和成膜性;二是,具有好的热稳定性能,有高的玻璃化温度(Tg)。改善小分子材料的溶解性和成膜性可以在分子中引入烷基链或烷氧基链(Angew.Chem.Int.Ed.,2009,48,6664;Adv.Funct.Mater.,2006,16,575)。为了满足高的玻璃化温度,小分子材料需要拥有非平面的结构。除此之外,小分子材料还需要具备优良的电荷传输能力和好的发光性能。因此,我们发明了新型的基于二苯并噻吩基吡啶的绿色磷光铱配合物,并在其环金属配体和辅助配体上引入己基咔唑,得到可溶液加工的绿色磷光铱配合物。通过旋涂成膜的方法,将其作为发光层得到了非掺杂的可溶液加工的绿色磷光电致发光器件。
技术实现要素:
为解决上述技术问题,本发明第一方面提供了一种环金属铱配合物,所述环金属铱配合物的结构式如下:
Ir-1的结构式为:
Ir-2的结构式为:
Ir-3的结构式为:
其中R为:
本发明第二方面提供了一种环金属铱配合物的制备方法,将Ir-1-Br、Ir-2-Br或Ir-3-Br中的任意一种与1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯、碳酸钾水溶液、甲苯和乙醇混合,惰性气体保护下加入四三苯基磷钯,加热反应;冷却后经水洗、二氯甲烷萃取、干燥、柱层析提纯后得到所述环金属铱配合物,即Ir-1、Ir-2或Ir-3。
其中,
所述Ir-1-Br与所述1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯的摩尔比为1:1-5。
所述Ir-2-Br与所述1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯的摩尔比为1:1-5。
所述Ir-3-Br与所述1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯的摩尔比为1:1-5。
其中,所述加热反应的温度为80-100℃,时间为20-28h。
其中,所述Ir-1-Br、所述Ir-2-Br和所述Ir-3-Br通过以下方法制备得到:
将二苯并噻吩基吡啶、乙二醇单乙醚和水混合,氮气保护下迅速加入IrCl3·3H2O并加热反应,冷却后经抽滤、洗涤、真空干燥,得橙黄色粉末;将橙黄色粉末、6-((6-(4-溴苯氧基)己基)氧基)吡啶甲酸、碳酸钠和乙二醇单乙醚进行混合,惰性气体保护下升温回流反应,冷却后经水洗、二氯甲烷萃取、干燥、柱层析提纯后得到Ir-1-Br;
将2-溴二苯并噻吩基吡啶、乙二醇单乙醚和水混合,氮气保护下迅速加入IrCl3·3H2O并加热反应,冷却后经抽滤、洗涤、真空干燥,得橙黄色粉末;将橙黄色粉末、吡啶甲酸、碳酸钠和乙二醇单乙醚进行混合,惰性气体保护下升温回流反应,冷却后经水洗、二氯甲烷萃取、干燥、柱层析提纯后得到Ir-2-Br;
将2-溴二苯并噻吩基吡啶、乙二醇单乙醚和水混合,氮气保护下迅速加入IrCl3·3H2O并加热反应,冷却后经抽滤、洗涤、真空干燥,得橙黄色粉末;将橙黄色粉末、6-((6-(4-溴苯氧基)己基)氧基)吡啶甲酸、碳酸钠和乙二醇单乙醚进行混合,惰性气体保护下升温回流反应,冷却后经水洗、二氯甲烷萃取、干燥、柱层析提纯后得到Ir-3-Br;
所述Ir-1-Br的结构式为:
所述Ir-2-Br的结构式为:
所述Ir-3-Br的结构式为:
其中,所述1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯通过以下方法制备得到:
S1、9-(6-溴己基)咔唑的合成
将咔唑,1,6-二溴己烷和氢氧化钠混合,加入N,N-二甲基甲酰胺溶液,氮气保护下室温反应,后经水洗、二氯甲烷萃取、干燥、柱层析提纯后得到白色固体即9-(6-溴己基)咔唑;
S2、1,3-二(6-咔唑基己氧基)-5-溴苯的合成
将9-(6-溴己基)咔唑、4-溴邻苯二酚、碳酸钾和丙酮混合,氮气保护下加热反应,后经水洗、二氯甲烷萃取、干燥、柱层析提纯后得到白色固体即1,3-二(6-咔唑基己氧基)-5-溴苯;
S3、1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯的合成
将1,3-二(6-咔唑基己氧基)-5-溴苯和无水四氢呋喃混合,氮气保护下低温滴加正丁基锂反应,再加入异丙醇频哪醇硼酸酯,常温下搅拌反应,后经水洗、二氯甲烷萃取、干燥、柱层析提纯后得到无色粘稠固体,即1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯,其结构如下:
本发明第三方面提供了一种环金属铱配合物的应用,所述环金属铱配合物用于有机绿光器件。
其中,所述有机绿光器件包括依次层叠设置的氧化铟锡导电玻璃、空穴注入层、发光层、阴极注入层和阴极层,所述发光层采用环金属铱配合物。
其中,所述有机绿光器件的制备包括以下步骤:
S1、在氧化铟锡导电玻璃上旋涂一层聚(3,4-乙烯二氧噻吩)-聚苯乙烯磺酸作为空穴注入层;
S2、在所述空穴注入层上旋涂一层环金属铱配合物作为发光层;
S3、在所述发光层上蒸镀一层氟化铯,作为阴极注入层;
S4、在所述阴极注入层上蒸镀一层金属铝,作为阴极层
本发明的有益效果:
本发明提供的环金属铱配合物发光材料Ir-1、Ir-2和Ir-3与已公开的功能化铱配合物发光材料相比,具有以下优点:
(1)Ir-1、Ir-2和Ir-3以二苯并噻吩基吡啶为环金属配体,二苯并噻吩砜是很好的电子传输基团,因此能够有效地改善铱配合物的电子注入和传输能力;
(2)在铱配合物的环金属配体和辅助配体上连接载流子基团咔唑,可以改善铱配合物的发光性能;
(3)铱核与载流子基团咔唑之间通过非共价的柔性基团连接可以减少共轭,防止铱配合物发光颜色的改变;另外,柔性基团的引入可以改善铱配合物的溶解性,实现可溶液加工的特性。
附图说明
为了更清楚地说明本发明的技术方案,下面将对实施方式中需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施方式,对应本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
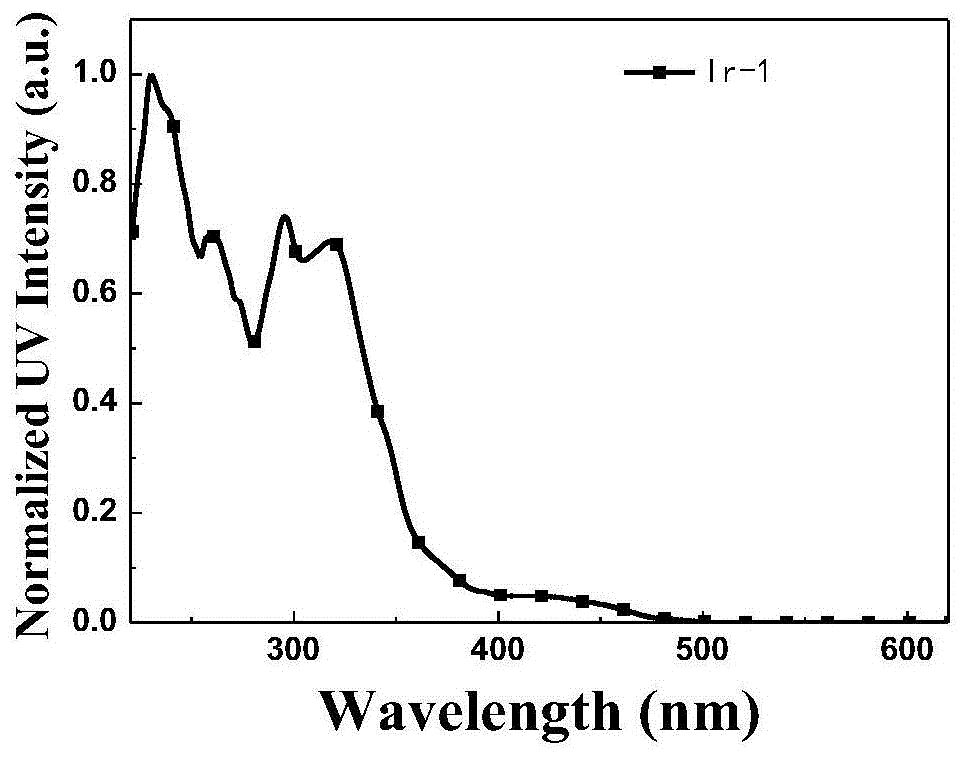
图1为本发明实施例1制备得到的环金属铱配合物Ir-1在二氯甲烷溶液中的紫外-可见光(UV)吸光光谱图;
图2为本发明实施例2制备得到的环金属铱配合物Ir-2在二氯甲烷溶液中的紫外-可见光(UV)吸光光谱图;
图3为本发明实施例3制备得到的环金属铱配合物Ir-3在二氯甲烷溶液中的紫外-可见光(UV)吸光光谱图;
图4为本发明实施例1制备得到的环金属铱配合物Ir-1在二氯甲烷溶液中的荧光发射光谱图;
图5为本发明实施例2制备得到的环金属铱配合物Ir-2在二氯甲烷溶液中的荧光发射光谱图;
图6为本发明实施例3制备得到的环金属铱配合物Ir-3在二氯甲烷溶液中的荧光发射光谱图;
图7为本发明实施例1制备得到的环金属铱配合物Ir-1的热分解(TG)曲线;
图8为本发明实施例2制备得到的环金属铱配合物Ir-2的热分解(TG)曲线;
图9为本发明实施例3制备得到的环金属铱配合物Ir-3的热分解(TG)曲线;
图10为本发明实施例制备得到的环金属铱配合物Ir-1,Ir-2和Ir-3的电致发光光谱图;
图11为本发明实施例制备得到的环金属铱配合物Ir-1,Ir-2和Ir-3的电流效率与亮度曲线图。
具体实施方式
以下是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
实施例1
本发明提供了一种环金属铱配合物的制备方法,包括以下步骤:
S1、Ir-1-Br的合成
将600mg(1.92mmol)二苯并噻吩基吡啶,乙二醇单乙醚21mL和水7mL加入到一个100mL三口瓶中,氮气保护下迅速加入260mg(0.76mmol)IrCl3·3H2O,100℃恒温反应20h。冷却,有黄色固体产生,抽滤,并先后用水和少许无水乙醇洗涤,真空干燥,得橙黄色粉末347mg,产品未进行进一步分离纯化直接用于下一步反应。
在100mL的三口瓶中,依次加入上一步反应产物82mg(0.054mmoL)、6-((6-(4-溴苯氧基)己基)氧基)吡啶甲酸65mg(0.164mmoL)、碳酸钠74mg(0.54mmoL)和乙二醇单乙醚30mL。氩气保护下,升温至135℃回流反应24h,冷却至室温后,倒入40mL去离子水中,二氯甲烷(30mL×3)萃取,有机层用蒸馏水洗(30mL×3),无水MgSO4干燥过夜,旋转蒸发仪蒸除挥发性溶剂。粗产品用色谱柱分离纯化(硅胶为固定相,乙酸乙酯/甲醇=20:1为洗脱剂)。真空干燥得黄色固体即Ir-1-Br(73mg),产率60.3%。
1H NMR(400MHz,DMSO)δ(ppm):8.85(d,J=12.3Hz,2H),8.53(t,J=15.0Hz,3H),8.35(d,J=7.8Hz,2H),8.30(d,J=7.8Hz,1H),8.12–8.00(m,3H),7.88(d,J=5.5Hz,1H),7.83–7.74(m,1H),7.71(d,J=7.9Hz,1H),7.44(dd,J=13.8,8.1Hz,2H),7.38–7.23(m,3H),7.17(d,J=8.3Hz,1H),6.91(dd,J=15.3,7.3Hz,2H),6.85–6.73(m,3H),6.56(s,1H),6.31(s,1H),3.59–3.41(m,4H),1.74(s,2H),1.43(d,J=27.5Hz,3H),1.22(d,J=6.8Hz,3H)。
Ir-1-Br的结构式为:
S2、环金属铱配合物Ir-1的合成
将73mg(0.066mmol)Ir-1-Br,72mg(0.099mmol)的1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯和2.0M碳酸钾水溶液10mL,以及30mL甲苯和20mL乙醇加入到100mL两口瓶中,氮气保护下加入30mg(0.025mmol)四(三苯基磷)钯,加热至90℃,反应24h。冷却至室温,反应液倒入去离子水中,二氯甲烷萃取3次,合并有机相,并用水洗,用无水MgSO4干燥过夜,旋转蒸发仪蒸除挥发性溶剂。粗产品用色谱柱分离纯化(硅胶为固定相,乙酸乙酯/甲醇=10/1为洗脱剂),真空干燥得到46mg黄色固体即Ir-1,产率43.8%。
1H NMR(400MHz,CDCl3)δ(ppm):8.78(d,J=5.4Hz,2H),8.33(d,J=10.3Hz,2H),8.18–7.99(m,8H),7.89(t,J=8.4Hz,2H),7.78(dd,J=11.8,6.5Hz,4H),7.68–7.54(m,4H),7.50–7.38(m,6H),7.38–7.29(m,6H),7.21(d,J=7.2Hz,6H),7.04(s,1H),7.03–6.91(m,2H),6.91–6.75(m,2H),6.72(d,J=2.8Hz,1H),4.23(q,J=7.2Hz,4H),4.05–3.93(m,4H),3.54–3.45(m,4H),3.43–3.34(m,2H),1.84(dd,J=14.1,7.0Hz,4H),1.81–1.71(m,4H),1.53–1.45(m,4H),1.45–1.37(m,2H),1.37–1.29(m,4H),0.95–0.66(m,2H),0.59(s,2H).13C NMR(100MHz,CDCl3)δ(ppm):175.33,166.95,164.81,158.62,157.49,157.16,150.73,150.44,149.60,149.51,149.24,149.02,147.57,146.88,141.23,141.22,140.95,139.65,139.36,139.12,139.17,137.05,137.42,135.36,135.97,132.63,132.92,129.14,129.01,128.42,128.95,126.17,126.90,126.43,124.16,124.70,124.95,123.52,123.48,122.36,122.20,122.16,121.80,121.64,121.55,121.53,121.27,120.33,119.71,119.68,119.66,119.45,117.21,114.99,113.50,111.63,110.29,109.46,109.33,109.10,69.70,69.66,69.19,66.50,66.49,66.32,58.30,58.22,58.21。
实施例1制备得到的环金属铱配合物Ir-1的结构式为:
Ir-1在二氯甲烷溶液中的紫外-可见光吸光光谱见图1,从图1可以看出,Ir-1的紫外吸收峰为230nm,260nm,295nm,318nm和425nm;Ir-1在二氯甲烷溶液中荧光发射光谱见图4,从图4可以看出,Ir-1的最大荧光发射峰为500nm,属于绿光发射范围;Ir-1的热分解曲线见图7,从图7可以看出,Ir-1的热分解温度为305℃,分解温度较高,适合应用于有机电致发光器件中。
实施例2
本发明提供了一种环金属铱配合物的制备方法,包括以下步骤:
S1、Ir-2-Br的合成
将512mg(1.49mmol)2-溴二苯并噻吩基吡啶,乙二醇单乙醚21mL和水7mL加入到一个100mL三口瓶中,氩气保护下迅速加入211mg(0.59mmol)IrCl3·3H2O,100℃恒温反应20h。冷却,有橙黄色固体产生,抽滤,并先后用水和少许无水乙醇洗涤,真空干燥,得橙黄色粉末540mg。产品未进行进一步分离纯化直接用于下一步反应。
在100mL的三口瓶中,依次加入上一步反应产物200mg(0.11mmol)、吡啶甲酸67mg(0.55mmoL)、碳酸钠157mg(1.1mmol)和乙二醇单乙醚30mL。氮气保护下,升温至135℃回流反应24h,冷却至室温后,倒入40mL去离子水中,二氯甲烷(30mL×3)萃取,有机层用蒸馏水洗(30mL×3),无水MgSO4干燥过夜,旋转蒸发仪蒸除挥发性溶剂。粗产品用色谱柱分离纯化(硅胶为固定相,乙酸乙酯/甲醇=20:1为洗脱剂)。真空干燥得黄色固体即Ir-2-Br(101mg),产率47%。
1H NMR(400MHz,DMSO)δ(ppm):9.05(d,J=7.9Hz,1H),8.95(d,J=7.3Hz,2H),8.67–8.54(m,5H),8.38(d,J=7.9Hz,2H),8.18–8.03(m,5H),7.81(dd,J=15.1,8.1Hz,3H),7.73(d,J=5.3Hz,1H),7.65(t,J=4.8Hz,1H),7.62–7.56(m,2H)。
Ir-2-Br的结构式为:
S2、环金属铱配合物Ir-2的合成
将100mg(0.10mmol)的Ir-2-Br,220mg(0.3mmol)1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯和10mL 2.0M碳酸钾水溶液,以及30mL甲苯和20mL乙醇加入到100mL两口瓶中,氮气保护下加入30mg(0.025mmol)四(三苯基磷)钯,加热至90℃,反应24h。冷却至室温,反应液倒入去离子水中,二氯甲烷萃取3次,合并有机相,并用水洗。无水MgSO4干燥过夜,旋转蒸发仪蒸除挥发性溶剂。粗产品用色谱柱分离纯化(硅胶为固定相,乙酸乙酯/甲醇=10:1为洗脱剂)。真空干燥得到73mg黄色固体即Ir-2,产率36.6%。
1H NMR(400MHz,CDCl3)δ(ppm):8.82(s,2H),8.45(s,1H),8.42(s,1H),8.39(s,2H),8.34(s,2H),8.25(s,1H),8.21(s,1H),8.08(dd,J=16.5,8.4Hz,8H),7.86(t,J=7.5Hz,3H),7.77(d,J=5.4Hz,4H),7.68(d,J=8.0Hz,2H),7.63(d,J=7.7Hz,2H),7.55–7.45(m,4H),7.44(s,1H),7.41(d,J=7.8Hz,4H),7.35(dd,J=16.4,8.4Hz,10H),7.20(dd,J=14.2,6.4Hz,9H),6.85–6.78(m,2H),6.62(d,J=4.7Hz,1H),4.29–4.15(m,8H),4.08–3.92(m,8H),3.71(q,J=6.8Hz,2H),2.94(s,2H),2.87(s,2H),1.92–1.70(m,11H),1.50(d,J=6.4Hz,5H),1.40(d,J=13.8Hz,6H),1.30–1.20(m,4H).13C NMR(100MHz,CDCl3)δ(ppm):174.72,157.80,157.22,150.97,150.50,149.50,149.45,149.26,148.40,147.21,147.20,142.61,142.18,141.77,141.40,141.36,138.95,138.64,137.95,137.93,137.82,137.44,134.65,134.36,134.18,134.17,134.05,132.93,132.19,129.91,129.44,126.17,126.90,124.43,124.16,124.09,123.52,122.48,122.35,122.24,122.19,121.84,121.66,121.58,121.52,121.29,117.18,117.02,113.74,113.71,110.66,69.92,69.46,69.37,69.22,58.33,58.32,29.60,29.01,25.30,25.07。
实施例2制备得到的环金属铱配合物Ir-2的结构式为:
Ir-2在二氯甲烷溶液中的紫外-可见光吸光光谱见图2,从图2可以看出,Ir-2的紫外吸收峰为231nm,262nm,295nm,319nm和429nm;Ir-2在二氯甲烷溶液中荧光发射光谱见图5,从图5可以看出,Ir-2的最大荧光发射峰为499nm,属于绿光发射范围;Ir-2的热分解曲线见图8,从图8可以看出,Ir-2的热分解温度为308℃,分解温度较高,适合应用于有机电致发光器件中。
实施例3
本发明提供了一种环金属铱配合物的制备方法,包括以下步骤:
S1、Ir-3-Br的合成
将512mg(1.49mmol)2-溴二苯并噻吩基吡啶,乙二醇单乙醚21mL和水7mL加入到一个100mL三口瓶中,氩气保护下迅速加入211mg(0.59mmol)IrCl3·3H2O,100℃恒温反应20h。冷却,有橙黄色固体产生,抽滤,并先后用水和少许无水乙醇洗涤,真空干燥,得橙黄色粉末540mg。产品未进行进一步分离纯化直接用于下一步反应。
在100mL的三口瓶中,依次加入上一步反应产物170mg(0.093mmoL)、6-((6-(4-溴苯氧基)己基)氧基)吡啶甲酸109mg(0.279mmoL)、碳酸钠98mg(0.93mmoL)和乙二醇单乙醚30mL。氩气保护下,升温至135℃回流反应24h,冷却至室温后,倒入40mL去离子水中,二氯甲烷(30mL×3)萃取,有机层用蒸馏水洗(30mL×3),无水MgSO4干燥过夜,旋转蒸发仪蒸除挥发性溶剂。粗产品用色谱柱分离纯化(硅胶为固定相,乙酸乙酯/甲醇=20:1为洗脱剂)。真空干燥得黄色固体即Ir-3-Br(113.43mg),产率48.3%。
1H NMR(400MHz,DMSO)δ(ppm):8.85(d,J=12.1Hz,2H),8.64–8.43(m,4H),8.33(dd,J=20.3,7.8Hz,2H),8.12–7.98(m,4H),7.88(d,J=5.6Hz,1H),7.82–7.74(m,2H),7.71(d,J=7.8Hz,2H),7.48–7.39(m,3H),7.31(dq,J=11.0,7.5Hz,4H),7.17(d,J=8.6Hz,1H),3.48(t,J=6.4Hz,4H),1.34–1.12(m,2H),0.70(dd,J=18.4,15.2Hz,6H)。
Ir-3-Br的结构式为:
S2、环金属铱配合物Ir-3的合成
将71mg(0.056mmol)的Ir-3-Br,65mg(0.225mmol)的1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯和10mL 2.0M碳酸钾水溶液,以及30mL甲苯和20mL乙醇加入到100mL两口瓶中,氮气保护下加入30mg(0.025mmol)四(三苯基磷)钯,加热至90℃,反应24h。冷却至室温,反应液倒入去离子水中,二氯甲烷萃取3次,合并有机相,并用水洗。无水MgSO4干燥过夜,旋转蒸发仪蒸除挥发性溶剂。粗产品用色谱柱分离纯化(硅胶为固定相,乙酸乙酯/甲醇=10/1为洗脱剂)。真空干燥得到57mg黄色固体即Ir-3,产率37.0%。
1H NMR(400MHz,CDCl3)δ(ppm):8.80(s,1H),8.31(s,2H),8.04(s,12H),7.92(s,2H),7.76(s,5H),7.64(s,4H),7.41(d,J=46.0Hz,20H),7.19(s,14H),6.99(s,6H),6.72(d,J=7.9Hz,14H),6.42(s,2H),4.23(d,J=16.3Hz,14H),4.07–3.81(m,14H),3.65–3.31(m,8H),1.81(d,J=29.1Hz,20H),1.57(s,2H),1.43(s,12H),1.26(s,14H).13C NMR(100MHz,CDCl3)δ(ppm):174.52,164.95,158.51,157.49,157.22,150.36,150.13,132.49,149.69,149.20,149.12,147.99,147.98,142.36,142.12,141.69,140.06,139.86,139.55,137.64,137.13,135.60,132.49,132.40,129.88,129.81,128.67,128.53,126.98,124.35,122.44,122.41,121.68,120.44,120.63,119.54,117.51,114.90,113.77,111.28,110.47,110.41,109.69,69.53,69.51,69.07,68.39,68.03,66.55,58.31,29.60,25.69。
实施例3制备得到的环金属铱配合物Ir-3的结构式为:
Ir-3在二氯甲烷溶液中的紫外-可见光吸光光谱见图3,从图3可以看出,Ir-3的紫外吸收峰为226nm,233nm,263nm,295nm,321nm和429nm;Ir-3在二氯甲烷溶液中荧光发射光谱见图6,从图6可以看出,Ir-3的最大荧光发射峰为501nm,属于绿光发射范围;Ir-3的热分解曲线见图9,从图9可以看出,Ir-3的热分解温度为309℃,分解温度较高,适合应用于有机电致发光器件中。
本发明实施例1-3中Ir-1、Ir-2和Ir-3结构式中R的结构式为:
本发明实施例1、实施例2和实施例3中使用的1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯通过以下步骤制备得到:
S1、9-(6-溴己基)咔唑的合成
将2.5g(15mol)咔唑,15g(60mol)1,6-二溴己烷和2.45g氢氧化钠置于250mL的圆底烧瓶中,加入100mL N,N-二甲基甲酰胺(DMF)溶液,通氮气30min,室温下反应,搅拌反应20h。反应后倒入大量水中,二氯甲烷萃取3次。水洗有机层,无水硫酸镁干燥,蒸除有机溶剂。柱层析提纯(硅胶为固定相,石油醚为洗脱剂),得到白色固体2.94g,产率73%。
1H NMR(400MHz,CDCl3)δ(ppm):8.10(d,J=7.7Hz,2H),7.50–7.43(m,2H),7.40(d,J=8.1Hz,2H),7.23(t,J=7.4Hz,2H),4.31(t,J=7.1Hz,2H),3.37(d,J=6.7Hz,2H),1.95–1.85(m,2H),1.80(dd,J=14.5,6.9Hz,2H),1.57–1.33(m,4H).
S2、1,3-二(6-咔唑基己氧基)-5-溴苯的合成
将2g(7.09mmol)9-(6-溴己基)咔唑,0.58g(3.08mmol)4-溴邻苯二酚,4.89g(35.4mmol)碳酸钾和60mL丙酮加入到100mL的圆底烧瓶中,氮气氛围中,然后升温至60℃,继续反应24h。倒入大量去离子水中,二氯萃取3次,并用水洗,无水MgSO4干燥,用旋转蒸发仪蒸除挥发性溶剂。粗产品用硅胶色谱柱分离纯化(石油醚:二氯甲烷=5:1为展开剂),得到白色固体0.88g,产率40.7%。
1H NMR(400MHz,CDCl3)δ(ppm):8.08(d,J=7.8Hz,4H),7.42(t,J=7.6Hz,4H),7.35(d,J=8.1Hz,4H),7.21(t,J=7.4Hz,4H),6.85(d,J=5.3Hz,2H),6.65(s,1H),4.23(t,J=7.2Hz,4H),3.90(dt,J=23.7,6.5Hz,4H),1.90–1.79(m,4H),1.74(dd,J=14.4,6.9Hz,4H),1.52–1.30(m,8H).
S3、1,3-二(6-咔唑基己氧基)-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷基)苯的合成
将3.3g(4.82mmol)1,3-二(6-咔唑基己氧基)-5-溴苯和60mL无水四氢呋喃加入到100mL的三口烧瓶中,氮气保护下,在-78℃下滴加4.82mL(12.05mmol 2.5M)正丁基锂反应3h,加入1.793g(9.64mmol)异丙醇频哪醇硼酸酯,移入常温,搅拌过夜。将反应液倒入去离子水中,二氯甲烷萃取3次,合并有几层,并水洗,无水MgSO4干燥,用旋转蒸发仪蒸除挥发性溶剂。粗产品用硅胶色谱柱分离纯化(石油醚:二氯甲烷=2:1为洗脱剂),得到2.21g无色粘稠固体,产率60%。
1H NMR(400MHz,CDCl3)δ(ppm):8.08(d,J=7.7Hz,4H),7.41(dd,J=14.4,7.3Hz,4H),7.34(dd,J=8.2,3.8Hz,4H),7.20(t,J=7.4Hz,4H),6.83(d,J=8.0Hz,3H),4.22(t,J=7.1Hz,4H),3.97(dt,J=12.8,6.5Hz,4H),1.88–1.70(m,10H),1.53–1.35(m,3H),1.33(s,9H),0.88(dd,J=11.0,6.5Hz,6H)。
本发明提供了一种环金属铱配合物的应用,所述环金属铱配合物用于有机绿光器件,所述有机绿光器件包括依次层叠设置的氧化铟锡导电玻璃、空穴注入层、发光层、阴极注入层和阴极层,所述发光层采用环金属铱配合物。
所述有机绿光器件的制备包括以下步骤:
S1、首先在氧化铟锡导电玻璃上旋涂一层40nm的聚(3,4-乙烯二氧噻吩)-聚苯乙烯磺酸作为空穴注入层,在80℃下真空干燥8h;
S2、在所述空穴注入层上旋涂一层厚度为90nm的环金属铱配合物作为发光层;
S3、再在所述发光层上蒸镀一层厚度为1.5nm的氟化铯,作为阴极注入层;
S4、最后在在所述阴极注入层上蒸镀一层厚度为100nm的高功函金属铝作为阴极层。
制备得到的有机绿光器件结构为:ITO/PEDOT:PSS/EML/CsF/Al,其中PEDOT:PSS是聚(3,4-乙烯二氧噻吩)-聚苯乙烯磺酸。阴极面积定义为器件有效活性面积为0.15cm2,用表面轮廓仪来测定各旋涂层的厚度,用Sycon Instrument公司生产的厚度/速度仪(Model STM-100)来控制氟化铯层和金属铝层的沉积速度和厚度,用Keithley 236 Source Measure Unit来测定器件的电流-电压(J-V)特性,用Oriel公司的Instaspec4CCD光栅光谱仪测定器件的电致发光光谱,用校正的硅光电二极管来测定器件的发光亮度,用积分球(IS080,Labsphere)来校准器件的外量子效率,器件用紫外固化环氧树脂和薄层玻璃封装。
以实施例1制备得到的化合物Ir-1为发光层制作的可溶液加工的有机绿光器件,器件的电致发光光谱如图10所示,电流效率与亮度曲线如图11所示。器件的最大发射光波长为530nm,最大发光亮度为1154cd/m2,最大流明效率为0.13cd/A。
以实施例2制备得到的化合物Ir-2为发光层制作的可溶液加工的有机绿光器件,器件的电致发光光谱如图10所示,电流效率与电流密度曲线如图11所示。器件的最大发射光波长为528nm,最大发光亮度为2415cd/m2,最大流明效率为0.19cd/A。
以实施例3制备得到的化合物Ir-3为发光层制作的可溶液加工的有机绿光器件,器件的电致发光光谱如图10所示,电流效率与电流密度曲线如图11所示。器件的最大发射光波长为514nm,最大发光亮度为2520cd/m2,最大流明效率为0.24cd/A。
以上实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都是属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!