一种基于RPA技术快速检测核酸的纸微流控芯片的制作方法
本发明属于生物技术领域,具体涉及一种基于rpa技术快速检测核酸的纸微流控芯片。
背景技术:
无论是植物、动物还是人体都有病原物的危害。核酸作为生命最重要的生物大分子物质之一,携带遗传物质,因此可通过对核酸的检测和分析来检测病原物的存在和含量。由于生物细胞中核酸含量低,从植物、动物和人体组织中检测痕量病原物,往往需要高灵敏的核酸检测。目前经常采用的聚合酶链式反应(polymerasechainreaction,pcr)必须经过变性、退火、延伸三个步骤,用时在90min左右,pcr仪本质上就是一个控制温度升降的设备。等温扩增技术(isothermalamplificationtechnology)是一种核酸体外扩增技术,其反应过程始终维持在恒定的温度下,通过添加不同活性的酶和各自特异性引物来达到快速核酸扩增的目的。
常见的等温扩增包括环介导核酸等温扩增(loop-mediatedisothermalamplification,lamp)、重组酶聚合酶扩增(recombinaseploymeraseamplification,rpa)等。lamp是2000年开发的一种新颖的恒温核酸扩增方法,其特点是针对靶基因的6个不同区域设计4种特异性lamp引物,利用一种具有链置换活性的bstdna聚合酶在等温条件(63℃左右)孵育30-60min,即可完成核酸扩增反应。与常规pcr相比,不需要模板的热变性、温度循环、电泳及紫外观察等过程。lamp是一种全新的核酸扩增方法,具有简单、快速、特异性强的特点。rpa采用的酶活性最适温度在37℃-42℃之间,无需变性,在常温下即可进行。此外,由于不需要温控设备,rpa可以真正实现便携式的快速核酸检测。
纸微流控芯片作为一种新发展的技术手段,为病原物的快速检测提供了一种新的工具。纸微流控芯片具有成本更低、分析系统易微型化和便携化、后处理简单和无污染的优点,在临床诊断、食品质量控制和环境监测等领域具有广阔的应用前景。
技术实现要素:
本发明的目的是快速检测核酸。
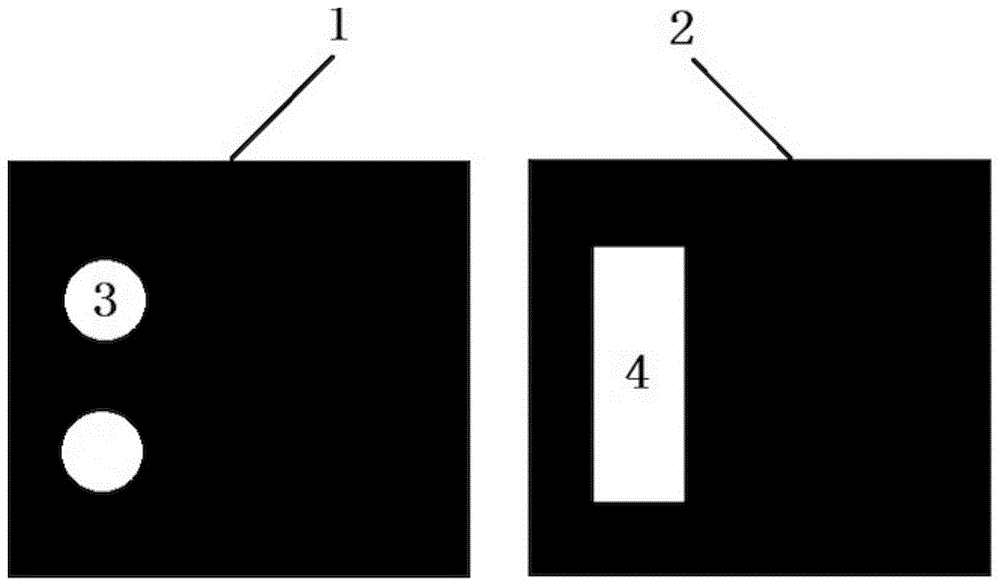
本发明首先保护一种纸微流控芯片。该纸微流控芯片可包括层a1和层b2;层a和层b的材质可为纸;该纸微流控芯片可由至少一个反应单元组成;每一个反应单元可包括设置在层a上的n个反应垫3和设置在层b上的1个点样区域4;每一个反应单元中,点样区域覆盖全部的反应垫;反应垫和点样区域可由亲水材料制成;除反应垫和点样区域外,纸微流控芯片均覆盖疏水材料。
纸可为滤纸。
层a和层b可以连接,也可以分别独立。连接可为折叠连接。
纸微流控芯片具体可由层a和层b组成。
纸微流控芯片可用于检测目标核酸。
亲水材料可为滤纸、玻璃纤维或聚醚砜。
疏水材料可为石蜡、光刻胶、聚苯乙烯或烷基烯酮二聚体。
反应垫上含有检测目标核酸的成套试剂。
检测目标核酸的成套试剂可包括引物对x和探针x。
检测目标核酸的成套试剂具体可由引物对x和探针x组成。
引物对x可由引物f和引物r组成。引物f和引物r均可为30-35个(如30-33个、33-35个、30个、31个、32个、33个、34个或35个)核苷酸组成的单链dna分子。引物对x的靶序列的长度可为100-200bp(如100-130bp、130-170bp、170-200bp、100bp、130bp、170bp或200bp),与部分目标核酸相同或互补。
探针x可为45-60个(如45-50个、50-55个、55-60个、45个、50个、55个或60个)核苷酸组成的单链dna分子。探针x从5’至3’依次可包括dna片段甲、外切酶exo的切断位点和dna片段乙。探针x从5’至3’依次可由dna片段甲、外切酶exo的切断位点和dna片段乙组成。dna片段甲可为30-40个(如30-35个、35-40个、30个、35个或40个)核苷酸组成的单链dna分子,与引物对x的靶序列上的区段甲部分相同。dna片段乙与引物对x的靶序列上的区段乙部分相同。区段甲和区段乙在引物对x的靶序列上无重叠。
外切酶exo的切断位点可为四氢呋喃。
dna片段甲的末端具有荧光标记(即dna片段甲末端的脱氧核糖核苷酸具有荧光标记)。更具体的,dna片段甲3’末端的脱氧核糖核苷酸具有荧光标记。
荧光标记具体可为fam荧光标记。
dna片段乙的一个末端具有荧光淬灭基团,另一个末端具有封闭基团。具体的,dna片段乙的一个末端的脱氧核糖核苷酸具有荧光淬灭基团,另一个末端的脱氧核糖核苷酸具有封闭基团。更具体的,dna片段乙5’末端的脱氧核糖核苷酸具有荧光淬灭基团,3’末端的脱氧核糖核苷酸具有封闭基团。
荧光淬灭基团具体可为bhq1荧光淬灭基团。
封闭基团具体可为c3-spacer、磷酸盐、生物素-teg或胺。
检测目标核酸的成套试剂还可包括rpa酶。
检测目标核酸的成套试剂可由引物对x、探针x和rpa酶组成。
纸微流控芯片具体可由两个反应单元、一个反应单元或三个反应单元组成。
当纸微流控芯片由一个反应单元组成时,进行目标核酸检测时,反应单元的点样区域中滴加待测溶液。
当纸微流控芯片由两个反应单元组成时,进行目标核酸检测时,一个反应单元的点样区域中滴加待测溶液,另一个反应单元的点样区域中滴加阴性对照或阳性对照。
当纸微流控芯片由三个反应单元组成时,进行目标核酸检测时,第一个反应单元的点样区域中滴加待测溶液,第二个反应单元的点样区域中滴加阴性对照,第三个反应单元的点样区域中滴加阳性对照。
本发明还保护制备检测目标核酸的纸微流控芯片的方法,可包括如下步骤:
(1)制备上述任一所述纸微流控芯片;
(2)制备上述任一所述的检测目标核酸的成套试剂;
(3)向步骤(1)制备的纸微流控芯片的反应垫上滴加步骤(2)制备的检测目标核酸的成套试剂,30-40℃(如30-35℃、35-40℃、30℃、35℃或40℃)烘干20-40min(如20-30min、30-40min、20min、30min或40min),得到检测目标核酸的纸微流控芯片。
本发明还保护采用上述任一所述的纸微流控芯片(已含有检测目标核酸的成套试剂)检测目标核酸的方法,可包括如下步骤:
(1)取上述任一所述的纸微流控芯片,向其中一个反应单元的点样区域中滴加待测溶液,然后使层a和层b紧密接触,37-42℃(如37-39℃、39-42℃、37℃、39℃或42℃)反应20-40min(如20-30min、30-40min、20min、30min或40min);
(2)完成步骤(1)后,取所述纸微流控芯片,进行如下判断:如果滴加待测溶液的反应垫呈现荧光,则待测溶液中含有目的核酸,否则待测溶液中不含有目的核酸。
本发明还保护采用上述任一所述的纸微流控芯片(未含有检测目标核酸的成套试剂)检测目标核酸的方法,可包括如下步骤:
(1)取上述任一所述的纸微流控芯片,向反应垫上滴加上述任一所述“检测目标核酸的成套试剂”,30-40℃(如30-35℃、35-40℃、30℃、35℃或40℃)烘干20-40min(如20-30min、30-40min、20min、30min或40min);
(2)完成步骤(1)后,取所述纸微流控芯片,向其中一个反应单元的点样区域中滴加待测溶液,然后使层a和层b紧密接触,37-42℃(如37-39℃、39-42℃、37℃、39℃或42℃)反应20-40min(如20-30min、30-40min、20min、30min或40min);
(3)完成步骤(2)后,取所述纸微流控芯片,进行如下判断:如果滴加待测溶液的反应垫呈现荧光,则待测溶液中含有目的核酸,否则待测溶液中不含有目的核酸。
上述任一所述方法中,如果所述纸微流控芯片由两个反应单元组成,则一个反应单元的点样区域中滴加待测溶液,另一个反应单元的点样区域中滴加阴性对照(或阳性对照),进行结果判断的原则如下:如果滴加待测溶液的反应垫呈现荧光且相应的滴加阴性对照的反应垫无荧光(或相应的滴加阳性对照的反应垫呈现荧光),则待测溶液中含有目的核酸,否则待测溶液中不含有目的核酸。
上述任一所述方法中,如果所述纸微流控芯片由三个反应单元组成,则第一个反应单元的点样区域中滴加待测溶液,第二个反应单元的点样区域中滴加阴性对照,第三个反应单元的点样区域中滴加阳性对照,进行结果判断的原则如下:如果滴加待测溶液的反应垫呈现荧光、相应的滴加阴性对照的反应垫无荧光且相应的滴加阳性对照的反应垫呈现荧光,则待测溶液中含有目的核酸,否则待测溶液中不含有目的核酸。
上文中,层a中反应垫上的“检测目标核酸的成套试剂”可以相同(用于检测相同的目标核酸),也可以不同(用于检测不同的目标核酸)。
上文中,待测溶液包括待测核酸、醋酸镁水溶液和再生水化液。
待测溶液具体可由待测核酸、醋酸镁水溶液、再生水化液和水组成。
待测溶液具体可由0.6体积份待测核酸和24.4体积份混合溶液组成。
阴性对照具体可由0.6体积份水和24.4体积份混合溶液组成。
48.8体积份混合溶液具体可由2.5体积份醋酸镁水溶液(浓度为280mm)、29.5体积份再生水化液和16.8体积份水组成。
再生水化液具体可为twistdx公司的产品。
实验证明,本发明提供的纸微流控芯片可以快速检测目标核酸,且成本低廉、准确率高。本发明具有重要的应用价值。
附图说明
图1为由一个反应单元组成的快速检测目标核酸的纸微流控芯片的结构示意图。
图2为由两个反应单元组成的快速检测目标核酸的纸微流控芯片的结构示意图。
图3为由三个反应单元组成的快速检测目标核酸的纸微流控芯片的结构示意图。
图4为快速检测油菜茎基溃疡病菌和/或油菜黑胫病菌的纸微流控芯片的结构示意图。
图5为实施例2中步骤四2的实验结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
下述实施例中,亲水材料为玻璃纤维、滤纸或聚醚砜。
下述实施例中,疏水材料为石蜡、光刻胶、聚苯乙烯或烷基烯酮二聚体。
含rpa酶的干粉为twistdx公司的产品,产品目录号为taexo02kit。
实施例1、快速检测目标核酸的纸微流控芯片的制备
一、引物和探针的合成
根据目标核酸的序列,设计基于rpa技术的引物和探针,设计原则如下:
(1)上游引物和下游引物的长度均为30-35bp;引物对由上游引物和下游引物组成;
(2)探针长度为45-60bp,从5’至3’依次包括dna片段甲、四氢呋喃(tetrahydrofuran,thf)(四氢呋喃为外切酶exo的切断位点)和dna片段乙;dna片段甲为30-40个核苷酸组成的单链dna分子;dna片段甲和dna片段乙分别与引物对的靶序列上的两个区段部分相同且两个区段在靶序列上无重叠;四氢呋喃上游紧挨的脱氧核糖核苷酸具有荧光标记,四氢呋喃下游紧挨的脱氧核糖核苷酸具有荧光淬灭基团bhq1;探针3’末端的脱氧核糖核苷酸具有封闭基团c3标记(目的为阻断探针延伸);
(3)两个引物和探针的序列尽可能不重叠,以避免出现引物和探针的二聚体结构和二级结构,扩增产物长度在100-200bp之间,以达到最佳扩增效率。
人工合成上游引物、下游引物和探针。
二、引物探针溶液的制备
将2.1μl上游引物(浓度为10μm)、2.1μl下游引物(浓度为10μm)和0.6μl探针(浓度为10μm)和45.2μl水混合,然后加入适量含rpa酶的干粉,充分溶解,得到引物探针溶液。
三、制备快速检测目标核酸的纸微流控芯片
快速检测目标核酸的纸微流控芯片的结构示意图见图1(由一个反应单元组成)、图2(由两个反应单元组成)和图3(由三个反应单元组成)。
制备图2所示的快速检测目标核酸的纸微流控芯片。
快速检测目标核酸的纸微流控芯片包括层a和层b,层a和层b折叠连接。
层a上设置2n个(n为1以上的自然数)圆形反应垫(由亲水材料制作而成),圆形反应垫分为两列,每列n个;除圆形反应垫外,层a的其余位置覆盖疏水材料。每行的2个反应垫上均滴加同一种引物探针溶液,37℃烘干0.5h。各行反应垫上滴加的引物探针溶液可以相同(用于检测相同的目标核酸),也可以不同(用于检测不同的目标核酸)。
层b上设置两个点样区域,其中一个点样区域完全覆盖层a上的一列圆形反应垫,另一个点样区域则完全覆盖层a上的另一列圆形反应垫。点样区域由亲水材料制作而成;除两个点样区域外,层b的其余位置覆盖疏水材料。
使用时,层b的一个点样区域中滴加待测溶液,另一个点样区域滴加水(阴性对照),然后折叠层a和层b,用小夹子夹住四周(目的为使层a和层b紧密接触),39℃静止30min;之后在暗处用便携式荧光观测镜观察圆形反应垫,进行如下判断:如果滴加待测溶液的反应垫呈现荧光且相应的滴加水的反应垫无荧光,则待测溶液中含有目的核酸,否则待测溶液中不含有目的核酸。
具体的,快速检测目标核酸的纸微流控芯片的层a和层b规格均为30mm×30mm。
实施例2、快速检测油菜茎基溃疡病菌和/或油菜黑胫病菌的纸微流控芯片的制备及其应用
一、引物和探针的合成
1、油菜茎基溃疡病菌的引物和探针的合成
根据油菜茎基溃疡病菌(leptosphaeriamaculans(l.maculans))的核酸序列和实施例1中步骤一的设计原则,设计的引物和探针的核苷酸序列如下:
引物l.maculans-f:5’-actgccgcctcgatcagtggcggcagtctac-3’;
引物l.maculans-r:5’-ttgcaagtggttttaggggatccaattggtg-3’;
探针l.maculans-p:5’
-actgccgcctcgatcagtggcggcagtctac
上述探针l.maculans-p中,自5’末端起第32位所示的胸腺嘧啶脱氧核苷酸(方框所示)具有fam荧光标记,第33位所示的胸腺嘧啶脱氧核苷酸(双下划线所示)具有bhq1荧光淬灭基团;3’末端的c3spacer为用封闭基团c3封闭以阻断探针l.maculans-p延伸。
人工合成引物l.maculans-f、引物l.maculans-r和探针l.maculans-p。
2、油菜黑胫病菌的引物和探针的合成
根据油菜黑胫病菌leptosphaeriabiglobosa(l.biglobosa)的核酸序列和实施例1中步骤一的设计原则,设计的引物和探针的核苷酸序列如下:
引物l.biglobosa-f:5’-cccttctatcaggggattggtgtcagcatttcgg-3’;
引物l.biglobosa-r:5’-ttacaagtggtttgaattgtccttttggcaggc-3’;
探针l.biglobosa-p:5’
-cccttctatcaggggattggtgtcagcatttcggccttt
上述探针l.biglobosa-p中,自5’末端起第40位所示的胸腺嘧啶脱氧核苷酸(方框所示)具有fam荧光标记,第41位所示的胸腺嘧啶脱氧核苷酸(双下划线所示)具有bhq1荧光淬灭基团;3’末端的c3spacer为用封闭基团c3封闭以阻断探针l.biglobosa-p延伸。
人工合成引物l.biglobosa-f、引物l.biglobosa-r和探针l.biglobosa-p。
二、引物探针溶液的制备
1、油菜茎基溃疡病菌引物探针溶液的制备
将2.1μl引物l.maculans-f(浓度为10μm)、2.1μl引物l.maculans-r(浓度为10μm)和0.6μl探针l.maculans-p(浓度为10μm)和45.2μl水混合,然后加入适量含rpa酶的干粉,充分溶解,得到油菜茎基溃疡病菌引物探针溶液。
2、油菜黑胫病菌引物探针溶液的制备
将2.1μl引物l.biglobosa-f(浓度为10μm)、2.1μl引物l.biglobosa-r(浓度为10μm)和0.6μl探针l.biglobosa-p(浓度为10μm)和45.2μl水混合,然后加入适量含rpa酶的干粉,充分溶解,得到油菜黑胫病菌引物探针溶液。
三、快速检测油菜茎基溃疡病菌和/或油菜黑胫病菌的纸微流控芯片的制备
快速检测油菜茎基溃疡病菌和/或油菜黑胫病菌的纸微流控芯片的结构示意图见图4。
快速检测油菜茎基溃疡病菌和/或油菜黑胫病菌的纸微流控芯片包括层a和层b,层a和层b折叠连接。层a上设置4个圆形反应垫(由亲水材料制作而成),分别命名为a1、a0、b1和b0,圆形反应垫分为两列,每列2个;除圆形反应垫外,层a的其余位置覆盖疏水材料。在a1和a0上分别滴加24μl油菜茎基溃疡病菌引物探针溶液,在b1和b0上分别滴加24μl油菜黑胫病菌引物探针溶液,37℃烘干0.5h。
层b上设置两个点样区域,分别命名为点样区域0和点样区域1,点样区域0完全覆盖层a上的一列圆形反应垫(包括a1和b1),点样区域1则完全覆盖层a上的另一列圆形反应垫(包括a0和b0)。两个点样区域由亲水材料制作而成;除两个点样区域外,层b的其余位置覆盖疏水材料。
四、采用实施例3制备的纸微流控芯片检测待测油菜是否感染油菜茎基溃疡病菌和/或油菜黑胫病菌
48.8μl混合溶液由2.5μl醋酸镁水溶液(浓度为280mm)、29.5μl再生水化液(twistdx公司的产品)和16.8μl水组成。
1、采用实施例3制备的纸微流控芯片检测待测油菜是否感染油菜茎基溃疡病菌和/或油菜黑胫病菌的方法
(1)将0.6μl待测油菜的基因组dna和24.4μl混合溶液混匀,得到待测样品反应液。将0.6μl水和24.4μl混合溶液混匀,得到空白反应液(作为对照)。
(2)完成步骤(1)后,取实施例3制备的纸微流控芯片,向点样区域0滴加25μl待测样品反应液,向点样区域1滴加25μl空白反应液,然后折叠层a和层b,用小夹子夹住四周(目的为使层a和层b紧密接触),39℃静止30min。
(3)完成步骤(2)后,取所述纸微流控芯片,在暗处用便携式荧光观测镜观察a、a0、b和b0,然后进行如下判断:如果a1呈现荧光且a0无荧光,则待测油菜感染油菜茎基溃疡病菌,否则待测油菜没有感染油菜茎基溃疡病菌;如果b1呈现为荧光且b0无荧光,则待测油菜感染油菜黑胫病菌,否则待测油菜没有感染油菜黑胫病菌。
2、准确性实验
(1)取感染油菜黑胫病菌的油菜,按照步骤1的方法进行检测。
检测结果见图5中a,该油菜感染油菜黑胫病菌,与预期结果完全一致。
(2)取感染油菜茎基溃疡病菌和油菜黑胫病菌的油菜,按照步骤1的方法进行检测。
检测结果见图5中b,该油菜感染茎基溃疡病菌和油菜黑胫病菌,与预期结果完全一致。
由此可见,采用步骤1的方法检测待测油菜是否感染油菜茎基溃疡病菌和/或油菜黑胫病菌具有较高的准确率。
- 还没有人留言评论。精彩留言会获得点赞!