一种白藜芦醇-苯酞杂合类化合物及其制备方法和用途与流程
本发明涉及一种白藜芦醇-苯酞杂合类化合物及其制备方法和用途,属于化学药品制备技术领域。
背景技术:
天然产物白藜芦醇(resveratrol)是一种具有二苯乙烯骨架的植物抗毒素,属于黄酮类的多酚化合物。1939年首次从毛叶藜芦的根部提取而获得,在自然界中广泛存在于葡萄、红酒、桑椹、花生等植物中,具有顺式和反式两种结构,在紫外照射下可以相互转化,自然界中主要以反式结构存在。白藜芦醇是一种天然的具有多酚结构的植物抗毒素,主要存在于葡萄的表皮种子、红酒、桑葚和花生等植物中。它具有广泛的药理作用,如抗癌症、抗氧化、抗菌抗炎、神经作用和对肝脏的保护作用等,但它存在选择性差、结构单一以及生物利用度低等缺点。
苯酞(phthalide),中文名为邻羟甲基苯甲酸内酯,是一类含有异苯并呋喃酮骨架的杂环化合物,也系内酯类化合物,常用于药物和蒽醌类染料中间体的合成。现已发现的苯酞类化合物主要来自天然伞形科植物中,是当归、川芎等中药的有效成分,也存在于芹属、蛇床属等植物及真菌、细菌等微生物的代谢产物中。苯酞类化合物是指一类含有苯酞母核的化合物,其典型特征为苯环与γ-内酯环的双环融合结构。因为苯酞类化合物都具有典型的五元内酯环结构,所以其结构极不稳定,容易受到温度、光照等条件的影响而发生氧化、光热分解反应或结构转化等,这也是自然界中苯酞类化合物数量及结构繁多的重要因素。自然界中的苯酞类化合物结构主要以简单苯酞和二聚体苯酞呈现。国内外众多研究表明,苯酞类化合物具有抗肿瘤、抗炎、镇痛、抑菌、抗病毒、抗氧化、神经保护、改善心血管系统等多种生物活性。苯酞类化合物以其广泛的生理活性和结构可塑性强的独特优势逐渐成为药物化学领域研究的焦点。
近年来,合成苯并呋喃酮类化合物得到了深入研究并取得重要的进展。然而,现有的技术路线中需要使用昂贵的过渡金属催化剂、过量的氧化剂以及苛刻的反应条件等,这些缺陷限制了这些合成方法的实用性。本发明中,具有二苯乙烯结构的紫檀芪进行甲酰化和分子内氧化,在二苯乙烯分子骨架中引入五元内酯环结构,合成出了一系列新型白藜芦醇-苯酞杂合类化合物,在抗炎研究中发挥重要作用。
技术实现要素:
本发明针对现有合成路线的缺点,提供了一种白藜芦醇-苯酞杂合类化合物及其制备方法和用途,具有工艺简单和操作方便等优点。
本发明白藜芦醇-苯酞杂合类化合物,其结构通式如下:
其中:r选自卤素原子、饱和烷基、不饱和烷基、取代烷基、芳基、取代芳基、酰基、氰基、硝基、氨基、取代氨基、羟基、烷氧基中的任意一种。
本发明白藜芦醇-苯酞杂合类化合物的制备方法,是以二苯乙烯类化合物紫檀芪为原料,通过甲酰化和氧化关环在二苯乙烯分子骨架中引入五元内酯环结构,分离提纯后得到目标产物。具体包括如下步骤:
步骤1:向50ml圆底烧瓶中加入1mmol紫檀芪和丙酮,溶解后加入1mmoltbab(四丁基溴化铵)、2mmolk2co3以及1mmol不同取代基的溴代物,55℃搅拌反应,时间因取代基不同而有不同,反应完全后抽滤得滤液,浓缩后柱层析分离得到不同取代基的紫檀芪衍生物;
所述不同取代基的溴代物中的取代基为饱和烷基、不饱和烷基、取代烷基、芳基、取代芳基、酰基、氰基、硝基、氨基、取代氨基、羟基、烷氧基中的任意一种。
所述不同取代基的紫檀芪衍生物的结构通式如下:
其中:r选自卤素原子、饱和烷基、不饱和烷基、取代烷基、芳基、取代芳基、酰基、氰基、硝基、氨基、取代氨基、羟基、烷氧基中的任意一种。
步骤2:向50ml圆底烧瓶中加入步骤1获得的不同取代基的紫檀芪衍生物1mmol,加入乙腈溶解,室温下缓慢滴加2mmoldmf,冰水冷却至0℃后缓慢滴加4mmolpocl3,滴毕将圆底烧瓶转至室温搅拌反应,1h后将反应液倒入冰水淬灭,搅拌1h,静置过滤并干燥得亮黄色固体,柱层析分离并浓缩得到紫檀芪衍生物甲酰化产物;
所述紫檀芪衍生物甲酰化产物的结构通式如下:
步骤3:向50ml圆底烧瓶中加入步骤2获得的紫檀芪衍生物甲酰化产物1mmol,室温下加入dmso溶解,冰水冷却至0℃后缓慢滴加含有2mmolnah2po4的溶液和含有30mmolnaclo2的溶液,约20min滴完,滴毕将圆底烧瓶转移至油浴锅中,升温至50℃,反应3h后冷却至室温,分离提纯后得到目标产物。
步骤2中,反应液倒入冰水淬灭后用饱和naoh溶液调节ph值至中性。
步骤2中,所述过滤采用循环水真空泵减压抽滤。
步骤2中,所述柱层析分离时以200-300目硅胶为分离介质,洗脱剂为石油醚、二氯甲烷、乙酸乙酯中的两种或两种以上。
步骤3中,nah2po4溶液和naclo2溶液均为饱和溶液。
步骤3中,所述分离提纯包括萃取、洗涤、干燥、浓缩和薄层色谱纯化过程。所述萃取是以二氯甲烷和乙酸乙酯为萃取剂;所述洗涤为水洗两次和饱和nahco3水洗一次;所述干燥是以无水硫酸钠和无水硫酸镁为干燥剂;所述浓缩采用常压蒸馏、减压蒸馏或旋转蒸发方法将溶剂旋干;所述薄层色谱纯化的展开剂为石油醚、二氯甲烷、乙酸乙酯中的两种或两种以上。
本发明反应过程如下:
本发明白藜芦醇-苯酞杂合类化合物的用途,是在制备炎症抑制剂中的应用。
所述白藜芦醇-苯酞杂合类化合物优选如下:
本发明的有益效果体现在:
1、本发明的合成方法条件较温和,操作简便安全、绿色环保,具有产率高、产物易于纯化等特点;反应过程不需要惰性气体保护,也不需要贵金属催化剂;
2、本发明的合成方法底物适用性广,能兼容多种官能团,制备多种取代基的白藜芦醇-苯酞杂合类化合物。
附图说明
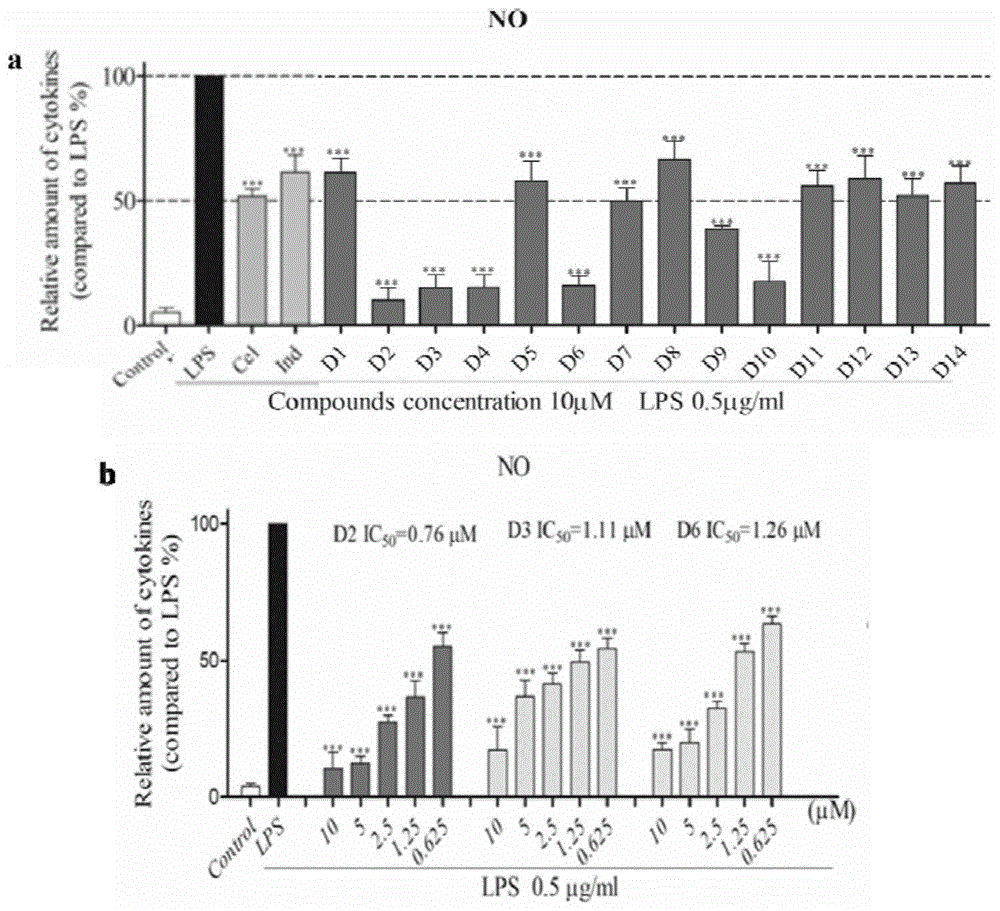
图1是利用griess法测试化合物对促炎因子no的抑制活性。其中a为所有合成的化合物对no的抑制活性,b为化合物活性较突出的化合物d2、d3和d6对no的抑制作用具有浓度依赖性。注:与正常组相比,***p<0.001;与lps刺激组相比,*p<0.05,*p<0.01,*p<0.001。
具体实施方式
为进一步阐述本发明的特征和优点,下面结合具体的实施例对本发明的技术方案进行描述。但下列实施例仅为了进一步说明本发明,而不是限制本发明。
实施例1:3-(羟基(4-甲氧基苯基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d1)的制备
向50ml圆底烧瓶中加入紫檀芪(5mmol,1.28g),加入20ml丙酮溶解,加入tbab(四丁基溴化铵5mmol,1.61g),无水k2co3(10mmol,1.38g),加入溴甲烷(6mmol,330ul),搅拌反应,待反应完全抽滤得滤液,浓缩并用石油醚:乙酸乙酯=3:1作洗脱剂进行柱层析分离(200-300目硅胶)得(e)-1,3-二甲氧基-5-(4-甲氧基苯乙烯基)苯。
取100ml圆底烧瓶中,加入紫檀芪衍生物(2mmol,568mg),加入10ml乙腈溶解,室温缓慢滴加dmf(2mmol,153ul);冰水冷却至0℃左右缓慢滴加pocl3(13mmol,1.2ml);滴毕将圆底烧瓶转至室温搅拌反应,1h后将反应液倒入冰水淬灭并用naoh溶液调ph至中性;搅拌1h,静置抽滤滤并干燥得亮黄色固体。粗产物用二氯甲烷:石油醚=3:1作洗脱剂进行柱层析分离(200-300目硅胶),浓缩得到纯度大于99%的淡黄色固体(e)-2,4-二甲氧基-6-(4-乙氧基苯乙烯)苯甲醛。
取50ml圆底烧瓶,加入(e)-2,4-二甲氧基-6-(4-乙氧基苯乙烯)苯甲醛(b,1mmol,298mg),加入dmso溶解,冰水冷却至0℃左右缓慢滴加nah2po4(2mmol,240mg)饱和水溶液和naclo2(30mmol,2.7g)饱和水溶液,约20min滴完,滴毕将圆底烧瓶转移至油浴锅中,升温至50℃,3h后冷却至室温,用乙酸乙酯和水萃取3次,nahco3溶液洗涤两次、无水硫酸钠干燥、旋转蒸发浓缩后,以乙酸乙酯:石油醚=1:1的展开剂薄层色谱得化合物d1,白色粉末,收率为73.3%,熔点202.3-203.5℃。1hnmr(400mhz,dmso-d6)δ7.26(t,j=9.1hz,2h),6.87(d,j=8.2hz,2h),6.54(s,1h),6.24(s,1h),5.89(d,j=4.7hz,1h),5.52(t,j=8.4hz,1h),4.97(t,j=4.5hz,1h),3.82(s,3h),3.75(d,j=18.7hz,6h).13cnmr(101mhz,cdcl3)δ168.38(s),166.34(s),159.65(s),159.46(s),151.28(s),130.5(s),129.13(s),127.78(s),113.80(s),107.57(s),99.38(s),99.25(s),82.54(s),73.45(s),71.48(s),55.77(s).esims(m/z)353(m+na);hrms(esi)(m/z)calcdforc18h18o6na,353.0996,found,353.1004.
实施例2:3-((4-((4-氟苄基)氧基)苯基)(羟基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d2)的制备
制备方法同实施例1。以4-氟苄溴代替溴甲烷,得白色固体,收率为69.9%,熔点190.5-91.0℃。1hnmr(600mhz,dmso-d6)δ7.56-7.43(m,2h),7.23(d,j=8.4hz,2h),7.19(t,j=8.8hz,2h),6.93(d,j=8.4hz,2h),6.52(s,1h),6.21(s,1h),5.85(s,1h),5.60-5.44(m,1h),5.05(s,2h),4.95(d,j=3.8hz,1h),3.86-3.65(m,6h).13cnmr(101mhz,cdcl3)δ168.13(s),166.14(s),163.74(s),161.34(s),159.48(s),158.60(s),151.07(s),132.56(s),130.68(s),129.35(s),129.26(s),127.84(s),115.64(s),115.43(s),115.14(s),114.85(s),107.60(s),99.34(s),99.25(s),82.34(s),73.70(s),69.37(s),55.95(s),55.73(s).esims(m/z)425(m+h);hrms(esi)(m/z)calcdforc24h22fo6,425.1395,found,425.1426.
实施例3:3-(羟基(4-异丁氧基苯基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d3)的制备
制备方法同实施例1。以1-溴-2-甲基丙烷代替溴甲烷,得白色固体,收率为59.7%,熔点126.6-127.1℃。1hnmr(600mhz,dmso-d6)δ7.20(d,j=8.6hz,3h),6.83(d,j=8.6hz,3h),6.51(d,j=1.3hz,2h),6.22(s,2h),5.84(s,2h),5.50(d,j=4.4hz,2h),4.93(d,j=3.9hz,2h),3.77(d,j=25.0hz,6h),3.69(d,j=6.5hz,3h),2.01-1.93(m,2h),0.95(dd,j=19.2,6.8hz,9h).13cnmr(101mhz,cdcl3)δ168.40(s),166.09(s),159.34(s),159.20(s),151.26(s),130.18(s),127.73(s),114.49(d,j=17.5hz),107.57(s),99.38(s),99.20(s),82.64(s),74.50(s),73.50(s),55.88(s),55.77(s),28.16(d,j=18.2hz),19.16(d,j=15.7hz).esims(m/z)373(m+h);hrms(esi)(m/z)calcdforc21h25o6,373.1646,found,373.1677.
实施例4:3-(羟基(4-(3-甲氧基丙氧基)苯基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d4)的制备
制备方法同实施例1。以1-溴-3-甲氧基丙烷代替溴甲烷,得白色固体,收率为66.2%,熔点100.8-103.9℃。1hnmr(600mhz,dmso-d6)δ7.22(d,j=8.6hz,2h),6.84(d,j=8.6hz,2h),6.52(s,1h),6.22(s,1h),5.83(d,j=4.8hz,1h),5.50(d,j=4.3hz,1h),4.94(t,j=4.5hz,1h),3.97(t,j=6.4hz,2h),3.80(s,3h),3.76(s,3h),3.44(t,j=6.3hz,2h),3.22(s,3h),1.90(p,j=6.3hz,2h).13cnmr(101mhz,cdcl3)δ168.32(s),166.10(s),159.36(s),158.94(s),151.23(s),130.35(s),127.75(s),114.40(s),107.58(s),99.38(s),99.20(s),82.57(s),73.53(s),69.19(s),64.91(s),58.71(s),55.90(s),55.78(s),29.55(s).esims(m/z)411(m+na);hrms(esi)(m/z)calcdforc21h25o6,411.1414,found,411.1426.
实施例5:3-(羟基(4-(2-苯氧基乙氧基)苯基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d5)的制备
制备方法同实施例1。以2-苯氧乙基溴代替溴甲烷,得白色固体,收率为57.4%,熔点96.9-97.3℃。1hnmr(400mhz,cdcl3)δ7.36-7.31(m,4h),6.96(d,j=8.4hz,5h),6.40(s,1h),6.03(s,1h),5.47(d,j=4.4hz,1h),5.13(d,j=4.3hz,1h),4.34(s,4h),3.91(s,3h),3.74(s,3h).13cnmr(101mhz,cdcl3)δ168.24(s),166.13(s),159.33(s),158.58-158.56(m),151.17(s),130.98(s),129.53(s),127.86(s),121.16(s),114.68(s),114.57(s),107.50(s),99.43(s),99.19(s),82.56(s),73.38(s),66.67(s),66.44(s),55.92(s),55.80(s),42.63(s).esims(m/z)459(m+na);hrms(esi)(m/z)calcdforc25h24o7na,459.1414,found,459.1419.
实施例6:3-((4-(丁-3-烯-1-基氧基)苯基)(羟基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d6)的制备
制备方法同实施例1。以4-溴-1-丁烯代替溴甲烷,得白色固体,收率为54.7%,熔点95.2-96.9℃。1hnmr(400mhz,dmso-d6)δ7.23(d,j=8.4hz,2h),6.86(d,j=8.4hz,2h),6.54(s,1h),6.23(s,1h),5.93-5.78(m,2h),5.52(d,j=4.4hz,1h),5.12-4.89(m,3h),3.94(t,j=6.4hz,2h),3.82(s,3h),3.77(s,3h),2.17(q,j=7.1hz,2h).13cnmr(101mhz,cdcl3)δ168.29(s),166.10(s),159.36(s),159.01(s),151.19(s),137.75(s),130.26(s),127.74(s),115.24(s),114.42(s),107.57(s),99.37(s),99.24(s),82.56(s),73.48(s),67.24(s),55.91(s),55.77(s),42.64(s),30.07(s),28.36(s).esims(m/z)371(m+h);hrms(esi)(m/z)calcdforc21h23o6,371.1495,found,371.1501.
实施例7:3-(羟基(4-(4-甲氧基丁氧基(苯基(甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d7)的制备
制备方法同实施例1。以1-溴-4-甲氧基丁烷代替溴甲烷,得白色固体,收率为58.8%,熔点179.5-182.4℃。1hnmr(400mhz,dmso-d6)δ7.25(t,j=9.5hz,2h),6.86(d,j=8.1hz,2h),6.54(s,1h),6.24(s,1h),5.89(t,j=8.2hz,1h),5.51(dd,j=16.4,4.0hz,1h),4.97(t,j=4.5hz,1h),4.00-3.90(m,2h),3.83(dd,j=23.9,12.5hz,6h),3.34(s,2h),3.23(s,3h),1.77-1.68(m,2h),1.67-1.55(m,2h).13cnmr(101mhz,dmso-d6)δ167.04(s),165.42(s),158.67(s),157.91(s),151.72(s),131.67(s),128.13(s),113.62(s),106.54(s),99.72(s),98.66(s),82.13(d,j=5.0hz),72.39(s),71.48(s),67.10(s),57.77(s),55.79(s),55.68(s),25.60(s),25.50(s).esims(m/z)425(m+h);hrms(esi)(m/z)calcdforc21h23o6,425.1571,found,425.1567.
实施例8:3-(羟基(4-丙氧基苯基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d8)的制备
制备方法同实施例1。以1-溴丙烷代替溴甲烷,得白色固体,收率为62.6%,熔点148.6-149.5℃。1hnmr(600mhz,dmso-d6)δ7.21(d,j=8.6hz,2h),6.84(d,j=8.6hz,2h),6.52(s,1h),6.23(s,1h),5.82(d,j=4.8hz,1h),5.50(d,j=4.3hz,1h),4.93(t,j=4.5hz,1h),3.88(t,j=6.5hz,2h),3.80(s,3h),3.76(s,3h),1.73-1.64(m,2h),0.95(t,j=7.4hz,3h).13cnmr(101mhz,cdcl3)δ168.22(s),166.10(s),159.41(s),159.17(s),151.11(s),130.01(s),127.70(s),114.46(s),99.30(d,j=8.1hz),82.49(s),73.61(s),69.61(s),55.93(s),55.76(s),22.55(s),10.49(s).esims(m/z)381(m+h);hrms(esi)(m/z)calcdforc21h23o6,381.1309.,found,381.1337.
实施例9:3-((4-(己氧基)苯基)(羟基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d9)的制备
制备方法同实施例1。以溴己烷代替溴甲烷,得白色固体,收率为67.1%,熔点157.6-158.5℃。1hnmr(600mhz,dmso-d6)δ7.21(d,j=8.5hz,2h),6.84(d,j=8.6hz,2h),6.52(s,1h),6.22(s,1h),5.82(d,j=4.8hz,1h),5.50(d,j=4.4hz,1h),4.93(t,j=4.5hz,1h),3.95-3.85(m,2h),3.80(s,3h),3.76(s,3h),1.73-1.58(m,2h),1.36(dd,j=26.6,19.3hz,2h),1.27(dd,j=23.3,19.7hz,4h),0.86(t,j=6.9hz,3h).13cnmr(101mhz,cdcl3)δ168.27(s),166.10(s),159.39(s),159.15(s),151.15(s),130.04(s),127.71(s),114.44(s),107.62(s),99.36(s),99.25(s),82.54(s),73.57(s),68.12(s),55.92(s),55.77(s),31.58(s),29.20(s),25.70(s),22.60(s),14.03(s).esims(m/z)401(m+h);hrms(esi)(m/z)calcdforc23h29o6,401.1959.,found,401.1990.
实施例10:3-((4-丁氧基苯基)(羟基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d10)的制备
制备方法同实施例1。以溴代正丁烷代替溴甲烷,得白色固体,收率为58.9%,熔点205.8-206.4℃。1hnmr(600mhz,dmso-d6)δ7.22(t,j=11.4hz,2h),6.83(d,j=8.5hz,2h),6.51(s,1h),6.21(s,1h),5.84(d,j=4.8hz,1h),5.49(t,j=12.0hz,1h),4.93(t,j=4.5hz,1h),3.98-3.87(m,2h),3.79(s,3h),3.75(s,3h),1.75-1.59(m,2h),1.47-1.32(m,2h),0.90(t,j=7.4hz,3h).13cnmr(101mhz,cdcl3)δ168.25(s),166.10(s),159.40(s),159.16(s),151.14(s),130.04(s),127.71(s),114.45(s),107.63(s),99.35(s),99.26(s),82.52(s),73.58(s),67.79(s),55.93(s),55.76(s),31.28(s),19.23(s),13.84(s).esims(m/z)395(m+na);hrms(esi)(m/z)calcdforc21h23o6,395.1465.,found,395.1494.
实施例11:3-((4-乙氧基苯基)(羟基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d11)的制备
制备方法同实施例1。以溴乙烷代替溴甲烷,得白色固体,收率为64.4%,熔点154.1-154.8℃。1hnmr(600mhz,dmso-d6)δ7.21(d,j=8.6hz,2h),6.83(d,j=8.6hz,2h),6.51(s,1h),6.21(s,1h),5.85(d,j=4.8hz,1h),5.49(t,j=11.2hz,1h),4.94(t,j=4.6hz,1h),3.98(dq,j=13.9,7.0hz,2h),3.79(s,3h),3.75(s,3h),1.28(t,j=6.9hz,3h).13cnmr(101mhz,cdcl3)δ168.21-168.12(m),166.11(s),159.44(s),158.99(s),151.07(s),130.01(s),127.71(s),114.45(s),107.71-107.53(m),99.33(s),99.28(s),82.43(s),73.65(s),63.54(s),55.95(s),55.76(s),4.80(s).esims(m/z)345(m+h);hrms(esi)(m/z)calcdforc19h21o6,345.1333,found,345.1361.
实施例12:3-(羟基(4-(2-甲氧基乙氧基)苯基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d12)的制备
制备方法同实施例1。以2-溴乙基甲基醚代替溴甲烷,得白色固体,收率为66.0%,熔点102.6-103.4℃。1hnmr(600mhz,dmso-d6)δ7.22(t,j=11.6hz,2h),6.85(d,j=8.7hz,2h),6.51(d,j=1.4hz,1h),6.21(s,1h),5.86(d,j=4.8hz,1h),5.48(dd,j=23.3,4.2hz,1h),4.99-4.89(m,1h),4.08-3.99(m,2h),3.80(d,j=5.8hz,3h),3.75(s,3h),3.65-3.57(m,2h),3.27(s,3h).13cnmr(101mhz,cdcl3)δ168.25(s),166.12(s),159.40(s),158.76(s),151.09(s),132.69(s),130.54(s),127.73(s),114.69(s),114.54(s),107.59(s),99.34(s),99.22(s),73.51(s),71.01(s),67.35(s),59.24(s),55.92(s),55.79(s).esims(m/z)375(m+h);hrms(esi)(m/z)calcdforc20h23o7,375.1438,found,375.1471.
实施例13:3-((4-(仲丁氧基)苯基)(羟基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d13)的制备
制备方法同实施例1。以2-溴丁烷代替溴甲烷,得白色固体,收率为53.8%,熔点155.5-156.7℃。1hnmr(400mhz,dmso-d6)δ7.24(d,j=8.3hz,2h),6.86(d,j=8.1hz,2h),6.54(s,1h),6.20(s,1h),5.86(s,1h),5.51(dd,j=15.5,4.2hz,1h),4.95(s,1h),4.37(dd,j=11.9,5.9hz,1h),3.82(s,3h),3.76(s,3h),1.60(ddt,j=26.1,13.1,6.6hz,2h),1.20(d,j=6.0hz,3h),0.91(t,j=7.4hz,3h).13cnmr(101mhz,dmso-d6)δ167.11(s),165.42(s),158.66(s),157.09(s),151.78(s),131.66(s),128.15(s),114.90(s),106.49(s),99.57(d,j=13.3hz),98.72(d,j=12.9hz),82.03(d,j=10.1hz),73.97(s),72.34(s),55.70(d,j=2.6hz),28.47(s),18.94(d,j=6.4hz),9.47(s).esims(m/z)373(m+h);hrms(esi)(m/z)calcdforc21h25o6,373.1646,found,373.1675.
实施例14:3-((4-(2-乙氧基乙氧基)苯基)(羟基)甲基)-5,7-二甲基异苯并呋喃-1(3h)-酮(化合物d14)的制备
制备方法同实施例1。以1-溴-3-甲氧基丙烷代替溴甲烷,得白色固体,收率为48.5%,熔点192.0-192.7℃。1hnmr(400mhz,dmso-d6)δ7.24(d,j=8.3hz,2h),6.88(d,j=8.2hz,2h),6.54(s,1h),6.23(s,1h),5.87(d,j=4.7hz,1h),5.53(d,j=4.3hz,1h),4.96(t,j=4.4hz,1h),4.10-4.00(m,2h),3.80(d,j=17.2hz,6h),3.73-3.61(m,2h),3.49(q,j=7.0hz,2h),1.12(t,j=7.0hz,3h).13cnmr(101mhz,dmso-d6)δ167.08(s),165.45(s),158.68(s),157.80(s),151.69(s),131.85(s),128.14(s),113.61(s),106.59(s),99.72(s),98.66(s),82.15(s),72.37(s),68.32(s),67.02(s),65.65(s),55.79(s),55.67(s),15.05(s).esims(m/z)389(m+h);hrms(esi)(m/z)calcdforc21h25o7,389.1595,found,389.1625.
实施例15:白藜芦醇-苯酞杂合类衍生物(化合物d1-14)对促炎因子no的抑制活性
我们利用griess法测定lps刺激raw264.7细胞产生的no含量,操作步骤如下:将在对数生长期的raw264.7细胞接种到48孔板中,培养24h。将实验分为三组即空白组(不加lps)、对照组(lps刺激组)和不同浓度的化合物加药组,使其混合均匀,继续培养24h,之后弃去上清液,加入griessreagent,室温放置半小时,后利用酶标仪测量各孔的吸光度值,计算待测样品对no的抑制率。结果如图1所示。从图1中可以看出大部分化合物对促炎因子no都具有抑制活性,其中化合物d2、d3、d6抑制活性较显著,特别是化合物d2对no抑制活性最佳(ic50为0.76μm),有望成为有效的炎症抑制剂。
- 还没有人留言评论。精彩留言会获得点赞!