一种用于几丁寡糖制备的几丁质酶及其基因的制作方法
本发明属于生物技术领域,具体涉及一种用于几丁寡糖制备的几丁质酶及其基因。
技术背景
海洋环境可以提供有巨大应用潜力的新的化合物,比如具有潜在市场价值的酶,尽管海洋环境中不断产生着甲壳类废物,但是在海洋沉积物中却是鲜有见到。这些现象说明在海洋环境中广泛分布着丰富的产几丁质酶的微生物,这些来源于海洋环境的微生物产生的几丁质酶将几丁质水解,完成自然界对几丁质的加工。据报道,海洋细菌alteromonassp.strain0-7,micrococcussp.ag84,pseudoalteromonassp.dl-6,vibriofurnissii,aeromonascaviae和pseudoalteromonassp.dxk012可以将几丁质降解为几丁寡糖供其代谢或被其他微生物作为唯一的碳氮来源。除此之外,从韩国济州岛沿海地区的苔藓虫分离得到的vibriosp.98cj11027产生的外切几丁质酶被纯化后用来生产几丁二糖。据报道,有一些细菌,包括acinetobacterask18,alcaligenesfaecalisau02,vibrio(aestuarianus,flavobacterium,shewenellaandexiguobacterium)等都是从海洋废弃物、沿海地区沉积土壤、海产品工业废水和甲壳类废物中分离得到的,这些环境样品都是几丁质酶的主要来源。
几丁质(chitin)又叫甲壳素、甲壳质、蟹壳素或明角壳蛋白,是存在于自然界中除纤维素之外的第二大类丰富的多糖,是由n-乙酰-d-氨基葡萄糖(glcnac)以β-1,4糖苷键连接而成的高分子聚合物,不溶于水和绝大多数有机溶剂,溶于浓盐酸和浓硫酸,是真菌细胞壁,昆虫外骨骼和甲壳动物壳的主要结构成分。几丁质酶(chitinase,ec3.2.2.14)是糖基水解酶,其特征在于水解几丁质链中的n-乙酰氨基葡萄糖的β-1,4糖苷键。几丁质酶的最适ph值一般为1.0-8.0,等电点为3.1-10.0。大多数几丁质酶的最适反应温度为40-60°c,热稳定性良好,一般在40-60°c条件下较为稳定。许多金属离子尤其是重金属离子如ag+、cu2+、zn2+、hg2+、co2+和fe3+等对几丁质酶活力有不同程度的影响。根据氨基酸序列保守型,几丁质酶分属于18,19,和20家族糖苷水解酶。根据细菌几丁质酶催化结构域的相似性,将18家族几丁质酶进一步划分为a、b、c三个亚家族。亚家族a几丁质酶的催化结构域中包含一段几丁质酶插入结构域(cid),是亚家族a的主要结构特征。
几丁质酶是专一降解几丁质为几丁寡糖或单糖的一组酶的总称,根据其作用的部位分为外切几丁质酶和内切几丁质酶。外切几丁质酶一般又分为几丁二糖酶和n-乙酰基葡糖苷酶,内切几丁质酶随机水解几丁质链生成几丁寡糖(glcnac)n,n>2。几丁二糖酶水解几丁质多糖链的一端或几丁寡糖生成n-乙酰-d-氨基葡萄糖二聚体(glcnac)2,n-乙酰基葡糖苷酶则可以水解几丁质多糖链的一端或(glcnac)2生成n-乙酰-d-氨基葡萄糖(glcnac)单体。
到目前为止,不同来源的几丁质酶已在大肠杆菌,毕赤酵母中成功表达。例如,2018年,lee等人在大肠杆菌bl21(de3)中成功表达来源于microbulbiferthermotoleransdau221的耐盐几丁质酶mtch509;李淑江等人将streptomycessampsoniikj40中的几丁质酶基因chikj406136在大肠杆菌bl21(de3)中表达,重组蛋白具有抗真菌作用;李高等人在streptomycesalbolongusatcc27414中克隆了一种新的几丁质酶基因,并在大肠杆菌bl21中成功表达。2019年,menghiu等人在毕赤酵母中成功表达来源于bacilluslicheniformisdsm8785的几丁质酶a。
大肠杆菌表达系统研究的比较清楚,而且易操作,生长周期短,然而,在大肠杆菌中异源表达的蛋白质易于形成包涵体。胞内酶的表达需要机械破坏以从细胞中释放,这可能导致酶失活或酶活性降低,限制了几丁质酶的大规模生产和应用。此外,毕赤酵母操作复杂,其生长周期较长但是具有高拷贝,高密度发酵,表达基因稳定在宿主基因组中等优点,因此选择合适的宿主也至关重要。
技术实现要素:
本发明的主要目的在于提供一种用于几丁寡糖制备的几丁质酶及其基因,以及将其在大肠杆菌和酵母细胞中克隆表达的方法,提供具有潜在应用价值的新酶源。
为实现上述目的,采用以下技术方案:
本发明的几丁质酶,所述几丁质酶的基因核苷酸序列如seqidno.1所示;几丁质酶的氨基酸序列如seqidno.2所示。
含有几丁质酶基因的重组载体是几丁质酶基因连接至大肠杆菌质粒或酵母质粒的重组载体;优选的所述重组载体为pet-28a(+)-chi1602或ppic9k-chi1602。
含有几丁质酶的基因的细胞选大肠杆菌细胞或酵母细胞为受体细胞;所述细胞由所述重组载体转化而得;所述细胞是包含所述核苷酸分子或用所述重组载体转化的大肠杆菌或包含所述核酸分子或用所述重组载体转化的毕氏酵母。
具体为:
本发明涉及从海洋环境中筛选几丁质酶产生菌及克隆几丁质酶基因。实施方式之一,本发明提取microbulbifersp.菌株的基因组dna,经测序获得几丁质酶基因全长序列,称之为chi1602。
本发明还涉及包含所述chi1602编码序列的重组载体,由各种本领域常用的表达载体制备的重组载体,其中,所述编码序列不包含来源微生物的内源性信号肽序列。实施方式之一中,将不带内源性信号肽的编码序列即本发明chi1602编码序列经saci和noti双酶切后与saci和noti双酶切的pet-28a(+)载体连接,得到大肠重组表达载体pet-28a(+)-chi1602。另一实施方式中,将不带内源性信号肽编码序列的本发明chi1602编码序列经snabi和avrⅱ双酶切后与snabi和avrⅱ双酶切的ppic9k载体连接,得到酵母重组表达载体ppic9k-chi1602。
本发明还制备包含本发明chi1602编码序列的细胞。实施方式之一中,所述细胞是用上述本发明重组载体转化来构建的。所述受体细胞优选各种利于基因产物表达的细胞,此类细胞为本领域熟知并常用,例如各种大肠杆菌细胞和酵母细胞。在本发明的实施方式之一中,选用大肠杆菌bl21(de3)和毕氏酵母x33构建表达chi1602的重组细胞。
本发明还提供了表达chi1602的方法,包括:培养前文所述包含本发明chi1602编码序列的细胞或所述经转化的细胞,诱导其表达,收获表达产物,还包括纯化表达产物的步骤。实施方式之一中,本发明通过包含本发明chi1602编码序列的酵母(例如毕氏酵母x33)发酵来生产几丁质酶chi1602,并通过阴离子交换层析纯化得到了纯酶形式的目的蛋白。
本发明利用基因工程手段制备了能够高效表达并分泌几丁质酶chi1602的重组生产株,获得了优质的几丁质酶chi1602产品。本发明通过酶活测定、酶学性质分析和底物特异性的分析,证明本发明的chi1602对胶体几丁质有很好的水解能力。
本发明的优点在于:本发明提供了一种新的几丁质酶基因,且异源表达的几丁质酶在广泛的ph范围内均可以保持高活性和稳定性,可以高效降解胶体几丁质产生几丁二糖和n-乙酰-d-氨基葡萄糖,具有应用价值。
附图说明
图1microbulbifersp.来源的chi1602在质粒pmd18-t、pet-28a(+)和ppic9k上的重组子结构图。
图2microbulbifersp.来源的chi1602的sds-page。m:蛋白质marker;1:粗酶液;2:重组几丁质酶chi1602deae柱纯化产物。
图3microbulbifersp.来源的chi1602的最适ph和ph稳定性。a:ph对重组酶chi1602的活性影响;b:重组酶chi1602的ph稳定性。
图4microbulbifersp.来源的chi1602的最适温度和温度稳定性。a:温度对重组酶chi1602的活性影响;b:重组酶chi1602的温度稳定性。
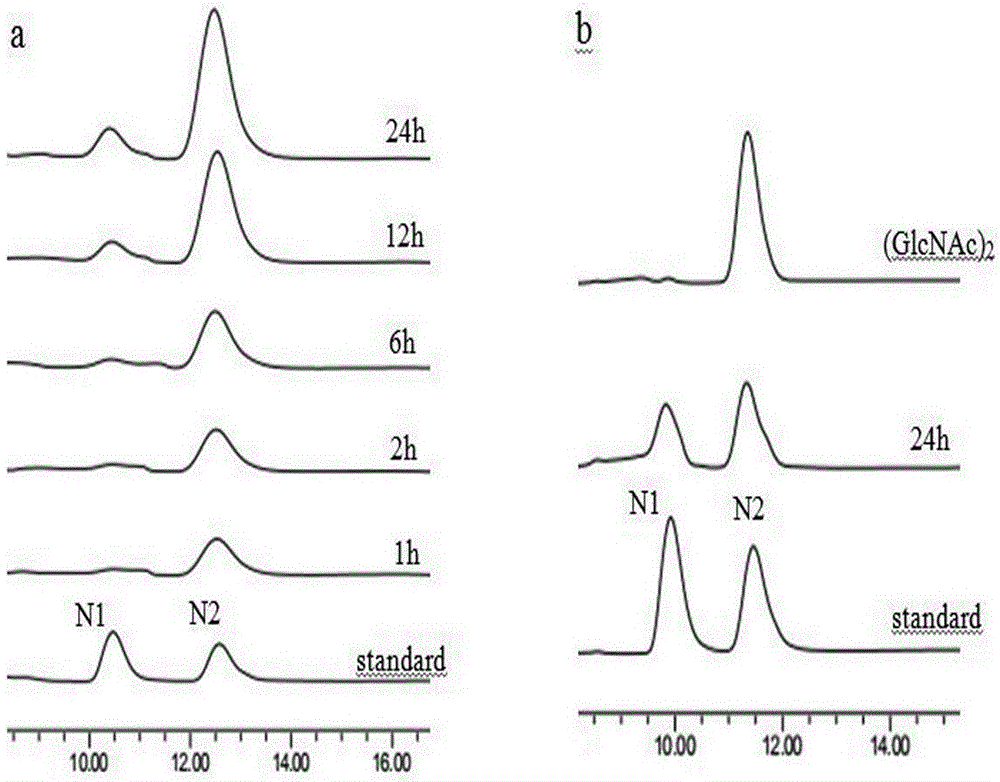
图5microbulbifersp.来源的chi1602降解产物分析。a:降解底物为胶体几丁质;b:降解底物为n-乙酰化壳二糖。n1:n-乙酰-d-氨基葡萄糖(glcnac)n2:n-乙酰化壳二糖((glcnac)2。
具体实施方式
以下根据具体的实施例充分说明本发明。
实验材料和试剂
1、菌株和载体:
大肠杆菌bl21(de3)、top10及表达载体pet-28a(+)购自novagen公司,毕氏酵母x33及表达载体ppic9k均购自invitrogen公司(carlsbad,ca,usa)。
2、酶类及其他生化试剂:
限制性内切酶购自newenglandbiolabs公司,dnamaker购自takara公司、proteinmaker购自全式金公司。
3、培养基:
使用的培养基:
(1)lb液体培养基:蛋白胨(tryptone)10.0g,nacl10.0g,酵母提取物(yeastextract)5.0g,蒸馏水定容至1l,121°c灭菌20min。
(2)lb固体培养基是在lb液体培养基中添加2%(w/v)琼脂粉,121°c灭菌20min。
(3)md培养基:称取15.0g琼脂粉于800ml蒸馏水中,121°c灭菌20min,待冷却至60°c左右,依次加入10×ynb100ml,500×生物素2ml,20%(w/v)葡萄糖100ml。
(4)ypd培养基:酵母粉1%(w/v),蛋白胨2%(w/v),121°c灭菌20min,使用时加入2%(w/v)葡萄糖。固体培养基是在ypd液体培养基加入2%(w/v)的琼脂粉。
(5)ypm培养基:酵母粉1%(w/v),蛋白胨2%(w/v),121°c灭菌20min,使用时加入2%(v/v)甲醇。
4、本发明中所用到的生物化学技术均为本领域中的常规技术。在以下实施例中,除非特殊说明,所有实验操作均按照以下实验手册或文献中的相关章节或部分进行,包括:[美]j.莎姆布鲁克等,分子克隆实验指南;赵永芳等,生物化学技术原理及其应用(第二版);朱检等,生物化学实验[m]。
5.本发明中所有相关的酶活、酶活力、酶活性均是指几丁质酶chi1602活性,均采用dns法并按照所述的方法进行测定及计算。
实施例1几丁质酶基因chi1602的获得
(1)microbulbifersp.基因组dna的分离提取:
取1.5ml菌体培养物microbulbifersp.(购自中国海洋微生物菌种保藏管理中心)于一灭菌ep管中,12000rpm离心1min,弃上清液,收集菌体。
加入400μl裂解液(40mmtris-醋酸,20mm醋酸钠,1mmedta,1%sds,ph7.8)混匀,置于37℃水浴1h。
然后加入200μll5mol/l的氯化钠溶液,混匀后于13000rpm离心15min。
取上清液,用苯酚抽提2次,氯仿抽提1次。
加两倍体积无水乙醇,1/10体积醋酸钾(3m,ph8.0),-20℃保存1h后,13000rpm离心15min,弃上清液,沉淀用70%乙醇洗2次;置于室温干燥后,溶于50μlte溶液中,置4℃保存备用。
(2)pcr获取目的基因
经microbulbifersp.基因组测序分析,得到一条几丁质酶基因序列,根据基因序列分别设计两对上下游引物p1/p2和p3/p4。引物p1和p2分别含有sacⅰ和notⅰ酶切位点,引物p3和p4分别含有snabi和avrⅱ酶切位点。引物由上海铂尚生物科技有限公司合成,引物序列如下:
p1:5'-ttcgagctcctgcaggtatacgtggatgg-3'
p2:5'-gttgcggccgcattgattgctgtgcatggcttcaat-3'
p3:5'-cagtacgtactgcaggtatacgtggatgg-3'
p4:5'-ctccctaggttgattgctgtgcatggcttcaat-3'
本实施例pcr反应体系为50ul(上下游引物各1ul,dntp1ul,基因组1ul,dna聚合酶1ul,ddh2o45ul),程序为:94℃预变性4min;94℃变性30s,52℃退火30s,72℃延伸2min,循环扩增30次;最后72℃延伸10min。扩增结束后取pcr产物进行电泳检测,并回收凝胶中的目标基因。
(4)cdna亚克隆:
pcr扩增制备双链cdna,通过双酶切的方法插入到载体pmd18-t上,得到重组质粒pmd18-t-chi1602(如图1所示),用化学转化法转化到受体菌e.colitop10,在含有100mg/mlamp的lb平板上37℃培养过夜。挑取单克隆菌落接种到2ml含有100mg/mlamp的lb液体培养基中,37℃200rpm培养6-10h,10000rpm离心10min收集菌体,提取质粒,分别用sacⅰ/notⅰ和snabi/avrⅱ进行双酶切,回收目的基因备用(质粒提取和胶回收分别用omega公司的e.z.n.a.plasmidminikiti和e.z.n.a.gelextractionkit试剂盒)。将所得目的基因进行dna序列测定(invitrogen公司),并在ncbi数据库中进行比对分析。
分析结果表明所得几丁质酶的编码序列共有1623bp(seqidno:1),编码不含信号肽的成熟蛋白,该成熟蛋白含有541个氨基酸(seqidno:2)。根据在ncbi数据库同源性比对的结果初步确定所得到的基因片段为几丁质酶基因。
实施例2几丁质酶编码基因chi1602在大肠杆菌中的表达和扩增
将实施例1-(4)中所得到的经seci和noti双酶切的目的基因,与经过seci和noti双酶切的pet-28a(+)质粒连接,得到重组质粒pet-28(a)-chi1602(如图1所示)。
取10ul构建好的质粒dna,加入到100ul制备好的大肠杆菌bl21(de3)感受态细胞中,摇匀置于冰上,冰浴30min;置于42℃水浴中热击45s;将离心管快速移至冰水混合物中冰浴2min;每管加入800ullb液体培养基,于37℃摇床上复苏1h(80rpm~200rpm);4000rpm离心5min,弃800ul上清,剩余部分混匀;涂平板(lb-agar平板,含100ug/mlamp),37℃过夜培养,挑取重组子到lb液体培养基,待菌液浑浊,用菌液pcr的方法验证阳性重组子,pcr产物经1.0%(w/v)琼脂糖凝胶电泳检测,目的条带大小为1600bp左右,与实施例1中从microbulbifersp.中所得到的原始基因chi1602的序列大小一致,将鉴定为阳性重组子的菌液送出测序,进一步验证目的基因序列和插入位点的正确性。
取插入基因正确的重组大肠杆菌菌株bl21(de3),接种于200mllb培养液中(1000ml三角瓶,100ug/mlamp),37℃200rpm震荡培养至od600为0.6-0.8,加入iptg诱导(终浓度为1mmol/l),20℃200rpm再振荡培养10h。取培养液10000rpm离心10min,收集菌体,再加入等体积的无菌水重新悬浮菌体,12000rpm离心10min,取沉淀用1/20体积ph7.4、20mm的tris-hcl缓冲液悬浮菌体,进行超声波破碎,破碎条件为:60%功率,间隔5s破碎10min,停止10min,再破碎10min。12000rpm离心,收集上清液测定重组酶活力,并通过sds-page电泳分析目的蛋白的表达量。
实施例3酵母重组表达载体的构建
将实施例1-(4)中所得到的经snabi和avrⅱ双酶切的目的基因,与经过snabi和avrⅱ双酶切的ppic9k质粒连接,得到重组质粒ppic9k-chi1602(如图1所示)。
将重组质粒转入e.colitop10感受态细胞,涂布在含有100mg/mlamp的lb筛选板上过夜培养,挑取重组子用菌液pcr的方法鉴定,若为阳性重组子,送出测序,测序结果进一步证明目的基因序列和插入位点的正确性。选择插入基因正确的菌液,参照omegaplasmidminikit的提取步骤,提取重组质粒,于-20°c保存备用。
实施例4毕氏酵母发酵生产重组酶chi1602
将实施例3制备的重组质粒ppic9k-chi1602经saci单酶切,得到线性化质粒ppic9k-chi1602。
取20µl已线性化的重组质粒ppic9k-chi1602加入到80µl的毕赤酵母x33感受态细胞中,轻轻吹打混匀;把混合液加入2mm预冷的电转杯中,将电转杯放入已预热30min的电转仪,电击一次;电击完成后,快速加入1ml预冷的山梨醇于电转杯中轻轻吹打悬浮菌液,吸出菌液至灭菌的1.5mlep管中,30°c静置复苏60min;将菌液6000×g离心2min,吸取80µl上清重悬菌体后涂布于md筛选板上;30°c倒置培养3天左右,直至转化子长出。在md平板上生长的为含有重组质粒的阳性克隆子。
挑取重组质粒ppic9k-chi1602转化的毕氏酵母x33菌株阳性克隆子至10mlypd液体培养基,过夜培养。按10.0%(v/v)的添加量将菌液添加到10mlypm培养基中,30°c、200rpm恒温摇床培养3天,每24h添加终浓度为2.0%(v/v)的甲醇诱导表达。将菌液13000rpm离心5min,取上清液测定几丁质酶活力并进行sds-page分析,结果如图2所示。重组chi1602的sds-page分子量与其理论分子量(59.47kda)一致,chi1602的表达水平(以发酵液上清的酶活力表示)达到1.266u/ml,这说明microbulbifersp.来源的几丁质酶基因chi1602在毕氏酵母中得到了表达和积累。
实施例5重组酶chi1602的纯化
按照实施例4方法制备大量发酵培养液,10000rpm离心10min去除菌体,取上清液作为粗酶液。将粗酶液用缓冲液a(50mm的ph8.0的tris-hcl)稀释5倍,以1ml/min的流速加载到deae纤维素柱中,用缓冲液a洗脱弱结合的蛋白至柱平衡,再用缓冲液b(含有1mol·l-1的nacl的50mmph8.0的tris-hcl,)以1ml/min的流速洗脱目的蛋白,收集洗脱液,sds-page测定目的蛋白纯度。
纯化完成后,获得的几丁质酶比活性从粗酶液的3.94u/mg提高到纯酶的5.0u/mg,纯化倍数为1.27倍,得率为34.72%。sds-page结果如图2。
实施例6重组酶chi1602的生化性质表征
1、重组酶的最适反应ph和ph稳定性的测定
重组酶最适反应ph测定:将纯化后的重组酶在50℃条件下,于不同ph(ph3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)的底物中测酶活,以确定其最适反应ph。
重组酶ph稳定性测定:将纯化好的重组酶在不同ph值(ph3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)的缓冲液中于37℃下水浴保温60min后,取酶液于最适ph和温度下分别测定其酶活力。结果显示重组酶chi1602在ph4.0-9.0条件下反应可以保持85%以上的最高活性(图3a所示),同时在ph4.0-9.0范围内具有良好的ph稳定性,实验结果如图3b所示。
2、重组酶最适反应温度和热稳定性的测定
重组酶最适反应温度的测定:将纯化后的重组酶在最适ph底物中,于不同温度(30℃、40℃、50℃、60℃、70℃)条件下反应测定酶活力,以确定其最适反应温度。
重组酶热稳定性测定:将纯化好的重组酶在不同温度(30℃、40℃、50℃、60℃、70℃)下水浴保温处理1h,在最适ph和温度条件下分别测定其剩余酶活力。结果显示chi1602最适反应温度为50℃到60℃之间。实验结果如图4所示。
3、重组酶的底物特异性研究
配制浓度为0.5%(w/v)胶体几丁质、细粉几丁质、壳聚糖、羧甲基纤维素钠(cmc-na),在最适反应条件下测定重组酶活力。以底物为胶体几丁质的酶活设为100%,计算其他底物的相对酶活力。结果显示,chitinase对胶体几丁质具有严格的底物特异性。实验结果如表1所示。
表1microbulbifersp.-g27来源的几丁质酶chi1602的底物特异性。
实施例7重组酶chi1602降解胶体几丁质分析
几丁寡糖是壳聚糖的衍生物,与甲壳素不同的是,几丁寡糖由于其短链得的长度而具有很好的水溶性,容易被机体吸收,并可以在体内完全自然降解。如果采用适当的方式将甲壳素降解,可以得到不同聚合度和乙酰度的几丁寡糖,已有研究显示,不同结构的几丁寡糖,具有不同的药理作用及生物学活性,在提高机体免疫力、抗氧化、抗菌及抗肿瘤方面已逐步显示出优势。因此,通过降解几丁质制备能够被人体直接吸收的几丁寡糖,就成为一个极为有意义的研究。本专利中利用生产的重组酶chi1602来降解胶体几丁质。
反应混合物为900µl1%(w/v)胶体几丁质和100µl0.5u·ml-1的纯化几丁质酶,在50℃孵育不同时间(1h、2h、6h、12h和24h),然后煮沸10min终止反应。采用hplc对重组酶的水解产物进行分析,液相色谱分析使用氨基柱,示差检测器:柱温30°c,流动相为70%(v/v)乙腈,流速为0.5ml·min-1,进样量为20µl。标品为n-乙酰-d-氨基葡萄糖(glcnac)和n-乙酰化壳二糖((glcnac)2。实验结果如图5所示,降解胶体几丁质终产物为(glcnac)2和glcnac,重组酶chi1602同时具有外切几丁质酶活性和n-乙酰基葡糖苷酶活性。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
sequencelisting
<110>福州大学
<120>一种用于几丁寡糖制备的几丁质酶及其基因
<130>6
<160>6
<170>patentinversion3.3
<210>1
<211>1623
<212>dna
<213>seqidno.1
<400>1
ctgcaggtatacgtggatggcagcacctacagcacgggcgacacagtacagaacaactct60
gtggcctacagctgcaaggttggtggctggtgtaccgtcggggggccctacgcgcccggt120
gaaggctgggcatggactgaggcttggtccgatctgggtgcctgtaccggcagctcgtcg180
tccagttcgtcttcatcttcttcctcatcgtccagcagctcctcttccggcggaagctcc240
agcggatcgtccaccagctgcgctggtctaccggtgtgggatgcggcaacagtttatgtc300
ggtggcaacgccgtgcagcactcgagcgcaaaatacaccgccaagtggtggacccaggga360
gacaatccgagcgagagcggcgaatacggcgtgtggcgcaacgatggcaactgctcgggc420
ggctcctcaagttccagctcctcaagttccagctcatccggatcctccggcggctcctcg480
tccagcagttcgtccagtggcgcctcctccagtggcgggagccgactgggtggctacttt540
gttcagtggggcgtttaccagcgcaactaccatgtgaaaaacattgtcaccagtgggtct600
gcagagaaactgacccacatctattacgccttcggcaatgtgcagaacggccagtgcacc660
atcggcgattcctatgccgattacgaccgtttctacagtgcggcagagagtgtggatggc720
caggcggatacctgggatgccggcgcactgcgcggcagtttcaaccagttgcgcaaactg780
aagcagatgtacccgcacatcaaagtgctgtggtcctttggtggctggacctggtccggc840
ggcttcggccaggcgtcgcagaacccgcaggcattcgcggattcctgttacaacctgctg900
cacgacccgcgctgggacggcgtgtttgacggtatcgacctcgactgggaataccccaat960
gcctgcggtctcagctgcgacagcagcggctattcatcactgaccaacgtcatggcggcc1020
atgcgcgcgcgcttcggcgatgaactggtgaccgcggccattaccgccgacgggacggcc1080
ggcggtaagatcgatgcggcggattacgccggcgcctcgcagtacgtcgatttctataac1140
gtcatgacctacgacttcttcggcgcattcgacgcggatggccccaccgcgccgcattcg1200
gctctgtacgactacccgggaattccgaatgccggtttctattccgacagagccattcag1260
gcactgaagaataagggtgtaccggccagtaaactcaacctgggaattggcttctatggc1320
cgcggctggaccggcgtcagtcagtctgccccgggtggctccgcaaccggtgccgccgcc1380
ggcacctacgagccgggcatcgaggactacaaggttttgaagaacacctgcccgtcaacc1440
ggactcgtcgccggcaccgcctacgcgttctgcggcaacaactggtggagctacgacacc1500
ccctctaccatcgccggcaagatgcagtacatcgcagatcaggacctcggcgggtctttc1560
ttctgggaactgagtggtgataccggcaatggcgaactgattgaagccatgcacagcaat1620
caa1623
<210>2
<211>541
<212>prt
<213>seqidno.2
<400>2
leuglnvaltyrvalaspglyserthrtyrserthrglyaspthrval
151015
glnasnasnservalalatyrsercyslysvalglyglytrpcysthr
202530
valglyglyprotyralaproglygluglytrpalatrpthrgluala
354045
trpseraspleuglyalacysthrglyserserserserserserser
505560
serserserserserserserserserserserserglyglyserser
65707580
serglyserserthrsercysalaglyleuprovaltrpaspalaala
859095
thrvaltyrvalglyglyasnalavalglnhisserseralalystyr
100105110
thralalystrptrpthrglnglyaspasnprosergluserglyglu
115120125
tyrglyvaltrpargasnaspglyasncysserglyglyserserser
130135140
serserserserserserserserserglyserserglyglyserser
145150155160
serserserserserserglyalaserserserglyglyserargleu
165170175
glyglytyrphevalglntrpglyvaltyrglnargasntyrhisval
180185190
lysasnilevalthrserglyseralaglulysleuthrhisiletyr
195200205
tyralapheglyasnvalglnasnglyglncysthrileglyaspser
210215220
tyralaasptyraspargphetyrseralaalagluservalaspgly
225230235240
glnalaaspthrtrpaspalaglyalaleuargglyserpheasngln
245250255
leuarglysleulysglnmettyrprohisilelysvalleutrpser
260265270
pheglyglytrpthrtrpserglyglypheglyglnalaserglnasn
275280285
proglnalaphealaaspsercystyrasnleuleuhisaspproarg
290295300
trpaspglyvalpheaspglyileaspleuasptrpglutyrproasn
305310315320
alacysglyleusercysaspserserglytyrserserleuthrasn
325330335
valmetalaalametargalaargpheglyaspgluleuvalthrala
340345350
alailethralaaspglythralaglyglylysileaspalaalaasp
355360365
tyralaglyalaserglntyrvalaspphetyrasnvalmetthrtyr
370375380
aspphepheglyalapheaspalaaspglyprothralaprohisser
385390395400
alaleutyrasptyrproglyileproasnalaglyphetyrserasp
405410415
argalaileglnalaleulysasnlysglyvalproalaserlysleu
420425430
asnleuglyileglyphetyrglyargglytrpthrglyvalsergln
435440445
seralaproglyglyseralathrglyalaalaalaglythrtyrglu
450455460
proglyilegluasptyrlysvalleulysasnthrcysproserthr
465470475480
glyleuvalalaglythralatyralaphecysglyasnasntrptrp
485490495
sertyraspthrproserthrilealaglylysmetglntyrileala
500505510
aspglnaspleuglyglyserphephetrpgluleuserglyaspthr
515520525
glyasnglygluleuileglualamethisserasngln
530535540
<210>3
<211>29
<212>dna
<213>p1
<400>3
ttcgagctcctgcaggtatacgtggatgg29
<210>4
<211>36
<212>dna
<213>p2
<400>4
gttgcggccgcattgattgctgtgcatggcttcaat36
<210>5
<211>29
<212>dna
<213>p3
<400>5
cagtacgtactgcaggtatacgtggatgg29
<210>6
<211>33
<212>dna
<213>p4
<400>6
ctccctaggttgattgctgtgcatggcttcaat33
- 还没有人留言评论。精彩留言会获得点赞!