具有神经保护活性的多酚类化合物及其制备方法与流程
本发明属于医药技术领域,涉及猴耳环中多酚类化合物及其制备方法,本发明还涉及所述的多酚类化合物在制备神经退行性疾病药物中的应用。
背景技术:
神经退行性疾病(neurodegenerativediseases)是以发作迟缓和选择性神经元的功能障碍为特征表现,由于大脑和脊髓的神经元细胞丧失而引起的一类不可逆转的神经系统疾病,主要包括阿尔兹海默病(alzheimerdisease,ad)、帕金森氏病(parkinson′sdisease,pd)和亨廷顿氏病(huntington′sdisease,hd)等。据现代研究表明,其发病机制可能包括如下几方面:(1)遗传因素(2)蛋白质异常堆积(3)氧化应激(4)金属离子紊乱(5)dna损伤修复(6)能量代谢障碍等。
猴耳环(pithecellobiumclypearia.)为豆科猴耳环属乔木植物,分布于我国华南及浙江、福建等地。猴耳环首载于明代李时珍的《本草纲目》,干燥带叶茎枝可入药,性味苦涩寒,具有清热解毒、收湿敛疮的功效,主治多种热毒证。目前在临床应用的成药主要有猴耳环消炎胶囊、猴耳环消炎片、猴耳环消炎颗粒,具有清热解毒,凉血消肿,止泻的功效,主治上呼吸道感染、急性咽喉炎、急性扁桃体炎、急性肠胃炎,也可用于细菌性痢疾。现代研究发现,猴耳环中主要含有黄酮类、苯丙素类、有机酚酸类、三萜和甾体类化合物。其现代药理研究大多集中于黄酮类,有机酚酸类成分的生物活性方面,具有抗氧化、抗炎、调节免疫、抗病毒、降血糖等作用。
本发明中涉及的五个多酚类化合物,经实验证明,所述的化合物具有神经细胞保护活性,可应用于治疗神经退行性疾病。
技术实现要素:
本发明的目的之一是提供五个多酚类化合物;
本发明的目的之二是提供五个多酚类化合物的制备方法;
本发明的目的之三在于提供五个多酚类化合物在制备神经退行性疾病药物中的应用。
本发明所述的五个黄酮类化合物,分别命名为:(1s)-pithecellobiuminc、(3s)-pithecellobiumind、pithecellobiumine、pithecellobiuminf、pithecellobiuming。化学结构式如下:
本发明所述五个化合物的制备方法如下:
猴耳环枝叶用乙醇进行提取,提取液减压浓缩,合并提取液浓缩成浸膏。用乙酸乙酯进行萃取,乙酸乙酯萃取物采用硅胶色谱柱、hp20色谱柱、ods色谱柱、hplc等手段分离得到以上5个化合物。
具体地:所述五个化合物制备方法如下:
(1)取干燥猴耳环枝叶,用70-80%乙醇进行提取,得到提取液浓缩成浸膏。总浸膏用水混悬后,用乙酸乙酯进行萃取,乙酸乙酯层采用硅胶柱,以二氯甲烷-甲醇系统进行梯度洗脱,收集馏分a。
(2)馏分a经ods柱色谱,经乙醇-水系统洗脱,收集馏分b。
(3)馏分b经硅胶柱,通过二氯甲烷-甲醇系统洗脱,收集馏分c。
(4)馏分c经hp20树脂,以乙醇-水系统梯度洗脱,收集馏分d。
(5)馏分d通过ods柱,经乙醇-水系统洗脱分别收集馏分g,馏分h,馏分i,馏分j,馏分h主要在40%-50%(40%,45%,50%)梯度收集,并通过hplc法在30%-45%乙腈-水中制备得到化合物1,化合物2,化合物3,化合物4,化合物5。
其中:
步骤(1)中二氯甲烷-甲醇的梯度为:50:1-1:2。
步骤(1)中馏分a为二氯甲烷-甲醇30:1-20:1的洗脱物。
步骤(2)中乙醇-水的梯度为30%-90%。
步骤(2)中馏分b为乙醇-水60%的洗脱物。
步骤(3)中二氯甲烷-甲醇的梯度为:50:1-1:2。
步骤(3)中馏分c为二氯甲烷-甲醇20:1-10:1的洗脱物。
步骤(4)中乙醇-水的梯度为30%-90%。
步骤(4)中馏分d为乙醇-水50%的洗脱物。
步骤(5)中乙醇-水的梯度为40%-70%。
本发明中,还进行了五个多酚类化合物在体外对由h2o2诱导的神经母细胞瘤sh-sy5y细胞损伤的神经保护作用测定,结果显示化合物1、化合物2、化合物3、化合物4在不同浓度均具强于阳性药的抗h2o2诱导的神经保护活性,化合物5具有与阳性药相当的抗h2o2诱导的神经保护活性。
附图说明:
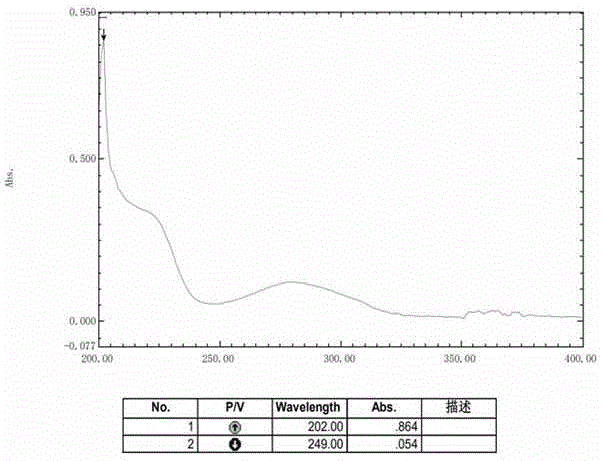
图1为化合物1的uv谱;
图2为化合物1的ir谱;
图3为化合物1的hresims谱;
图4为化合物1的1h-nmr(400mhz,dmso-d6)谱;
图5为化合物1的13c-nmr(100mhz,dmso-d6)谱;
图6为化合物1的hmqc(600mhz,dmso-d6)谱;
图7为化合物1的hmbc(600mhz,dmso-d6)谱;
图8为化合物2的uv谱;
图9为化合物2的ir谱;
图10为化合物2的hresims谱;
图11为化合物2的1h-nmr(400mhz,cd4o)谱;
图12为化合物2的13c-nmr(100mhz,cd4o)谱;
图13为化合物2的hmqc(600mhz,cd4o)谱;
图14为化合物2的hmbc(600mhz,cd4o)谱;
图15为化合物1和化合物2的ecd谱;
图16为化合物3的uv谱;
图17为化合物3的ir谱;
图18为化合物3的hresims谱;
图19为化合物3的1h-nmr(400mhz,dmso-d6)谱;
图20为化合物3的13c-nmr(100mhz,dmso-d6)谱;
图21为化合物3的hmqc(600mhz,dmso-d6)谱;
图22为化合物3的hmbc(600mhz,dmso-d6)谱;
图23为化合物4的uv谱;
图24为化合物4的ir谱;
图25为化合物4的hresims谱;
图26为化合物4的1h-nmr(400mhz,dmso-d6)谱;
图27为化合物4的13c-nmr(100mhz,dmso-d6)谱;
图28为化合物4的hmqc(600mhz,dmso-d6)谱;
图29为化合物4的hmbc(600mhz,dmso-d6)谱;
图30为化合物5的uv谱;
图31为化合物5的ir谱;
图32为化合物5的hresims谱;
图33为化合物5的1h-nmr(400mhz,dmso-d6)谱;
图34为化合物5的13c-nmr(100mhz,dmso-d6)谱;
图35为化合物5的hmqc(600mhz,dmso-d6)谱;
图36为化合物5的hmbc(600mhz,dmso-d6)谱。
具体实施方式
实施例1猴耳环中五个多酚类化合物的制备方法
取干燥的猴耳环枝叶20kg,用6倍量的70%乙醇回流提取2次,每次2小时,合并提取液,减压浓缩得浸膏0.9kg,用8l水混悬浸膏,再用8l乙酸乙酯萃取4次,乙酸乙酯层过硅胶柱,以二氯甲烷-甲醇系统50:1-1:2梯度洗脱,收集30:1-20:1梯度洗脱物为馏分a,馏分a经ods柱色谱,以乙醇-水系统30%,60%,90%洗脱,收集60%梯度洗脱物b,馏分b经硅胶柱,通过二氯甲烷-甲醇系统50:1-1:2梯度洗脱得到4个馏分,在20:1和10:1梯度收集的洗脱物为馏分c,馏分c经hp20树脂,以乙醇-水系统梯度洗脱得到3个馏分,在50%梯度收集的洗脱物为馏分d,馏分d通过ods柱,经乙醇-水系统洗脱分别收集馏分g,馏分h,馏分i,馏分j,馏分h主要在40%,45%,50%梯度收集,并通过hplc法在30%-45%乙腈-水中制备得到化合物1,化合物2,化合物3,化合物4,化合物5。
实施例2猴耳环中五个多酚类化合物的波谱信息及核磁信号归属
化合物1:
化合物1为黄色油状化合物(甲醇),uv(meoh)λmax(logε):200nm(2.42),249nm(3.27);高分辨电喷雾离子质谱(hr-esi-ms)给出准分子离子峰349.0918[m+h]+(calcdforc17h17o8,349.0918),结合1h-nmr,13c-nmr谱,确定分子式为c17h16o8,不饱和度为10。在1h-nmr(400mhz,dmso-d6,ppm,jinhz)谱中,δh6.13(1h,d,j=2.2,h-6),δh6.20(1h,d,j=2.2,h-8)为一个非对称四取代苯环的芳香质子信号,δh7.05(2h,s,h-3′,h-7′)为一个对称四取代苯环的芳香质子信号,δh3.38(3h,s)为甲氧基质子信号,δh5.15(1h,t,j=2.7,h-1)为次甲二氧基质子信号,δh1.81(1h,m,h-2),δh1.97(1h,m,h-2)为一个亚甲基碳上的两个偕偶质子信号,δh2.42(1h,m,h-3),δh2.58(1h,m,h-3)为另一组亚甲基碳上的两个偕偶质子信号,δh9.31(4h,brs)为4个酚羟基质子信号。在13c-nmr(100mhz,dmso-d6,ppm)谱中给出17个碳信号,包括12个芳香碳信号δc149.7(c-7),δc152.7(c-5),δc101.1(c-8),δc101.2(c-6),δc107.3(c-4),δc155.6(c-9),δc118.5(c-2′),δc109.0(c-3′,c-7′),δc145.7(c-4′,c-6′),δc139.2(c-5′),2个sp3杂化碳信号δc25.2(c-2),δc14.5(c-3),1个连氧碳信号δc97.6(c-1),1个酯基碳信号δc164.4(c-1′)以及1个甲氧基碳信号δc55.3(-och3)。在hmbc谱中,h-1与c-5相关,h-2与c-1相关,h-3与c-5相关,结合不饱和度,提示苯环的4、5位存在一个苯骈吡喃环片段。甲氧基氢信号与c-1有相关,可以确定甲氧基连在1位上。h-3′,7′与c-1′位的酯羰基有相关,h-3′与c-5′,7′有相关,h-7′与c-3′,5′有相关,提示结构中存在一个没食子酰基片段。与c-7位连羟基的化合物相比,该化合物c-7位的化学位移值明显向高场移动,说明没食子酰基连在c-7位上。h-6与c-4,5,7,8有相关,h-8与c-4,6,9有相关,证明另1个羟基连接在9位,通过以上分析确定了该化合物的平面结构。化合物1的绝对构型是通过比较计算旋光值和实测旋光值以及计算和实测ecd得到的,当c-1位绝对构型为s时,计算旋光值为
化合物2:
化合物2为深黄色油状化合物(甲醇),uv(meoh)λmax(logε):210nm(2.78),280nm(2.97);高分辨电喷雾离子质谱(hr-esi-ms)给出准分子离子峰383.0739[m+na]+(calcdforc18h16nao8,383.0737),结合1h-nmr,13c-nmr谱,确定分子式为c18h16o8,不饱和度为11。在1h-nmr(400mhz,cd4o,ppm,jinhz)谱中,δh6.22(1h,d,j=2.3,h-8),δh6.19(1h,d,j=2.3,h-10)为非对称的四取代苯环上2个芳香质子信号,δh7.14(2h,s,h-3′,h-7′)为对称四取代苯环上的2个芳香质子信号,δh4.52(1h,dd,j=8.6,3.2,h-3)为连氧次甲基的氢信号,δh2.63(2h,m,h-5)为一个亚甲基质子信号,δh1.97(1h,m,h-4),δh2.19(1h,m,h-4)为另一个磁不全同的亚甲基质子信号,δh2.25(3h,s,h-1)为1个甲基质子信号。在13c-nmr(100mhz,cd4o,ppm)谱中给出18个碳信号,包括12个芳香碳信号δc108.3(c-6),δc156.1(c-7),δc102.5(c-8),δc102.1(c-10),δc151.7(c-9),δc157.4(c-11),δc120.7(c-2′),δc110.5(c-3′,c-7′),δc146.7(c-4′,c-6′),δc140.5(c-5′),1个酮羰基碳信号δc210.0(c-2),1个连氧碳信号δc81.5(c-3),3个sp3杂化碳信号δc19.0(c-5),δc24.4(c-4),δc26.2(c-1),1个酯基碳信号δc167.0(c-1′)。结合hmbc谱,h-1与c-2,c-3相关,提示甲基与c-2位的羰基相连,h-4与c-2,c-5,c-6相关,h-5与c-4,c-3,c-6,c-11相关,h-3与c-7,c-5,c-2,c-4,相关,证明3位羟基与苯环的c-7位相连,形成苯骈吡喃环结构,也提示c-2位的羰基与c-3位相连。h-3′与c-7′,c-5′,c-2′,c-1′,c-4′相关,结合碳谱数据可推测c-3′与c-7′在苯环上处于对称位置并未连接取代基,c-4′,c-5′,c-6′位连有羟基基团,c-2′位连有酯基基团,提示了该化合物存在没食子酰基片段。h-10与c-11相关,h-8与c-6,c-7,c-9相关,结合碳谱数据提示了苯环上c-11位连有羟基基团,并且与c-9位连羟基的化合物相比该化合物c-9位化学位移明显向高场移动,说明没食子酰基连在苯环的c-9位上,从而确定了该化合物的平面结构。化合物2的绝对构型是通过比较计算旋光值和实测旋光值以及计算和实测ecd得到的,当c-3位绝对构型为s时,计算旋光值为
化合物3:
化合物3为黄色油状化合物(甲醇),uv(meoh)λmax(logε):207nm(2.36),290nm(3.48);高分辨电喷雾离子质谱(hr-esi-ms)给出准分子离子峰481.0741[m+na]+(calcdforc22h18nao11,481.0741),结合1h-nmr,13c-nmr谱,确定分子式为c22h18o11,不饱和度为14。在1h-nmr(400mhz,dmso-d6,ppm,jinhz)谱中,δh6.98(2h,s,h-2″,h-6″),δh7.05(2h,s,h-3′,h-7′),δh6.12(2h,s,h-6,h-8)为3个四取代对称苯环上的芳香质子信号,δh2.76(2h,t,j=8.4,h-3),δh2.92(2h,t,j=8.4,h-2)提示为2个亚甲基基团。在13c-nmr(100mhz,dmso-d6,ppm)谱中给出22个碳信号,包括18个芳香碳信号δc107.6(c-2″,c-6″),δc127.2(c-1″),δc138.8(c-4″),δc145.6(c-3″,c-5″),δc100.1(c-6,c-8),δc111.4(c-4),δc149.4(c-7),δc156.4(c-5,c-9),δc109.0(c-3′,c-7′),δc118.4(c-2′),δc139.3(c-5′),δc145.8(c-4′,c-6′),2个sp3杂化碳信号δc18.5(c-3),δc37.2(c-2),1个酯羰基碳信号δc164.5(c-1′),1个酮羰基碳信号δc198.5(c-1)。结合hmbc谱,h-3′与c-3′,c-2′,c-4′,c-1′相关,同时结合δc109.0(c-3′,c-7′),δc139.3(c-5′),δc145.8(c-4′,c-6′),δc118.4(c-2′)提示苯环上c-4′,c-5′c-6′上连有羟基,c-3′,c-7′位上无取代基,c-2′上连有酯基基团,可以推测结构中存在没食子酰基基团。h-6″与c-1″,c-5″,c-4″,c-1,c-2″相关,结合碳谱数据δc138.8(c-4″),δc145.6(c-3″,c-5″),δc127.2(c-1″)提示,苯环上c-3″,c-4″c-5″连有3个酚羟基,c-1位羰基与苯环上c-1″相连。h-2与c-4,c-3,c-1相关,h-3与c-4,c-1,c-9,c-2相关,说明c-4位连有1个酰乙基片段。h-2″/6″与c-5″,c-4″,c-1″相关,结合δc138.8(c-4″),δc145.6(c-3″,c-5″),δc127.2(c-1″)说明三个羟基的取代位置是c-3″,c-4″,c-5″,c-1″位上连有取代基,h-8与c-4,c-9,c-6,c-7相关,并且c-5,c-9位化学位移向低场移动,可以确定苯环上c-5,c-9上连有羟基。与c-7位连羟基的化合物相比该化合物c-7位化学位移明显向高场移动,说明c-7位上连有没食子酰基基团,进而确定了该化合物的结构。经scifinder数据库检索,化合物3为未报道的新化合物。
化合物4:
化合物4为深黄色油状化合物(甲醇),uv(meoh)λmax(logε):240nm(2.43),280nm(2.69);高分辨电喷雾离子质谱(hr-esi-ms)给出准分子离子峰387.0674[m+na]+(calcdforc17h16nao9,387.0687),结合1h-nmr,13c-nmr谱,确定分子式为c17h16o9,不饱和度为10。在1h-nmr(400mhz,dmso-d6,ppm,jinhz)谱中,δh6.11(2h,s,h-6,h-8),δh7.05(2h,s,h-3′,h-7′)提示结构中存在两个对称的苯环,δh3.60(3h,s)为甲氧基质子信号,δh2.41(2h,t,j=8.0,h-2),δh2.76(2h,t,j=8.0,h-3)为2个亚甲基质子信号,δh9.23(5h,brs)为5个酚羟基质子信号。在13c-nmr(100mhz,dmso-d6,ppm)谱中给出17个碳信号,包括12个芳香碳信号δc110.6(c-4),δc100.1(c-6,c-8),δc156.5(c-5,c-9),δc149.6(c-7),δc118.5(c-2′),δc109.1(c-3′,c-7′),δc145.9(c-4′,c-6′),δc139.3(c-5′),2个sp3杂化碳信号,δc18.7(c-3),δc33.0(c-2),2个酯羰基碳信号δc164.5(c-1′),δc173.3(c-1),1个甲氧基碳信号δc51.3(-och3)。结合hmbc谱,甲氧基氢信号与c-1相关,说明c-1位上连有1个甲氧基基团,h-2与c-1,c-3,c-4相关,h-3与c-1,c-2,c-4相关,说明化合物中存在一个酰丙基片段,并且与苯环上c-4位相连。h-7′/3′与c-1′,c-2′,c-3′,c-5′,c-6′相关,同时结合相应的氢谱、碳谱数据说明c-4′,c-5′,c-6′位都连有羟基取代基,c-2′位连有酯基基团,由此推测化合物结构中存在一个没食子酰基片段。h-6/8与c-4,c-5,c-6,c-7,c-9相关,同时结合碳谱数据提示c-6,c-8位上未连接取代基团,c-5,c-9位都直接与羟基基团相连,并且与c-7位连羟基的化合物相比该化合物c-7位化学位移明显向高场移动,说明c-7位上连有没食子酰基基团,进而确定了该化合物的结构。经scifinder数据库检索,化合物4为未报道的新化合物。
化合物5:
化合物5为黄色油状化合物(甲醇),uv(meoh)λmax(logε):240nm(2,63),281nm(3.46);高分辨电喷雾离子质谱(hr-esi-ms)给出准分子离子峰373.0532[m+na]+(calcdforc16h14nao9,373.0530),结合1h-nmr,13c-nmr谱,确定分子式为c16h14o9,不饱和度为10。在1h-nmr(400mhz,dmso-d6,ppm,jinhz)谱中,δh7.05(2h,s,h-3′,h-7′)提示为对称四取代苯环的2个芳香质子信号,δh6.12(2h,s,h-5,h-7)为另一个对称四取代苯环上的2个芳香质子信号。δh3.48(2h,s,h-2)为亚甲基质子信号,δh3.58(3h,s)为甲氧基质子信号。在13c-nmr(100mhz,dmso-d6,ppm)谱中给出16个碳信号,包括12个芳香碳信号δc105.8(c-3),δc156.7(c-4,c-8),δc99.9(c-5,c-7),δc150.2(c-6),δc118.4(c-2′),δc109.0(c-3′,c-7′),δc145.8(c-4′,c-6′),δc139.3(c-5′),2个酯基信号δc164.4(c-1′),δc171.8(c-1),1个sp3杂化碳信号δc28.3(c-2)以及1个甲氧基碳信号δc51.4(-och3)。结合hmbc谱,甲氧基氢信号与c-1相关,提示c-1位置上连有1个甲氧基。h-2和c-8,c-3,c-4,c-1相关,提示苯环上c-3位连有酰甲基基团。h-7′和c-6′,c-5′,c-3′,c-2′,c-1′相关,同时结合δc145.8(c-4′,c-6′),δc139.3(c-5′),δc109.0(c-3′,c-7′)提示苯环上c-4′,c-5′c-6′上连有羟基,c-3′,c-7′位上无取代基,c-2′上连有酯基基团,可以推测存在没食子酰基基团。h-5和c-6,c-7,c-4,c-3相关,结合δh6.12(2h,s,h-5,h-7)以及δc99.85(c-5,c-7)推测另一个苯环上c-5,c-7位上无取代基,c-4位、c-8位化学位移向低场移动,说明c-4位和c-8位上连有羟基基团,与c-6位连羟基的化合物相比该化合物c-6位化学位移明显向高场移动,说明c-6位上连有没食子酰基基团,进而确定了该化合物的结构。经scifinder数据库检索,化合物5为未报道的新化合物。
表1化合物1~化合物5的1h(100mhz)nmr数据
表2化合物1~化合物5的13c(100mhz)nmr数据
实施例3猴耳环中五个多酚类化合物在体外对由h2o2诱导的神经母细胞瘤sh-sy5y细胞损伤的神经保护作用测定
(1)建立h2o2诱导的sh-sy5y细胞损伤模型
选取处于对数生长期增殖活跃的sh-sy5y细胞,以1.5×105个/ml的密度接种在96孔培养板中,在环境条件为37℃,5%co2的培养箱中静置培养12h后,观察细胞贴壁情况。空白对照组加不含血清培养液,对照组不加h2o2,模型组加含h2o2不含血清的培养液,配成终浓度是200μmol/l,分别作用1,2,3,4,5,6h,以上每组设3个复孔,采用mtt测细胞活力。
(2)化合物对h2o2诱导sh-sy5y细胞损伤的保护作用
实验分别设置模型组,给药组,阴性及空白对照组4个组,每组3个复孔。
h2o2模型组:sh-sy5y细胞依次经传代,常规培养,无血清培养液稀释之后,于96孔培养板中接种。在恒温培养箱(37℃,5%co2)中静置培养12h至细胞贴壁后使用含血清培养液接着培养2h,再向每孔加h2o2使终浓度为200μmol/l,作用5h后mtt测细胞活力,
给药组:细胞培养同上,之后加入含待测化合物(12.5,25,50μmol/l)培养液同条件孵育2h,再向每个孔加h2o2(200μmol/l)反应5h。
阴性对照组:细胞培养同上,不加受试化合物及h2o2,其它步骤同上。
空白对照组:不加受试化合物及h2o2,不接种细胞,其它步骤同上。
最后用酶标仪(λ=490nm)测每孔吸光度值(a),计算存活率,公式如下:
(3)实验结果:
对5个化合物的抗h2o2诱导的sh-sy5y细胞损伤的保护作用筛选,结果如下表所示:
表3给药后细胞存活率
以上结果显示化合物1在12.5μm,25μm,50μm时具有较好的抗h2o2诱导的神经保护活性,其细胞存活率在12.5μm高于模型组30%以上,在25μm高于模型组40%以上,在50μm高于模型组50%以上。化合物2在50μm时具有较好的抗h2o2诱导的神经保护活性,其细胞存活率均高于模型组40%以上。化合物3在25μm,50μm时具有较好的抗h2o2诱导的神经保护活性,其细胞存活率在在25μm高于模型组10%以上,在50μm高于模型组30%以上。化合物4在50μm时具有较好的抗h2o2诱导的神经保护活性,其细胞存活率均高于模型组10%以上。化合物1、化合物2、化合物3、化合物4在不同浓度均具强于阳性药的抗h2o2诱导的神经保护活性,化合物5具有与阳性药相当的抗h2o2诱导的神经保护活性。
- 还没有人留言评论。精彩留言会获得点赞!