一种荧光探针及其在pH值和氧化还原状态检测中的应用的制作方法
本申请属于生物荧光探针技术领域,具体涉及一种荧光探针及其在ph值和氧化还原状态检测中的应用专利申请事宜。
背景技术:
生物细胞学研究中,活性氧(ros)是一个重要的研究对象,最初活性氧被认为是具有细胞毒性的代谢副产物,但现有研究认为,细胞中所产生的活性氧(ros)如羟自由基几乎可以和所有的生物分子发生反应,如色素、蛋白、脂类和dna并开启细胞的程序性死亡,因此越来越多的证据证明活性氧是动植物细胞中调节从细胞防御到细胞生长过程中的重要因子。
活性氧(ros)研究中,常用研究方法之一利用探针进行检测。而现有检测ros用探针多是基于gfp(绿色荧光蛋白)改造的,这类ros探针在一定程度上受ph影响较大,这是由于gfp本身的属性所决定的。例如越来越多的研究发现在使用hyper监测h2o2的过程中,ph的影响很难被排除,此外hyper的荧光可能受h2o2之外的ros因子影响(welleretal.,2014,responsepropertiesofthegeneticallyencodedopticalh2o2sensorhyper,freeradicbiolmed)。因此设计一种不受ph影响的监测ros用探针是十分必要的。
现有研究表明,细胞胞质和不同细胞器环境中的ph值是有明显区别的,例如:质外体的ph范围在5~6,胞质6.4~7.7,液泡5.2~6.5,核7.2~7.3。而这种ph的差异使得细胞内部不同条件的酶促反应可以正常进行,进而维持着细胞的生长、极化、囊泡运输和细胞骨架形成。这些反应过程中,h+作为信号转导的介质参与并影响着动植物的生长发育已经被广泛认可。而针对h+检测用的ph荧光探针为研究不同ph条件下各种信号转导途径提供了有效手段。但另一方面,由于细胞内的氧化还原状态和ph变化之间存在千丝万缕的联系,因此,如何实现氧化还原状态和ph的双重监测仍然是需要克服的技术难题之一。
技术实现要素:
本申请目的在于提供一种可以同时检测ph值和氧化还原状态的双重荧光探针,从而为相关细胞状态的判定奠定一定技术基础。
本申请所采取的技术方案详述如下。
一种荧光探针,该探针利用绿色荧光蛋白ilov和具有long-stokes位移的红色荧光蛋白mberfp荧光蛋白制备而成,主要用于细胞内ph值和氧化还原状态的双重监测;应用时,利用ilov蛋白荧光变化检测氧化还原状态,利用mberfp蛋白荧光变化检测ph值;
具体通过如下步骤制备而成:
(1)构建含有ilov基因序列的重组质粒pyes2-ilov
以pgex-ilov为模板,pcr获得ilov序列;pcr扩增时,引物序列设计如下:
正向引物ilov-f:5'–cgaagcttccaatgtctatagagaagaatttcgtc-3',
反向引物ilov-r:5'–gctggatccgctatacatgatcacttccatc-3';
(f引物序列中5’端“aagctt”、r引物序列中5’端“ggatcc”部分序列分别为hindiii、bamhi酶切位点)
然后对pcr扩增产物和pyes2质粒分别进行hindiii、bamhi双酶切,并将pcr扩增后的ilov酶切产物进一步与pyes2连接重组,构建获得重组质粒pyes2-ilov;
(2)构建含有berfp基因序列的重组载体pyes2-pharos
以prset-berfp为模板,pcr扩增获得berfp序列;
正向引物berfp-f:5’–gaattcatggtgtctaagggcgaagag-3’,
反向引物berfp-r:5’-ctcgagtattaagtttgtgccccagtttg-3’;
对pcr扩增产物进行ecori、xhoi双酶切,同时对步骤(1)中所构建的pyes2-ilov质粒进行ecori和xhoi双酶切,再进一步对酶切产物进行连接重组,构建获得重组载体pyes2-pharos载体;
(3)构建含有启动子的pact-pharos载体
为了获得在酵母中稳定表达的质粒,我们将pyes2的诱导型启动子替换为稳定表达启动子pact,从by4741酵母基因组dna中pcr获得actin基因启动子序列pact;
pcr扩增时,具体引物序列设计如下:
正向引物pact-f:5’-gaactagtcaaaacccttaaaaacatatgc-3’,
反向引物pact-r:5’-agaaagctttgttaattcagtaaattttcgatc-3’;
所述pact序列(470bp),如seqidno.1所示,具体如下:
aaaacccttaaaaacatatgcctcaccctaacatattttccaattaaccctcaatatttctctgtcacccggcctctattttccattttcttctttacccgccacgcgtttttttctttcaaatttttttcttccttcttctttttcttccacgtcctcttgcataaataaataaaccgttttgaaaccaaactcgcctctctctctcctttttgaaatatttttgggtttgtttgatcctttccttcccaatctctcttgtttaatatatattcatttatatcacgctctctttttatcttcctttttttcctctctcttgtattcttccttcccctttctactcaaaccaagaagaaaaagaaaaggtcaatctttgttaaagaataggatcttctactacatcagcttttagatttttcacgcttactcttttttcttcccaagatcgaaaatttactgaattaaca
对步骤(2)中所构建的pyes2-pharos载体进行spei、hindiii双酶切,与pact进行连接重组(即,将pyes2中原有的gal4启动子重组替换为pact启动子),构建获得重组的pact-pharos载体,该载体用于后续细胞器定位探针的构建;
(4)构建用于细胞器定位的荧光探针
在步骤(3)基础上,将pact-pharos载体进一步重组结合不同的细胞器定位序列,构建获得可定位于不同细胞器的荧光探针,具体而言:
定位于细胞核的pharos-t探针:以sv40t抗原的7个氨基酸pkkkrkv序列作为细胞核定位序列,将7个氨基酸pkkkrkv对应编码碱基序列(如seqidno.2所示,具体为:ccaaaaaagaaaagaaaagtg)重组进入pact-pharos载体;
定位于过氧化物酶体的pharos-skl探针:以serine-lysine-leucine(skl)组成的过氧化物酶体定位信号作为定位序列,将对应碱基序列(具体为:tccaaactt)重组进入pact-pharos载体;
定位于线粒体的su9-pharos探针:以su9线粒体定位序列作为定位序列,将对应碱基序列
(如seqidno.3所示,具体为:
atggcctccactcgtgtcctcgcctctcgcctggcctcccggatggctgcttccgccaaggttgcccgccctgctgtccgcgttgctcaggtcagcaagcgcaccatccagactggctcccccctccagaccctcaagcgcacccagatgacctccatcgtcaacgccaccacccgccaggctttccagaagcgcgcctactcttccggattc)重组进入pact-pharos载体。
所述荧光探针在细胞状态检测中应用,用于细胞内部或者具体细胞器内部的ph值和/或细胞氧化还原状态检测;
所述细胞具体例如为真核细胞,具体例如为酵母;
所述细胞器具体例如为:细胞核、过氧化物媒体、线粒体。
利用所述荧光探针的细胞ph值和/或细胞氧化还原状态检测方法,包括如下步骤:
(1)质粒转化
将所构建的pact-pharos载体探针、或所构建的细胞器定位载体探针(例如pharos-t探针、pharos-skl探针、su9-pharos探针)转化细胞,并筛选获得阳性转化菌株;
所述细胞例如酵母细胞,进一步例如为insvc酵母菌株;
(2)观察检测
利用激光共聚焦显微镜,观察并记录细胞内ilov蛋白和berfp蛋白的荧光比率,从而进一步判断细胞内、或具体细胞器内的ph值和/或细胞氧化还原状态;具体应用时:
利用ilov蛋白荧光变化检测氧化还原状态,利用mberfp蛋白荧光变化检测ph值。
需要说明的是:ilov荧光蛋白在488nm的激发光下,可以在507nm出产生最大发射峰;而mberfp荧光蛋白是一个具有long-stokes位移的红色荧光蛋白,在488nm或561nm的激发光下,能够在609nm出产生发射峰值,因此检测应用时在同一488nm的激光条件下可以同时或者分别进行ph值和氧化还原状态的检测,当然,也可在561nm条件下单独进行ph检测。
lov(light-oxygen-voltage,lov)是一种广泛存在于细菌、真菌和植物中并行使感受光信号功能的蛋白结构域,该结构域通过结合发色团的黄素单核苷酸(flavinmononucleotide,fmn)可以使蛋白发出微弱的固有荧光,其发射波长最高峰在495nm。针对这一特点,christie研究组(christicet.al,2012,structuraltuningofthefluorescentproteinilovforimprovedphotostability,thejournalofbiologicalchemistry)通过改造lov的半胱氨酸位点得到了一个c/a点突变能够维持荧光不衰减(即ilov);正是这一改造,使得ilov这一新型小分子荧光蛋白广泛应用于生物领域研究中。
前期研究过程中,发明人发现常规应用的ilov荧光蛋白具有氧化还原状态敏感性,因而具有用于构建氧化还原探针的潜力;另一方面,发明人发现mberfp具有ph敏感性,因而具有用于构建ph探针的潜力;但是对于两者同时表达后的融合蛋白在具体荧光检测应用时是否相互干扰目前仍是未知的。为此,发明人进一步利用ilov和mberfp的编码基因构建表达获得了融合蛋白,并利用fret(fluorescenceresonanceenergytransfer,荧光共振能量转移)实验进行验证,结果表明ilov和mberfp融合后并未发生fret现象,也即不存在荧光串扰作用,这为双重属性(ph检测和氧化还原状态检测)荧光探针的制备奠定了基础。
总体上,初步细胞转化应用实验中,发明人证明了本申请所构建的相关探针在细胞ph和氧化还原状态检测中具有较好的应用效果,相关检测结果准确可靠,且灵敏度较高,并且证明了ilov的发射光光谱是随着氧化状态变化而发生梯度改变的,而mberfp荧光蛋白的荧光强度则随着ph梯度发生改变。基于这些结果,可为新型探针设计、细胞信号转导研究、细胞状态研究等奠定一定技术基础和提供较好技术借鉴。
附图说明
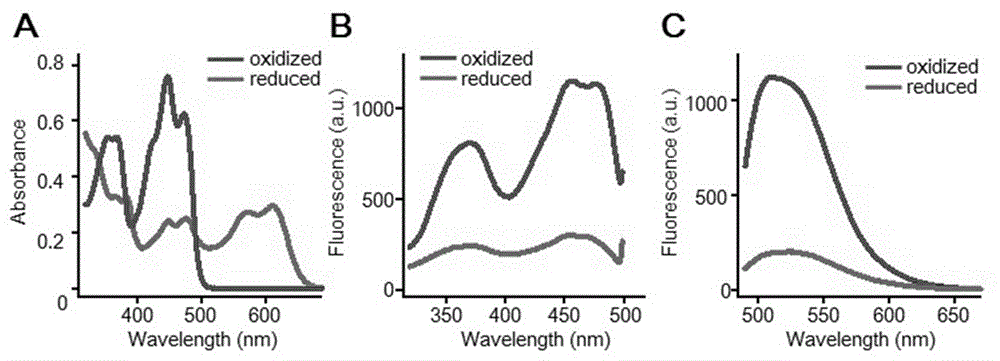
图1为ilov荧光蛋白在氧化剂(h2o2)和还原剂(dtt)处理下的荧光属性,其中:
(a)ilov荧光蛋白在2mmh2o2和50mmdtt处理下的紫外吸收光谱;从大肠杆菌表达纯化出ilov蛋白,分别在h2o2和dtt溶液中孵育60min后检测其吸收谱;
(b)用荧光光谱仪检测同样处理条件下ilov蛋白的激发光谱变化;
(c)与图a采用相同处理条件,检测ilov蛋白的发射光谱;
图2为ilov荧光蛋白在不同ph条件下特性,可以看出ilov荧光蛋白对ph不敏感;
图3为mberfp荧光蛋白在ph5或ph8时不同波长下的荧光属性,其中:
(a)mberfp蛋白在ph5.0和ph8.0缓冲液中的激发光谱检测;
(b)488nm激发下,mberfp蛋白在ph5.0和ph8.0缓冲液中的吸收光谱;
(c)561nm激发下,mberfp蛋白在ph5.0和ph8.0缓冲液中的吸收光谱;
图4为ilov在单独存在和融合蛋白pharos中的荧光寿命,分析可以看出:pharos中两个蛋白间无fret作用;
图5为pharos探针的结构(a)和在酵母体内的荧光特征(b);
图6为pharos探针所检测细胞内ph和氧化还原状态的变化情况;
图7为利用pharos探针检测酵母野生型(by4741)和突变体(gpx3δ)细胞的ph和eh;
图8为pharos在酵母细胞中的不同细胞器定位。
具体实施方式
下面结合附图和实施例对本申请做进一步的解释说明。在介绍具体实施例前,就下述实施例中部分生物材料情况简要说明如下。
生物材料:mberfp序列由武汉光电研究所获得;ilov和lov2.1序列,由johnm.christie实验室获得;
其他生物实验试剂及操作仪器均为生物工程领域研究常用和常见物料,不再具体赘述。
实施例1
在对ilov荧光蛋白和mberfp荧光蛋白的发光特性研究过程中,发明人发现ilov荧光蛋白对ph变化不敏感,但对具有氧化还原状态具有敏感性,而mberfp则对ph具有敏感性,本实施例就相关实验发现过程简要介绍如下。
需要说明的是,本实施例中所采用的ilov荧光蛋白和mberfp荧光蛋白通过常规基因工程手段制备获得,具体过程为:
参考现有基因工程技术收到,首先分别将荧光蛋白的基因编码序列ilov序列、mberfp序列克隆至pet28a大肠杆菌表达载体上,然后通过iptg诱导表达,进一步纯化分别得到ilov荧光蛋白和mberfp荧光蛋白,以对其荧光特性进行研究。
所述ilov序列(333bp)具体为:
atgatagagaagaatttcgtcatcactgatcctaggcttcccgataatcccattatctttgcatcagacggctttcttgaattgacagagtattcgcgcgaggaaatattggggagaaatgcccggtttcttcaggggccagagacagatcaagcgactgtccagaagataagagacgcaattagagatcagagggagactactgtgcagttgataaactacactaaaagcggaaagaaattctggaacttactccacctgcaacctgtgcgtgatcagaagggagagcttcaatacttcatcggtgtgcagctcgatggaagtgatcatgta
所述mberfp序列(714bp)具体为:
atggtgtctaagggcgaagagctgattaaggagaacatgcacatgaagctgtacatggagggcaccgtgaacaaccaccacttcaagtgcacatccgagggcgaaggcaagccctacgagggcacccagaccatgagaatcaaggtggtcgagggcggccctctccccttcgccttcgacatcctggctaccagcttcatgtacggcagcaagaccttcatcaaccacacccagggcatccccgacttctttaagcagtccttccctgagggcttcacatgggagagatccaccacatacgaagacgggggcgtgctgaccgctacccaggacaccagcctccaggacggctgcctcatctacaacgtcaagatcagaggggtgaacttcccatccaacggccctgtgatgcagaagaaaacactcggctgggaggccagcaccgagatgctgtaccccgctgacggcggcctggaaggcagagactacatggccctgaagctcgtgggcgggggccacctgatctgcaacgccaagaccacatacagatccaagaaacccgctaagaacctcaagatgcccggcgtctactatgtggacagaagactggaaagaatcaaggaggccgacaaagagacctccgtcgagcagcacgaggtggctgtggccagatactgcgacctccctagcaaactggggcacaaacttaattga。
(1)对ilov荧光蛋白检测
取1milov蛋白置于2mmh2o2和50mmdtt溶液中孵育60min,之后利用荧光光谱仪检测其光谱变化,结果如图1所示。从图中可以看出,ilov荧光蛋白在氧化剂和还原剂中呈现不同的光谱属性,表明ilov蛋白的荧光受氧化还原状态的影响。
另一面,将ilov荧光蛋白用不同ph的buffer(先用mes、heps、tris配制成50mm的缓冲液,用1m的naoh和1m的hcl调节缓冲液的ph,得到ph5.4、5.8、6.2、6.6、7.0、7.4、7.8、8.2、8.6、9.0的缓冲液,4℃保存)进行孵育30min,之后利用荧光光谱仪检测其光谱变化,结果如图2所示。从图2中可以看出,荧光强度基本不受ph影响。
(2)对mberfp荧光蛋白检测
先用mes、tris配制成50mm的缓冲液,用1m的naoh和1m的hcl调节缓冲液的ph,得到ph5和ph8的缓冲液(4℃保存)。mberfp蛋白用不同ph的缓冲液配制成1ml体积终浓度为1μm的蛋白溶液,静置30min。
用hitachif-4500荧光光谱仪检测mberfp的光谱属性。参数设置为:激发波长(exwl):450nm,发射波长范围470-600nm,扫描速度(scanspeed):1200nm/min,延迟:1s,激发狭缝(exslit):5nm,发射狭缝(emslit):10nm,光电倍增管电压(pmtvoltage):700v,响应时间:2s。
结果如图3所示。分析可以看出,mberfp蛋白在碱性条件下荧光增强,酸性条件下荧光减弱,即:mberfp蛋白荧光特性明显受ph值的影响,可用于检测指示ph值情况。
实施例2
在实施例1基础上,虽然表明ilov蛋白的荧光受氧化还原状态的影响,而mberfp荧光蛋白受ph影响,但对于两者的融合蛋白在荧光检测时,其荧光特性是否有干扰尚需进一步验证,为此,发明人进一步利用ilov和berfp基因序列构建了双荧光载体,以对两者的融合蛋白的荧光特性进行检测评价。具体过程简要介绍如下。
(一)构建含有ilov基因序列的重组质粒pyes2-ilov
以pgex-ilov为模板,pcr获得ilov序列;pcr扩增时,引物序列设计如下:
正向引物为5'-cgaagcttccaatgtctatagagaagaatttcgtc-3',
反向引物为5'-gctggatccgctatacatgatcacttccatc-3';
然后对pcr扩增产物和pyes2质粒分别进行hindiii、bamhi双酶切,并将pcr扩增后的ilov酶切产物进一步与pyes2连接重组,构建获得重组质粒pyes2-ilov。
(二)构建含有berfp基因序列的重组载体pyes2-pharos
以prset-berfp为模板,pcr扩增获得berfp序列;pcr扩增时,引物序列设计为:
正向引物berfp-f:5’–gaattcatggtgtctaagggcgaagag-3’,
反向引物berfp-r:5’-ctcgagtattaagtttgtgccccagtttg-3’;
对pcr扩增产物进行ecori、xhoi双酶切,同时对步骤(1)中所构建的pyes2-ilov质粒进行ecori和xhoi双酶切,再进一步对酶切产物进行连接重组,构建获得重组载体pyes-ilov-mberfp,并将之命名为pyes2-pharos载体;
需要说明的是,重组的融合载体在ilov的下游酶切位点bamhi和mberfp的上游酶切位点之间有一段pyes2的载体序列,因此融合蛋白在翻译完成后在两个酶切位点之间会产生一段由13个氨基酸gstsngrqcagil组成的短肽序列。
(三)融合蛋白pharos蛋白和ilov蛋白荧光特性对比
参考现有常规操作,将pyes2-pharos双荧光载体转化大肠杆菌表达菌株,制备纯化的ilov-mberfp融合蛋白(pharos蛋白)。
将实施例1所制备的ilov蛋白与本实施例所制备的融合蛋白pharos蛋白,分别用荧光寿命检测仪器(harp300,picoquant)检测荧光寿命。该检测仪器包括时间相关单光子计数模块(time-correlatedsingle-photoncounting,tcspc),分辨率小于4ps,同时包括宽场可调脉冲飞秒钛宝石激光器(ti:sappihirelaser)(chameleonultraii,coherentinc.)。利用bbo非线性晶体产生的二次谐波作为475nm飞秒激光源,利用脉冲选择系统调节脉冲震荡频率为40mhz以下。发射光则通过et540/30nm(chroma)宽场滤光片过滤,使用显微成像系统(mpd,picoquant)进行荧光采集,采集时间间隔小于40ps;激发光寿命曲线利用发射光轨迹进行单指数衰减曲线拟合。
检测过程中,根据fret发生原理,若pharos中ilov和mberfp两个蛋白之间发生fret现象,那么在457nm的激光器激发下,pharos蛋白中的ilov荧光寿命将出现二次衰减,同单独的ilov的荧光寿命相比较,pharos中ilov的寿命会低于ilov单独存在下的荧光寿命。检测结果如图4所示。
分析可以看出:pharos蛋白中的ilov荧光与单独ilov蛋白比较,并未发生荧光寿命的二次衰减,这一结果表明pharos荧光蛋白中的ilov和mberfp之间不存在fret现象,因此所构建的融合蛋白可以用作双功能探针进行应用。
实施例3
在实施例2基础上,发明人进一步将所构建的重组载体pyes2-pharos转化进入酵母细胞,进行了不同实验检测,具体实验情况简要介绍如下。
(一)基本荧光特性
将实施例2中所构建重组载体pyes2-pharos转化进入invsc酵母细胞中进行表达。具体操作参考如下:
(1)制备感受态酵母细胞(现用现制)
在复壮的酿酒酵母平板中挑选直径约为2-3mm的单菌落,接种到1ml的液体ypd培养基中,剧烈振荡或涡旋5min将菌落悬起来;
将悬起的酵母菌液转加入50mlypd液体培养基中(250ml三角瓶中),将三角瓶放置于摇床中30℃、250rpm震荡培养16h,检测od600>1.5;
取30ml过夜培养酵母菌重新接种于300ml液体ypd培养基中(1l三角瓶)使终浓度为od600约为0.2~0.3;
将三角瓶放置于摇床中,30℃、230rpm震荡培养4h,至菌落浓度达到od600为0.4~0.6;
将酵母菌液转移至100ml无菌离心管中,1000rpm室温离心5min,弃去上清,在离心管中加入25-50ml灭菌的超纯水重悬酵母;
1000rpm室温离心5min,轻轻倒去上清,将酵母菌用900μl灭菌的超纯水重悬,并转移至1.5ml灭菌的eppendorf离心管中,12000rpm离心1min,弃去上清;
用700μl1×liac溶液重悬菌体,使其终体积达1ml,将离心管放置于30℃温育10min;用无菌的1.5mleppendorf离心管分装酵母感受态,每管100μl备用。
(2)转化和筛选
取一管步骤(1)中所制备感受态细胞,于12000rpm离心1min,弃上清;
依次加入:240μl50%peg,36μl1mliac,50μl鲑鱼精dna(ss-dna)(2mg/ml),5μl约100ng转化dna,去离子水29μl;将混合溶液置于旋涡震荡器上剧烈震荡,重悬细胞;
放置于30℃培养箱静置30min;然后将离心管放置于42℃恒温金属浴中热激30min;取出后放进离心机中,12000rpm离心1min,弃上清;在离心管中加入500μl去离子水,用移液器吹打至菌体悬浮均匀;
取200μl涂布于筛选用sd固体培养基;将培养皿倒置于30℃培养箱中培养3天左右,能够正常生长的菌落为阳性菌落,进一步鉴定确保转化正确。
(3)荧光检测
利用zeiss710激光共聚焦显微镜观察转化正确菌株的荧光特性。结果表明:pyes2-pharos转化酵母后,可以观察到酵母细胞质中有红色和绿色的荧光。图5a图解了pharos探针如何同时检测体内的氧化还原状态和ph状态,pharos探针由能够感知ph的mberfp蛋白和ilov蛋白共同构建的。图5b中比较了pharos和ilov、mberfp在酵母细胞的荧光成像情况。其中ilov和mberfp之间存在较少的光谱重叠,在488nm激发下可同时对pharos探针中的ilov和mberfp同时成像,标尺为5μm。
(二)ph和eh的双重检测
对前述转化正确的含有重组载体pyes2-pharos的酵母细胞invsc,利用棉籽糖诱导培养至对数生长期,然后利用含有不同浓度dtt的不同ph的缓冲液进行处理(实验中发现,当固定dtt浓度时,ph的调节直接影响dtt溶液的电势。因此,我们使用50mm的dtt缓冲液,再利用hcl或者naoh调节dtt溶液中的ph分别为5.0、6.0、7.0、8.0、8.2,用氧化还原电位计检测dtt缓冲液中的电势,最终得到一组ph和eh均发生变化的缓冲液),将含有pharos探针的酵母在这种缓冲液中孵育,并用激光共聚焦显微镜观察并拍照。
图6的结果显示,pharos蛋白在ph和eh同时改变的缓冲液中时,它具备同时检测ph和eh的功能。其中ilov结构域能感知电势的变化,g488的荧光随电势的降低而减弱,而mberfp结构域能感知ph的变化,r561和r488的荧光随着ph的升高而增强。eh的比率(g488/r561max)随着电势的降低而减小,ph的比率(r561/r488)则随着ph的增加而变大。
(三)具体检测应用
进一步地,参考现有常规相关操作,将pharos探针转入by4741和gpx3δ突变体酵母中进行表达。
gpx3δ突变体酵母缺失gpx3基因,因此清除ros能力降低。我们将pharos探针转入by4741和gpx3δ突变体酵母中进行表达,用转盘式共聚焦显微镜采集大量酵母细胞的pharos荧光成像图,并在imagej软件中对pharos各个通道的荧光进行定量统计,根据荧光比率计算突变和和野生型酵母中的ph和eh的差异。
统计结果发现,gpx3δ突变体细胞内eh要高于野生型by4741用转盘式共聚焦显微镜采集大量酵母细胞的pharos荧光成像图,如图7所示。在imagej软件中对pharos各个通道的荧光进行定量统计,根据荧光比率计算突变和和野生型酵母中的ph和eh的差异。结合荧光图及统计结果,分析表明:gpx3δ突变体细胞内eh要高于野生型by4741,这种差异很可能是gpx3基因的缺失导致的。但是突变体和野生型酵母胞内的ph水平并无显著差异。
实施例4
在实施例2基础上,为进一步便于具体细胞器定位研究,发明人将pact-pharos载体进一步重组结合不同的细胞器定位序列,构建获得可定位于不同细胞器的荧光探针,具体而言:
定位于细胞核的pharos-t探针:以sv40t抗原的7个氨基酸pkkkrkv序列作为细胞核定位序列,将7个氨基酸pkkkrkv对应编码碱基序列(ccaaaaaagaaaagaaaagtg)重组进入pact-pharos载体;
定位于过氧化物酶体的pharos-skl探针:以serine-lysine-leucine(skl)组成的过氧化物酶体定位信号作为定位序列,将对应碱基序列(tccaaactt)重组进入pact-pharos载体;
定位于线粒体的su9-pharos探针:以su9线粒体定位序列作为定位序列,将对应碱基序列
(atggcctccactcgtgtcctcgcctctcgcctggcctcccggatggctgcttccgccaaggttgcccgccctgctgtccgcgttgctcaggtcagcaagcgcaccatccagactggctcccccctccagaccctcaagcgcacccagatgacctccatcgtcaacgccaccacccgccaggctttccagaagcgcgcctactcttccggattc)重组进入pact-pharos载体。
参考前述描述及现有常规相关操作,将系列细胞器用探针分别转化酵母invsc细胞。结果如图8所示。
分析可以看出:pharos能够在细胞器定位序列的引导下进入相应的细胞器,并能够正常产生荧光,因此可为细胞器中氧化还原和ph的实时监测奠定一定技术基础。
综上结果,发明人认为,pharos双功能探针由小分子蛋白ilov结构域和mberfp荧光蛋白组成,这两种荧光蛋白分别具有检测氧化还原和ph的功能,融合后并未发生荧光光谱的重叠和fret现象,可以很好的作为双功能探针应用于活细胞研究;其衍生的探针可以应用于细胞器和不同种类细胞的研究,是一种很有潜力的荧光探针。
sequencelisting
<110>河南大学
<120>一种荧光探针及其在ph值和氧化还原状态检测中的应用
<130>none
<160>3
<170>patentinversion3.5
<210>1
<211>470
<212>dna
<213>by4741酵母
<400>1
aaaacccttaaaaacatatgcctcaccctaacatattttccaattaaccctcaatatttc60
tctgtcacccggcctctattttccattttcttctttacccgccacgcgtttttttctttc120
aaatttttttcttccttcttctttttcttccacgtcctcttgcataaataaataaaccgt180
tttgaaaccaaactcgcctctctctctcctttttgaaatatttttgggtttgtttgatcc240
tttccttcccaatctctcttgtttaatatatattcatttatatcacgctctctttttatc300
ttcctttttttcctctctcttgtattcttccttcccctttctactcaaaccaagaagaaa360
aagaaaaggtcaatctttgttaaagaataggatcttctactacatcagcttttagatttt420
tcacgcttactcttttttcttcccaagatcgaaaatttactgaattaaca470
<210>2
<211>21
<212>dna
<213>sv40t抗原
<400>2
ccaaaaaagaaaagaaaagtg21
<210>3
<211>213
<212>dna
<213>su9线粒体
<400>3
atggcctccactcgtgtcctcgcctctcgcctggcctcccggatggctgcttccgccaag60
gttgcccgccctgctgtccgcgttgctcaggtcagcaagcgcaccatccagactggctcc120
cccctccagaccctcaagcgcacccagatgacctccatcgtcaacgccaccacccgccag180
gctttccagaagcgcgcctactcttccggattc213
- 还没有人留言评论。精彩留言会获得点赞!