携带GITR共刺激信号靶向EGFR的嵌合抗原受体T细胞的制作方法
本发明涉及肿瘤治疗技术领域,更具体地涉及携带gitr共刺激信号靶向egfr的嵌合抗原受体t细胞,其可以有效攻击过表达egfr的肿瘤细胞而不会攻击egfr阴性的肿瘤细胞。
背景技术:
免疫治疗是一种新兴的非常有前景的治疗癌症的方法。t细胞或t淋巴细胞是免疫系统的有效武器,它们能够持续性地搜寻外来抗原并从正常细胞中或非正常细胞,如癌症或被感染的细胞。基因修饰的嵌合抗原受体t细胞(car-t)是设计肿瘤特异性t细胞的常见方案。将靶向肿瘤相关抗原(taa)的car-t细胞输入患者(称为过继细胞转移或act),代表了一种有效的免疫治疗方法。与化疗或抗体技术相比,car-t技术的优点在于重编程的t细胞可以在患者体内增殖并持续存在(“活的药物”)。
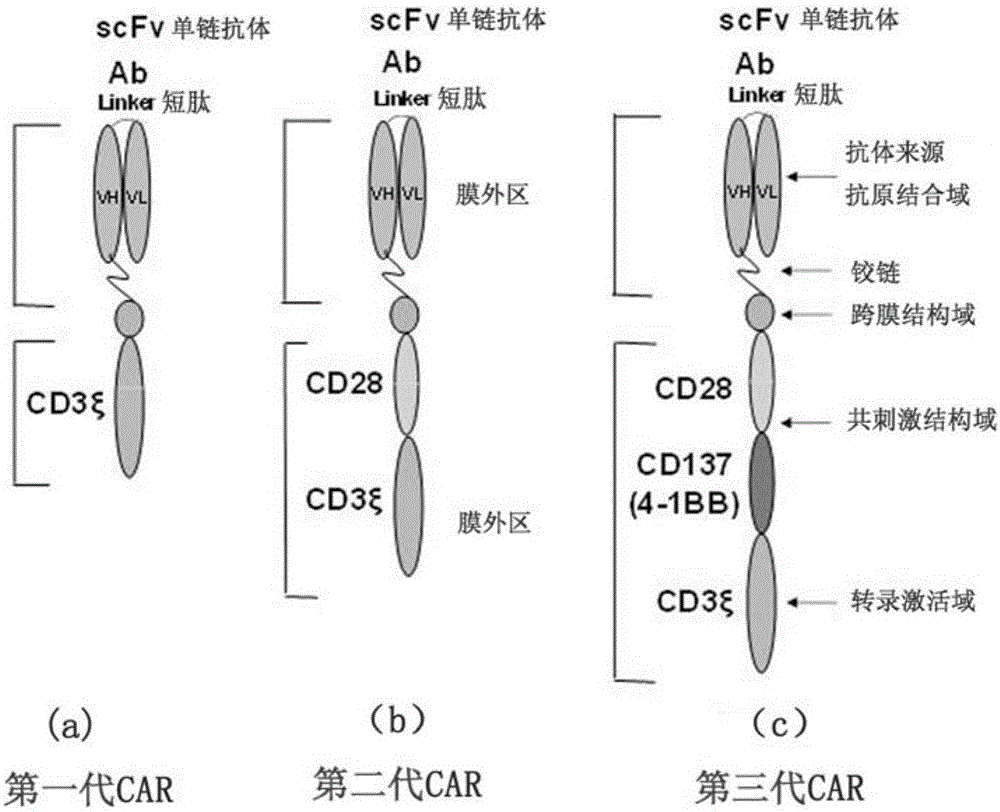
car(嵌合抗原受体)通常是由一个单克隆抗体衍生的单链可变区片段(scfv)通过铰链和跨膜结构域连接到可变数目的胞内信号结构域:(i)单个细胞活化的cd3-ζ结构域;(ii)和cd3-ζ结构域相连的cd28,cd137(4-1bb)或其他共刺激域(也可用cd27信号结构域代替cd28或cd137结构域)。car的发展从第一代(没有共刺激域)到第二代(具有一个共刺激域)到第三代car(具有多个共刺激域)。生成的具有多个共刺激域的car(即所谓的第三代car)会产生增加的细胞溶解活性,并显着改善car-t细胞的持续性,表现出增强的抗肿瘤活性。
然而,目前嵌合抗原受体的研究还有很多不足,还存在复发率高、安全性低等问题。因此,本领域迫切需要开发特异性好、疗效稳定、副作用小的嵌合抗原受体。
技术实现要素:
本发明的目的在于提供一种携带gitr共刺激信号靶向egfr的嵌合抗原受体t细胞。
在本发明的第一方面,提供了一种嵌合抗原受体融合蛋白,所述的融合蛋白从n-末端到c-末端包含:
(i)包含vh和vl的单链可变区片段(scfv),其中scfv对人表皮生长因子受体(egfr)具有低亲和力,解离常数(kd)>50nm,
(ii)跨膜结构域,
(iii)gitr共刺激结构域,和
(iv)激活结构域。
在另一优选例中,所述的scfv来源于c10抗体,并具有seqidno:6所示的氨基酸序列,或其至少90%的序列同一性。
在另一优选例中,所述的scfv来源于p3-5抗体,并且具有其至少90%的序列同一性。
在另一优选例中,所述的激活结构域是cd3ζ。
在另一优选例中,所述的car具有下式i结构:
l-scfv-h-tm-c-cd3ζ(i)
式中,
各“-”独立地为连接肽或肽键;
l为任选的信号肽序列;
scfv为对人表皮生长因子受体(egfr)具有低亲和力,解离常数(kd)>50nm的单链抗体;
h为任选的铰链区;
tm为跨膜结构域;
c为gitr共刺激结构域;
cd3ζ为源于cd3ζ的胞浆信号传导序列。
在另一优选例中,所述的l为选自下组的蛋白的信号肽:cd8、gm-csf、cd4、cd137、或其组合。
在另一优选例中,所述的h为选自下组的蛋白的铰链区:cd8、cd28、cd137、或其组合。
在另一优选例中,所述的tm为选自下组的蛋白的跨膜区:cd28、cd3epsilon、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、或其组合。
在另一优选例中,所述的嵌合抗原受体融合蛋白的氨基酸序列如seqidno.:2所示。
在本发明的第二方面,提供了一种核酸分子,所述的核酸分子编码本发明第一方面所述的融合蛋白。
在另一优选例中,所述的核酸序列如seqidno:1所示,或在每个片段中具有其至少90%的同一性。
在本发明的另一方面,提供了一种egfrscfv-cd8铰链-cd28跨膜结构域-gitr结构域-cd3ζ的核酸序列,所述的核酸序列如seqidno:1所示,或在每个片段中具有其至少90%的同一性。
在本发明的另一方面,提供了一种由本发明第二方面所述的核酸序列编码的蛋白。
在本发明的第三方面,提供了一种载体,所述的载体含有本发明第二方面所述的核酸分子。
在另一优选例中,所述的载体选自下组:dna、rna、质粒、慢病毒载体、腺病毒载体、逆转录病毒载体、转座子、或其组合。
在另一优选例中,所述载体为慢病毒载体。
在另一优选例中,所述核酸分子位于慢病毒载体的xbai和ecori慢病毒位点中。
在本发明的第四方面,提供了一种宿主细胞,所述的宿主细胞含有本发明第三方面所述的载体或染色体中整合有外源的本发明第二方面所述的核酸分子或表达本发明第一方面所述的融合蛋白。
在另一优选例中,所述细胞为分离的细胞,和/或所述细胞为基因工程化的细胞。
在另一优选例中,所述细胞为哺乳动物细胞。
在另一优选例中,所述细胞为t细胞。
在本发明的第五方面,提供了一种制备工程化免疫细胞的方法,所述的工程化免疫细胞表达本发明第一方面所述的融合蛋白,包括以下步骤:将本发明第二方面所述的核酸分子或本发明第三方面所述的载体转导入t细胞或nk细胞内,从而获得所述工程化免疫细胞。
在另一优选例中,所述的方法还包括对获得的工程化免疫细胞进行功能和有效性检测的步骤。
在本发明的第六方面,提供了一种制剂,所述制剂含有本发明第一方面所述的融合蛋白、本发明第二方面所述的核酸分子、本发明第三方面所述的载体、或本发明第四方面所述的细胞,以及药学上可接受的载体、稀释剂或赋形剂。
在另一优选例中,所述制剂为液态制剂。
在另一优选例中,所述制剂的剂型为注射剂。
在另一优选例中,所述制剂中所述car-t细胞的浓度为1×103-1×108个细胞/ml,较佳地1×104-1×107个细胞/ml。
在本发明的第七方面,提供了一种本发明第一方面所述的融合蛋白、本发明第二方面所述的核酸分子、本发明第三方面所述的载体、或本发明第四方面所述的细胞的用途,用于制备预防和/或治疗癌症或肿瘤的药物或制剂。
在另一优选例中,所述肿瘤为egfr阳性的肿瘤,较佳地为egfr高表达的肿瘤。
在另一优选例中,所述肿瘤选自下组:血液肿瘤、实体瘤、或其组合。
在另一优选例中,所述血液肿瘤选自下组:急性髓细胞白血病(aml)、多发性骨髓瘤(mm)、慢性淋巴细胞白血病(cll)、急性淋巴白血病(all)、弥漫性大b细胞淋巴瘤(dlbcl)、或其组合。
在另一优选例中,所述实体瘤选自下组:胃癌、胃癌腹膜转移、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、宫颈癌、卵巢癌、淋巴癌、鼻咽癌、肾上腺肿瘤、膀胱肿瘤、非小细胞肺癌(nsclc)、脑胶质瘤、子宫内膜癌、睾丸癌、结直肠癌、尿路肿瘤、甲状腺癌、或其组合。
在另一优选例中,所述肿瘤选自下组:乳腺癌、卵巢癌、胰腺癌、脑癌、成胶质细胞瘤、或其组合。
在本发明的第八方面,提供了一种用于制备本发明第四方面所述细胞的试剂盒,所述试剂盒含有容器,以及位于容器内的本发明第二方面所述的核酸分子、或本发明第三方面所述的载体。
在本发明的第九方面,提供了一种本发明第四方面所述细胞、或本发明第六方面所述的制剂的用途,用于预防和/或治疗癌症或肿瘤。
在本发明的第十方面,提供了一种治疗疾病的方法,包括给需要治疗的对象施用适量的本发明第四方面所述的细胞、或本发明第六方面所述的制剂。
在另一优选例中,所述疾病为癌症或肿瘤。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示了car的结构。其中,左边是第一代car(没有共刺激域),中间是第二代car(一个共刺激结构域cd28或者4-bb),右边是第三代car(两个或多个共刺激结构域)。
图2显示了egfr和egfrviii蛋白的结构。其中,egfr包含胞外,跨膜和胞内结构域。酪氨酸磷酸化位点标记于酪氨酸激酶和羧基末端结构域内(y845-y1175)。egfrviii由缺失第5-273位氨基酸以及在第5和274位氨基酸的连接处引入甘氨酸形成。
图3显示了egfrcar构建物的结构。使用第二代car-t构建物,共刺激结构域为cd28,4-1bb或gitr。
图4显示了egfr-gitr-cd3zetacar-t细胞的体外扩增。
图5显示fab染色证明egfrscfv在转导的t细胞中的表达。egfr-car-t细胞中用抗人fab抗体进行的fab染色比未转导的t细胞中的高。
图6显示了egfr-gitr-cd3zetacar-t细胞对egfr阳性细胞具有高细胞毒性,对egfr阴性癌细胞无毒性。图6a-6d显示卡egfr高表达的不同癌细胞系中具有不同共激活结构域的egfr-car的细胞毒性。图6e显示在egfr-1阴性的mcf-7细胞中没有观察到egfr-car的细胞毒性。其中,e:t表示效应物和靶细胞的比例。
具体实施方式
本发明人经过广泛而深入地研究,首次意外地发现一种嵌合抗原受体融合蛋白,其从n端到c端包含:(i)包含vh和vl的单链可变区片段(scfv),其中scfv对人表皮生长因子受体(egfr)具有低亲和力,解离常数(kd)>50nm(ii)跨膜结构域,(iii)gitr共刺激结构域,和(iv)激活域。
术语
为了可以更容易地理解本公开,首先定义某些术语。如本申请中所使用的,除非本文另有明确规定,否则以下术语中的每一个应具有下面给出的含义。在整个申请中阐述了其它定义。
术语“约”可以是指在本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其将部分地取决于如何测量或测定值或组成。
术语“给予”是指使用本领域技术人员已知的各种方法和递送系统中的任一种将本发明的产品物理引入受试者,包括静脉内,肌内,皮下,腹膜内,脊髓或其它肠胃外给药途径,例如通过注射或输注。
术语“抗体”(ab)应包括但不限于免疫球蛋白,其特异性结合抗原并包含通过二硫键互连的至少两条重(h)链和两条轻(l)链,或其抗原结合部分。每条h链包含重链可变区(本文缩写为vh)和重链恒定区。重链恒定区包含三个恒定结构域ch1、ch2和ch3。每条轻链包含轻链可变区(本文缩写为vl)和轻链恒定区。轻链恒定区包含一个恒定结构域cl。vh和vl区可以进一步细分为称为互补决定区(cdr)的高变区,其散布有更保守的称为框架区(fr)的区域。每个vh和vl包含三个cdr和四个fr,从氨基末端到羧基末端按照以下顺序排列:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。
如本文所用,“嵌合抗原受体(car)”是一种融合蛋白,其包含能够结合抗原的胞外结构域,与胞外结构域衍生自不同多肽的跨膜结构域,以及至少一个胞内结构域。“嵌合抗原受体(car)”也称为“嵌合受体”、“t-body”或“嵌合免疫受体(cir)”。所述的“能够结合抗原的胞外结构域”是指能够结合某一抗原的任何寡肽或多肽。“胞内结构域”是指已知的作为传递信号以激活或抑制细胞内生物过程的结构域的任何寡肽或多肽。
如本文所用,“域”或“结构域”是指多肽中独立于其它区域且折叠成特异结构的区域。
如本文所用,“单链可变区片段(scfv)”是指源自抗体的单链多肽,其保留了结合抗原的能力。scfv的实例包括通过重组dna技术形成的抗体多肽,其中免疫球蛋白重链(h链)和轻链(l链)片段的fv区经由间隔序列连接。制备scfv的各种方法是本领域技术人员所熟知的。
如本文所用,“肿瘤抗原”是指具有抗原性的生物分子,其表达导致癌症。
egfr
egfr是一种表皮生长因子受体,在多种类型的癌症中过度表达。egfr是erb家族的四种受体酪氨酸激酶之一,该家族包括erbb2/her-2,erbb3/her3和erbb4/her4。egfr在增殖、生长调节、血管生成、存活和转移中起重要作用。
egfr的结构如下:包括胞外结构域、跨膜结构域,以及含有酪氨酸激酶结构域和羧基末端尾巴的胞内结构域(如图2所示)。多种类型的癌症,如成胶质细胞瘤和其他癌症,都具有第5-273位氨基酸的缺失,导致egfrviii型的表达。egfr野生型和egfrviii型,这两种类型都对于肿瘤存活信号传导至关重要。
egfr参与调节map激酶、pj3k、akt、stat信号通路。最近,研究人员开发了多种酪氨酸激酶抑制剂,免疫治疗方法领域也已经开发了10种靶向egfr信号的方法。car-t细胞有效用于针对血液癌靶点的临床试验。
近期,car-t细胞用于针对间皮素、egfr、her-2或其他靶点的实体瘤。与正常细胞相比,亲和力调整的her-2和egfr显示出对癌细胞的高度特异性,为car-t治疗提供了更高的安全性。
本发明提供了靶向egfr肿瘤抗原的car-t细胞,egfr在许多类型的癌症例如乳腺癌、胰腺癌和成胶质细胞瘤中高度过表达。本发明人利用(i)以低亲和力特异性识别egfr阳性癌细胞的egfr抗体制备scfv,和(ii)gitr作为共激活结构域,以产生egfr-gitr-car-t细胞。本发明的egfr-gitr-cd3-car-t细胞对多种egfr高表达的癌细胞系具有高细胞毒性,并且在egfr阴性细胞中无毒性。
gitr
gitr(糖皮质激素诱导的tnfr家族相关基因,c0357)结构域属于tnfr超家族(tnfrsf),并且是提供t细胞激活的共刺激结构域。本发明人发现了使用gitr进行car-t疗法的以下优点。通过促进效应t细胞群的扩增和活化以及抑制treg(t调节)细胞(可抑制免疫活性),gitr-gitrl的相互作用可以有效介导的抗肿瘤免疫应答。gitr激活效应细胞和抑制treg细胞抑制功能的双重功能使其有效用于car-t免疫治疗。
嵌合抗原受体
本发明涉及一种嵌合抗原受体融合蛋白,其从n端到c端包含:(i)包含vh和vl的单链可变区片段(scfv),其中scfv对人表皮生长因子受体(egfr)具有低亲和力,解离常数(kd)>50nm(ii)跨膜结构域,(iii)gitr共刺激结构域,和(iv)激活域。
可用于本发明的scfv对人efgr具有低亲和力,即其解离常数(kd)>50nm,或>80nm,或>100nm,或>150nm,优选地≥200nm或250nm。在一个实施方案中,scfv来源于c10(liu,x.;jiang,s.;fang,c.;yang,s.;olalere,d.;pequignot,e.c.;cogdill,a.p.;li,n.;ramones,m.;granda,b.,elal.affinity-tunederbb2oregfrchimericantigenreceptortcellsexhibitanincreasedtherapeuticindexagainsttumorsinmice.cancerres2015,75,3596-3607.)或p3-5(zhou,y.;drummond,d.c.;zou,h.;hayes,m.e.;adams,g.p.;kirpotin,d.b.;marks,j.d.impactofsingle-chainfvantibodyfragmentaffinityonnanoparticletargetingofepidermalgrowthfactorreceptor-expressingtumorcells.jmolbiol2007,371,934-947.)。并且与c10或p3-5的同源性至少为90%。优选地,scfv与c10或p3-5的同源性至少为92%,9s%,98%或99%。本发明的car-t细胞包含对egfr有低亲和力的scfv,其表现出与高亲和力抗体细胞类似的强效抗肿瘤效力,但不作用于表达生理性egfr水平的正常细胞,因而增加了治疗指数。
本发明展示了包含egfr-gitr-cd3ζ慢病毒载体和egfr-gitr-car-t细胞的构建;egfr-gitr-car-t细胞可以杀死egfr阳性癌细胞但不杀死egfr阴性癌细胞。
本发明利用低亲和力的egfr抗体和gitr制备efgr-gitrcar-t细胞构建物。将egfrscfv(例如来自低亲和力抗体c10或p3-5)克隆到慢病毒载体的xbai和ecori位点。
本发明的car构建物(图2)含有cd8信号肽,egfrscfv:来自低亲和力的egfr抗体的vh(重链可变区)-接头3x(ggggs,seqidno.:10)-vl(轻链可变区),cd8铰链区,cd28跨膜结构域,gitr和cd3ζ激活结构域。
本发明人制备了针对egfr阳性的癌细胞系,例如乳腺癌、卵巢癌、胰腺癌、脑癌等的egfr-scfv-gitr-cd3ζ-car-t细胞。本发明人提供了数据证明培养的egfr-gitrcar-t细胞可以有效扩增。
egfr-gitr-cd3zetacar-t可靶向egfr阳性和egfr-viii阳性癌细胞。
egfr-gitr-cd3zetacar-t可以与不同的化学疗法(检查点抑制剂)、靶向治疗、小分子抑制剂和抗体联合使用。
egfr-gitr-cd3zetacar-t细胞可以生产用于临床用途。与具有其他共刺激结构域的egfr-car相比,本发明的car具有优势。
tag-缀合的egfrscfv可以用于car的生产。
对于car内部相同的egfr-scfv,可以使用第三代car-t或其他共激活信号域。
egfr-gitr-car-t与靶向其他肿瘤抗原或肿瘤微环境(vegfr-i-3)的car-t或双scfvcar的组合,可用于增强egfr-gitr-car单药治疗的活性。
核酸分子
本发明提供了编码上述car的核酸。通过常规方法,利用特定car的氨基酸序列,可以很容易地制备编码car的核酸。利用前述各结构域的氨基酸序列的ncbirefseqid或genbenk登录号,可以获得编码氨基酸序列的核苷酸序列。本发明的核酸可以使用标准分子生物学和/或化学方法制备。例如,可以基于碱基序列合成核酸,并且可以通过使用聚合酶链反应(pcr)将从cdna文库获得的dna片段融合来制备本发明的核酸。
编码本发明的car的核酸可以插入载体中,并且可以将载体导入细胞。例如,可以使用病毒载体如逆转录病毒载体(包括致癌反转录病毒载体、慢病毒载体和假型载体)、腺病毒载体、腺相关病毒(aav)载体、猿病毒载体、牛痘病毒载体或仙台病毒载体、爱泼斯坦-巴尔病毒(ebv)载体和hsv载体。作为病毒载体,优选使用缺乏复制能力的病毒载体,以免在感染细胞中自复制。作为病毒载体,优选使用缺乏复制能力的病毒载体,以免在感染细胞中自复制。
例如,当使用逆转录病毒载体时,本发明的方法可以是通过基于载体所具有的ltr序列和包装信号序列,选择合适的包装细胞,并使用包装细胞制备逆转录病毒颗粒。包装细胞的实例包括pg13(atcccrl-10686)、pa317(atcccrl-9078)、gp+e-86、gp+envam-12和psi-crip。还可以使用具有高转染效率的293细胞或293t细胞来制备逆转录病毒颗粒。基于逆转录病毒和包装细胞产生的多种逆转录病毒载体可广泛地从许多公司获得。
本发明的细胞通过car与特异性抗原结合,从而将信号传递到细胞中,进而活化细胞。表达car的细胞的活化,可以根据宿主细胞的种类和car的胞内结构域而变化,并且可以基于例如细胞因子的释放,细胞增殖率的提高,细胞表面分子的改变等作为指标。例如,从活化细胞释放细胞毒性因子(肿瘤坏死因子,淋巴毒素等),从而破坏表达抗原的靶细胞。此外,细胞因子的释放或细胞表面分子的变化还可以激活其他免疫细胞,例如b细胞、树突状细胞、nk细胞和巨噬细胞。表达car的细胞可以用作疾病的治疗剂。该治疗剂包含表达car的细胞作为活性成分,并且还可以包含合适的赋形剂。赋形剂的实例包括上述的药学上可接受的赋形剂(用于包含本发明的核酸作为活性成分的组合物的赋形剂)、各种细胞培养基和等渗氯化钠。
载体
编码期望分子的核酸序列可利用在本领域中已知的重组方法获得,诸如例如通过从表达基因的细胞中筛选文库,通过从已知包括该基因的载体中得到该基因,或通过利用标准的技术,从包含该基因的细胞和组织中直接分离。可选地,感兴趣的基因可被合成生产。
本发明也提供了其中插入本发明的表达盒的载体。源于逆转录病毒诸如慢病毒的载体是实现长期基因转移的合适工具,因为它们允许转基因长期、稳定的整合并且其在子细胞中增殖。慢病毒载体具有超过源自致癌逆转录病毒诸如鼠科白血病病毒的载体的优点,因为它们可转导非增殖的细胞,诸如肝细胞。它们也具有低免疫原性的优点。
简单概括,通常可操作地连接本发明的表达盒或核酸序列至启动子,并将其并入表达载体。该载体适合于复制和整合真核细胞。典型的克隆载体包含可用于调节期望核酸序列表达的转录和翻译终止子、初始序列和启动子。
本发明的表达构建体也可利用标准的基因传递方案,用于核酸免疫和基因疗法。基因传递的方法在本领域中是已知的。见例如美国专利号5,399,346、5,580,859、5,589,466,在此通过引用全文并入。在另一个实施方式中,本发明提供了基因疗法载体。
该核酸可被克隆入许多类型的载体。例如,该核酸可被克隆入如此载体,其包括但不限于质粒、噬菌粒、噬菌体衍生物、动物病毒和粘粒。特定的感兴趣载体包括表达载体、复制载体、探针产生载体和测序载体。
进一步地,表达载体可以以病毒载体形式提供给细胞。病毒载体技术在本领域中是公知的并在例如sambrook等(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork)和其他病毒学和分子生物学手册中进行了描述。可用作载体的病毒包括但不限于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒和慢病毒。通常,合适的载体包含在至少一种有机体中起作用的复制起点、启动子序列、方便的限制酶位点和一个或多个可选择的标记(例如,wo01/96584;wo01/29058;和美国专利号6,326,193)。
已经开发许多基于病毒的系统,用于将基因转移入哺乳动物细胞。例如,逆转录病毒提供了用于基因传递系统的方便的平台。可利用在本领域中已知的技术将选择的基因插入载体并包装入逆转录病毒颗粒。该重组病毒可随后被分离和传递至体内或离体的对象细胞。许多逆转录病毒系统在本领域中是已知的。在一些实施方式中,使用腺病毒载体。许多腺病毒载体在本领域中是已知的。在一个实施方式中,使用慢病毒载体。
额外的启动子元件,例如增强子,可以调节转录开始的频率。通常地,这些位于起始位点上游的30-110bp区域中,尽管最近已经显示许多启动子也包含起始位点下游的功能元件。启动子元件之间的间隔经常是柔性的,以便当元件相对于另一个被倒置或移动时,保持启动子功能。在胸苷激酶(tk)启动子中,启动子元件之间的间隔可被增加隔开50bp,活性才开始下降。取决于启动子,表现出单个元件可合作或独立地起作用,以起动转录。
合适的启动子的一个例子为即时早期巨细胞病毒(cmv)启动子序列。该启动子序列为能够驱动可操作地连接至其上的任何多核苷酸序列高水平表达的强组成型启动子序列。合适的启动子的另一个例子为延伸生长因子-1α(ef-1α)。然而,也可使用其他组成型启动子序列,包括但不限于类人猿病毒40(sv40)早期启动子、小鼠乳癌病毒(mmtv)、人免疫缺陷病毒(hiv)长末端重复(ltr)启动子、momulv启动子、鸟类白血病病毒启动子、艾伯斯坦-巴尔(epstein-barr)病毒即时早期启动子、鲁斯氏肉瘤病毒启动子、以及人基因启动子,诸如但不限于肌动蛋白启动子、肌球蛋白启动子、血红素启动子和肌酸激酶启动子。进一步地,本发明不应被限于组成型启动子的应用。诱导型启动子也被考虑为本发明的一部分。诱导型启动子的使用提供了分子开关,其能够当这样的表达是期望的时,打开可操作地连接诱导型启动子的多核苷酸序列的表达,或当表达是不期望的时关闭表达。诱导型启动子的例子包括但不限于金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
为了评估car多肽或其部分的表达,被引入细胞的表达载体也可包含可选择的标记基因或报道基因中的任一个或两者,以便于从通过病毒载体寻求被转染或感染的细胞群中鉴定和选择表达细胞。在其他方面,可选择的标记可被携带在单独一段dna上并用于共转染程序。可选择的标记和报道基因两者的侧翼都可具有适当的调节序列,以便能够在宿主细胞中表达。有用的可选择标记包括例如抗生素抗性基因,诸如neo等等。
报道基因用于鉴定潜在转染的细胞并用于评价调节序列的功能性。通常地,报道基因为以下基因:其不存在于受体有机体或组织或由受体有机体或组织进行表达,并且其编码多肽,该多肽的表达由一些可容易检测的性质例如酶活性清楚表示。在dna已经被引入受体细胞后,报道基因的表达在合适的时间下进行测定。合适的报道基因可包括编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌型碱性磷酸酶或绿色萤光蛋白的基因(例如,ui-tei等,2000febsletters479:79-82)。合适的表达系统是公知的并可利用已知技术制备或从商业上获得。通常,显示最高水平的报道基因表达的具有最少5个侧翼区的构建体被鉴定为启动子。这样的启动子区可被连接至报道基因并用于评价试剂调节启动子-驱动转录的能力。
将基因引入细胞和将基因表达入细胞的方法在本领域中是已知的。在表达载体的内容中,载体可通过在本领域中的任何方法容易地引入宿主细胞,例如,哺乳动物、细菌、酵母或昆虫细胞。例如,表达载体可通过物理、化学或生物学手段转移入宿主细胞。
将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀、脂质转染法、粒子轰击、微注射、电穿孔等等。生产包括载体和/或外源核酸的细胞的方法在本领域中是公知的。见例如sambrook等(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork)。将多核苷酸引入宿主细胞的优选方法为磷酸钙转染。
将感兴趣的多核苷酸引入宿主细胞的生物学方法包括使用dna和rna载体。病毒载体,特别是逆转录病毒载体,已经成为最广泛使用的将基因插入哺乳动物例如人细胞的方法。其他病毒载体可源自慢病毒、痘病毒、单纯疱疹病毒i、腺病毒和腺伴随病毒等等。见例如美国专利号5,350,674和5,585,362。
将多核苷酸引入宿主细胞的化学手段包括胶体分散系统,诸如大分子复合物、纳米胶囊、微球、珠;和基于脂质的系统,包括水包油乳剂、胶束、混合胶束和脂质体。用作体外和体内传递工具(deliveryvehicle)的示例性胶体系统为脂质体(例如,人造膜囊)。
在使用非病毒传递系统的情况下,示例性传递工具为脂质体。考虑使用脂质制剂,以将核酸引入宿主细胞(体外、离体(exvivo)或体内)。在另一方面,该核酸可与脂质相关联。与脂质相关联的核酸可被封装入脂质体的水性内部中,散布在脂质体的脂双层内,经与脂质体和寡核苷酸两者都相关联的连接分子附接至脂质体,陷入脂质体,与脂质体复合,分散在包含脂质的溶液中,与脂质混合,与脂质联合,作为悬浮液包含在脂质中,包含在胶束中或与胶束复合,或以其他方式与脂质相关联。与组合物相关联的脂质、脂质/dna或脂质/表达载体不限于溶液中的任何具体结构。例如,它们可存在于双分子层结构中,作为胶束或具有“坍缩的(collapsed)”结构。它们也可简单地被散布在溶液中,可能形成大小或形状不均一的聚集体。脂质为脂肪物质,其可为天然发生或合成的脂质。例如,脂质包括脂肪小滴,其天然发生在细胞质以及包含长链脂肪族烃和它们的衍生物诸如脂肪酸、醇类、胺类、氨基醇类和醛类的该类化合物中。
在本发明的一个优选地实施方式中,所述载体为慢病毒载体。
制剂
本发明提供了一种含有本发明第一方面所述的car-t细胞,以及药学上可接受的载体、稀释剂或赋形剂。在一个实施方式中,所述制剂为液态制剂。优选地,所述制剂为注射剂。优选地,所述制剂中所述car-t细胞的浓度为1×103-1×108个细胞/ml,更优地1×104-1×107个细胞/ml。
在一个实施方式中,所述制剂可包括缓冲液诸如中性缓冲盐水、硫酸盐缓冲盐水等等;碳水化合物诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸诸如甘氨酸;抗氧化剂;螯合剂诸如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。本发明的制剂优选配制用于静脉内施用。
治疗性应用
本发明包括用编码本发明表达盒的慢病毒载体(lv)转导的细胞(例如,t细胞)进行的治疗性应用。转导的t细胞可靶向肿瘤细胞的标志物egfr,协同激活t细胞,引起t细胞免疫应答,从而显著提高其对肿瘤细胞的杀伤效率。
因此,本发明也提供了刺激对哺乳动物的靶细胞群或组织的t细胞-介导的免疫应答的方法,其包括以下步骤:给哺乳动物施用本发明的car-t细胞。
在一个实施方式中,本发明包括一类细胞疗法,分离病人自体t细胞(或者异源供体),激活并进行基因改造产生car-t细胞,随后注入同一病人体内。这种方式患移植物抗宿主病概率极低,抗原被t细胞以无mhc限制方式识别。此外,一种car-t就可以治疗表达该抗原的所有癌症。不像抗体疗法,car-t细胞能够体内复制,产生可导致持续肿瘤控制的长期持久性。
在一个实施方式中,本发明的car-t细胞可经历稳固的体内t细胞扩展并可持续延长的时间量。另外,car介导的免疫应答可为过继免疫疗法步骤的一部分,其中car-修饰t细胞诱导对car中的抗原结合结构域特异性的免疫应答。例如,抗egfr的car-t细胞引起抗表达egfr的细胞的特异性免疫应答。
尽管本文公开的数据具体公开了包括抗-egfrscfv、铰链和跨膜区、和4-1bb和cd3ζ信号传导结构域的慢病毒载体,但本发明应被解释为包括对构建体组成部分中的每一个的任何数量的变化。
可治疗的癌症包括没有被血管化或基本上还没有被血管化的肿瘤,以及血管化的肿瘤。癌症可包括非实体瘤(诸如血液学肿瘤,例如白血病和淋巴瘤)或可包括实体瘤。用本发明的car治疗的癌症类型包括但不限于癌、胚细胞瘤和肉瘤,和某些白血病或淋巴恶性肿瘤、良性和恶性肿瘤、和恶性瘤,例如肉瘤、癌和黑素瘤。也包括成人肿瘤/癌症和儿童肿瘤/癌症。
血液学癌症为血液或骨髓的癌症。血液学(或血原性)癌症的例子包括白血病,包括急性白血病(诸如急性淋巴细胞白血病、急性髓细胞白血病、急性骨髓性白血病和成髓细胞性、前髓细胞性、粒-单核细胞型、单核细胞性和红白血病)、慢性白血病(诸如慢性髓细胞(粒细胞性)白血病、慢性骨髓性白血病和慢性淋巴细胞白血病)、真性红细胞增多症、淋巴瘤、霍奇金氏疾病、非霍奇金氏淋巴瘤(无痛和高等级形式)、多发性骨髓瘤、瓦尔登斯特伦氏巨球蛋白血症、重链疾病、骨髓增生异常综合征、多毛细胞白血病和脊髓发育不良。
实体瘤为通常不包含囊肿或液体区的组织的异常肿块。实体瘤可为良性或恶性的。不同类型的实体瘤以形成它们的细胞类型命名(诸如肉瘤、癌和淋巴瘤)。实体瘤诸如肉瘤和癌的例子包括纤维肉瘤、粘液肉瘤、脂肪肉瘤间皮瘤、淋巴恶性肿瘤、胰腺癌卵巢癌。
优选的肿瘤类型为egfr阳性的肿瘤,较佳地为egfr高表达的肿瘤,如乳腺癌、卵巢癌、胰腺癌、脑癌、成胶质细胞瘤、或其组合。
本发明的car-修饰t细胞也可用作对哺乳动物离体免疫和/或体内疗法的疫苗类型。优选地,哺乳动物为人。
对于离体免疫,以下中的至少一项在将细胞施用进入哺乳动物前在体外发生:i)扩增细胞,ii)将编码car的核酸引入细胞,和/或iii)冷冻保存细胞。
离体程序在本领域中是公知的,并在以下更完全地进行讨论。简单地说,细胞从哺乳动物(优选人)中分离并用表达本文公开的car的载体进行基因修饰(即,体外转导或转染)。car-修饰的细胞可被施用给哺乳动物接受者,以提供治疗益处。哺乳动物接受者可为人,和car-修饰的细胞可相对于接受者为自体的。可选地,细胞可相对于接受者为同种异基因的、同基因的(syngeneic)或异种的。
除了就离体免疫而言使用基于细胞的疫苗之外,本发明也提供了体内免疫以引起针对患者中抗原的免疫应答的组合物和方法。
本发明提供了治疗肿瘤的方法,其包括施用给需要其的对象治疗有效量的本发明的car-修饰的t细胞。
本发明的car-修饰的t细胞可被单独施用或作为药物组合物与稀释剂和/或与其他组分诸如il-2、il-17或其他细胞因子或细胞群结合施用。简单地说,本发明的药物组合物可包括如本文所述的靶细胞群,与一种或多种药学或生理学上可接受载体、稀释剂或赋形剂结合。这样的组合物可包括缓冲液诸如中性缓冲盐水、硫酸盐缓冲盐水等等;碳水化合物诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸诸如甘氨酸;抗氧化剂;螯合剂诸如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。本发明的组合物优选配制用于静脉内施用。
本发明的药物组合物可以以适于待治疗(或预防)的疾病的方式施用。施用的数量和频率将由这样的因素确定,如患者的病症、和患者疾病的类型和严重度——尽管适当的剂量可由临床试验确定。
当指出“免疫学上有效量”、“抗肿瘤有效量”、“肿瘤-抑制有效量”或“治疗量”时,待施用的本发明组合物的精确量可由医师确定,其考虑患者(对象)的年龄、重量、肿瘤大小、感染或转移程度和病症的个体差异。可通常指出:包括本文描述的t细胞的药物组合物可以以104至109个细胞/kg体重的剂量,优选105至106个细胞/kg体重的剂量(包括那些范围内的所有整数值)施用。t细胞组合物也可以以这些剂量多次施用。细胞可通过使用免疫疗法中公知的注入技术(见例如rosenberg等,neweng.j.ofmed.319:1676,1988)施用。对于具体患者的最佳剂量和治疗方案可通过监测患者的疾病迹象并因此调节治疗由医学领域技术人员容易地确定。
对象组合物的施用可以以任何方便的方式进行,包括通过喷雾法、注射、吞咽、输液、植入或移植。本文描述的组合物可被皮下、皮内、瘤内、结内、脊髓内、肌肉内、通过静脉内(i.v.)注射或腹膜内施用给患者。在一个实施方式中,本发明的t细胞组合物通过皮内或皮下注射被施用给患者。在另一个实施方式中,本发明的t细胞组合物优选通过i.v.注射施用。t细胞的组合物可被直接注入肿瘤,淋巴结或感染位置。
在本发明的某些实施方式中,利用本文描述的方法或本领域已知的其他将t细胞扩展至治疗性水平的方法活化和扩展的细胞,与任何数量的有关治疗形式结合(例如,之前、同时或之后)施用给患者,所述治疗形式包括但不限于用以下试剂进行治疗:所述试剂诸如抗病毒疗法、西多福韦和白细胞介素-2、阿糖胞苷(也已知为ara-c)或对ms患者的那他珠单抗治疗或对牛皮癣患者的厄法珠单抗治疗或对pml患者的其他治疗。在进一步的实施方式中,本发明的t细胞可与以下结合使用:化疗、辐射、免疫抑制剂,诸如,环孢菌素、硫唑嘌呤、甲氨喋呤、麦考酚酯和fk506,抗体或其他免疫治疗剂。在进一步的实施方式中,本发明的细胞组合物与骨髓移植、利用化疗剂诸如氟达拉滨、外部光束放射疗法(xrt)、环磷酰胺结合(例如,之前、同时或之后)而施用给患者。例如,在一个实施方式中,对象可经历高剂量化疗的标准治疗,之后进行外周血干细胞移植。在一些实施方式中,在移植后,对象接受本发明的扩展的免疫细胞的注入。在一个额外的实施方式中,扩展的细胞在外科手术前或外科手术后施用。
施用给患者的以上治疗的剂量将随着治疗病症的精确属性和治疗的接受者而变化。人施用的剂量比例可根据本领域接受的实践实施。通常,每次治疗或每个疗程,可将1×106个至1×1010个本发明经修饰的t细胞(如,car-t20细胞),通过例如静脉回输的方式,施用于患者。
本发明的主要优点包括:
(a)本发明利用低亲和力的egfr抗体制备car-t细胞,仅对egfr阳性癌细胞具有高细胞毒性,对egfr阴性癌细胞以及少量表达egfr的正常细胞没有细胞毒性;
(b)本发明的car将gitr作为共刺激结构域,制备efgr-gitrcar-t细胞,对egfr阳性癌细胞的细胞毒性有提高。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
总体而言,发明人将egfrcar构建物克隆至慢病毒载体的xbai和ecori位点,从而在慢病毒载体内产生egfrcar构建物。pcd510-fmc63-28z慢病毒car构建物包含位于xbai和ecori克隆位点之间的cds信号肽-egfrscfv-cd8铰链区-cd28跨膜结构域-gitr结构域-cd3zeta。
利用293t细胞生产慢病毒,通过rt-pcr建立效价。随后,如实施例中所述,利用相同剂量的慢病毒转导t细胞。本发明使用car慢病毒转导t细胞,并且还利用未转导的t细胞对照来检测car-t细胞对egfr阳性细胞系的毒性。
实施例1car慢病毒的生产
慢病毒通过以下步骤制备:
第1天:
1.将5×106hek293ft细胞接种到100毫米直径的培养皿;
第2天:
2.检查以确保70%-90%的细胞融合;
3.为每个100毫米直径的培养皿准备转染复合物,流程如下:
a.在1.5ml管a中:将2.5μgcar(嵌合抗原受体)dna质粒(plasmid)和20μl慢病毒包装组合(alstem,产品目录号vp100;见appendixb3)稀释到0.5mldmem或opti-mem无血清培养基中,轻轻混合;
b.在1.5ml管b中:将30μlnanofect转染试剂(alstem,产品目录号nf100)稀释到0.5mldmem或opti-mem无血清培养基中,轻轻混合;
c.将管b中的nanofect/dmem加入到dna/dmem溶液(管a)中,涡旋5-10秒,将dmem-plasmid-nanofect混合物在室温下孵育15分钟;
4.将步骤3获得的全部转染复合物逐滴滴加到细胞板上,将板来回旋转使得转染复合物均匀地分散在板上;
5.37℃加湿5%co2培养箱中过夜培养该细胞;
第3天:
6.用10ml新鲜培养基替换上述转染复合物的上清液,并补充20μlviralboost(500x,alstem,产品目录号vb100);
7.37℃培育24小时;
第4天:
8.将含有慢病毒的培养液上清收集到50ml无菌有盖锥形离心管中,并放置于冰上;
9.上清液在4℃3000转条件下离心15分钟,以沉淀细胞碎片;
10.利用0.45μm的低蛋白结合无菌过滤器过滤澄清后的上清液;
11.通过定量rt-pcr测定慢病毒的浓度/滴度,利用lenti-xqrt-pcr滴定试剂盒(clontech;产品目录号631235),测定上清液中hek293的病毒浓度(通过dnasei预处理去除任何可能残留的质粒dna);
12.上述病毒可以用于感染、纯化,或作为病毒原液存储于‐80℃备用,优选为小份单独存储,以减少反复冻融带来的病毒滴度损失。
实施例2慢病毒包装系统
产品说明
产品名称:superlentitmlentiviruspackagingsystem
说明书:
对于慢病毒颗粒的生产,通常需要三种成分:1)含有目标外源基因的慢病毒载体,2)包含所有必需的病毒结构蛋白的包装载体,3)表达水泡性口炎病毒(vsv)糖蛋白(g)的包膜载体。第三代慢病毒包装系统提供了最大的生物安全性,因为慢病毒rev基因是作为相对其他结构基因的独立载体提供,进一步消除了将载体逆向重组到有复制能力的病毒颗粒中的可能性。第三代慢病毒包装混合物仅支持嵌合5’ltr的慢病毒表达载体,其中hiv启动子被cmv或rsv替代,因此使其独立于tat。
superlenti慢病毒包装混合物是一种基于hiv的即用型第三代慢病毒包装系统,其中质粒表达慢病毒生产所需的元件,其允许创建基于hiv-1的复制无效的慢病毒,在分裂或非分裂哺乳动物细胞中递送并表达目标外源基因。
产品目录号:vp100;
规格:200μl;
运输:室温;
储存和安全性:-20℃储存,该产品可以在-20℃稳定储存6个月。应该分装成一次使用的剂量,以便尽量避免反复冻融。使用前-20℃冰箱小份储存。
使用方法:
对于100mm培养皿的慢病毒包装,用20μl慢病毒包装混合物混合2.5μg慢病毒表达载体。
对于150mm培养皿的慢病毒包装,用40μl慢病毒包装混合物混合5μg慢病毒表达载体。
质量控制:在转染实验条件下,通过使用人类胚胎肾293细胞对每批次的慢病毒包装混合物进行测试。
仅供研究使用。不用于诊断或治疗过程。
实施例3全血中外周血单核细胞(pbmc)的分离
全血(斯坦福大学医院血液中心,斯坦福,加州)采集自单个个体或多个个体(取决于所需血的量),并置于10ml的heparinvacutainers(bectondickinson公司)中。
注:应该在采血后的两小时内处理血液,以确保细胞产量最大。血液可以在室温下(室内)储存过夜,用于第二天的处理;然而,细胞产量会有一些损失。血液不应在4℃下储存在空管中。在50ml锥形离心管中,将约10ml抗凝全血与无菌磷酸盐缓冲液(pbs)混合,总体积为20ml(pbs,ph7/4,不含ca2+/mg2+)。在另一单独的,无菌50ml锥形离心管中,移液管移入15mlficoll-paqueplus(gehealthcare,17-1440-03)。非常轻柔地将20ml的血液/pbs层压到ficoll的表面,并在室温下以400xg离心样品30-40min,无需制动。小心吸取稀释血浆和ficoll分界处的包含外周血单核细胞(pbmc)的细胞层,避免吸入ficoll。为了确保完全去除ficoll,血小板和血浆蛋白,用总体积为40ml的pbs洗涤pbmc两次,并在室温下以200xg离心10分钟。然后用血细胞计数器计数细胞。如果洗涤的pbmc立即使用,则用car-t培养基(aimv-albumax(bsa)(生命科技)洗涤一次,含有5%ab血清和1.25μg/ml两性霉素b(geminibioproducts,伍德兰,ca),100u/ml青霉素和100μg/ml链霉素)。如果要将pbmc冷冻,则在转移绝缘小瓶中重悬洗涤细胞,-80℃,保持24小时,然后储存在液氮中。
实施例4外周血单核细胞t细胞活化
如果使用新鲜分离的pbmc,分离的细胞(用1xpbs(ph7.4)洗涤,无ca2+/mg2+)用car-t培养基(aimv-albumax(bsa)(生命科技,含有5%ab血清和1.25μg/ml两性霉素b(geminibioproducts,伍德兰,ca),100u/ml青霉素和100μg/ml链霉素)洗涤一次,不使用人白细胞介素-2(huil-2)(invitrogen),浓度为5×105个细胞/ml。在不含huil-2的car-t培养基中洗涤一次,最后用含300u/mlhuil2(1000×stock;invitrogen)的car-t培养基重悬浮至终浓度为5×105个细胞/ml。
如果使用冷冻的pbmc,在9ml预热(37℃)的dmem培养基(生命科技)中,在10%fbs,100u/ml青霉素和100μg/ml链霉素存在下,以5×105个细胞/ml的浓度,解冻并重悬细胞(1×107细胞/ml)。300xg离心细胞5分钟,然后用不含huil-2的car-t培养基洗涤一次,最后用含30u/mlhuil2的car-t培养基重悬浮至终浓度为5×105个细胞/ml。
在活化之前,将缀合抗人cd28和cd3抗体的磁珠(invitrogen)用1ml无菌1xpbs(ph7.4)(使用磁性架从溶液中分离珠子)洗涤三次,然后重悬于car-t培养基中(300u.mlhuil-2),终浓度为2×107珠/ml。
然后将25ul的磁珠添加到1ml的pbmc中,以1:1的磁珠细胞比混合pbmc和磁珠。
将所需数量的等分试样加到12孔低附着或未处理细胞培养板的各个孔中,并在37℃下co2存在下培养24小时,然后进行病毒转导。
实施例5t细胞转导和扩增
pbmc活化后,将细胞在37℃,5%co2下培养24小时。
冰上解冻慢病毒。每孔1x106个细胞并添加5×106个慢病毒和2μl/mltransplus培养基(alstem,richmond,ca)(最终稀释1:500)。细胞额外培养24小时后重复添加病毒。
然后将细胞在持续存在300u/mlil-2的新鲜培养基中培养12-14天(总培养时间取决于所需car-t细胞的最终数量)。
每隔2-3天分析细胞浓度,分析时添加培养基稀释细胞悬浮液至1×106细胞/ml。
实施例6转导验证-细胞染色
在facs缓冲液(磷酸盐缓冲液(pbs),缓冲液中加0.1%叠氮钠和0.4%牛血清白蛋白)中洗涤并悬浮细胞。然后细胞按等分为1×106的小份。
用正常山羊igg(生命科技)阻断fc受体,添加100μl1:1000稀释的正常山羊igg到各管,冰上孵育10分钟。
每管中加入1.0mlfacs缓冲液,300g旋转沉淀5分钟。
加入生物素标记的多克隆山羊抗鼠f(ab)2抗体(生命科技)检测cd24scfv;加入生物素标记的正常多克隆山羊igg抗体(生命科技)作为同种型对照。(1:200稀释,反应体积为100μl)。
将细胞在4℃孵育25分钟,并用facs缓冲液洗涤一次。
在facs缓冲液中悬浮细胞并通过向每个管中加入100μl1:1000稀释的正常小鼠igg来阻断细胞。在冰中孵育10分钟。用facs缓冲液洗涤细胞并重悬于100μlfac缓冲液中。
随后用藻红蛋白(pe)标记的链霉亲和素(bdpharmingen,sandiego,ca)和别藻蓝蛋白(apc)标记的cd3(ebiocience,sandiego,ca)对细胞进行染色。将1.0μlpe和apc分别加入管2和3。
利用流式细胞仪bdfacscalibur(bdbiosciences)进行细胞采集,并用flowjo软件(treestar,inc.amland,or)进行分析。
实施例7细胞毒性试验(实时acea)
根据下述制造商的方案使用acea仪器进行细胞毒性试验。
实时细胞试验(rtca)方案
第1天:
a.制备(贴壁)靶细胞:
1.从培养瓶中吸去旧的培养基。
2.加入5-10ml常规培养基(无血清)到培养瓶中,冲洗掉血清残留物。然后,吸入培养基。
3.向培养瓶中加入0.5ml-1ml的0.05%胰蛋白酶-edta以分离细胞。
4.将4.5ml-9.5ml培养基(含fbs)加入培养瓶中,上下吸取培养基至烧瓶底部,将细胞分散成单细胞溶液。
5.将悬浮的细胞悬液转移到15ml管中。
6.取出10μl细胞悬液并用血细胞计数器计数,测定细胞浓度。
7.在25℃下以1000rpm(或300xg)离心细胞悬液5分钟。
8.离心后,吸去上清液,将细胞沉淀重新悬浮于含有fbs的培养基中,直到浓度达到1×105个细胞/ml。
b.制备rtca板:
1.只将50ul培养基(与用于细胞悬液的培养基相同)加入到待检测的孔中。
2.将e-板(acea生物科学,inc,产品编号:jl-10-156010-1a)放回台上。
3.启动rtca2.0软件
a.输入版面信息:
i.至少,选择所有的孔,然后点击“应用”。这激活了孔。
b.输入计划:
i.步骤1=背景测量。不要改变。
ii.步骤2=监测细胞
iii.步骤3=短期细胞毒性
iv.步骤4=长期细胞毒性(点击“自动”框)
**可以更改每个步骤的循环次数和每个循环之间的间隔**
4.单击“步骤1”,然后按开始命名实验,并测量培养基的背景。
5.“步骤1”完成后,从台上取下e-板。
6.将a部分的100μl细胞悬液加入孔中(不要移除先前的培养基,每个孔中最终总计150ul)。
7.让细胞在通风橱中静置5分钟。
8.将e-板放回台上。
9.点击“步骤2”,然后按开始恢复记录。
第2天-处理:
a.制备car-t效应细胞:
1.从6孔板中取出所有悬浮的car-t细胞并充分混合。
2.取10μl细胞悬液,用血细胞计数器测定细胞浓度。
3.在25℃下以1000rpm(或300xg)离心细胞悬液5分钟。
4.吸出上清液,并将细胞沉淀重悬于2ml细胞毒性缓冲液(rpmi1640无苯酚(invitrogen)+1%p/s(invitrogen)+5%人ab血清(geminibioproducts;100-318)。
5.重复步骤3。
6.吸出上清液并将细胞沉淀重悬于细胞毒性培养基(无酚红rpmi1640(invitrogen)加5%ab血清(geminibioproducts;100-318))中以获得1×106细胞/ml的终浓度。
b.制备rtca板:
1.a部分完成后,按快进至步骤3。
2.从台上取下e-板。
3.从每个孔小心地吸去上清液。
4.向每个孔中加入100μl的细胞毒性培养基。
5.重复步骤3。
6.向每个孔中加入50μl的细胞毒性培养基。
7.将100μl来自a部分的car-t细胞悬液(1×105个细胞)分配至每个设计的所需孔中。
8.将e-板放回到台上。
9.点击“步骤3”,然后按开始恢复记录。
实施例8egfr-gitr-cd3ζcar的序列
实施例8-11的car结构如下:人cd8信号肽,来源于低亲和力的c10egfr抗体的人egfrscfv(vh-linker-3x(ggggs,seqidno.:10)-vl),cd8铰链区,cd28跨膜区,共激活结构域(实施例8和9的gitr,实施例10的cd28,或实施例11的4-1bb),cd3ζ激活域(图3)。c10egfr抗体对a431细胞的解离常数kd为265nm。
ecor1和xhoi位点之间插入car构建物的慢病毒载体的序列如下所示。scfv的旁侧为nhei和xhoi位点,以便有可能重新克隆到其他构建物。
核苷酸序列,seqidno:1。
seqidno:2是对应于seqidno:1的氨基酸序列(seqidno:1的翻译序列,egfr-gitr-cd3zetacar)
car构建物的构建方案如下所示,显示了seqidno:1的各亚结构域的序列。
seqidno.:1的第1-78位为<hucd8信号肽>
seqidno.:1的第85-831位为<egfrscfv>,其中,所述的egfrscfv来源于c10,氨基酸序列如下所示(seqidno.:3):
seqidno.:1的第838-984位为<cd8>
seqidno.:1的第985-1065位为<cd28tm>
seqidno.:1的第1066-1239位为<gitr>
seqidno.:1的第1240-1584位为<cd3zeta>
实施例9egfr-cd28-cd3ζ-car的序列
该构建物包括人cd8信号肽,来源于p3-5的人egfrscfv(vh-linker-3x(ggggs,seqidno.:10)-vl),cd8铰链区,cd28跨膜区,cd28共刺激结构域,cd3ζ激活结构域(图3)。p3-5对a431细胞的kd为88nm。
除人egfrscfv来源于p3-5外,该构建物的序列与实施例8中所述的序列相似。
来源于p3-5的egfrscfv的vh如下所示(seqidno.:4),用下划线标示的氨基酸是与c10不同的氨基酸。
以最可能密码子,使用www.bioinformatics.org/sms2/rev_trans.html反向翻译成具有375个碱基的序列(seqidno.:5)。
来源于p3-5的egfrscfv的vl如下所示(seqidno.:6),用下划线标示的氨基酸是与c10不同的氨基酸。
以最可能密码子,将氨基酸序列反向翻译成具有324个碱基的序列(seqidno.:7)。
实施例10egfr-cd28-cd3zeta-car的序列
该构建物包括人cd8信号肽,人egfrscfv(vh-linker-3x(ggggs,seqidno.:10)-vl),cd8铰链区,cd28跨膜区,cd28共刺激结构域,cd3ζ激活结构域(图3)。
除共刺激结构域为cd28外,该构建物的序列与实施例8中所述的序列相似。
<cd28共激活结构域序列>如下所示(seqidno.:8):
实施例11egfr-4-1bb-cd3zetacar
该构建物包括人cd8信号肽,人egfrscfv(vh-linker-3x(ggggs,seqidno.:10)-vl),cd8铰链区,cd28跨膜区,4-1bb共刺激结构域,cd3ζ激活结构域(图3)。
除共刺激结构域为4-1bb外,该构建物的序列与实施例8中所述的序列相似。
<4-1bb共刺激结构域序列>如下所示(seqidno.:9):
实施例12egfr-gitr-cd3zetacar-t细胞在培养中表现出有效扩增
egfr-gitr-cd3ζcar细胞在体外有效扩增(图4)。在培养20天内,egfr-car-t细胞扩增了超过60倍。培养16天后,egfr-4-1bb-cd3z-car-t细胞的生长减缓。cd19-cd28-cd3zetacar-t,非cd19-car-t细胞和未转导的t细胞也在体外有效扩增。
实施例13用egfr-car慢病毒构建物转导t细胞证明egfrscfv的表达
为了检测来源于c10egfr抗体的人scfv的转导和表达,将car-t细胞用抗人fab抗体染色。染色显示慢病毒car的有效转导。egfrscfv的表达比未转导的对照细胞(9.3%)高22-32%。结果见图5。
实施例14egfr-gitr-cd3zetacar对egfr阳性癌细胞具有更高的细胞毒性,对egfr阴性癌细胞没有细胞毒性
实时细胞毒性测定显示,egfr-gitr-cd3zeta-car细胞对egfr阳性癌细胞具有高细胞毒性(图6)。egfr-car的细胞毒性为癌症型依赖。例如,在u87成胶质细胞瘤细胞中,egfr-gitr-cd3z-car-t细胞具有比egfr-cd28-cd3zeta-car-t细胞更高的细胞毒性(图6a)。egfr-gitr-cd3zetacar-t的活性是剂量依赖性的;活性比从10:1增加至20:1。
在skov-3卵巢癌细胞中,egfr-gitr-cd3zetacar-t和egfr-cd28-cd3zetacar-t细胞的活性相同,但高于egfr-4-1bb-cd3zeta和模拟对照car-t细胞的活性(图6b)。在skov-3卵巢癌细胞中,含有gitr和cd28共刺激结构域的car-t细胞比含有4-1bb的car-t细胞具有更高的细胞毒性。在另一种卵巢癌细胞系a1847中,在e:t(效应物:靶细胞比例)为30:1的条件下,egfr-gitr-cd3zeta的活性比egfr-cd28-cd3zeta更好(图6c)。
在胰腺癌细胞sxpc3中,egfr-cd28-cd3ζ的细胞毒性高于egfr-gitr-cd3ζ和egfr-41bb-cd3ζ(图6d)。在egfr阴性细胞mcf-7细胞中,没有细胞毒性(图6e)。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>亘喜生物科技(上海)有限公司
<120>携带gitr共刺激信号靶向egfr的嵌合抗原受体t细胞
<130>p2017-2043
<160>10
<170>patentinversion3.5
<210>1
<211>1590
<212>dna
<213>人工序列(artificialsequence)
<400>1
tctagagccgccaccatggccttaccagtgaccgccttgctcctgccgctggccttgctg60
ctccacgccgccaggccggctagcgaagtgcagctggtgcagagcggcgcggaagtgaaa120
aaaccgggcagcagcgtgaaagtgagctgcaaagcgagcggcggcacctttagcagctat180
gcgattagctgggtgcgccaggcgccgggccagggcctggaatggatgggcggcattatt240
ccgatttttggcaccgcgaactatgcgcagaaatttcagggccgcgtgaccattaccgcg300
gatgaaagcaccagcaccgcgtatatggaactgagcagcctgcgcagcgaagataccgcg360
gtgtattattgcgcgcgcgaagaaggcccgtattgcagcagcaccagctgctatggcgcg420
tttgatatttggggccagggcaccctggtgaccgtgagcagcggtggcggtggttctggt480
ggcggtggttctggtggcggtggttctcagagcgtgctgacccaggatccggcggtgagc540
gtggcgctgggccagaccgtgaaaattacctgccagggcgatagcctgcgcagctatttt600
gcgagctggtatcagcagaaaccgggccaggcgccgaccctggtgatgtatgcgcgcaac660
gatcgcccggcgggcgtgccggatcgctttagcggcagcaaaagcggcaccagcgcgagc720
ctggcgattagcggcctgcagagcgaagatgaagcggattattattgcgcggcgtgggat780
gatagcctgaacggctatctgtttggcgcgggcaccaaactgaccgtgctgctcgagaag840
cccaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagccc900
ctgtccctgcgcccagaggcgagccggccagcggcggggggcgcagtgcacacgaggggg960
ctggacttcgccagtgataagcccttttgggtgctggtggtggttggtggagtcctggct1020
tgctatagcttgctagtaacagtggcctttattattttctgggtgcagcttggactgcac1080
atctggcagctgaggagtcagtgcatgtggccccgagagacccagctgctgctggaggtg1140
ccgccgtcgaccgaagacgccagaagctgccagttccccgaggaagagcggggcgagcga1200
tcggcagaggagaaggggcggctgggagacctgtgggtgagagtgaagttcagcaggagc1260
gcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctagga1320
cgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatgggggga1380
aagccgcagagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataag1440
atggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcac1500
gatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatg1560
caggccctgccccctcgctaataggaattc1590
<210>2
<211>521
<212>prt
<213>人工序列(artificialsequence)
<400>2
metalaleuprovalthralaleuleuleuproleualaleuleuleu
151015
hisalaalaargproalasergluvalglnleuvalglnserglyala
202530
gluvallyslysproglyserservallysvalsercyslysalaser
354045
glyglythrphesersertyralailesertrpvalargglnalapro
505560
glyglnglyleuglutrpmetglyglyileileproilepheglythr
65707580
alaasntyralaglnlyspheglnglyargvalthrilethralaasp
859095
gluserthrserthralatyrmetgluleuserserleuargserglu
100105110
aspthralavaltyrtyrcysalaargglugluglyprotyrcysser
115120125
serthrsercystyrglyalapheaspiletrpglyglnglythrleu
130135140
valthrvalserserglyglyglyglyserglyglyglyglysergly
145150155160
glyglyglyserglnservalleuthrglnaspproalavalserval
165170175
alaleuglyglnthrvallysilethrcysglnglyaspserleuarg
180185190
sertyrphealasertrptyrglnglnlysproglyglnalaprothr
195200205
leuvalmettyralaargasnaspargproalaglyvalproasparg
210215220
pheserglyserlysserglythrseralaserleualailesergly
225230235240
leuglnsergluaspglualaasptyrtyrcysalaalatrpaspasp
245250255
serleuasnglytyrleupheglyalaglythrlysleuthrvalleu
260265270
leuglulysprothrthrthrproalaproargproprothrproala
275280285
prothrilealaserglnproleuserleuargproglualaserarg
290295300
proalaalaglyglyalavalhisthrargglyleuaspphealaser
305310315320
asplysprophetrpvalleuvalvalvalglyglyvalleualacys
325330335
tyrserleuleuvalthrvalalapheileilephetrpvalglnleu
340345350
glyleuhisiletrpglnleuargserglncysmettrpproargglu
355360365
thrglnleuleuleugluvalproproserthrgluaspalaargser
370375380
cysglnpheprogluglugluargglygluargseralagluglulys
385390395400
glyargleuglyaspleutrpvalargvallyspheserargserala
405410415
aspalaproalatyrglnglnglyglnasnglnleutyrasngluleu
420425430
asnleuglyargarggluglutyraspvalleuasplysargarggly
435440445
argaspproglumetglyglylysproglnargarglysasnprogln
450455460
gluglyleutyrasngluleuglnlysasplysmetalaglualatyr
465470475480
sergluileglymetlysglygluargargargglylysglyhisasp
485490495
glyleutyrglnglyleuserthralathrlysaspthrtyraspala
500505510
leuhismetglnalaleuproproarg
515520
<210>3
<211>249
<212>prt
<213>人工序列(artificialsequence)
<400>3
gluvalglnleuvalglnserglyalagluvallyslysproglyser
151015
servallysvalsercyslysalaserglyglythrphesersertyr
202530
alailesertrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyglyileileproilepheglythralaasntyralaglnlysphe
505560
glnglyargvalthrilethralaaspgluserthrserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargglugluglyprotyrcysserserthrsercystyrglyala
100105110
pheaspiletrpglyglnglythrleuvalthrvalserserglygly
115120125
glyglyserglyglyglyglyserglyglyglyglyserglnserval
130135140
leuthrglnaspproalavalservalalaleuglyglnthrvallys
145150155160
ilethrcysglnglyaspserleuargsertyrphealasertrptyr
165170175
glnglnlysproglyglnalaprothrleuvalmettyralaargasn
180185190
aspargproalaglyvalproaspargpheserglyserlyssergly
195200205
thrseralaserleualaileserglyleuglnsergluaspgluala
210215220
asptyrtyrcysalaalatrpaspaspserleuasnglytyrleuphe
225230235240
glyalaglythrlysleuthrvalleu
245
<210>4
<211>125
<212>prt
<213>人工序列(artificialsequence)
<400>4
gluvalglnleuvalglnserglyalagluvallyslysproglyser
151015
servallyssercyslysalaserglyglythrphesersertyrala
202530
ilesertrpvalargglnalaproglyglnglyleuglutrpvalgly
354045
glyileileproilepheglythralaasntyralaglnlysphegln
505560
glyargvallysilethralaaspgluseralaserthralatyrmet
65707580
gluleuserserleuargsergluaspthralavaltyrtyrcysala
859095
argglugluglyprotyrcysserserthrsercystyrglyalaphe
100105110
aspiletrpglyglnglythrleuvalthrvalserser
115120125
<210>5
<211>375
<212>dna
<213>人工序列(artificialsequence)
<400>5
gaagtgcagctggtgcagagcggcgcggaagtgaaaaaaccgggcagcagcgtgaaaagc60
tgcaaagcgagcggcggcacctttagcagctatgcgattagctgggtgcgccaggcgccg120
ggccagggcctggaatgggtgggcggcattattccgatttttggcaccgcgaactatgcg180
cagaaatttcagggccgcgtgaaaattaccgcggatgaaagcgcgagcaccgcgtatatg240
gaactgagcagcctgcgcagcgaagataccgcggtgtattattgcgcgcgcgaagaaggc300
ccgtattgcagcagcaccagctgctatggcgcgtttgatatttggggccagggcaccctg360
gtgaccgtgagcagc375
<210>6
<211>108
<212>prt
<213>人工序列(artificialsequence)
<400>6
glnservalleuthrglnaspproalavalservalalaleuglygln
151015
thrvallysilethrcysglnglyaspserleuargsertyrleuala
202530
sertrptyrglnglnlysproglyglnalaprothrleuvalthrtyr
354045
alaargasnaspargproalaglyvalproaspargpheserglyser
505560
lysserglythrseralaserleualaileserglyleuglnserglu
65707580
aspglualaasptyrtyrcysalaalatrpaspaspserleuasngly
859095
tyrleupheglyalaglythrlysleuthrvalleu
100105
<210>7
<211>324
<212>dna
<213>人工序列(artificialsequence)
<400>7
cagagcgtgctgacccaggatccggcggtgagcgtggcgctgggccagaccgtgaaaatt60
acctgccagggcgatagcctgcgcagctatctggcgagctggtatcagcagaaaccgggc120
caggcgccgaccctggtgacctatgcgcgcaacgatcgcccggcgggcgtgccggatcgc180
tttagcggcagcaaaagcggcaccagcgcgagcctggcgattagcggcctgcagagcgaa240
gatgaagcggattattattgcgcggcgtgggatgatagcctgaacggctatctgtttggc300
gcgggcaccaaactgaccgtgctg324
<210>8
<211>123
<212>dna
<213>人工序列(artificialsequence)
<400>8
aggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgcccc60
gggcccacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgc120
tcc123
<210>9
<211>126
<212>dna
<213>人工序列(artificialsequence)
<400>9
aaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaa60
actactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgt120
gaactg126
<210>10
<211>5
<212>prt
<213>人工序列(artificialsequence)
<400>10
glyglyglyglyser
15
- 还没有人留言评论。精彩留言会获得点赞!