高效的肝炎病毒的抗体诱导方法、抗体以及检测系统与流程
[0001]
本发明涉及乙型肝炎病毒抗原及其制造方法、含有乙型肝炎病毒抗原的疫苗用组合物、抗乙型肝炎病毒抗体和编码其抗体的核酸、乙型肝炎病毒的检测系统、以及乙型肝炎病毒用药物组合物。
背景技术:
[0002]
乙型肝炎病毒(hbv)属于嗜肝dna病毒,具有不完全双链dna,是特异性感染人肝脏的病毒。由于hbv的感染,有可能发展成乙型急性肝炎、慢性肝炎、肝硬化、肝细胞癌,是重大的健康问题之一。认为目前日本有人口的约1%(约110-140万人)的乙型肝炎病毒(hbv)持有者,全世界约有5%(3亿5千万人)的感染者(who报告)。
[0003]
使用基于干扰素(抗病毒药)的免疫疗法和核酸类似物(逆转录酶抑制剂)进行乙型肝炎的治疗,但已指出副作用、耐药病毒的产生等问题,期待针对新靶的新治疗药。
[0004]
另一方面,为了防止hbv感染的扩散,疫苗的接种是有效的。目前,尽管世界各国和各地区对hbv实施了常规疫苗接种,但在日本直到最近也没有进行常规疫苗接种,因此认为很难防止新的hbv感染的发生。目前,使用酵母制备的疫苗(重组s-hbs抗原),但均作为没有附加糖链的蛋白质使用。
[0005]
为了引起疫苗接种后抗体效价的上升,需要接种多次(3次)以上,根据以往的疫苗,约有近90%的接种者获得抗体。但是,得到的抗体效价存在很大的个人差异。为了抑制常规疫苗接种的经费,也需要改善这些抗体诱导效率的问题。另一方面,最近的报告报道了即使hbv疫苗能够防止乙型肝炎的发病,也不能防止hbv感染的事例。另外,报告了通过hbv疫苗接种诱导的抗体无法识别的逃逸变异、隐匿性感染,重要的是开发也能够与这些变异hbv对应的新一代hbv疫苗(例如接种次数少也有效,有更广泛的抗病毒效果的疫苗)、抗hbv抗体。
[0006]
在hbv感染者的血液中,存在具有感染性的hbv颗粒(大球形颗粒(dane颗粒))和无感染性的空颗粒(svp)。具有感染性的大球形颗粒在核(hbc)中含有dna,还具有被包膜(hbs)包围的结构,但无感染性的空颗粒(svp)仅为hbs,不含有dna(图1)。
[0007]
hbs基因由pres1、pres2、s构成,编码从不同的翻译起始蛋氨酸密码子开始的3种膜蛋白(l-hbs抗原、m-hbs抗原、s-hbs抗原)。根据这些不同的hbs抗原的构成的不同,形成上述hbv颗粒(大球形颗粒和svp)。以往的疫苗是作为抗原在酵母中表达的无糖链的s-hbs抗原(s(-gly)),不含有实际的hbv颗粒中含有的具有糖链的l、m、s(+gly)糖蛋白。表明了svp以大球形颗粒的一千倍以上存在于患者血清中,认为现有的hbv疫苗识别的hbv以没有感染性的svp为主。
[0008]
hbv是一种感染能力非常高的病毒,尽管感染性大球形颗粒的比例与没有感染性的svp相比仅存在1/1000左右。为了准确地测定hbv颗粒(大球形颗粒)或提高hbv的检出限,一种方法是将具有感染性的大球形颗粒浓缩。另外,为了高效地制备诱导抗体的疫苗,重要的是选定能够区分大球形颗粒和无感染性的小颗粒(svp)的靶(抗原)。
[0009]
另外,献血的安全性通过实施根据核酸检查(nat)的筛选来确保,但hbv在检出限以下的低拷贝下感染成立,因此,与hcv、hiv相比,输血引起的感染事故不断发生。即,浓缩大球形颗粒的技术对于提高hbv检测的精度是不可或缺的。
[0010]
现有技术文献
[0011]
专利文献
[0012]
专利文献1:国际公开第2016/167369号小册子。
[0013]
非专利文献
[0014]
非专利文献1:ito k et al.j virol.2010dec;84(24):12850-61。
技术实现要素:
[0015]
发明要解决的课题
[0016]
本发明的目的在于,提供用于获得不能识别乙型肝炎病毒(hbv)的空颗粒而能够识别大球形颗粒的检查系统、或者能作为能够诱导不能识别空颗粒而能够识别大球形颗粒的抗体的产生的疫苗使用的乙型肝炎病毒抗原、不能识别空颗粒而识别大球形颗粒并表现出抑制感染效果的中和抗体,以能够广泛地涵盖目前要求解决的上述事例的技术和生成物。
[0017]
用于解决课题的手段
[0018]
本发明人等明确了大球形颗粒与特定的糖链结构相关。由此,成功地构建了具有感染性的即含有核酸的乙型肝炎病毒颗粒的新型检测系统。
[0019]
即,本発明涉及以下的(1)~(21)和[1]~[21]。
[0020]
(1)一种使用抗体的诱导和抗体及凝集素的筛选方法,其用于区分乙型肝炎病毒中具有感染性的hbv颗粒(大球形颗粒)和无感染性的空颗粒(svp)。
[0021]
(2)一种具有糖链的乙型肝炎病毒抗原,其用于上述使用抗体的诱导和抗体及凝集素的筛选方法。
[0022]
(3)一种乙型肝炎病毒抗原,其用于上述方法,在由从由pres1、pres2以及s区域组成的组中选出的基因编码的hbs糖蛋白中具有糖链。
[0023]
(4)一种来自hbs糖蛋白的乙型肝炎病毒抗原,其具有下述式[1]、[2]或[3]的结构。
[0024]
化学式1
[0025][0026]
化学式2
[0027][0028]
化学式3
[0029][0030]
(5)一种乙型肝炎病毒抗原,在上述式[1]、[2]或[3]中,氨基酸序列的同源性为70%以上。
[0031]
(6)一种乙型肝炎病毒抗原,在上述式[1]、[2]或[3]中,1~3个残基的氨基酸残基被附加、缺失和/或置换。
[0032]
(7)一种乙型肝炎病毒抗原,在上述式[1]、[2]或[3]的连续的thr(ptta中的tt)的一方和/或双方中,附加的糖链结构被neuacα2-6置换,galβ1-3galnac、仅galnac和1~2个糖的糖链被附加、缺失和/或置换。
[0033]
(8)如(2)~(7)中任一项所述的乙型肝炎病毒抗原的制造方法,其中,使用糖链合成技术。
[0034]
(9)如(8)所述的制造方法,其中,糖链合成技术是利用酵母的生物合成、化学合成、酶合成或它们中的2种以上的组合。
[0035]
(10)一种疫苗用组合物,其含有(2)~(7)中任一项所述的乙型肝炎病毒抗原或通过(8)或(9)的制造方法制造的乙型肝炎病毒抗原。
[0036]
(11)一种识别(2)~(7)中任一项所述的乙型肝炎病毒抗原、或者通过(8)或(9)的制造方法制造的乙型肝炎病毒抗原的抗体、噬菌体抗体。
[0037]
(12)如(11)所述的抗体,其为小鼠抗体、大鼠抗体、羊驼抗体、马抗体、猴抗体、兔抗体、山羊抗体、绵羊抗体、人抗体、人源化抗体、单链抗体(scfv)或嵌合抗体。
[0038]
(13)一种具有由序列号1或2表示的碱基序列的编码抗乙型肝炎病毒抗原抗体基因的核酸。
[0039]
(14)一种与由序列号1或2表示的碱基序列具有70%以上的同源性的核酸。
[0040]
(15)一种在严谨条件下与由序列号1或2表示的碱基序列的互补序列杂交的核酸。
[0041]
(16)一种抗乙型肝炎病毒抗原抗体,具有由序列号3~10中的任一个表示的氨基酸序列。
[0042]
(17)一种与由序列号3~10中任一个表示的氨基酸序列具有70%以上同源性的蛋白质。
[0043]
(18)一种在由序列号3~10中任一个表示的氨基酸序列中1~10个残基氨基酸被附加、缺失和/或置换的蛋白质。
[0044]
(19)使用由(13)~(15)中任一项所述的核酸编码的抗体或蛋白质、或者(16)~(18)中任一项所述的抗体或蛋白质的检测乙型肝炎病毒的方法。
[0045]
(20)如(19)所述的方法,检测的乙型肝炎病毒是具有感染性的大球形颗粒。
[0046]
(21)一种乙型肝炎病毒用药物组合物,其使用由(13)至(15)中任一项所述的核酸编码的抗体或蛋白质,或者(16)~(18)中任一项所述的抗体或蛋白质。
[0047]
[1]一种乙型肝炎病毒抗原,其中,具有在pres1、pres2和s区域的氨基酸序列(序列号14)中在包括位置15、123和/或320的氨基酸asn和/或位置156和/或157的氨基酸thr的连续的至少13个氨基酸序列或者上述连续的至少13个氨基酸序列中附加、缺失和/或置换1
~3个残基的氨基酸残基的氨基酸序列,并且具有在位置15、123和/或320的氨基酸asn上附加的n结合型糖链和/或在位置156和/或157的氨基酸thr上附加的o结合型糖链,所述o结合型糖链包括附加在所述氨基酸thr上的galnac。
[0048]
[2]如[1]所述的乙型肝炎病毒抗原,其中,所述乙型肝炎病毒抗原具有序列号15所示的氨基酸序列。
[0049]
[3]如[1]或[2]所述的乙型肝炎病毒抗原,其中,o结合型糖链为neuacα2-3galβ1-3galnac。
[0050]
[4]如[1]或[2]所述的乙型肝炎病毒抗原,其中,
[0051]
所述o结合型糖链为,
[0052]
(1)neuacα2-6galβ1-3galnac、
[0053]
(2)galβ1-3galnac、
[0054]
(3)galnac、或
[0055]
(4)在(1)~(3)上附加、缺失和/或置换1~2个糖的糖链。
[0056]
[5]一种疫苗用组合物,其中,其含有[1]~[4]中任一项所述的乙型肝炎病毒抗原。
[0057]
[6]一种抗乙型肝炎病毒抗原抗体,其中,其与[1]~[4]中任一项所述的乙型肝炎病毒抗原特异性结合。
[0058]
[7]如[6]所述的抗乙型肝炎病毒抗原抗体,其中,其包括序列号3所示的氨基酸序列中的cdr序列以及序列号4所示的氨基酸序列中的cdr序列、或者包括序列号5所示的氨基酸序列中的cdr序列、序列号7所示的氨基酸序列中的cdr序列、或者序列号9所示的氨基酸序列中的cdr序列、以及序列号6所示的氨基酸序列中的cdr序列、序列号8所示的氨基酸序列中的cdr序列、或者序列号10所示的氨基酸序列中的cdr序列。
[0059]
[8]如[6]或[7]所述的抗乙型肝炎病毒抗原抗体,其中,其具有序列号3以及4所示的氨基酸序列、或者具有序列号5、7或9所示的氨基酸序列以及序列号6、8或10所示的氨基酸序列。
[0060]
[9]一种核酸,其中,其编码[6]所述的抗乙型肝炎病毒抗原抗体的氨基酸序列。
[0061]
[10]如[9]所述的核酸,其含有序列号1或2的碱基序列。
[0062]
[11]一种表达载体,其中,其含有[9]或[10]所述的核酸。
[0063]
[12]一种抗乙型肝炎病毒药物组合物,其中,其含有[6]~[8]中任一项所述的抗体。
[0064]
[13]一种检测乙型肝炎病毒的大球形颗粒的方法,其中,其使用[6]~[8]中任一项所述的抗体。
[0065]
[14]如[13]所述的方法,其中,其还包括使用凝集素。
[0066]
[15]一种用于检测乙型肝炎病毒的大球形颗粒的试剂盒,其中,其包括[6]~[8]中任一项所述的抗体。
[0067]
[16]一种预防乙型肝炎病毒感染的方法,其中,其包括给药[1]~[4]中任一项所述的乙型肝炎病毒抗原。
[0068]
[17]一种治疗乙型肝炎病毒感染病的方法,其中,其包括给药[6]~[8]中任一项所述的抗体。
[0069]
[18]一种检测乙型肝炎病毒感染的方法,其中,其包括:使从怀疑感染乙型肝炎病毒的患者得到的试样与[6]~[8]中任一项所述的抗体接触的工序;浓缩含有所述抗体的复合体的工序;以及从得到的浓缩物中检测乙型肝炎病毒的dna的工序。
[0070]
[19]一种浓缩乙型肝炎病毒的大球形颗粒的方法,其中,其包括使木菠萝凝集素(jacalin凝集素)与能够含有乙型肝炎病毒的大球形颗粒的试样接触的工序。
[0071]
[20]一种检测试样中是否含有乙型肝炎病毒的大球形颗粒的方法,其中,其包括:使木菠萝凝集素与试样接触的工序;浓缩木菠萝凝集素与乙型肝炎病毒的大球形颗粒的复合体的工序;以及从得到的浓缩物中检测乙型肝炎病毒的dna的工序。
[0072]
[21]一种用于检测乙型肝炎病毒的大球形颗粒的试剂盒,其中,其含有木菠萝凝集素。
[0073]
发明的效果
[0074]
根据本发明,提供用于获得不能识别乙型肝炎病毒(hbv)的空颗粒而能够识别大球形颗粒的检查系统、或者能作为能够诱导不能识别空颗粒而能够识别大球形颗粒的抗体的产生的疫苗使用的乙型肝炎病毒抗原、不能识别空颗粒而识别大球形颗粒并表现出抑制感染效果的中和抗体的技术以及产物。
附图说明
[0075]
图1是表示hbv颗粒和以往的疫苗的靶的图。
[0076]
图2是表示hbs抗原的sds-page(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)(银染色)的图。
[0077]
图3是表示hbv颗粒的非破坏糖组分析的图。
[0078]
图4是表示hbv颗粒与凝集素的结合反应性的差异的图。
[0079]
图5是表示使用木菠萝凝集素进行分离hbv(hbv dna)的图。
[0080]
图6是表示hbs抗原上的糖链(ms和推定结构)的图。
[0081]
图7是表示hbs抗原上的o型糖链和位置的图。
[0082]
图8是表示经鉴定的hbs抗原的序列(基因型c)的图。
[0083]
图9是表示抗原列表(s、m、l、pres2、pres2+0)的图。
[0084]
图10是表示glyco-pres2的化学合成的图。
[0085]
图11是表示glyco-pres2的糖链修饰的图。
[0086]
图12是表示glyco-l的酵母表达用载体的制备的图。
[0087]
图13是表示glyco-l的制备方法/纯化方法(酵母)的图。
[0088]
图14是表示酵母中表达的glyco-l的推定结构和纯化的glyco-l的图。
[0089]
图15是表示抗体效价的推移的比较(glyco-l和s-hbs bimmugen(商品名))的图。
[0090]
图16是表示酶联免疫吸附试验(elisa)和蛋白免疫印迹(血清、l-&s-hbs mix)的图。
[0091]
图17是表示抗体效价的推移的比较(glyco-pres2,酶联免疫吸附试验)的图。
[0092]
图18是表示酶联免疫吸附试验和蛋白免疫印迹(血清、glyco-pres2、pres2)的图。
[0093]
图19是表示免疫小鼠的酶联免疫吸附试验的差异(血清、glyco-pres2)的图。
[0094]
图20a是表示识别pres1的igg重链的氨基酸序列的图。
[0095]
图20b是表示识别pres1的igg轻链的氨基酸序列的图。
[0096]
图21a是表示对glyco-pres2进行免疫并通过快速筛选b细胞而获得的f5克隆#4的igg重链的cdna序列和氨基酸序列的图。
[0097]
图21b是表示f5克隆#4的igg轻链的cdna序列和氨基酸序列的图。
[0098]
图22是表示纯化抗体的电泳图(抗体量的定量)的图。
[0099]
图23是表示蛋白免疫印迹(纯化抗体、抗pres1、抗glyco-pres2)的图。
[0100]
图24是表示蛋白免疫印迹(纯化f5#4抗体、s、m、l在细胞中的表达)的图。
[0101]
图25是表示蛋白免疫印迹(纯化f5#4抗体、glyco-m在细胞中的表达)的图。
[0102]
图26是表示抑制hbv感染的实验方法的图。
[0103]
图27是表示抑制hbv感染的实验(hbv dna)的图。
[0104]
图28是表示hbv特异性糖蛋白诱导抑制hbv感染抗体的图。
具体实施方式
[0105]
下面,详细地说明本发明的一实施方式。本发明不限于以下的实施方式,在不妨碍本发明的效果的范围内能够适当变更来实施。
[0106]
[糖链合成技术]
[0107]
(细胞的生物合成)
[0108]
通过公知的方法培养表达编码hbs糖蛋白的基因的载体的转化宿主细胞,从该培养物中采取、纯化,从而能够进行本发明中的hbs糖蛋白的制造。“培养物”除了指培养上清液外,还指培养细胞、培养菌体或者细胞或菌体的破碎物中的任一种。
[0109]
用培养基培养转化宿主细胞的方法能够按照用于培养该宿主细胞的一般方法进行。
[0110]
当转化宿主细胞为酵母时,作为培养的培养基,只要是含有酵母能够同化的碳源、氮源、无机盐类等且能够高效地进行转化体的培养的培养基,就可以使用天然培养基、合成培养基中的任一种。作为碳源,只要酵母能够同化即可,能够使用葡萄糖、果糖、蔗糖、淀粉等碳水化合物;醋酸、丙酸等有机酸;乙醇、丙醇等醇类。作为氮源,除了氨、氯化铵、硫酸铵、醋酸铵、磷酸铵等无机酸或有机酸的铵盐或其他含氮化合物以外,还能够使用蛋白胨、肉提取物、玉米浆等。作为无机盐类,能够使用磷酸二氢钾、磷酸氢二钾、磷酸镁、硫酸镁、氯化钠、硫酸亚铁、硫酸锰、硫酸铜、碳酸钙等。另外,在培养基中,根据选择标记的种类,可以适当添加金担子素、氨苄青霉素、四环素等抗生素、或者除去通过补充营养需要性的基因(leu、ura、trp等)能够供给的氨基酸。
[0111]
对于转化宿主细胞的培养,例如在酵母的情况下,培养基的ph调整为4~7是适当的。另外,培养温度为15~32℃,优选为28℃左右。当表达立体结构复杂蛋白质时,为了在细胞内更高效地进行其折叠,有时也优选在低温下培养。培养时间为24~1000小时左右,培养能够通过静置、振荡、搅拌、通气下的分批培养或连续培养等来实施。
[0112]
来自上述培养物(培养液、培养菌体)的糖蛋白基因的表达产物的确认能够通过sds-page后的银染色、蛋白质的染色、蛋白免疫印迹分析、酶联免疫吸附试验等进行。
[0113]
另外,为了分离纯化生产的糖蛋白,使用通常的糖蛋白分离、纯化法即可。培养后,当在菌体内或细胞内生产目标糖蛋白时,通过超声波粉碎机、弗氏压碎器(french press)、
曼童高林均质机(menton gaulin homogenizer)、华宝研磨机(dyno-mill)等粉碎菌体或细胞,从而采取目标糖蛋白。另外,当在菌体外或细胞外生产目标糖蛋白时,直接使用培养液、或者通过离心分离等除去菌体或细胞。然后,通过使用有机溶剂的提取等采取目标糖蛋白,根据需要单独或者组合使用各种色谱(疏水色谱、反相色谱、亲和色谱法、离子交换色谱等)、使用分子筛的凝胶过滤法、使用聚丙烯酰胺凝胶等的电泳法等方法来进行分离纯化即可。
[0114]
上述培养法、纯化法只是一例,并不限定于此。此外,纯化的基因产物具有的氨基酸序列的确认能够通过公知的氨基酸分析、例如基于埃德曼分解法的氨基酸自动测序法等进行。
[0115]
(化学合成)
[0116]
作为本发明的hbs糖蛋白的一部分的肽能够通过肽合成中通常使用的固相法和液相法等化学方法极其容易地合成。另外,也能够通过依靠委托肽合成的制造公司来获得。
[0117]
(酶合成)
[0118]
对于作为本发明的hbs糖蛋白的一部分的肽,通过使用所有种类的糖基转移酶,能够得到来自附加糖链的hbs糖蛋白的乙型肝炎病毒抗原。在本发明中,化学合成从pres2(序列号11)的n末端开始的第37个和/或第38个苏氨酸残基上附加了n-乙酰半乳糖胺的糖肽,使用重组体糖蛋白-n-乙酰半乳糖胺3-β-半乳糖转移酶1(c1galt1)将半乳糖附加到n-乙酰半乳糖胺中,使用重组体st3β-半乳糖苷α-2,3-唾液酸转移酶1(st3gal1)将唾液酸附加到半乳糖上的方法优选作为酶合成法使用。
[0119]
另外,按照使用通常的蛋白质分解酶的酶处理等,通过酶处理等水解得到的hbs糖蛋白,从水解物中分离纯化糖肽,也能够得到。
[0120]
[乙型肝炎病毒]
[0121]
在本说明书中,“hbv”的记载是指具有使乙型肝炎发病的能力的病毒。对于hbv,目前已知a~h的基因型,作为用于本发明的hbv传染病的药物组合物中的治疗和抑制对象的hbv,包括所有基因型。
[0122]
另外,在本发明中,典型地,“hbv传染病”是乙型肝炎,分为慢性肝炎、急性肝炎、重症肝炎。另外,不仅限于乙型肝炎,只要是hbv感染包括人在内的生物体引起的症状,也包括肝硬化、肝纤维化、肝细胞癌等肝癌。是否是hbv传染病例如能够通过血液中hbs抗原的检测、血液中hbe抗原的检测、血液中hbv-dna量的测定以及血液中hbv的dna聚合酶量的测定以及它们的组合来判断。
[0123]
在本说明书中,“hbv传染病的治疗”是指排除hbv、减轻hbv感染引起的症状、肝炎的平息化、以及阻止和减轻从肝炎向肝硬化、肝纤维化和肝癌的进展。此外,为了明确包括即使没有缓解hbv传染病,hbv传染病的症状、进展也减轻的方式,有时也表达为“hbv传染病的治疗或抑制”。另外,“预防hbv传染病”是指在hbv感染之前或之后,防止乙型肝炎等hbv传染病的发病。
[0124]
[大球形颗粒]
[0125]
如上所述,体内的hbv以无感染性(不含核酸)的空颗粒远远多于有感染性(含核酸)的病毒颗粒(也称为大球形颗粒)的比例存在,在目前的hbs抗原测定系统中,不能仅准确地测定有感染性的大球形颗粒。但是,在本发明中,明确了大球形颗粒与特定的糖链结构
相关,成功地构建了使用它的新的检测系统。
[0126]
而且,如上所述,献血的安全性通过实施基于核酸检查(nat)的筛选来确保,但hbv在检出限以下的低拷贝下感染成立,因此,与hcv、hiv相比,输血引起的感染事故不断发生。即,浓缩大球形颗粒的技术对于提高hbv检测的精度是不可或缺的。
[0127]
使用浓缩大球形颗粒的技术浓缩试样中的大球形颗粒,从得到的浓缩物中检测乙型肝炎病毒的dna,从而能够以更高的灵敏度检测乙型肝炎病毒的感染。另外,利用该技术有可能能够检测乙型肝炎病毒的隐匿性感染。
[0128]
如下所示,通过使用本发明的抗体、木菠萝凝集素能够浓缩大球形颗粒。
[0129]
[hbs糖蛋白]
[0130]
hbs抗原是hbv的包膜糖蛋白,从一个hbs基因的不同的蛋氨酸(met)密码子开始,根据其大小存在l-hbs、m-hbs、s-hbs三种抗原。
[0131]
hbs抗原在细胞内的核糖体中翻译后,在内质网和高尔基体中受到糖链修饰。内包有hbv dna(rna)的核(hbc)在内质网中进入hbs抗原,成为感染性hbv颗粒(参照schaedler s et al,viruses.2009sep;1(2):185-209.;grimm d et al,hepatol int.2011jun;5(2):644-53.)。
[0132]
而且,对该hbs抗原的糖链修饰是感染性hbv的颗粒形成和分泌所必须的重要工序(非专利文献1)。
[0133]
在本说明书中,除非另有说明,hbs蛋白或肽或者hbs糖蛋白或肽包括a~h所有基因型的hbv的包膜蛋白或肽。
[0134]
本发明的乙型肝炎病毒抗原是来自hbv颗粒(大球形颗粒)的包膜(hbs)糖蛋白的糖链肽。对于本发明的乙型肝炎病毒抗原,由于浓缩了具有感染性的大球形颗粒,因此特异性地检测,因而对于通过该检测诊断感染是有用的,另外,作为用于预防乙型肝炎病毒感染的疫苗的有效成分也是有用的。
[0135]
乙型肝炎病毒抗原具有在pres1、pres2和s区域(序列号14)的氨基酸序列中包括位置15、123和/或320的氨基酸asn和/或位置156和/或157的氨基酸thr的连续的至少13个氨基酸序列。此处,乙型肝炎病毒抗原的氨基酸序列在根据乙型肝炎病毒抗原的用途能够发挥作为抗原的功能的范围内没有限定,可以是在连续的至少13个氨基酸序列中1~3个残基的氨基酸残基被附加、缺失和/或置换的氨基酸序列,优选为具有序列号14的氨基酸序列,更优选具有序列号11的氨基酸序列,进一步优选具有序列号12的氨基酸序列,最优选具有序列号15的氨基酸序列。
[0136]
乙型肝炎病毒抗原在具有上述氨基酸序列的肽中具有附加在位置156和/或157的氨基酸thr上的o结合型糖链,o结合型糖链可以包含附加在上述氨基酸thr上的galnac。此处,o结合型糖链优选包括galnac,在乙型肝炎病毒抗原能够根据其用途发挥作为抗原的功能的范围内,o结合型糖链也可以是在galnac上附加、缺失和/或置换1~2个糖的糖链的糖链。另外,更优选o结合型糖链包含galβ1-3galnac,在乙型肝炎病毒抗原根据其用途能够发挥作为抗原的功能的范围内,o结合型糖链也可以是在galβ1-3galnac上附加、缺失和/或置换1~2个糖的糖链。o结合型糖链进一步优选为neuacα2-3galβ1-3galnac,在乙型肝炎病毒抗原根据其用途能够发挥作为抗原的功能的范围内,o结合型糖链也可以是在neuacα2-6galβ1-3galnac或galβ1-3galnac上附加、缺失和/或置换1~2个糖的糖链。
[0137]
乙型肝炎病毒抗原也可以在上述具有氨基酸序列的肽中具有附加在位置15、123和/或320的氨基酸asn上的n结合型糖链。此处,n结合型糖链优选为(hex)
2
(hexnac)
2
(neuac)
2
+(man)
3
(glcnac)
2
、(hex)
2
(hexnac)
2
(neuac)
1
+(man)
3
(glcnac)
2
或(hex)
2
(hexnac)
2
+(man)
3
(glcnac)
2
,在乙型肝炎病毒抗原根据其用途能够发挥作为抗原的功能的范围内,也可以是在所述糖链上附加、缺失和/或取代1~2个糖的糖链的糖链。
[0138]
[疫苗用组合物]
[0139]
通过将免疫佐剂和抗原混合能够制造疫苗等免疫原性组合物。作为免疫佐剂,能够利用无机类的免疫佐剂。例如,作为无机类的免疫佐剂,能够利用氢氧化铝、磷酸铝或磷酸钙等。由于磷酸钙还具有作为载体的功能,因此,在磷酸钙上还能够负载第二免疫刺激因子。或者,也能够在以树突状细胞等抗原呈递细胞作为靶的纳米颗粒等药物释放系统(dds)中内包来进行免疫。
[0140]
[抗体]
[0141]
本发明抗体是与本发明的乙型肝炎病毒抗原中的至少任一个特异性结合的抗体。
[0142]
本发明的抗体能够使用在hbs糖蛋白(pres1、pres2或s区域)中具有糖链的乙型肝炎病毒抗原、或者具有上述式[1]、[2]或[3]的结构的来自hbs糖蛋白的乙型肝炎病毒抗原、或者所述“hbs糖蛋白”项中说明的乙型肝炎病毒抗原并按照常规方法来制备,包括多克隆抗体和单克隆抗体中的任意一个。
[0143]
本发明的抗体优选为包括具有相对于序列号3所示的氨基酸序列中的3个重链cdr序列和序列号4所示的氨基酸序列中的3个轻链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列的抗体,更优选包括序列号3所示的氨基酸序列中的3个重链cdr序列以及序列号4所示的氨基酸序列中的3个轻链cdr序列。
[0144]
本发明的另一抗体优选为包括具有相对于序列号5所示的氨基酸序列中的3个重链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列、具有相对于序列号7所示的氨基酸序列中的3个重链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列、或者具有相对于序列号9所示的氨基酸序列中的3个重链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的cdr序列,而且,具有相对于序列号6所示的氨基酸序列中的3个轻链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列、具有相对于序列号8所示的氨基酸序列中的3个轻链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列、或者具有相对于序列号10所示的氨基酸序列中的3个轻链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列的抗体,更优选为包括序列号5所示的氨基酸序列中的3个重链cdr序列、序列号7所示的氨基酸序列中的3个重链cdr序列、或序列号9所示的氨基酸序列中的3个重链cdr序列、以及序列号6所示的氨基酸序列中的3个轻链cdr序列、序列号8所示的氨基酸序列中的3个轻链cdr序列、或者序列号10所示的氨基酸序列中的3个轻链cdr序列的抗体。
[0145]
此外,作为重链cdr序列和轻链cdr序列的组合,可举出序列号5和序列号8所示的氨基酸序列中的重链cdr和轻链cdr序列、序列号5和序列号9所示的氨基酸序列中的重链
cdr和轻链cdr序列、序列号5和序列号10所示的氨基酸序列中的重链cdr和轻链cdr序列、序列号6和序列号8所示的氨基酸序列中的重链cdr和轻链cdr序列、序列号6和序列号9所示的氨基酸序列中的重链cdr和轻链cdr序列、序列号6和序列号10所示的氨基酸序列中的重链cdr和轻链cdr序列、序列号7和序列号8所示的氨基酸序列中的重链cdr和轻链cdr序列、序列号7和序列号9所示的氨基酸序列中的重链cdr和轻链cdr序列、以及序列号7和序列号10所示的氨基酸序列中的重链cdr和轻链cdr序列。另外,也可以是具有相对于这些重链cdr序列和轻链cdr序列分别具有至少80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列。
[0146]
该另一抗体进一步优选为包括具有相对于序列号5所示的氨基酸序列中的3个重链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列、以及具有相对于序列号6所示的氨基酸序列中的3个轻链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列的抗体、包括具有相对于序列号7所示的氨基酸序列中的3个重链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列、以及具有相对于序列号8所示的氨基酸序列中的3个轻链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列、或者具有相对于序列号9所示的氨基酸序列中的3个重链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的cdr序列、以及具有相对于序列号10所示的氨基酸序列中的3个轻链cdr序列中的每一个至少具有80%、85%、90%、95%、98%、99%的序列一致性的氨基酸序列的cdr序列的抗体,更优选为包括序列号5所示的氨基酸序列中的3个重链cdr序列、以及序列号6所示的氨基酸序列中的3个轻链cdr序列的抗体、序列号7所示的氨基酸序列中的3个重链cdr序列、以及序列号8所示的氨基酸序列中的3个轻链cdr序列的抗体、或者序列号9所示的氨基酸序列中的3个重链cdr序列、以及序列号10所示的氨基酸序列中的3个轻链cdr序列的抗体。
[0147]
本发明的抗体可以是低分子化抗体,只要与本发明的乙型肝炎病毒抗原结合,全长抗体的一部分缺失的抗体片段也是允许的,即也可以是抗原结合性片段。
[0148]
作为单克隆抗体,例如,可举出能够从使通过上述抗原免疫的产生抗体的细胞和骨髓瘤细胞融合而得到的杂交瘤产生的抗体、通过基因工程方法用包含抗体基因的表达载体转化的宿主能够产生的抗体、以及与本发明的这些抗体相同的表位特异性结合的抗体。抗体可以是嵌合抗体、人源化抗体、人抗体或来自文库的抗体。对来自抗体的生物种没有特别限定。
[0149]
进一步,抗体可以是双特异性抗体。双特异性抗体是指在同一抗体分子内具有识别不同表位的可变区域的抗体,该表位可以存在于不同分子中,也可以存在于同一分子中。用于制造双特异性抗体的方法是公知的。例如,能够使识别抗原不同的两种抗体结合来制备双特异性抗体。结合的抗体可以是分别具有h链和l链的抗体的1/2分子,也可以是仅由h链构成的抗体的1/4分子。或者,也能够使产生不同单克隆抗体的杂交瘤融合来制备产生双特异性抗体的融合细胞。进一步,能够通过基因工程的方法制备双特异性抗体。
[0150]
[抗体的制备]
[0151]
本发明的单克隆抗体例如能够通过以下说明的本领域技术人员公知的方法(杂交
瘤法、噬菌体展示法等)制备。
[0152]
从抗原免疫小鼠脾脏、淋巴结或外周血中获取产生抗体的b细胞,通过制备杂交瘤或获取cdna也能够从免疫小鼠中获取抗体。
[0153]
具体而言,针对在hbs糖蛋白(pres1、pres2或s区域)上具有糖链的乙型肝炎病毒抗原、具有上述式[1]、[2]或[3]的结构的来自hbs糖蛋白的乙型肝炎病毒抗原或者所述“hbs糖蛋白”项中说明的乙型肝炎病毒抗原的单克隆抗体能够通过对哺乳动物给药在hbs糖蛋白(pres1、pres2或s区域)上具有糖链的乙型肝炎病毒抗原、具有上述式[1]、[2]或[3]的结构的来自hbs糖蛋白的乙型肝炎病毒抗原、或者所述“hbs糖蛋白”项中说明的乙型肝炎病毒抗原,即,在能够产生抗体的部位进行给药其自身或与载体、稀释剂一同给药来制造。作为载体,能够使用具有抗原性刺激的载体蛋白、例如,钥孔血蓝蛋白(klh)、牛血清白蛋白(bsa)、牛甲状腺球蛋白、卵清蛋白(ova)等。关于载体和抗原肽的混合比,只要相对于与载体交联而免疫的抗原肽抗体能够高效地产生,就可以以任意比率交联任何物质,例如,使用按照以重量比计相对于抗原1约0.1~20优选约1~5的比例结合载体的方法。能够使用各种缩合剂来使抗原与载体结合,能够使用戊二醛、碳二亚胺、马来酰亚胺活性酯、含有巯基、二硫吡啶基的活性酯试药等。
[0154]
给药时,为了提高产生抗体的能力,也可以给药完全弗氏佐剂、不完全弗氏佐剂等各种佐剂(抗原性加强剂)。给药通常每2~6周一次,共计2~10次左右。作为使用的哺乳动物,例如,可举出猴、兔、狗、豚鼠、小鼠、大鼠、羊驼、绵羊、山羊、仓鼠等,但优选考虑与细胞融合中使用的骨髓瘤细胞的适应性等来选择,通常,优选使用小鼠、大鼠、仓鼠等。
[0155]
制备产生单克隆抗体的细胞时,从对抗原免疫的哺乳动物例如小鼠中选择确认了抗体效价的个体,在最终免疫的2~5天后采取脾脏或淋巴结,使它们中含有的产生抗体的细胞与骨髓瘤细胞(myeloma cells)融合从而能够制备产生单克隆抗体的杂交瘤。抗血清中的抗体效价的测定能够按照酶联免疫吸附试验法等本领域技术人员公知的方法进行。例如,在直接或与载体一起吸附作为免疫原使用的抗原肽的固相(例如微孔板)中添加抗血清,接着添加用放射性物质、酶等标记的抗免疫球蛋白抗体(细胞融合中使用的细胞为小鼠时,使用抗小鼠免疫球蛋白抗体)或蛋白质a或蛋白质g来检测与固相结合的单克隆抗体的方法。融合操作能够按照已知的方法例如柯勒和米尔斯坦的方法[nature,256,495(1975年)]实施。作为融合促进剂,例如,可举出聚乙二醇(peg)、仙台病毒等,但优选使用peg。
[0156]
作为骨髓瘤,例如,可举出ns-1、ns0、p3u1、sp2/0等,但优选使用sp2/0。使用的产生抗体的细胞(脾脏细胞)数与骨髓瘤细胞数的优选比率为1:1~20:1左右,以10~80%左右的浓度添加peg(优选peg1000~peg6000),以约20~40℃优选约30~37℃孵育约1~10分钟从而能够高效地实施细胞融合。
[0157]
产生单克隆抗体的杂交瘤的筛选能够使用各种方法,例如,可举出在直接或与载体一起吸附作为免疫原使用的抗原的固相(例如微孔板)中添加杂交瘤培养上清液,接着加入用放射性物质、酶等标记的抗免疫球蛋白抗体(细胞融合中使用的细胞为小鼠时,使用抗小鼠免疫球蛋白抗体)或蛋白质a或者蛋白质g,检测与固相结合的单克隆抗体的方法,在吸附抗免疫球蛋白抗体或蛋白质a的固相中添加杂交瘤培养上清液,加入用放射性物质、酶等标记的抗原肽,检测与固相结合的单克隆抗体的方法等。
[0158]
单克隆抗体的筛选能够按照公知或基于公知的方法进行,通常能够在添加了hat
(次黄嘌呤、氨基蝶呤、胸苷)的动物细胞用培养基等中进行。作为筛选和育种用培养基,只要能生长杂交瘤,可以使用任何培养基。例如,含有1~20%、优选10~20%的胎牛血清的rpmi 1640培养基、含有1~10%的胎牛血清的git培养基(和光纯药工业(株))或杂交瘤培养用无血清培养基(sfm-101,日水制药(株))、含有10~20%的胎牛血清的杂交瘤培养用无血清培养基(hybridoma-sfm、英杰生命技术公司(
インビトロジェン
))等。培养温度通常为20~40℃,优选为约37℃。培养时间通常为5天~3周,优选为1周~2周。培养能够在通常5%的二氧化碳气体下进行。杂交瘤培养上清液的抗体效价能够与上述抗血清中的抗体效价的测定同样进行测定。
[0159]
进一步,对针对抗原肽的酶联免疫吸附试验呈阳性的杂交瘤克隆进行二次培养后,通过蛋白免疫印迹法评价使用各克隆的培养上清液产生识别抗原的抗体的能力,调查是否检测到抗原,从而能够筛选产生特异性识别抗原的单克隆抗体的杂交瘤。
[0160]
对于单克隆抗体的分离纯化,与通常的多克隆抗体的分离纯化同样地能够通过免疫球蛋白的分离纯化法,例如盐析法、醇沉淀法、等电点沉淀法、电泳法、利用离子交换体(例如deae(二乙胺基乙基))的吸附解吸法、超离心法、凝胶过滤法、用抗原结合固相或蛋白质a或蛋白质g等活性吸附剂仅采取抗体并使结合解离从而获得抗体的特异性纯化法等进行。
[0161]
本发明的单克隆抗体也能够对编码上述杂交瘤产生的抗体的碱基序列进行分析,使用该序列制备产生抗体的质粒,进行基因工程制备。另外,本发明的单克隆抗体也能够通过从在hbs糖蛋白(pres1、pres2或s区域)中具有糖链的乙型肝炎病毒抗原、具有式[1]、[2]或[3]结构的来自hbs糖蛋白的乙型肝炎病毒抗原、或者所述“hbs糖蛋白”项中说明的乙型肝炎病毒抗原免疫的小鼠等动物中取出脾脏,获取产生抗体的b细胞,使用抗体基因特异性引物确定编码抗体的碱基序列,制备产生抗体的质粒,进行基因工程制备。
[0162]
针对在所述hbs糖蛋白(pres1、pres2或s区域)中具有糖链的乙型肝炎病毒抗原、具有式[1]、[2]或[3]结构的来自hbs糖蛋白的乙型肝炎病毒抗原、或者所述“hbs糖蛋白”项中说明的乙型肝炎病毒抗原的多克隆抗体能够按照公知或基于公知的方法制造。具体而言,与上述单克隆抗体的制备方法同样地,通过对哺乳动物或鸡在能够产生抗体的部位将在hbs糖蛋白(pres1、pres2或s区域)中具有糖链的乙型肝炎病毒抗原、具有所述式[1]、[2]或[3]结构的来自hbs糖蛋白的乙型肝炎病毒抗原自身或与载体、稀释剂一起给药从而能够制造。给药时,为了提高产生抗体的能力,也可以给药完全弗氏佐剂、不完全弗氏佐剂。给药能够通常约每2~6周一次,总计进行约3~10次左右。
[0163]
多克隆抗体能够从用上述方法免疫的哺乳动物的血液、腹水、母乳等优选为血液中采取,在鸡的情况下,能够从血液和蛋黄中采取。
[0164]
抗血清中的多克隆抗体效价的测定、对于在hbs糖蛋白(pres1、pres2或s区域)中具有糖链的乙型肝炎病毒抗原、具有所述式[1]、[2]或[3]结构的来自hbs糖蛋白的乙型肝炎病毒抗原、或者所述“hbs糖蛋白”项中说明的乙型肝炎病毒抗原的反应性的评价、多克隆抗体的分离纯化等能够按照上述单克隆抗体的制备方法进行。
[0165]
本发明的抗体的“抗原结合性片段”包括本发明的单克隆抗体的部分、优选为其抗原结合区域或可变区域,与在hbs糖蛋白(pres1、pres2或s区域)中具有糖链的乙型肝炎病毒抗原、具有所述式[1]、[2]或[3]的结构的来自hbs糖蛋白的乙型肝炎病毒抗原、或者所述
“
hbs糖蛋白”项中说明的乙型肝炎病毒抗原具有结合性。作为该片段的具体例,例如,可举出fv、scfv、fab、f(ab')
2
、fab'、fd、dab、cdr、scfv-fc片段、纳米抗体、亲合体、双特异抗体、高亲和性多聚体(avimer)、微抗体、万能抗体(versabody)等。
[0166]
这些片段能够使用本领域技术人员公知的方法得到,具体而言,用酶例如木瓜蛋白酶、胃蛋白酶等处理抗体并生成抗体片段、或者构建编码这些抗体片段的基因,将其导入表达载体后,使其在适当的宿主细胞中表达即可。得到的片段能够与本发明的抗体一样评价与抗原的反应性、特异性等。
[0167]
另外,作为本发明中使用的抗体,优选小鼠抗体、大鼠抗体、羊驼抗体、马抗体、猴抗体、兔抗体、山羊抗体、绵羊抗体、人抗体、人源化抗体、单链抗体(scfv)或嵌合抗体。
[0168]
[凝集素阵列]
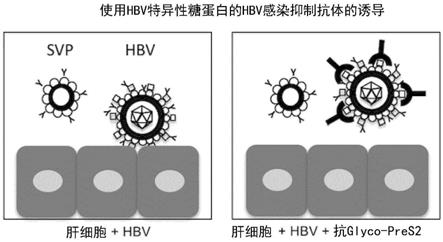
[0169]
凝集素阵列是将复数种特异性不同的识别子(探针)凝集素并列固定(阵列化)在一个基板上而成的,能够同时分析哪个凝集素与作为分析对象的复合糖质进行多少的相互作用。通过使用凝集素阵列,能够通过一次分析获取糖链结构推定所需的信息,而且,从样品制备到扫描的操作工序能够迅速且简便。在质量分析等糖链轮廓系统中,不能直接分析糖蛋白,必须预先处理至糖肽、游离糖链的状态。另一方面,在凝集素微阵列中,例如,具有仅通过直接向核心蛋白质部分导入荧光体就能够直接分析的优点。
[0170]
作为用于凝集素阵列的凝集素,可举出以下表1、2中记载的凝集素。
[0171]
表1
[0172]
[0173][0174]
表2
[0175][0176]
例如,将45种凝集素固定与基板上的凝集素阵列(糖科技公司(glyco technica ltd.)制的lec chip)已经在商用上能够得到。
[0177]
目前,凝集素阵列不仅发展到纯化样品,还发展到能够进行血清、细胞裂解物等混合试样的定量比较糖链轮廓的应用化技术。特别是,细胞表层糖链的比较糖链轮廓的发展是惊人的(ebe,y.et al.j.biochem.(2006)139,323-327;pilobello,k.t.et al.proc natl acad sci usa.(2007)104,11534-11539;tateno,h.et al.glycobiology(2007)17,1138-1146)。
[0178]
另外,对于使用糖链轮廓的统计分析的数据挖掘,例如,能够通过“kuno a,et al.j proteomics bioinform.(2008)1,68-72.”或者“日本糖质学会2008/8/18凝集素微阵列应用技术开发~生物体试样的比较糖链轮廓和统计分析~久野敦、松田厚志、板仓阳子、松崎英树、成松久、平林淳”以及“matsuda a,et al.biochem biophys res commun.(2008)370,259-263.”所示的方法进行。
[0179]
[核酸]
[0180]
在本发明中,也能够利用由从产生抗体的细胞克隆的抗体基因编码的抗体。克隆的抗体基因能够通过插入适当的载体中并导入宿主从而以抗体的形式表达。已经确立用于分离抗体基因、导入载体以及转化宿主细胞的方法(例如,参考vandamme,a.m.et al.,eur.j.biochem.(1990)192,767-775)。
[0181]
例如,从产生本发明的抗体的杂交瘤细胞能够获得编码本发明的抗体的可变区域(v区域)的cdna。为此,通常,首先从杂交瘤中提取全部rna。作为用于从细胞中提取全部rna
的方法,例如,能够使用胍超速离心法(chirgwin,j.m.et al.,biochemistry(1979)18,5294-5299)、agpc法(chomczynski,p.et al.,anal.biochem.(1987)162,156-159)等。提取的全部rna还能够使用mrna纯化试剂盒(ge医疗生物科学(ge
ヘルスケアバイオサイエンス
)制)等来纯化。或者,像快速制备mrna纯化试剂盒(quickprep mrna purification kit)(ge医疗生物科学(ge
ヘルスケアバイオサイエンス
)制)等那样,用于从细胞直接提取全部mrna的试剂盒也是市售的。使用这种试剂盒也能够从杂交瘤获得全部mrna。使用逆转录酶能够由得到的mrna合成编码抗体v区域的cdna。cdna能够通过amv逆转录酶第一链cdna合成试剂盒(生化学工业社制)等合成。另外,为了合成和扩增cdna,能够利用使用5
’-
ampli finder race试剂盒(美国克隆科技制)和pcr的5'-race法(frohman,m.a.et al.,proc.natl.acad.sci.usa(1988)85,8998-9002;belyavsky,a.et al.,nucleic acids res.(1989)17,2919-2932)。进一步,在合成这种cdna的过程中能够在cdna的两个末端导入后述的适当的限制性酶位点。
[0182]
从得到的pcr产物中纯化目标cdna片段,然后与载体dna连结。如此制备重组载体,选择导入大肠杆菌等的菌落后,能够从形成该菌落的大肠杆菌中制备期望的重组载体。然后,关于该重组载体是否具有目标cdna的碱基序列,能够通过公知的碱基序列确定方法例如通过双脱氧核苷酸链终止法等确认。
[0183]
另外,作为与序列号1或2所示的碱基序列具有同源性的核酸,可举出由从与序列号1或2所示的碱基序列具有至少70%以上、优选80%以上、更优选90%以上、进一步优选95%以上的同源性的碱基序列构成的核酸。
[0184]
进一步,作为与序列号1或2所示的碱基序列具有同源性的核酸,包括编码由与序列号3或4所示的氨基酸序列具有至少70%以上、优选80%以上的同源性的氨基酸序列构成的蛋白质的核酸、编码由在序列号3或4所示的氨基酸列中1~10个残基的氨基酸附加、缺失和/或置换的序列构成的蛋白质的核酸、与序列号1或2所示的碱基序列的互补碱基序列在严格条件下杂交的核酸。
[0185]
另外,上述“严格条件”是指形成所谓的特异性杂交而不形成非特异性杂交的条件。例如,可举出同源性高的dna、即由与序列号1所示的碱基序列具有至少70%以上、优选80%以上、更优选90%以上、进一步优选95%以上的同源性的碱基序列构成的dna的互补链杂交,而同源性更低的dna的互补链不杂交的条件。作为杂交的更具体条件,可举出钠浓度为150~900mm、优选为600~900mm、温度为60~68℃、优选为65℃的条件。
[0186]
上述变异(附加、缺失和/或置换)的导入能够通过孔克尔(kunkel)法或带缺口的双链体(gapped duplex)法等该技术领域公知的方法或基于公知的方法来进行,例如能够使用利用部位特异性突变诱发法的变异导入用试剂盒(例如突变体-k(宝生物工程株式会社(
タカラバイオ
社)制)或突变体-g(宝生物工程株式会社(
タカラバイオ
社)制))、宝生物工程株式会社(
タカラバイオ
社)的la pcr体外突变系列试剂盒等。
[0187]
[蛋白质]
[0188]“与序列号3或4所示的氨基酸序列具有70%以上同源性的蛋白质”是具有至少70%以上、优选80%以上、更优选90%以上、最优选95%以上的同源性的氨基酸序列的蛋白质。蛋白质的同源检索例如能够以日本dna数据库(dna databank of japan(ddbj)等为对象使用fasta、blast等程序进行。
[0189]
在上述“在序列号3或4表示的氨基酸序列中,1~10个残基的氨基酸附加、缺失和/或取代的蛋白质”中的附加、缺失和/或置换的氨基酸残基的数量没有特别限定,优选为10个以下,更优选为7个以下,进一步优选为5个以下,更进一步优选为3个以下。
[0190]
[乙型肝炎病毒的检测方法]
[0191]
本发明中的乙型肝炎病毒的检测方法,其特征在于,使用由本发明的乙型肝炎病毒抗原诱导的抗体、或由本发明的核酸编码的抗体或蛋白质、和/或本发明的抗体或蛋白质。作为乙型肝炎病毒的检测系统,优选蛋白质印迹、酶联免疫吸附试验等,只要是能检测乙型肝炎病毒的系统,就没有特别限制。
[0192]
对于感染性乙型肝炎病毒(hbv)颗粒的大球形颗粒,尽管感染性非常高,但与非感染性的svp相比只存在1/1000左右,因此检测非常困难。根据本发明的乙型肝炎病毒的检测方法(以下,也称为检测方法),能够特异性地检测hbv大球形颗粒。由于其低浓度及感染性高,因此感染事故不断的输血中hbv大球形颗粒的感染检查也能够以更高的精度进行。
[0193]
作为该检测方法中的检测试样,可举出疑似感染乙型肝炎病毒的被检体的以血液、血清、唾液、精液、阴道分泌液、伤口渗出液为主的体液或组织提取物,考虑到试样获取以及处理的简便性,可举出血液、血清、唾液。
[0194]
通过常规方法对这些试样进行适当处理后,使其与本发明的抗体或蛋白质接触。由于本发明的抗体或蛋白质与本发明的乙型肝炎病毒抗原中的至少任一个特异性结合,因此,与hbv大球形颗粒特异性结合。在本发明的检测方法中,如上所述也能够通过蛋白质印迹、酶联免疫吸附试验法等直接检测与抗体或蛋白质结合的hbv大球形颗粒,例如,对于通过与抗体或蛋白质结合而浓缩的试样,也可以再应用pcr法等检测hbv大球形颗粒。特别是,在试样少量、试样中的hbv大球形颗粒为低浓度的情况下有效。
[0195]
[使用木菠萝凝集素的乙型肝炎病毒的检测方法]
[0196]
本发明的浓缩大球形颗粒的方法(以下,也称为浓缩方法)包括使o结合糖链结合型凝集素与上述检测试样接触的工序。该浓缩方法可以包括将o结合糖链结合型凝集素与hbv大球形颗粒的复合体浓缩的工序。该工序例如能够使用与珠子等载体结合的o结合糖链结合型凝集素来进行。由此,能够浓缩试样中的大球形颗粒。此处,只要o结合糖链结合型凝集素是与本发明的乙型肝炎病毒抗原中的至少任一个特异性结合的凝集素即可,优选为木菠萝凝集素。
[0197]
对于含有使用本浓缩方法浓缩的hbv大球形颗粒的试样,能够进一步应用pcr法等检测hbv大球形颗粒。以木菠萝凝集素为主的o结合糖链结合型凝集素能够形成包括它的用于检测乙型肝炎病毒的大球形颗粒的试剂盒。
[0198]
[诊断]
[0199]
如果使用本发明的乙型肝炎病毒的检测方法,能够以比以往更高的精度诊断有无感染性大球形颗粒的感染。由此,在初期症状较轻的阶段也能够进行诊断,能够早期开始治疗、或者还能够预防感染扩散到其他人。
[0200]
[药物组合物]
[0201]
本发明的药物组合物的主要实施方式之一是以抗体或蛋白质为有效成分,含有任意药学上可接受的载体和/或赋形剂的hbv传染病的治疗和预防用药物组合物。此时,有效成分的抗体或蛋白质可以编入到已知的肝脏特异性可传递的载体中。另外,也优选使用内
质网特异性可传递的ph敏感性脂质体等脂质体递送法。
[0202]
需要说明的是,以下主要对抗体或蛋白质等制剂化以及具体的给药方法、给药量等进行说明。
[0203]
给药途径可以是口服或非口服中的任意一种,在非口服给药的情况下,优选为皮下或静脉内注射,也可以通过鼻腔喷雾等鼻腔给药、经皮给药、吸入、栓剂等给药。抗体或蛋白质能够通过静脉注射、皮下注射、口服递送、脂质体递送或鼻腔内递送向患者给药,然后蓄积在患者的全身、肝脏或肝细胞中。
[0204]“药学上可接受的载体和/或赋形剂”对本领域技术人员来说是已知的,包括像非毒性固体、半固体或液体填充剂、稀释剂、脂质体等那样的任意形式的封入材料或制剂辅料。
[0205]
用于非口服注射的药学组合物可以包括药学上可接受的灭菌后的水性或非水性溶液、分散液、悬浊液或乳浊液,以及用于在刚要使用前重建灭菌后的可注射溶液或分散液的灭菌粉末。适合的水性和非水性载体、稀释剂、溶剂或介质的例子包括水、乙醇、甘油、丙二醇、聚乙二醇等多元醇、羧甲基纤维素及其适合的混合物、橄榄油等植物油以及像油酸乙酯那样的可注射有机酯。通过配合卵磷脂等包衣材料、表面活性剂等,能够维持适当的流动性。此外,还可以含有像保存剂、润湿剂、乳化剂和分散剂那样的辅料、抗细菌剂和抗真菌剂、糖、氯化钠等等渗剂。
[0206]
另外,能够通过像聚丙交酯-聚乙交酯那样的生物降解性聚合物将药学组合物形成微胶囊基质、或者通过将药学组合物封闭在与身体组织具有适应性的脂质体或微乳液内来制备贮库可注射制剂。可注射制剂例如能够由通过细菌保留过滤器的过滤、或者编入采取在刚要使用前能溶解或分散于灭菌水或其他可灭菌注射介质中的灭菌固体组合物的形式的灭菌剂来灭菌。
[0207]
对用于口服给药的固体剂型没有限定,包括胶囊、片剂、丸剂、粉末和颗粒。在这种固体剂型中,活性成分与像柠檬酸钠或磷酸二钙那样的至少一种药学上可接受的赋形剂或载体和/或(a)淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸等填充剂或增量剂、(b)羧甲基纤维素、海藻酸、聚乙烯吡咯烷酮、蔗糖和阿拉伯树胶等粘合剂、(c)甘油等湿润剂、(d)琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、特定的硅酸盐和碳酸钠等崩解剂、(e)石蜡等溶液延缓剂、(f)季铵化合物等吸收促进剂、(g)像乙酰基醇和单硬脂酸甘油酯那样的润湿剂、(h)像高岭土和膨润土那样的吸收剂,以及(i)滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠以及它们的混合物等润滑剂混合。在胶囊、片剂和丸剂的情况下,剂型还可以包括缓冲剂。
[0208]
口服组合物除了包括非活性稀释剂以外,还能够包括润湿剂、乳化剂和悬浮剂、甜味剂、增味剂以及芳香剂等辅料,悬浮液除了包括活性化合物以外,例如还可以包括乙氧基化异硬脂醇、聚氧乙烯山梨糖醇以及山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶以及它们的混合物等悬浮剂。
[0209]
用于口服给药的组合物可以含有活性成分不溶解的程度的液体或固体的非离子型表面活性剂、或含有固体阴离子表面活性剂的氮气或液化气喷射剂等压缩气体。
[0210]
在活性成分为抗体或蛋白质的情况下,优选应用包括磷脂酰肌醇(pi)脂质的ph敏感性脂质体、肝脏特异性可递送的阳离子脂质体等脂质体递送法迅速到达肝脏内的hbv感
染细胞。
[0211]
另外,在使用其他递送载体的情况下,也优选采取脂质体的形式给药。像本技术领域已知那样,脂质体通常由磷脂或其他脂质物质构成。脂质体由分散在水性介质中的单层状或多层状水和液体结晶形成。可以使用能够形成脂质体的任意的非毒性的生理学可接受且可代谢的脂质。脂质体型中的该组合物除了含有本发明的活性成分以外,可以含有稳定剂、保存剂、赋形剂等。优选脂质为天然和合成的两者的磷脂以及磷脂酰胆碱(卵磷脂)。形成脂质体的方法是本技术领域已知的。
[0212]
实施例
[0213]
下面,示出实施例更具体地说明本发明,但本发明不限于这些实施例。
[0214]
为了区分大球形颗粒和svp,首先着眼于hbv颗粒上的糖链修饰,对各hbs抗原的糖链附加和糖链结构进行分析。使用超离心浓缩法从hbv感染患者的混合血清中制备含有hbv颗粒的颗粒组分。在60℃下将颗粒组分热处理灭活一夜后,用于各种研究。在0.4%的sds和还原剂(0.2m二硫苏糖醇;dtt)存在下对浓缩的hbv颗粒进行95℃、5分钟的热处理后,用sds-page(富士胶片和光纯药公司(富士
フィルム
和光纯药株式会社)supersep
tm ace,10-20%)展开并固定后进行银染色(图2)。
[0215]
同样地,用sds-page展开来自hbv感染患者的hbv(hbs)抗原后,转印至pvdf膜(伯乐公司(bio-rad),trans-turbo
tm
)。在37℃下封闭(ds生物医药公司(ds
ファーマバイオメディカル
株式会社),block ace)处理1小时后,使用抗s-hbs抗原单克隆抗体(hb0116抗体,富山大学,jin a,and muraguchi a,et.al.,nat med.(2009)15(9):1088-1092.、tajiri et.al.,antiviral res.(2010)87(1):40-49.)实施免疫印迹。另外,一部分转印至pvdf膜后,实施凝集素印迹,对糖链修饰的有无进行分析。对于凝集素印迹,使用生物素化凝集素,用hrp标记链霉亲和素进行2次反应,使用荧光检测试药检测。生物素化凝集素使用从vector公司(船越公司(
フナコシ
))、j-化学公司(j
-ケミカルズ
社)(维百奥生物科技公司(
コスモバイオ
))、ey实验室公司(ey
-ラボラトリーズ
)(维百奥生物科技公司(
コスモバイオ
))等销售的市售品。
[0216]
进一步,使用hb0116抗体构建免疫沉降系统以纯化血清中存在的hbv颗粒并进行糖链结构分析。将250ng的hbv颗粒加入到市售健康者血清(高金生物科技公司(
コージンバイオ
株式会社))2.5μl中,作为hbv感染者模型血清(添加对照血清),使用1μg的hb0116抗体对添加对照血清2.5μl进行免疫沉降后,使用溶出液(tbs中0.2%的sds)在95℃下热溶出5分钟。此时,在溶出液中在含有0.2m的dtt的条件(还原溶出)和不含有0.2m的dtt的条件(非还原洗脱)下溶出。使用免疫沉降样品(相当于5nghbs抗原量)进行凝集素微阵列分析(图3、图4)。凝集素微阵列分析中的凝集素芯片(凝集素微阵列芯片)使用糖科技公司(glyco technica)的lec chip ver.1.0。
[0217]
[hbs抗原的sds-page(银染)(图2)]
[0218]
在sds和还原剂的存在下对含有由hbv感染患者的血清制备的hbv颗粒的颗粒组分进行热处理,用sds-page展开。固定后进行银染色,结果检测到s-hbs抗原
·
m-hbs抗原
·
l-hbs抗原的各谱带。基于有无糖链的s-hbs抗原(相当于gp28和p25)几乎1比1地存在,含有最多。
[0219]
接种疫苗后诱导的抗体需要在血液中与hbv结合。因此,将构成hbv外壳的糖蛋白
(hbs抗原蛋白质)在未变性或未破坏的状态下进行糖链分析。
[0220]
[hbv颗粒的非破坏糖组分析(图3)]
[0221]
图3a示出了对作为构成hbv颗粒的表面的蛋白质hbs抗原之一的s-hbs抗原(gp28和p25)的探针反应性。将电泳后的银染色图像(ss)、使用以s的环区域肽部分为表位的抗体(hb0116)的抗体印迹图像(ab)、以及使用识别附加在s的环区域上的糖链的末端唾液酸的凝集素(ssa)的凝集素印迹图像(lec)。
[0222]
图3b示出了使用hb0116抗体的抗体覆盖凝集素阵列的非破坏hbv颗粒特异性糖链轮廓的图像。如上所述,hbv颗粒中的s-hbs抗原具有1条n型糖链的gp28和不具有糖链的p25两种,各自的存在比约为1:1。如果不破坏hbv颗粒地获取并应用于凝集素阵列,首先,包含gp28的糖蛋白上的糖链与芯片基板上的凝集素结合。结合反应后,如果覆盖检测抗体hb0116,该抗体会与颗粒上的p25反应。在这样的条件下能够进行信号检测(左图),但在hbv颗粒被表面活性剂等破坏且蛋白质未缔合的状态下,即使包含gp28的糖蛋白与凝集素结合,检测抗体也不能反应,因此,结果不能检测信号(右图)。即,如果使用该方法,则仅能够分析没有破坏的hbv颗粒的糖链。
[0223]
图3c是通过超离心从hbv患者血清中分离的hbv颗粒的抗体覆盖凝集素阵列的结果。离心分离后,在温和的条件下对加热处理而非活性化的病毒颗粒进行凝集素阵列分析的情况(左图)以及将在sds和dtt的存在下对获取颗粒进行加热处理而得到的破坏颗粒进行凝集素阵列分析的情况(右图)。如b的说明所述,只有在保持颗粒形状的情况下,能得到hbv颗粒上固有糖链的结合信号图案。
[0224]
可知像图3中明确的那样,实施使用识别hbs抗原的抗体、由凝集素阵列表示的凝集素的凝集素印迹时,抗体和凝集素能识别明显不同的分子种。例如,由于从疫苗接种者获取的单克隆抗体hb0116主要识别的hbs抗原没有被凝集素印迹识别,因此,可知识别出没有带糖链的s-hbs抗原。此外,根据参考文献(jin a,and muraguchi a,et al.nat med.2009sep;15(9):1088-92.),hb0116识别的抗原表位的位置被认为是c1区域。根据本申请的实验结果,认为因糖链附加而不能识别(受到抗体结合的影响)。
[0225]
[hbv颗粒与凝集素的结合反应性的差异(图4)]
[0226]
使用一部分明确与hbv颗粒结合的凝集素进行凝集素印迹。识别n结合型糖链的末端唾液酸的ssa对gp28表现出最强的结合性,但识别o结合型糖链的木菠萝凝集素对gp33表现出很强的结合性。
[0227]
如此地,可知各凝集素对不同的hbv颗粒构成蛋白质成分表现出选择性的反应性,因此,用7个凝集素进行比较(图4b)。在选定这些凝集素时,考虑(1)凝集素的类似特异性的重复以及(2)具有用于把握hbv颗粒的整体糖链结构的特异性种类的幅度的最低限度的组合,从在凝集素阵列分析中显示出阳性信号的凝集素组中选择剩余的7种凝集素。用这7种凝集素进行比较,结果表明对作为m蛋白的gp33和gp36显示出最强反应性的是木菠萝凝集素。
[0228]
为了浓缩具有感染性的大球形颗粒,尝试用对hbs抗原蛋白质组中的m蛋白显示选择性反应性的凝集素,即木菠萝凝集素回收hbv颗粒。
[0229]
使用感染hbv基因型c的患者血清构建木菠萝凝集素反应性hbv颗粒的回收系统。将生物素标记化后的木菠萝凝集素(矢量实验室公司)5μg、10μg与链霉亲和素结合磁珠
(dynabeads myone streptavidin t1;美国生命技术公司)100μl结合后,加入血清试样,在4℃下搅拌一夜使其反应。反应后,将上清液作为木菠萝凝集素非结合组分(-)回收后,在包含hbv颗粒的木菠萝凝集素结合磁珠中加入拮抗糖(1m甲基-α-d-半乳糖苷),在4℃下搅拌一夜使其反应。将得到的拮抗糖溶出液作为木菠萝凝集素结合组分(+)非加热地回收。在该一系列系统中,也准备木菠萝凝集素非结合磁珠(木菠萝凝集素,0μg),作为反应体系中的对照。使用患者血清0.625μl分离为木菠萝凝集素非结合组分(-)和木菠萝凝集素结合组分(+)后,使用qiaamp病毒dna小型试剂盒(德国凯杰公司)从两个组分中纯化hbv dna。使用实时定量pcr(light cycler 480;罗氏诊断公司)和taq聚合酶(eagle taq master mix with rox;罗氏生命科学)对hbv dna的量进行定量。热循环在95℃下以10分钟使dna热变性后,通过45次扩增循环(95℃,15秒;60℃,1分钟)进行测定。
[0230]
在s-hbs抗原内使用hbv-sf2(5
’-
cttcatcctgctgctatgcct-3
’
)(序列号18)和hbv-sr2(5
’-
aaagcccaggatgatgggat-3
’
)(序列号19)对目标序列扩增后,使用taqman探针,hbv-sp2(fam-atgttgcccgtttgtcctctaattccag-tamra)(序列号20)进行荧光检测。另外,使用患者血清2.5μl同样地与木菠萝凝集素反应后,通过clia法(hbsag qt;美国雅培实验室公司)对在非加热获得的两个组分中存在的hbs抗原量进行测定(图5)。
[0231]
[使用木菠萝凝集素分离hbv(hbv dna)(图5)]
[0232]
图5示出了通过固定有对hbs抗原蛋白质组中的m蛋白表现出选择性反应性的木菠萝凝集素的载体,对hbv感染患者血清成分进行亲和性色谱分析,将hbv颗粒分别分离为结合组分(+)和非结合组分(-),通过免疫沉降获得各个组分中含有的hbv颗粒,并考察它们的性状的结果。有趣的是,有感染力的大球形颗粒拥有的颗粒内包的hbv dna主要包含在木菠萝凝集素结合组分中,(b)与木菠萝凝集素结合的hbsag只占血清成分中hbsag总量的5%左右(c)。这表明了通过木菠萝凝集素分离能够富含大球形颗粒以及能够推测具有感染性的颗粒总量。
[0233]
为了制备识别疫苗、具有感染性的hbv颗粒的抗体,通过使用质量分析器的糖蛋白组学分析法如下所述地鉴定hbv颗粒上的糖链结构和糖链附加位置。
[0234]
通过sds-凝胶电泳法分离由hbv感染患者血清制备的hbv颗粒(亚病毒颗粒部分),用银染色法检测后,将s、m、l型hbs按n型糖链附加数切出(s;p25,gp28,m;gp33,gp36,l;p39,gp42,图2)。对各谱带的凝胶片进行还原烷基化处理后,渗入胰蛋白酶,在凝胶内消化蛋白质,提取生成的肽。将其提供给亲水性相互作用色谱(hilic:使用酰胺80柱),分离为结合组分(n型糖肽)和通过组分,在用稳定同位素
18
o标记的水(缓冲液)中对一部分前者进行pngasef(肽n葡聚糖酶f)处理,切除糖链并标记糖链附加部位(igot处理)。分别进行了lc/ms分析。对从s-hbs gp28游离的糖链进行完全甲基化处理后,用maldi-tof ms(基质辅助激光解吸电离-飞行时间型质谱法)进行糖链的组成分析(图6)。
[0235]
[hbs抗原上的糖链(ms和结构)(图6)]
[0236]
图6示出了为了详细地分析hbs抗原蛋白质上的糖链结构、修饰而使用质谱分析装置进行分析的结果。
[0237]
将由hbv感染患者血清制备的hbv颗粒(亚病毒颗粒部分)变性并还原烷基化后,用胰蛋白酶消化。对通过hilic从该消化物中收集的糖肽组分进行igot处理,用液相色谱/质量分析(lc/ms)对其进行分析,鉴定n型糖链附加部位。另外,同样地对于通过凝胶电泳法分
离、分取的各谱带的糖肽也进行igot处理后,通过lc/ms分析鉴定。
[0238]
明确了n型糖链的主要结构(图6)和n型糖链的附加位置(表3),除了s-hbs上的糖链以外,还确认了pres1、pres2上的n型糖链。如下所示,在pres1、pres2和s区域的氨基酸序列(序列号14)中,明确了n结合型糖链结合在位置15、123和320的氨基酸asn上。
[0239]
表3 n型糖链附加位置
[0240][0241]
将用质谱分析装置测定从hbs抗原释放的糖链并鉴定的峰的质量和推断的糖链结构示于图6。
[0242]
基于图4和图5的结果,对将hbv试样蛋白质的胰蛋白酶消化物供于凝集素(木菠萝凝集素)固定化柱而得到的糖肽进行lc/ms分析。作为选择离子的片段化法,利用碰撞诱导解离(cid)法和电子转移解离(etd)法得到ms/ms光谱,对糖链的组成和结合位置进行鉴定。同样地,对按类别切出而制备的肽提取物的hilic未吸附组分进行lc/ms分析,并检测该糖肽(图7)。
[0243]
[hbs抗原上的o型糖链和位置(图7)]
[0244]
为了明确木菠萝凝集素结合的o型糖链的附加位置,使用质量分析装置进行分析。根据与已知的氨基酸序列的比较,表明在存在于pres2区域的1个或2个苏氨酸(thr,t)上存在o型糖链(图7)。
[0245]
将用质量分析装置对pres2区域的糖肽进行ms/ms分析并鉴定的峰的质量和推断
的o型糖链结构示于图7。
[0246]
使用蛋白酶消化hbv感染者血清中存在的hbs抗原后,使用lc/ms分析法分析。对于得到的ms/ms光谱,使用制成为包括各种基因型的hbs的已知氨基酸序列的蛋白质序列数据库,使用数据库检索引擎(mascot)检索(图8)。
[0247]
[鉴定的hbs抗原的序列(基因型c)(图8)]
[0248]
图8是对hbv感染者血清中存在的hbs抗原进行提取并进行肽酶处理并使用质谱分析装置鉴定的hbs抗原的序列以及糖链的附加位置和结构(糖链组成)。关于鉴定的肽,示出了对hbv数据库中基因型c的hbs抗原映射的结果。
[0249]
在该分析中,通过质量分析装置对hbs抗原进行分析并鉴定的序列示于图8。
[0250]
[抗原列表(s,m,l,pres2,pres2+0)(图9)]
[0251]
目前作为疫苗使用的用酵母制备的重组s-hbs抗原没有糖链修饰。但是,在hbv上的hbs抗原中存在糖链,表明了用木菠萝凝集素能够浓缩hbv颗粒的可能性。然后,为了诱导或制备识别具有感染性的hbv颗粒的抗体,需要合成大量接近天然hbv的hbs抗原蛋白质。基于质谱分析结果制备带糖链的hbs抗原。我们成功地使用出芽酵母株制备具有n型糖链的l-hbs抗原(glyco-l)。m-hbs抗原在作为肝癌细胞的huh7细胞中表达,具有n型糖链和o型糖链。进而制备作为hbv上的木菠萝凝集素识别部位的o型糖链及其结合肽,并作为抗原使用(图9)。
[0252]
将本开发中使用的候选疫苗(抗原)的示意图示于图9。以往疫苗的抗原(s(-gly))是无糖链的s-hbs抗原(黑),用酵母表达并制备。在huh7细胞中表达并制备的m-hbs抗原(pres2(灰)+s)具有糖链(m(+gly))。在使用出芽酵母株制备的l-hbs抗原(pres1(白)+pres2+s)上结合了n型糖链(l(+gly))。pres2肽是化学合成的。带o型糖链的pres2肽是化学合成后用糖转移酶加入糖链修饰而制备的(pres2+0)。
[0253]
本开发中使用的pres2的序列来自基因型c,在v17到r48的肽的n
’
末端附加了半胱氨酸残基。进一步,作为抗体诱导肽(候选抗原),也合成了基因型a-d的pres2和pres1。
[0254]
表4中示出了合成肽列表(pres1、pres2)。
[0255]
表4合成肽列表(pres1、pres2)
[0256][0257]
示出了上述基因型c的pres2肽和糖肽的合成方法。使用固相载体(h-arg(pbf)-hmpb-chemmatrix)通过根据fmoc法(芴甲氧羰基法)的固相合成合成肽。将溶胀的固相载体、相应的fmoc氨基酸(5当量)或fmoc糖氨基酸(1.5当量)、缩合剂comu(相对于fmoc氨基酸或fmoc糖氨基酸为1当量)、碱基diea(相对于fmoc氨基酸或fmoc糖氨基酸为2当量)加入dmf0.8ml(糖氨基酸缩合反应时为0.5ml)中,在室温下搅拌30分钟(糖氨基酸时为3小时)后,用dmf洗涤。接着,使用13mm的hobt/(ac
2
o/diea/dmf)(4.75/2.25/93.0v/v/v)在室温下进行2分钟的乙酰封盖反应,用dmf洗涤。接着,加入20%哌啶/dmf溶液,在室温下搅拌5分钟,脱保护fmoc基后,用dmf洗涤。重复该操作,依次延伸肽链。用二氯甲烷洗涤得到的肽树脂,干燥后,加入裂解混合物(tfa/h
2
o/edt/tis=94/2.5/2.5/1),在室温下搅拌2小时,从载体上切出并进行侧链的脱保护。回收滤液后,加入冰冷却的醚,作为沉淀,得到粗肽。将通过hplc纯化得到的化合物溶解在甲醇中,加入1n的naoh,将糖部分的乙酰基脱保护。将反应
液中和并浓缩后,用hplc再次纯化,得到目标物(图10)。
[0258]
comu:(1-氰基-2-乙氧基-2-氧代亚乙基氨基氧基)二甲基氨基-吗啉-碳鎓六氟磷酸盐。
[0259]
hobt:1-羟基苯并三唑。
[0260]
diea:n,n-二异丙基乙胺。
[0261]
dmf:n,n-二甲基甲酰胺。
[0262]
tfa:三氟醋酸。
[0263]
edt:1,2-乙二硫醇。
[0264]
tis:三异丙基硅烷。
[0265]
[glyco-pres2的化学合成(图10)]
[0266]
图10中示出了表4中所示的pres2(pres2(cys+v17-r48(序列号31)),上段)和pres2+0(pres2(cys+v17-r48,t37+galnac),下段)的化学式。
[0267]
为了制备glyco-pres2糖肽,合成了pres2(cys+v17-r48,t37+galnac),糖链延伸使用糖转移酶进行。伸长反应中使用的糖转移酶(来自果蝇的gal转移酶[dro c1galt1]和唾液酸[sia]转移酶[st3gal1])是使用hek293t细胞生产的。从转染了各糖基转移酶表达载体的hek293t细胞的培养上清液中,使用抗ddddk-tag抗体(mbl,#m185-7,克隆:fla-1)纯化酶蛋白质。用sds-page展开一部分纯化蛋白质后,使用hrp标记的抗ddddk-tag抗体(mbl)进行蛋白质印迹分析。检测的谱带确认了以预计的分子量能够生产酶(dro c1galt1和st3gal1)。t37+galnac上的gal的附加使用dro c1galt1和基质(udp-gal),另外,sia的附加使用st3gal1和基质(cmp-sia)按照后述进行。t37+galnac上的gal的附加反应以dro c1galt酶作为供体基质,使用udp-gal(雅玛山酱油株式会社(
ヤマサ
醤油株式会社),ym7213),在包含25mm的hepes(ph7.0)、10mm的mncl
2
、udp-gal、t37+galnac肽、dro c1galt的反应溶液中以37℃进行一夜。反应后,通过maldi-tof-ms(ultrafrex,德国布鲁克公司)对一部分反应溶液进行分析,确认附加反应100%进行。接着,在反应溶液中加入st3siai酶和cmp-neuac(雅玛山酱油株式会社(
ヤマサ
醤油株式会社),ym7215),以37℃再反应一夜。最终产物使用cosmosil 5c18-ar-ii填充柱(半井试药公司(半井
テスク
),38145)分离纯化,通过maldi-tof-ms确认质量(图11)。
[0268]
[glyco-pres2的糖链修饰(图11)]
[0269]
a)示出糖链延伸反应的方案。以galnac-pres2肽为基质,使用dro c1galt1进行gal的附加,使用st3gal1进行sia的附加。方形表示galnac,圆圈表示gal,菱形表示sia。b)延伸反应中使用的糖基转移酶是使用hek293t细胞生产的。使用抗ddddk-tag抗体(抗flag标记抗体)从转染了各糖基转移酶表达载体的hek293t细胞的培养上清液中纯化酶蛋白质。通过sds-page展开一部分纯化蛋白质后,确认了能够通过抗ddddk-tag抗体的蛋白质印迹以预计的分子量生产酶。c)利用质谱分析装置确认反应产物。酶反应的产物用hplc纯化后,分别用质谱分析装置测定质量。
[0270]
质量分析结果表明了来自患者的l-hbs抗原上结合了多个n型糖链。因此,作为候选疫苗,使具有糖链的l-hbs抗原(l(+gly))在出芽酵母株中表达而制备。
[0271]
将编码基因型c(c_jpnat)的hbs抗原的氨基酸序列信息示于[序列号14]。根据该氨基酸序列信息,设计基因序列以使用出芽酵母中使用频率高的密码子,进行基因序列的
全合成。信号序列使用出芽酵母的α因子的前原序列,作为紧接其后连接hbs抗原的l区域(pres1+pres2+s区域)的基因序列[序列编号64]。此外,基因合成是通过外包进行的。
[0272]
用ecori和sali切断得到的合成基因,用市售的ecori和sali切断yep352gapii载体后,分别进行琼脂糖凝胶电泳,从凝胶中切出相当于各个片段的谱带。用普洛麦格公司(
プロメガ
社)的wizard sv dna和pcr清除系统从切出的凝胶中提取并纯化dna片段。用nanodrop lite(赛默飞世尔科技公司)测定dna浓度后,将各50ng的片段混合,用h
2
o使其成为7.5μl,加入3.75μl的ligation high ver.2(日本东洋纺公司),在16℃下反应30分钟。其中,使用2μl对大肠杆菌competent e.coli.dh5α进行转化。在含有50μg/ml的氨苄青霉素的lb琼脂培养基中在37℃下培养16小时,得到转化体。
[0273]
在37℃下将得到的菌落在含有50μg/ml的氨苄青霉素的lb液体培养基中培养16小时。使用普洛麦格公司(
プロメガ
社)的wizard plus sv minipreps dna纯化系统从菌体中纯化yephbvc2载体(图12)。进行序列解析,确认碱基序列没有差异。
[0274]
使用该载体(yephbvc2)按照常规方法进行出芽酵母(酿酒酵母:saccharomyces cerevisiae)w303-1b株(matαura3-52 trp1δ2leu2-3_112his3-11 ade2-1 can1-100)的转化。
[0275]
将转化后的菌液涂布在酪蛋白氨基酸-ura琼脂培养基(0.67%酵母氮源w/o氨基酸、1%酪蛋白氨基酸、2%葡萄糖、40μg/ml色氨酸、40μg/ml腺嘌呤1/2硫酸盐、2%琼脂)上,在30℃下培养两天,从而得到转化体的菌落。从板上刮取菌落,用悬浮在pcr反应液中的简易pcr法确认其插入染色体,将该酵母作为hbv l-hbs(glyco-l)表达出芽酵母。
[0276]
预培养glyco-l表达酵母后,接种1l的1
×
酪蛋白氨基酸-ura培养基(0.67%酵母氮源w/o氨基酸、1%酪蛋白氨基酸、2%葡萄糖、40μg/ml色氨酸、40μg/ml腺嘌呤1/2硫酸盐)。在120rpm、30℃条件下培养120小时。通过离心分离菌体后,将其上清液的一部分供于sds-page,转印到pvdf膜上后,通过蛋白质印迹分析确认表达。作为一次抗体,使用市售的抗hbs抗体(抗pres1单克隆抗体(小鼠);特殊免疫研究所或乙型肝炎表面抗原a,山羊抗体;prospec),二次抗体使用抗小鼠igg抗体-过氧化物酶或抗山羊ig抗体-过氧化物酶。检测使用ecl免疫印迹检测试剂(ge)通过图像分析仪(ge las-1000)进行。
[0277]
接着,进行纯化。将培养的1g菌体悬浮在含有7.5m尿素和0.1m的二硫苏糖醇的y-per
tm plus可透析型酵母蛋白提取试剂(赛默飞世尔科技公司)5ml中,在室温下提取20分钟。进行该提取后,在2000
×
g、4℃下离心5分钟除去残渣后,回收再以12000
×
g、4℃下离心5分钟而得到的沉淀物。用含有7.5m尿素、15mm的edta的0.1m磷酸缓冲液(ph 7.2)3ml溶解该沉淀物,制成glyco-l的粗提取液。
[0278]
接着,设定4.55ml的10-40%的溴化钾(kbr)的密度梯度,在最上层添加0.45ml的粗提取液,用beckman sw 55ti转子进行了73000
×
g、4℃、16小时的超离心。从管的上层各回收0.3ml溶液,对各组分进行了使用抗pres1抗体的蛋白质印迹分析。除去夹杂蛋白质比较多(kbr密度轻)的组分,回收抗体反应阳性的组分。将该溶液进行peg沉淀,用含有7.5m尿素、15mm的edta的0.1m磷酸缓冲液(ph 7.2)溶解该沉淀物,提供给下一次超离心。
[0279]
作为下一步,设定4.8ml的5-50%的蔗糖密度梯度,在最上层添加0.48ml的样品,在与上述相同的条件下进行超离心。从管的上层各回收0.3ml溶液,对各组分进行sds-page,使用oriole染色(伯乐公司)和抗pres1抗体进行蛋白质印迹分析。回收抗体反应阳性
的组分,对蒸馏水透析后,进行冷冻干燥。
[0280]
为了用电子显微镜观察冷冻干燥样品(glyco-l),添加pbs后,进行超声波处理(sonicator),熔解。用30k的超滤离心管(amicon ultra)0.5ml离心式过滤器(millipore)简单纯化。在载置0.1mg/ml浓度样品的电试验观察用栅极上以2.5万倍、5万倍、10万倍进行观察并拍摄。
[0281]
为了在出芽酵母中表达来自基因型_c的全长hbs抗原,对密码子进行优化并进行全合成,克隆,构建表达载体(yephbvc2)(图12)。用yephbvc2对出芽酵母株w303-1b进行转化,筛选表达l(+gly)的克隆。通过蛋白质印迹分析确认一部分培养物的表达,在菌体内、培养液中均确认了信号。在培养上清液中确认表达的glyco-l的分子量约为60kda,比预计的分子量约45kda大很多,因此,用endo-hf切断糖链,确认有无糖链附加。结果表明endo-hf处理后的glyco-l的分子量约为50kda,附加了至少一条以上n-型糖链。另外,在该培养上清液中表达的glyco-l在抗pre-s1抗体中也检测到,因此确认了以含有l区域的n末端的形式表达。转化并培养120小时后收集菌体,将在7.5m尿素存在下溶菌、采用溴化钾和蔗糖的密度梯度离心,透析纯化的组分作为glyco-l(图13)。为了确认glyco-l的结构,用电子显微镜观察。确认了与不带糖链的l-hbs抗原同样地形成颗粒。另外,用5-20%梯度凝胶对纯化后的glyco-l进行sds-page后,进行oriole荧光凝胶染色,确认为单谱带(图14)。
[0282]
[glyco-l的酵母表达用载体的制备(图12)]
[0283]
将编码gapdh:出芽酵母甘油醛-3-磷酸脱氢酶、af-pp:出芽酵母α-因子的前原序列的基因、编码c_jpnat:hbv基因型_c的合成基因示于图12。
[0284]
[glyco-l的制备方法/纯化方法(酵母)(图13)]
[0285]
用yephbvc2对出芽酵母株w303-1b进行转化,筛选表达l(+gly)的克隆。培养120小时后收集菌体,将在7.5m尿素的存在下溶菌、采用溴化钾和蔗糖进行密度梯度离心,透析纯化的组分作为glyco-l。图13示出了培养方法、宿主、纯化方法的方案。
[0286]
[酵母中表达的glyco-l的推定结构(图14)]
[0287]
用酵母表达并纯化l(+gly)。用电子显微镜确认了制备的组分(glyco-l)生成颗粒(图14左下)。用5-20%梯度凝胶将glyco-l进行sds-page后,进行了oriole荧光凝胶染色(图14右下)。
[0288]
用电子显微镜观察glyco-l:l(+gly)时,明确形成了颗粒。进一步,用sds-page展开l(+gly)并确认分子量后,还确认了与未带糖链的l-hbs抗原(贝则科技公司(beacle))相比大约65kda左右,通过酶处理在l(+gly)上结合了n型糖链(m:分子量标记,g-l:纯化的glyco-l)。
[0289]
[抗hbs抗体的制备]
[0290]
(对hbs蛋白的小鼠的免疫)
[0291]
使用市售的重组hbs蛋白(s-hbs:bimmugen)或我们制备的带糖链的重组hbs蛋白(glyco-l、glyco-m)对小鼠(balb/c小鼠,8周龄雌性)进行免疫。关于各种肽抗原,使用与钥孔血蓝蛋白(klh)结合的抗原。使用赛默飞世尔公司的imject马来酰亚胺活化mcklh spin试剂盒(#77666),将各种抗原肽0.2mg分别与klh结合(conjugate)。将溶解在生理盐水中的这些各种hbs蛋白(klh结合肽)与完全弗氏佐剂(pierce,也能够使用imject明矾佐剂)混合,将其在第一天(第0天)腹腔注射1μg,在第四天腹腔注射0.5μg,在第十天腹腔注射0.5μg
进行免疫。定期进行小鼠眼眶采血,一边监测血清中抗体效价相对于抗原的上升一边进行免疫。另外,由于能够期待抗体效价的上升,因此,在回收血清和免疫b细胞的2~7天前,通过尾静脉给药免疫原(糖肽或糖蛋白)(0.1~1μg左右)进行增强。
[0292]
从确认抗体效价充分上升的免疫小鼠中采取产生抗体的细胞。更优选在最终免疫日起2~5天后采取,因此在3天后采取。作为产生抗体的细胞,可举出脾细胞、淋巴结细胞、外周血细胞等,但优选脾细胞或局部淋巴结细胞。从小鼠中采取产生抗体的细胞的方法按照本领域公知的技术进行即可。具体而言,通常采取脾细胞,进行后述[0140]中记载的融合操作,从而能够获取产生抗体的杂交瘤细胞。另外,也能够通过后述的[0143]记载的方法获取重组抗体蛋白质。
[0293]
[使用本发明中得到的抗hbs抗体的抗体-抗体酶联免疫吸附试验测定系统]
[0294]
(通过抗体-抗体酶联免疫吸附试验测定系统检测总hbs分子)
[0295]
使用从如上所述免疫的小鼠得到的针对各种hbs抗原的抗血清(包括针对免疫原的抗体),通过酶联免疫吸附试验测定系统对对于各种hbs抗原的反应性(结合性)进行检测。将各种hbs抗原分别固相化在酶联免疫吸附试验板上,在检测端使用抗血清或市售的hbs抗体在酶联免疫吸附试验测定系统中进行研究。
[0296]
首先,用pbs将各hbs抗原(市售的重组hbs蛋白(来自酵母的s-hbs:mybiosource;来自酵母的l-hbs:beacle公司;来自大肠杆菌的pres1肽:beacle公司;来自大肠杆菌的pres2肽:beacle公司)或者我们制备的重组hbs蛋白(带糖链的pres1肽、pres2肽以及l-hbs、m-hbs)稀释到0.5μg/ml,以100μl/孔添加在酶联免疫吸附试验用微孔板(赛默飞世尔公司,immobilizer amino)中,通过氨基共价键合。在4℃下将各抗体吸附(固相化)在板上一夜后,废弃溶液,用pbs-t(pbs,0.05%的吐温-20)洗涤孔。接着,向各孔中添加抗血清的稀释系列溶液100μl。在37℃下反应2小时后,废弃孔中的溶液,用pbs-t洗涤后,在室温下使稀释4000倍的辣根过氧化物酶(hrp)标记抗小鼠igg抗体(杰克逊公司(jackson),115-035-062)反应1小时。然后,废弃并洗涤反应液后,以450nm的吸光度测定1stepultra tmb基质液(皮尔斯公司(pierce))的显色(图15)。
[0297]
使用表4中记载的带糖链的pres2肽以及l-hbs、m-hbs对balb/c小鼠进行免疫,将对于各种抗原(l-hbs、m-hbs、s-hbs、pres1肽、pres2肽)的反应性与抗s-hbs抗体进行比较分析,结果获得抗原反应性不同的小鼠血清。
[0298]
通过将作为免疫抗原的l-hbs抗原(来自产总研制备的来自酵母的糖基化l-hbs)、s-hbs抗原(bimmugen)或者仅pbs(无免疫抗原)对小鼠进行免疫而得到的抗血清研究对于l-hbs抗原的反应性。
[0299]
[抗体效价的推移的比较(glyco-l和s-hbs bimmugen)(图15)]
[0300]
图15示出了使用来自对具有糖链的l-hbs抗原(glyco-l)免疫的小鼠(yl-1至yl-4)、对s-hbs抗原(bimmugen)免疫的小鼠(b1和b2)、来自对照小鼠(n1+n2)的经时血清(第0、21、28、35天)以及市售抗pres1抗体(bcl-002)的l-hbs的酶联免疫吸附试验结果(a)、以及同样地稀释(1/1000、1/3000、1/9000、1/2700)第35天的血清得到的酶联免疫吸附试验的结果(b)。
[0301]
如图15(a)所示,确认了与s-hbs抗原(bimmugen)免疫的小鼠(b)相比,l-hbs抗原(glyco-l)免疫的小鼠(yl)的抗体效价从更早阶段(免疫后经过天数少的第21天时刻)开始
page展开pres1肽(大肠杆菌)、pres2肽(大肠杆菌)、s-hbs抗原(酵母)、glyco-m-hbs抗原(hek293)、l-hbs抗原(酵母)、hbs抗原(患者血清)并比较各抗血清的反应性的结果。
[0307]
在以往的疫苗(s-hbs抗原)免疫的抗血清中,虽然识别s-hbs抗原,但与其他hbs抗原的成分的反应性很低。另一方面,glyco-l-hbs抗原免疫的抗血清对s-hbs抗原以外的成分的反应性优异。s-hbs抗原和glyco-l-hbs抗原同时免疫的抗血清识别上述全部主要成分,表明混合免疫的情况下作为疫苗的有效性。
[0308]
以上结果表明了l-hbs抗原比s-hbs抗原的抗体更能诱导pres1、pres2的抗体,通过s-和l-hbs抗原的共免疫,一次获得覆盖广范围的抗体。换言之,这表明pres1、pres2区域的抗原性(免疫原性)比s区域更高,明确了其比以往主要使用的s区域疫苗更有效。即,为了解决在通用疫苗化中应该解决课题(3次接种的费用、非响应者、糖链附加引起的逃逸突变株的出现等),需要推进新一代疫苗的开发,但作为疫苗接种方法的改良,能够开发l-hbs抗原和s-hbs抗原两者的联用、混合疫苗。
[0309]
使用将作为免疫抗原的o-糖基化的pres2肽(产总研制备的klh-结合的glyco-pres2,基因型c)或者l-hbs抗原(产总研制备的来自酵母的glyco-l-hbs)对小鼠进行免疫而得到的抗血清(免疫后49天后血清),研究针对各hbs抗原(glyco-pres2肽、pres2肽、pres1肽、s-hbs抗原)的反应性。
[0310]
用pbs将各hbs抗原(glyco-pres2肽、pres2肽(大肠杆菌生产)、pres1肽(大肠杆菌生产)、s-hbs抗原(adr,酵母生产)稀释为0.5μg/ml,以100μl/孔添加在酶联免疫吸附试验用微孔板(赛默飞世尔公司immobilizer amino)中,通过氨基使其共价键合。在4℃下使各抗体吸附(固相化)在板上一夜后,废弃溶液,用pbs-t(pbs,0.05%的吐温-20)洗涤孔。然后,在各孔中添加抗血清(glyco-pres2免疫f1小鼠0天、49天、glyco-l-hbs免疫yl3小鼠35天)、抗体(抗pres1抗体(抗pres1)、抗pres2抗体(抗pres2)、抗s抗体(抗s(a))的稀释系列溶液100μl。在37℃下反应2小时后,废弃孔中的溶液,用pbs-t洗涤后,在室温下使稀释4000倍的辣根过氧化物酶(hrp)标记抗小鼠igg抗体(jackson公司,115-035-062)反应1小时。接着,废弃反应液并洗涤后,在450nm的吸光度下测定1stepultra tmb基质液(pierce公司)的显色(图17)。
[0311]
[抗体效价的推移的比较(glyco-pres2,酶联免疫吸附试验)(图17)]
[0312]
对于使用glyco-pres2肽或glyco-l-hbs抗原对小鼠进行免疫而得到的抗血清(f1或yl3),用酶联免疫吸附试验法分析对于a)o-糖基化的pres2肽、b)pres2肽、c)pres1肽、d)s-hbs抗原的反应性。将识别用于酶联免疫吸附试验板的固相化的蛋白质的抗体作为对照进行测定。
[0313]
如图17(a)所示,用glyco-pres2肽免疫的小鼠抗血清f1(稀释系列)确认对于免疫原的反应性(抗体效价的上升)。另一方面,在该血清中,如图17(b)~(d)所示,没有发现对于免疫原以外的抗原(pres2肽、pres1肽、s-hbs抗原)的反应性。由此确认了对带糖链的pres2抗原的特异性活性。
[0314]
另外,在l-hbs免疫抗血清(yl3)中发现了对于pres2肽、pres1肽的反应性,但发现对s区域(s-hbs抗原)几乎没有什么活性。由此再次表明了作为免疫原,pres2区域比pres1区域具有更高的免疫原性。
[0315]
使用得到的抗血清(glyco-pres2抗血清)和市售抗hbs单克隆抗体(抗pres1抗体:
beacle公司抗pres1 mab-2,批号bcl-ab-002、抗pres2抗体:特殊免疫研究所hyb-5520、抗s-hbs抗体:特殊免疫研究所hyb-824),比较对于各hbs抗原(o-糖基化的pres2肽、pres2肽、pres1肽、s-hbs抗原(adr,my biosource公司)、无糖链的l-hbs抗原(beacle公司)的反应性(图18上)。
[0316]
另外,为了确认有无糖链的差异诱导的抗体的差异,实施使用pres2抗血清和glyco-pres2抗血清的免疫印迹。
[0317]
使用glyco-pres2抗血清和市售抗hbs单克隆抗体(抗pres1抗体:beacle公司抗pres1 mab-2,批号bcl-ab-002,抗pres2抗体:特殊免疫研究所hyb-5520,抗s-hbs抗体:特殊免疫研究所hyb-824),通过上述酶联免疫吸附试验法比较对于各hbs抗原(o-糖基化的pres2肽、pres1肽(大肠杆菌)、pres2肽(大肠杆菌生产)、s-hbs抗原(酵母生产,adr,my biosource公司)、无糖链的l-hbs抗原(酵母,beacle公司)的反应性。也与上述图16同样地进行蛋白质印迹法。在sds-page还原条件下使用12.5%聚丙烯酰胺凝胶对pres1肽(大肠杆菌生产)、pres2肽(大肠杆菌生产)、s-hbs抗原(酵母生产)、glyco-m-hbs抗原(hek293生产)、l-hbs抗原(酵母生产)、hbs抗原(患者血清)进行电泳,转印到pvdf膜。用含有5%脱脂乳的pbs封闭后,在室温下使hbs抗原免疫的血清(s-hbs抗原免疫的抗血清、glyco-l-hbs抗原免疫的抗血清、s-hbs抗原和glyco-l-hbs抗原同时免疫的抗血清)反应1小时。洗涤pvdf膜后,在室温下使其与二次抗体(0.5μg/ml的hrp标记抗小鼠igg抗体)反应1小时。洗涤这些pvdf膜后,通过免疫印迹检测试药(珀金埃尔默公司)采用化学发光检测(图18)。
[0318]
glyco-pres2抗血清仅对附加糖链的glyco-pres2肽表现出特异性反应。另一方面,观察到市售抗hbs抗体(抗pres1抗体、抗pres2抗体)对各区域的肽均有反应性,但对附加糖链的o-糖基化的pres2抗原几乎没有反应。
[0319]
另外,为了确认有无糖链的差异诱导的抗体的差异,实施使用pres2抗血清和glyco-pres2抗血清的免疫印迹。未观察到pres2抗血清对含有附加糖链的pres2抗原的glyco-m和来自患者的hbs抗原有反应。另一方面,确认了glyco-pres2抗血清与不含这些糖链的pres2(也包括对其他基因型的pres2)、l-hbs的反应性很低,而对glyco-m和来自患者的hbs抗原有很强的反应。由此表明了有无糖链附加对得到的抗体(抗血清)的抗原识别(反应性)产生影响。
[0320]
[酶联免疫吸附试验和蛋白质印迹分析(血清、glyco-pres2、pres2)(图18)]
[0321]
图18上段示出了使用得到的抗血清(glyco-l-hbs抗血清、l-hbs抗血清)和市售抗hbs抗体(抗pres1抗体、抗pres2抗体、抗s抗体)并通过酶联免疫吸附试验法确认对于各hbs抗原(o-糖基化的pres2、pres1肽(大肠杆菌)、pres2肽(大肠杆菌)、s-hbs抗原(酵母)、l-hbs抗原(酵母)的反应性的结果。
[0322]
图18下段示出了用sds-page展开pres1肽(大肠杆菌)、pres2肽(大肠杆菌)、s-hbs抗原(酵母)、glyco-m-hbs抗原(hek293)、l-hbs抗原(酵母)、hbs抗原(患者血清)并进行使用pres2抗血清(左)和glyco-pres2抗血清(右)的免疫印迹的结果。
[0323]
表明了glyco-pres2抗血清不识别不带糖链的pres2肽(大肠杆菌),而识别glyco-m-hbs抗原(hek293)。另外,明确了在hbs抗原(患者血清)中存在与pres2抗血清相比被glyco-pres2抗血清更强识别的glyco-m-hbs抗原。
[0324]
包括再现性的确认在内,再次进行了免疫的研究。使用将作为免疫抗原的o-糖基
化的pres2肽对小鼠进行免疫而得到的抗血清(免疫后43天后血清)研究对于免疫抗原(o-糖基化的pres2肽)的反应性。
[0325]
用pbs将hbs抗原(glyco-pres2肽)稀释为0.5μg/ml,以100μl/孔添加在酶联免疫吸附试验用微孔板(赛默飞世尔科技公司immobilizer amino)中并通过氨基使其共价键合。在4℃下使各抗体吸附(固相化)在板上一夜后,废弃溶液,用pbs-t(pbs,0.05%的吐温-20)洗涤孔。然后,向各孔中添加glyco-pres2免疫的抗血清(f1、f2、f3小鼠0天和49天)的稀释系列溶液100μl。在37℃下反应2小时后,废弃孔中的溶液,用pbs-t洗涤后,在室温下使稀释4000倍的辣根过氧化物酶(hrp)标记抗小鼠igg抗体(jackson公司,115-035-062)反应1小时。然后,废弃反应液并洗涤后,以450nm的吸光度测定1stepultra tmb基质液(pierce公司)的显色(图19)。
[0326]
如图19所示,通过o-糖基化的pres2肽免疫的复数个小鼠的抗血清(稀释系列)确认对于免疫原o-糖基化的pres2肽的反应性(抗体效价的上升)。
[0327]
[免疫小鼠的酶联免疫吸附试验的差异(血清、glyco-pres2)(图19)]
[0328]
使用o-糖基化的pres2肽免疫43天后的血清(f3、f4、f5)通过酶联免疫吸附试验法分析对于o-糖基化的pres2肽的反应性。在o-糖基化的pres2肽免疫的抗血清(f3、f4、f5)中虽然观察到抗体效价存在差异,但全部对附加糖链的o-糖基化的pres2肽显示出反应。表明了在附加糖链的pres2抗原免疫得到的抗体(抗血清)中包括抗原识别(反应性)且具有再现性。
[0329]
根据通过酶联免疫吸附试验法确认这些小鼠血清中抗体效价的上升的结果,确认了成功获得识别hbs抗原的几乎全部区域的血清群。另外,将通过各种抗原的免疫得到的抗体的抗原识别汇总在表5中。
[0330]
表5获得血清与抗血清的比较
[0331][0332]
通过glyco-l-hbs和s-hbs抗原的共免疫,能够获得识别广范围的区域的抗体。另外,通过pres2糖肽能够获得特异性识别m-hbs抗原的抗体,以上表明能够获得识别全部hbs成分的抗体。
[0333]
在glyco-l-hbs、s-hbs抗原、pres2糖肽免疫得到的抗血清中确认了抑制hbv感染活性。特别是,由于通过glyco-l-hbs抗原、pres2糖肽能诱导抑制hbv感染的中和抗体,因此,可知与以往没有糖链的抗原相比,带糖链的抗原高效地诱导抑制hbv感染的中和抗体。
[0334]
[杂交瘤的制备]
[0335]
能够通过各种方法从观察到抗体效价上升的小鼠个体中获得产生抗hbs抗原抗体的产生抗体的细胞。
[0336]
通过进行产生抗体的细胞与骨髓瘤(myeloma)细胞的细胞融合,能够制备生产抗hbs抗原单克隆抗体的杂交瘤。使用来自免疫小鼠的脾细胞和小鼠骨髓瘤细胞(p3u1细胞),按照常规方法(后述)用rpmi培养基洗涤各细胞后混合,用细胞融合促进剂(peg1500)进行细胞融合操作。优选脾细胞和小鼠骨髓瘤细胞(p3u1)的混合比率以8:1进行,但条件也因免疫抗原的不同而不同,因此,更优选分别按照通过适当的预研究确定的比率进行。细胞融合后,通过作为选择培养基的hat培养基(在rpmi1640培养基中加入100单位/ml青霉素、100μg/ml链霉素和10%胎牛血清(fbs)、10-4
m次黄嘌呤、1.5
×
10-5
m胸苷和4
×
10-7
m氨基喋呤的培养基)进行培养,进行选择性培养以使只有融合细胞存活。为了在选择培养基中选择培养开始后约10天以后生长的细胞作为杂交瘤,接着通过有限稀释法得到单克隆细胞。具体而言,在96孔培养板上从浓到淡制备细胞溶液(浓度)的稀释序列进行播种,选择来自限定数量的细胞的杂交瘤细胞群,并且通过后述的筛选选择产生对于各种hbs抗原的抗体的克隆(包括96孔板的阳性孔)。
[0337]
[筛选方法]
[0338]
通过酶免疫测定法(elisa法)筛选增殖的杂交瘤培养上清液中是否含有目标抗hbs抗原单克隆抗体。提取培养杂交瘤的孔中含有的一部分培养上清液,将对于作为免疫原使用的hbs重组蛋白质的结合活性(以及对于作为阴性对照的免疫抗原以外的抗原、本来非结合性抗原的结合活性)作为指标。将各种hbs抗原固相化在96孔板上(以1μg/ml计为100μl/孔),封闭后,加入100μl培养上清液,在37℃下反应1小时。通过使用酶联免疫吸附试验的筛选和有限稀释法(具体而言,在96孔培养板上以每孔含有0.3个左右细胞的浓度进行播种),选择阳性的克隆。优选的是,获取一次筛选时得到的阳性孔,再用有限稀释法将其展开,进一步锁定细胞。该二次筛选以后,根据情况反复进行筛选,最终通过选拔单一的抗hbs单克隆抗体产生细胞即杂交瘤的克隆,能够获取产生针对目标hbs抗原的单克隆抗体的杂交瘤细胞。
[0339]
[来自杂交瘤的产生抗体的回收]
[0340]
这些杂交瘤细胞株能够使用在rpmi1640中添加10%fbs的培养基在37℃下适当培养。从得到的杂交瘤细胞的培养上清液(100ml~1l左右,根据需要量适当)中纯化抗体并获取。
[0341]
抗hbs抗原单克隆抗体能够通过惯用技术回收,在需要纯化抗体的情况下,能够使用离子交换色谱法、蛋白质a或蛋白质g等的亲和层析法、凝胶色谱法、硫酸铵盐析法等公知的方法进行纯化。
[0342]
[重组抗hbs抗原抗体的制备:产生抗体的b细胞的获取]
[0343]
作为获取抗体的方法,一般进行杂交瘤的制备,但抗体的获取方法有复数种方法,此处使用直接获取对抗原具有结合性的抗体基因的方法。为了获得抗体cdna,从观察到抗体效价的上升的小鼠个体中取出脾脏,用免疫抗原刺激约1
×
10
7
的b细胞群,播种到孔中,从在荧光显微镜下检测到与抗原反应的抗体的孔中回收b细胞(参考文献jin et al.nat.med.(2009)15:1088-1092.)。制备各细胞的rna,使用抗体基因(igg重链和轻链)特异性的引物进行逆转录pcr(rt-pcr)。扩增含有可变区域的cdna。导入含有相同序列的质粒
dna,转化大肠杆菌,制备产生抗体的质粒。将得到的产生抗体的质粒转染到hek293t细胞等,使用含有抗体的培养上清液再次确认与抗原的反应性。仅对于具有抗原反应性的质粒dna确认序列,作为各自的确定抗体cdna。
[0344]
使用bigdye终止剂v3.1(赛默飞世尔科技公司)和cmv启动子用引物,通过热循环仪(biorad)进行反应,通过fast gene dye终止剂去除试剂盒(日本遗传学公司(日本
ジェネティクス
))除去未反应试药后,使用毛细管测序仪(赛默飞世尔科技公司制)进行质粒dna的序列确定。进行同源性检索,将得到的dna序列与以往的dna序列进行比较。
[0345]
glyco-l-hbs抗原免疫的结果是,从识别pres1区域的9个b细胞中成功获得抗体cdna(图20a、b)。
[0346]
[抗体cdna的可变区域序列(pres1)(图20a、b)]
[0347]
图20示出了识别pres1的抗体:igg重链的氨基酸序列(a)、igg轻链的氨基酸序列(b)。根据可变区域的氨基酸序列的比较分为3组。另外,将图20a的06g-aa.seq表示为序列号5,将14g-aa.seq表示为序列号7,将25g-aa.seq表示为序列号9。另外,将图20b的06k-aa.seq表示为序列号6,将14k-aa.seq表示为序列号8,将25k-aa.seq表示为序列号10。
[0348]
从glyco-pres2肽免疫的小鼠脾脏细胞中同样地回收产生抗体的b细胞并制备rna。与免疫源反应的产生抗体的质粒只获得一种(f5克隆#4)。因此,由同时期免疫的另一个体小鼠(f3)的脾脏细胞制备mrna,实施全转录组分析。
[0349]
将glyco-pres2肽免疫的小鼠(f3)脾脏细胞(约1
×
10
7
细胞)离心,用pbs洗涤后回收。使用rneasy plus小型试剂盒(德国凯杰公司(qiagen))制备总rna,用nanodrop(赛默飞世尔科技公司)测定浓度。使用dynabeads mrna direct试剂盒(赛默飞世尔科技公司)纯化mrna,用安捷伦2100生物分析仪进行定量。全转录组用文库使用ion total rna-seq kit v2(赛默飞世尔科技公司)制备。文库使用ion onetouch 2.0系统和ionpgm(赛默飞世尔科技公司)进行扩增分析从而得到序列。序列数据使用clc基因组学工作台(德国凯杰公司(qiagen))进行分析,提取与f5#4克隆具有同源性的序列,得到共有序列(图21)。
[0350]
[抗体cdna的可变区域序列(glyco-pres2、ngs)(图21a、b)]
[0351]
图21示出了(a)glyco-pres2免疫并迅速筛选b细胞而得到的f5克隆#4的igg重链的cdna序列(序列号1)和氨基酸序列(序列号3)(f5#4)。从另一个体小鼠(f3)的脾脏细胞的rna-seq中显示出与f5克隆#4相同的氨基酸序列(f3 rna、f3 rna2)。(b)示出了f5克隆#4的igg轻链的cdna序列(序列号2)和氨基酸序列(序列号4)。
[0352]
与f5克隆#4映射的结果是,在f3mrna中也确认了同源性较高的序列,因此,通过f3血清的酶联免疫吸附试验法确认的活性被认为是与f5克隆#4类似的抗体(图21a、b)。
[0353]
编入表达载体的抗体cdna(重链(g)和轻链(k))通过genelute
tm hp无内毒素质粒大量制备试剂盒(西格玛奥德里奇公司)制备,使用lipofectamine ltx试剂(赛默飞世尔科技公司)转染到hek293t细胞。更换不含蛋白质的培养基,从3天后的培养液中纯化抗体。小鼠igg抗体使用prog珠子回收,通过0.1m甘氨酸(ph2.5)溶出,用3m的tris-cl(ph8.5)中和后,缓冲液更换为pbs。纯化的抗体用12.5%sds-page展开,如上所述通过银染色法确认(图22)。
[0354]
[纯化抗体的电泳图(抗体量的定量)(图22)]
[0355]
图22示出了将使抗体cdna表达而制备的抗体通过sds-page展开和银染色法得到
的结果。对通过glyco-pres2免疫获得的克隆(f5#4)、通过glyco-l-hbs抗原免疫获得的克隆(s1#14)、市售小鼠igg(migg)作为对照进行电泳。
[0356]
[各抗体克隆的识别的抗原表位区域的分析]
[0357]
蛋白质印迹法与上述图16同样地进行。在sds-page还原条件下使用12.5%聚丙烯酰胺凝胶将pres1肽(大肠杆菌)、pres2肽(大肠杆菌)、s-hbs抗原(酵母)、glyco-m-hbs抗原(hek293)、l-hbs抗原(酵母)、hbs抗原(患者血清)进行电泳,转印到pvdf膜。用含有10%脱脂乳的pbs封闭后,在室温下与一次抗体(抗hbs抗原抗体的各克隆)反应1小时。洗涤pvdf膜后,在室温下与二次抗体(0.5μg/ml的hrp标记抗小鼠igg抗体)反应1小时。洗涤这些pvdf膜后,通过免疫印迹检测试药(珀金埃尔默公司)采用化学发光检测(图23)。
[0358]
[免疫印迹(纯化抗体、抗pres1,抗glyco-pres2)(图23)]
[0359]
认为图22所示的通过glyco-l-hbs抗原免疫获得的抗体(s1#14)和通过glyco-pres2免疫获得的抗体(f5#4)分别识别pres1区域(白色)和带有糖链的pres2区域(灰色),未识别s区域(黑色)。关于这些抗体,通过蛋白免疫印迹法检测对于带标记(tag)pres1(大肠杆菌)、带标记(tag)pres2(大肠杆菌)、s-hbs抗原(酵母)、glyco-m-hbs抗原(hek293t)、l-hbs抗原(酵母)、来自患者血清的hbs抗原的反应性。
[0360]
s1#14较强地识别pres1和l-hbs抗原(酵母),来自患者的hbs抗原很少。另一方面,明确了f5#4较强地识别glyco-m-hbs抗原和来自患者的hbs抗原,完全不识别pres2和l-hbs抗原(酵母)。结果与使用免疫后血清的结果(图16和图18)略有不同,认为这是单克隆抗体导致的。
[0361]
为了使基因型c的hbs抗原在肝癌细胞中表达,将编码s-hbs、m-hbs、l-hbs的dna插入表达载体pflag-cmv3(西格玛奥德里奇公司)。由此表达的hbs抗原在n末端结合了flag标记,能够用抗flag抗体进行纯化、检测。使用lipofectamine 2000(赛默飞世尔科技公司)将构建的s-hbs、m-hbs、l-hbs的表达质粒分别转染到肝癌细胞株huh7和plc/prf/5细胞,48小时后,回收培养上清液。培养上清液中含有的hbs抗原使用抗flag m2抗体(西格玛奥德里奇公司)纯化。为了确认f5#4抗体对纯化hbs抗原的反应性,在sds-page还原条件下使用12.5%聚丙烯酰胺凝胶对纯化hbs抗原进行电泳,转录到pvdf膜。用含有10%脱脂乳的pbs封闭后,在室温下使f5#4抗体与作为对照的抗flag抗体反应1小时。洗涤pvdf膜后,在室温下与二次抗体(0.5μg/ml的hrp标记抗小鼠igg抗体)反应1小时。洗涤这些pvdf膜后,通过免疫印迹检测试药(珀金埃尔默公司)采用化学发光检测(图24)。
[0362]
[免疫印迹(纯化f5#4抗体、s、m、l在细胞中的表达)(图24)]
[0363]
在基因型c的hbs抗原(s-、m-、l-)上附上flag标记,使其在肝癌细胞(huh7细胞、plc/prf/5细胞)中表达。在pres1区域(白色)、pres2区域(灰色)、s区域(黑色)上分别结合n型糖链,在m-hbs抗原的pres2区域上主要结合o型糖链(参考图24的上示意图、表3和图7)。使用抗flag抗体的检测显示s-、m-、l-hbs抗原几乎被等量回收(图24下左)。另一方面,纯化的f5#4抗体较强地识别m-hbs抗原,较弱地识别l-hbs抗原。但是,没有识别s-hbs抗原(图24下右)。
[0364]
在患者血清中的l-hbs抗原中,只在很少的pres2中观察到o型糖链的修饰,在huh7细胞和plc/prf/5细胞中观察到差异,因此,认为是这由在各细胞中表达的糖链基因的表达量引起的差异。
[0365]
为了使没有o型糖链的基因型c的m-hbs表达,制备将附加o型糖链结合的苏氨酸37转换为丙氨酸的突变体。设计将苏氨酸密码子(act)的腺嘌呤变更为鸟嘌呤(gct)的引物,通过pcr导入突变。另外,将编码基因型a的m-hbs的dna插入表达载体pflag-cmv3,作为阴性对照使用。hek293细胞的唾液酸缺失细胞(-slc35a1)、半乳糖缺失细胞(-slc35a2)通过使用geneart crispr核酸载体试剂盒(赛默飞世尔科技公司)的基因组编辑在cmp-唾液酸转运体基因(slc35a1)和udp-半乳糖转运体基因(slc35a2)中分别导入非活性型突变来制备。构建在geneart crispr核酸cd4载体上克隆用于导入突变的目标序列(slc35a1:5
’-
tgaacagcatacactaacgagtttt-3
’
(序列号39)、slc35a2:5
’-
gcgtgtccacatactgcaccgtttt-3
’
(序列号40))的质粒,使用lipofectamine 2000(赛默飞世尔科技公司)转染到hek293细胞。24-48小时后,使用cd4富集试剂盒(赛默飞世尔科技公司)筛选导入质粒的细胞,通过有限稀释法分离复数个单克隆。使用分离的单克隆株,用识别唾液酸的sna、malii凝集素进行facs分析,筛选出凝集素信号减少的菌株。从这些细胞中提取基因组dna,用pcr扩增目标部位周边的序列,进行直接测序,确认了在目标位置发生基因组编辑。用上述方法将基因型c的m-hbs、没有o型糖链的基因型c的m-hbs、基因型a的m-hbs转染到这些细胞,如上述图24所示,从培养上清液中纯化各m-hbs,进行蛋白质印迹分析(图25)。
[0366]
[免疫印迹(纯化f5#4抗体、glyco-m在细胞中的表达)(图25)]
[0367]
图25的上示意图示出了在基因型c和基因型a的m-hbs抗原上附上flag标记并使其在hek293细胞、唾液酸缺失细胞(-slc35a1)、半乳糖缺失细胞(-slc35a2)中表达。在基因型c的pres2区域(灰色)结合了o型糖链,但在基因型a的pres2区域没有结合o型糖链。图25的结果示出了在两个苏氨酸(t37和t38)上结合了o型糖链,也使t37突变为丙氨酸的m-hbs抗原表达(t37a)。基因型c(c)和t37a变异(c-o)m-hbs抗原几乎等量回收(用抗flag抗体检测,图25下左)。对于纯化的f5#4抗体,同样地检测了在hek293细胞和唾液酸缺失细胞(-唾液酸)中表达的c和c-o。另一方面,在半乳糖缺失细胞(-半乳糖)中表达的c和c-o在检测量上存在差异,因此认为在f5#4抗体的抗原识别中包括o型糖链中的半乳糖(图25下右)。
[0368]
[使用本发明中得到的抗hbs抗体的抗体-抗体酶联免疫吸附试验测定系统]
[0369]
(使用抗体-抗体酶联免疫吸附试验测定系统检测总hbs分子)
[0370]
也能够使用抗hbs单克隆抗体通过hbs抗原的抗体-抗体酶联免疫吸附试验测定系统进行检测。将建立的抗hbs单克隆抗体分别固相化在酶联免疫吸附试验板上,在检测端能够使用相同的或其他抗hbs抗体对能否用于酶联免疫吸附试验测定系统进行研究。抗体的组合通常在酶联免疫吸附试验板固相化端和检测端(液相侧)均可以使用,通过灵敏度升高的抗体的组合进行检测系统的构建。一般来说,以灵敏度高、背景噪声少的组合进行检测系统的构筑。
[0371]
首先,用pbs将各抗体(固相化用)稀释至4μg/ml,以100μl/孔添加在酶联免疫吸附试验用微板上。在4℃下将各抗体吸附在板上一夜后,废弃溶液,用pbs-t(pbs,0.05%的吐温-20)洗涤孔。接着,以300μl/孔加入封闭液(含3%的bsa的pbs),进行封闭。废弃所述封闭液,洗涤后,向各孔中添加样品(各种hbs抗原、hbv病毒粒子)的溶液100μl。在37℃下反应2小时后,废弃孔中的溶液,用pbs-t洗涤后,将生物素标记抗hbs抗体(r&d生物素化的抗hbs pab cat#baf329)制备成2μg/ml,在室温下反应1小时。接着,废弃溶液并洗涤后,每孔加入100μl辣根过氧化物酶(hrp)标记链霉亲和素(jackson公司)溶液,在室温下反应1小时。废
弃反应液并洗涤后,以450nm的吸光度测定1stepultra tmb基质液(pierce公司)的显色。除了使用单克隆抗体-多克隆抗体(或抗血清)的酶联免疫吸附试验系统检测以外,作为其他组合,除了多克隆抗体以外,也可以使用单克隆抗体。在该情况下,优选以能够检测的组合进行并选择灵敏度更高的组合。
[0372]
根据参考文献(hamada-tsutsumi et al.plos one(2015)10:e0118062.)确认本发明中开发的抗体的抑制hbv感染。
[0373]
hbv感染肝细胞的实验通常在使用人肝癌细胞、小鼠肝细胞的实验中不成立。培养来自人肝细胞的初生细胞或人肝嵌合小鼠的细胞(pxb细胞,凤凰生物公司),通过向培养液中添加hbv,诱导hbv感染。为了进行感染抑制实验,首先将抗体或抗原诱导的血清与hbv混合,使抗体吸附在hbv后添加到细胞中。作为阴性对照,使用小鼠血清、igg,作为阳性对照,使用由现有的疫苗诱导的小鼠抗体、从血清或者人血液中纯化的抗hbs抗体(hbig)等。
[0374]
[抑制hbv感染的实验方法(图26)]
[0375]
图26示出了使用抗体、抗血清的抑制hbv感染实验的方法。使用来自人肝嵌合小鼠的细胞(pxb细胞)、抗体、抗血清、作为感染源的小鼠中扩增的基因型c的hbv。准备hbv使其成为5个基因组/细胞,与抗体、抗血清混合2小时后添加到pxb细胞的培养液中。在接下来的两天洗涤细胞,第8、13、18、23天后回收上清液,测定hbv dna、hbs抗原量。
[0376]
图26的下图:抑制hbv感染实验的示意图。培养肝细胞并添加hbv。在加入的hbv中还包括空颗粒svp(图26左)。s-hbs抗原在svp中表达,疫苗诱导的抗体(抗s)对svp也有反应。另一方面,与svp相比,本发明中的抗体(抗pres2)主要对hbv产生反应,有效地抑制感染。另外,明确了空颗粒的大部分仅由s-hbs抗原构成。
[0377]
通过图26所示的方法将本发明的使用glyco-pres2的f5抗体的抑制hbv感染活性与市售的hbig(来自s抗原接种者的纯化抗体)进行了比较。
[0378]
用sds-page展开2个抗体(f5抗体和hbig),进行银染色,分析抗体的纯度和浓度。使用相同量的抗体进行抑制hbv(基因型c)感染pxb细胞的实验。对于在96孔胶原蛋白涂层板上播种的pxb细胞(7
×
10
4
个细胞/孔),以5geq/细胞(3.5
×
10
5
个拷贝/孔)使hbv致敏。在37℃下将f5抗体或hbig(0-1000ng)和hbv预孵育2小时。然后,在不使用peg的情况下使其感染pxb细胞,比较各抗体的感染抑制效果。在37℃下感染48小时后,除去含有hbv-抗体的培养上清液,置换为新培养基,沿着图26所示的时间轴进行培养。回收感染后第8天和第13天的培养上清液,对存在从感染pxb细胞释放的hbv的培养上清液100μl中的hbv dna进行纯化(与使用木菠萝凝集素分离hbv的方法相同)。与图5b同样地,通过实时定量pcr对培养上清液中的hbv dna量进行定量。
[0379]
[抑制hbv感染实验(hbv dna)(图27)]
[0380]
图27示出了使用pxb细胞和基因型c的hbv的hbv感染实验的结果。将hbv与f5抗体或hbig(0-1000ng)孵育并吸附,并比较抑制感染效果。感染后从肝细胞释放的hbv是通过用实时pcr测定hbv dna来定量的。
[0381]
f5抗体在100ng时也表现出充分的抑制hbv感染,而100ng的hbig时抑制hbv感染不充分(图27)。该结果表明了与母婴传播感染、针刺事故时使用的血液制剂hbig相比,f5抗体具有同等程度以上的抑制效果。即,能够期待作为能诱导本抗体的糖肽的疫苗的效果。
[0382]
以上,本发明提供用于获得能够识别附加糖链的抗原的检查系统、或者能够诱导
能识别附加糖链的抗原的抗体的疫苗、识别附加糖链的抗原并表现出抑制感染效果的中和抗体的技术和产物,以能够广泛地涵盖目前要求解决的上述事例。
[0383]
此外,对本发明的实验方法分别进行说明。
[0384]
[hbv(hbs抗原)的糖链分析]
[0385]
为了分析hbv的包膜蛋白质(l-、m-、s-hbs抗原)中有无糖链、其他翻译后修饰,使用从血清中得到的纯化hbs抗原研究了使用质量分析器的糖蛋白质组学分析法,进行纯化hbs抗原上的糖链附加位置的确定。进一步,利用ms/ms法分析了糖链结构的确定。
[0386]
[新型hbs抗原测定系统的构建]
[0387]
体内的hbv以无感染性(不含核酸)的空颗粒远远多于有感染性(含核酸)的病毒颗粒(称为大球形颗粒)的比例存在,在目前的hbs抗原测定系统中,不能仅准确地测定有感染性的大球形颗粒。另外,分析hbv表面上的hbs抗原,结果表明了接种以往疫苗后建立的抗体群很难对附加糖链的hbs抗原产生反应,可以看出其与隐匿性感染的关联性。因此,根据与来自接种疫苗诱导的b细胞克隆的人抗hbs抗原抗体对于纯化hbs抗原的免疫印迹结果的比较,研究了通过识别糖链的凝集素和抗体的组合检测新型hbs抗原的方法。在本发明中,能够构建大球形颗粒的特定、不受s-hbs抗原上的糖链影响的新的检测系统。
[0388]
[新型hbv dna测定系统的构建]
[0389]
献血的安全性通过实施根据核酸检查(nat)的筛选来确保,但hbv在检出限以下的低拷贝下感染成立,因此,与hcv、hiv相比,输血引起的感染事故不断发生。即,浓缩大球形颗粒的技术对于提高hbv检测的精度是不可或缺的。使用治疗过程、hbv dna的拷贝数、基因型的不同等背景肝不同的hbv感染患者的血清,在大球形颗粒的糖链中使用特异性探针凝集素,从而构建用于测定大球形颗粒量的系统。表明了使用该凝集素探针的大球形颗粒的筛选/浓缩和微量检测系统的有效性。另外,能够开发使用本发明中开发的新型抗体浓缩并测定大球形颗粒量的系统。
[0390]
[受到糖链修饰的hbs抗原的合成/大量纯化]
[0391]
目前,s-hbs抗原作为疫苗使用,没有糖链修饰。为了确定适合作为疫苗的肽或者hbs抗原,首先,进行了pres1、pres2以及s上的糖链附加部位、糖链结构的详细分析,获取疫苗开发的基础信息。制备带糖链的hbs抗原(酵母)\肽(转糖基作用法、酶法)(带糖链的l-hbs、带糖链的m-hbs、pres1肽、pres2肽、带糖链的pres2肽等)。将这些接种(免疫)到小鼠,每经过一段时间采血,通过酶联免疫吸附试验法确认抗体效价的上升,结果成功获得识别hbs抗原的几乎整个区域的血清群。另外,能够确认这些抗原作为提高抗体效价的疫苗(抗原)是有效的。
[0392]
[使用诱导抗hbs抗体的抑制感染效果]
[0393]
由于也确认了抑制效果,因此期待新型疫苗的开发。另外,根据因l-hbs抗原和s-hbs抗原的免疫而上升的抗体效价、抗体群的不同,能得到通过接种法的改良以较少次数获得广范围的抗体的结果。而且,由于从小鼠脾细胞中迅速筛选b细胞并成功克隆了几个抗体cdna,因此,也能够将混合单克隆抗体或中和抗体作为hbig的替代品使用(作为感染事故后的紧急措施使用的药物)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1