核酸检测方法与流程
1.本发明涉及用于检测具有确定序列的核酸的方法及用于该方法的试剂盒和装置。
背景技术:
2.基于聚合酶的核酸序列扩增方法广泛用于分子诊断领域。最成熟的方法聚合酶链反应(pcr)通常涉及每个靶序列使用两个引物,并使用温度循环来在循环指数扩增过程中实现引物退火、dna聚合酶延伸和新合成的dna的变性。进行温度循环的要求使得需要复杂的设备,这限制了基于pcr的方法在某些应用中的使用。
3.链置换扩增(sda)(ep0497272;us5455166;us5712124)是作为pcr的等温替代方法开发的,无需温度循环来在聚合酶扩增过程中实现双链dna的退火和变性,而是用限制酶与链置换聚合酶组合来分开两条dna链。
4.在sda中,在存在一种或多种α-巯基核苷酸的情况下,将每个引物5'端的限制酶位点引入扩增产物中,并且凭借限制酶仅切割其识别位点的半硫代磷酸酯形式的未修饰链的能力,用限制酶在限制位点产生切口。链置换聚合酶延伸每个切口的3'端并置换下游dna链。指数扩增产生自耦合的正义和反义反应,其中从正义反应中置换出的链作为反义反应的靶,且反之亦然。sda通常需要进行1个多小时,这大大限制了其在临床诊断领域的应用潜力。此外,要求分开的过程来进行扩增后产物的特异性检测和起始该反应,也增加了该方法的显著复杂性。
5.maples等人(wo2009/012246)随后使用切口酶进行sda,切口酶是限制酶的一个子类,该酶在与其特异性双链识别序列结合后,仅能切割dna的两条链中的一条。他们将这种方法称为切口和延伸扩增反应(near)。利用切口酶而不是限制酶的near随后也被其他人所利用,他们尝试了使用软件优化的引物(wo2014/164479)和通过温启动或有控制的降温(wo2018/002649)来改进方法。然而,只有极少量的切口酶可得,因此寻找一种对特定应用具有所需性质的酶更具挑战性。
6.使用限制酶或切口酶的sda(near)的一个关键缺点是它产生双链核酸产物,因此不能提供有效检测扩增信号的固有方法。这大大限制了它在例如低成本诊断装置中的应用。所产生的扩增产物的双链性质对将扩增方法耦合到信号检测提出了挑战,因为不首先分离两条链就不可能进行基于杂交的检测。因此,需要更复杂的检测方法,如分子信标和荧光团/猝灭剂探针,这会因要求单独的过程步骤而使测定方案复杂化,并显著降低开发多重测定法的潜力。
7.对于可以克服sda局限性的、可以用于快速、灵敏和特异的核酸序列检测的增强型扩增方法,存在重要的需求。本发明涉及靶核酸序列扩增和检测的方法,除了一对具有5'限制性位点的引物之外,该方法还利用附加的寡核苷酸探针来产生能够允许有效信号检测的检测物种类(detector species)。
8.发明概述
9.本发明提供用于检测样品中具有确定序列的单链靶核酸的存在的方法,其包括:
10.a)使样品与以下接触:
11.i.第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中的第一杂交序列杂交的区域的一条链,并且该第二引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域的一条链;
12.ii.链置换dna聚合酶;
13.iii.dntp;
14.iv.一种或多种修饰的dntp;
15.v.第一限制酶,其不是切口酶,但在第一引物的识别序列和切割位点为双链时能够识别第一引物的识别序列,并仅切割具有切割位点的该第一引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;和
16.vi.第二限制酶,其不是切口酶,但在第二引物的识别序列和切割位点为双链时能够识别第二引物的识别序列,并仅切割具有切割位点的该第二引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;
17.以不经温度循环在该靶核酸的存在下产生扩增产物;
18.b)使步骤a)的扩增产物与以下接触:
19.i.第一寡核苷酸探针,其中所述探针能够与扩增产物内至少一个分子种类中的第一单链检测序列杂交,并且所述探针附着在允许所述探针检测的部分上;和
20.ii.第二寡核苷酸探针,其中所述探针能够与扩增产物内所述至少一个分子种类中的第一单链检测序列上游或下游的第二单链检测序列杂交,并且所述探针附着在固体材料上或允许其附着于固体材料的部分上;
21.其中第一和第二探针与扩增产物内的该至少一个分子种类的杂交产生检测物种类(detector species);和
22.c)检测在步骤b)中产生的检测物种类的存在,其中检测物种类的存在指示该样品中存在靶核酸。
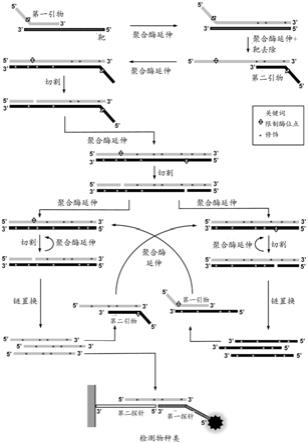
23.图1中显示该方法的实施方案。
24.在多种实施方案中,在存在靶核酸的情况下,该方法快速产生理想地适合于灵敏检测的检测物的许多拷贝。
25.本发明在多种方面优于已知方法,因为除了提供用于有效检测扩增产物的固有方法之外,本发明还包括不经温度循环的快速扩增。
26.本发明的方法克服了sda(包括使用切口酶的sda(near))的主要缺点,即由于扩增产物的双链性质,sda不提供可用于有效检测扩增信号的固有方法。本发明方法通过利用两种附加的寡核苷酸探针,克服了此局限性,所述寡核苷酸探针与扩增产物中的至少一个分子种类杂交,从而利于其快速和特异性检测。这两种附加的寡核苷酸探针(其中第一种附着于允许其检测的部分,其中第二种附着于固体材料或允许其附着于固体材料的部分)的使用,为本发明提供了许多超出已知方法(例如sda)的其他优势。例如,在本发明的实施方案中,其中寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,不能被限制酶切割,并
且在步骤a)进行的同时与样品接触,令人惊讶的是,未观察到显著的对扩增的有害抑制,含有单链区的前体检测物(pre-detector species)可以有效地产生。本发明的这一方面是违反直觉的,因为这样的封闭探针可能被推测将导致不对称扩增,偏向于与包含在前体检测物中的扩增产物链相反的扩增产物链。事实上,该前体检测物可以有效地产生,并且理想地适合于有效的检测,这是因为暴露的单链区易用于其他寡核苷酸探针的杂交。
27.本方法的固有样品检测方法与先前克服sda的这一重要局限性的尝试根本上形成对比,先前的尝试涉及进行“不对称”扩增,例如,通过使用不相等的引物比率,目的是产生一条扩增子链超过另一条扩增子链。本发明方法不需要不对称扩增,也不需要产生一条扩增子链超过另一条扩增子链,相反它集中于产生检测物,随后与第一和第二寡核苷酸探针杂交。涉及产生检查物的本发明方法的该固有样品检测方法,理想地适合于其与核酸侧流(nucleic acid lateral flow)等检测方法的耦合,例如通过将第二探针打印在侧流试纸条上,提供在步骤c)中进行检测的简单、快速和低成本手段。在与核酸侧流耦合时,本发明方法还允许基于附着在侧流试纸条上离散位置的多个第二寡核苷酸探针的差异杂交进行有效多重检测,每个探针具有针对样品中不同靶核酸序列设计的不同序列。在该方法的其他实施方案中,通过使用单链寡核苷酸作为第二寡核苷酸探针中允许将其附着到固体材料的部分,并且将该部分的反向互补序列打印在试纸条上,可以增强侧流检测的效率。此后一种方法还允许优化侧流试纸条,将其制造为跨多个目标应用的单个“通用”检测系统,因为附着到侧流试纸条的序列可以是确定的并且不需要对应于靶核酸的序列。因此,在本发明方法中整合应用两个附加寡核苷酸探针,提供了超过sda(包括使用切口酶的sda(near))的许多优点。
28.由于本发明要求使用非切口酶的限制酶和一种或多种修饰dntp,因此本发明根本上不同于用切口酶进行的sda(near),并且与此类依赖于切口酶的方法相比具有许多其他优点。例如,可获得的非切口酶的限制酶的数量比切口酶的数量多得多,这意味着可从大量潜在酶中选择用于本发明方法中的限制酶,以鉴定对于给定应用,例如反应温度、缓冲液相容性、稳定性和反应速率(灵敏度),具有优异性质的那些酶。由于本方法的这一关键优势,我们已经能够选择比用切口酶所可能达到的最适温度和速率具有更低的最适温度和更快的速率的限制酶。这类限制酶更适合在低成本诊断装置中利用。此外,使用一种或多种修饰dntp的要求是本发明的一个特征,除了使得限制酶仅切割具有其限制位点的一条链外,该特征还提供了重要的优点。例如,某些修饰dntp,如α-巯基dntp,导致它们所掺入到其中的dna的熔解温度(tm)降低,这意味着,与在扩增过程中产生的任何含有修饰dntp的竞争互补链相比,本方法中的寡核苷酸引物和探针对扩增产物中的分子种类具有更高的杂交亲和力。此外,修饰dntp碱基插入引起的扩增产物tm降低,将便于双链dna分子种类的分离,从而增强扩增速率,降低最适温度,并提高灵敏度。备选地,其他修饰dntp可以提高它们所掺入其中的dna的tm,从而提供进一步的机会来针对给定的应用定制该方法的性能。
29.总之,本发明相对于使用限制酶或切口酶(near)的sda的众多优点,由于在已知方法中是不可能的扩增速率提高和扩增信号简单可视化,提供了该方法在低成本、一次性使用诊断装置中的用途。
30.下文更详细地描述本发明的上述方面和其他方面的多种实施方案。
31.附图简述
32.图1.根据本发明的一个方面的方法的示意图。
33.图2.方法示意图,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)中与样品接触。
34.图3.方法步骤b)和c)的示意图,其中允许第二寡核苷酸探针附着到固体材料的部分是单链寡核苷酸。
35.图4.方法步骤a)的部分的示意图,其中在步骤a)中使样品还与第三和第四寡核苷酸引物接触。
36.图5.方法性能,其中第二寡核苷酸探针附着到固体材料硝化纤维素侧流试纸条(参见实施例1)。
37.图6a和6b.方法性能,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)中与样品接触(参见实施例2)。
38.图7a、7b、7c和7d.方法性能,其中在同一样品中检测两种或多种具有确定序列的不同靶核酸(参见实施例3)。
39.图8.方法性能,其中靶核酸中的第一和第二杂交序列由5个碱基分开(参见实施例4)。
40.图9.方法性能,其中允许第二寡核苷酸探针附着到固体材料的部分是抗原,并且相应的抗体附着在固体表面硝化纤维素侧流试纸条(参见实施例5)。
41.图10a和10b.方法性能,其中允许第二寡核苷酸探针附着到固体材料的部分是单链寡核苷酸,其包含三碱基dna序列基序的四个重复拷贝,并且该单链寡核苷酸序列的反向补序列附着在固体材料上(参见实施例6)。
42.图11.方法在检测临床标本中的rna病毒中的应用(参见实施例7)。
43.图12a和12b.不同温度下的方法性能(参见实施例8)。
44.图13a和13b.方法性能,其中通过链侵入(strand invasion)从双链dna衍生靶核酸(参见实施例9)。
45.图14a和14b.本发明方法与已知方法的性能比较(参见实施例10)。
46.发明详述
47.本发明提供用于检测样品中具有确定序列的单链靶核酸的存在的方法。靶核酸可以是单链dna,包括样品中在双链解离(如通过热变性或通过聚合酶的链置换活性)后从双链dna衍生的单链dna,或例如通过逆转录酶的作用从rna衍生的单链dna,或例如通过使用核酸酶(如限制性内切核酸酶或外切核酸酶iii)从双链dna衍生的单链dna,或例如通过诸如核糖核酸酶h的酶从rna/dna杂交体衍生的单链dna。靶核酸可以是通过dna聚合酶、解旋酶或重组酶从样品中的dna衍生的单链dna。双链dna内的单链位点可充分暴露用于第一寡核苷酸引物的杂交和延伸以启动该方法,例如通过“链侵入”,其中在双链dna内发生一个或多个dna碱基对的瞬时开放足以允许第一寡核苷酸引物的杂交和3'羟基的延伸;或通过dna碱基对的自发开放、瞬时转化为hoogsteen对、或通过限制酶或热化学方法产生dna切口。靶核酸可为单链rna,包括在两条链解离(如通过热变性)后从样品中的双链rna衍生的单链rna,或例如通过转录从双链dna衍生的单链rna。
48.本发明方法在步骤a)中涉及使样品与以下接触:(i)第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能
够与靶核酸中的第一杂交序列杂交的区域的一条链,并且该第二引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域的一条链;(ii)链置换dna聚合酶;(iii)dntp;(iv)一种或多种修饰dntp;(v)第一限制酶,其不是切口酶,但在第一引物的识别序列和切割位点为双链时能够识别第一引物的识别序列,并仅切割具有切割位点的该第一引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;和(vi)第二限制酶,其不是切口酶,但在第二引物的识别序列和切割位点为双链时能够识别第二引物的识别序列,并仅切割具有切割位点的该第二引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中。
49.在样品中待检测的靶核酸为双链时,任一条链均可视为本方法的单链靶核酸,因为两个寡核苷酸引物之一能够与一条链杂交,而另一个寡核苷酸引物能够与另一条链杂交。通常,在该方法中使用的寡核苷酸引物是dna引物,其与dna或rna靶标形成双链dna或包含rna和dna链的杂交双链体。然而,也可使用包含其它核酸例如非天然碱基和/或替代骨架结构的引物。
50.在靶核酸存在的情况下,第一寡核苷酸引物与靶核酸中的第一杂交序列杂交。在该杂交之后,第一引物的3'羟基通过链置换dna聚合酶延伸,或者可选地,在rna靶核酸的情况下,通过逆转录酶(例如m-mulv)延伸,以产生包含延伸的第一引物和靶核酸的双链分子种类(参见图1)。链置换dna聚合酶或逆转录酶(当存在时)在该延伸中使用dntp和一种或多种修饰dntp。第一引物5'端的具有限制酶识别序列和切割位点的一条链通常不杂交,因为其反向互补序列通常不存在于靶核酸序列中。因此,第一引物通常用于将具有限制酶识别序列和切割位点的该一条链引入随后的扩增产物分子种类中。第一引物延伸后,进行“靶去除”。通过靶去除,该延伸的第一引物分子种类可允许第二寡核苷酸引物与第二杂交序列的反向互补序列的杂交。在靶核酸为rna时,可通过例如rna的rnase h降解、通过逆转录酶(如果存在)的rnase h活性或通过单独添加该酶来达到靶去除。备选地,在靶核酸是单链dna(包括双链dna中的单链区域)时,可通过使用附加的上游引物或凸点引物(bump primer)通过链置换来达到。备选地,这种靶去除可在自发解离后发生,特别是当仅从给定的靶核酸分子产生短延伸产物时;或者可以通过链侵入发生,其中在双链的延伸第一引物分子种类中发生的一个或多个dna碱基对的瞬时开放足以允许第二寡核苷酸引物的杂交和3'羟基的延伸以及链置换。
51.在第二寡核苷酸引物与第二杂交序列的反向互补序列杂交之后,链置换dna聚合酶使用dntp和一种或多种修饰dntp延伸该引物的3'羟基。第一限制酶的双链限制识别序列和切割位点形成,其中掺入反向互补链中的一种或多种修饰dntp碱基发挥作用,阻断该第一限制酶对该链的切割。第一限制酶识别其识别序列并仅切割第一引物链的切割位点,产生3'羟基,该羟基通过链置换dna聚合酶使用dntp和一种或多种修饰dntp延伸并置换第一引物链。第二限制酶的双链限制识别序列和切割位点形成,其中掺入反向互补链中的一种或多种修饰dntp碱基发挥作用,阻断该第二限制酶对该链的切割。由此产生双链分子种类,在所述分子中两个引物序列并置并且存在第一限制酶和第二限制酶的部分阻断的限制位
点。然后发生第一限制酶对第一引物链和第二限制酶对第二引物链的切割,并且产生两个双链分子种类,一个包含第一引物序列,另一个包含第二引物序列。然后在循环扩增过程中,发生第一引物链和第二引物链的相继切割和置换,其中置换出的第一引物链用作第二引物的靶标,置换出的第二引物链用作第一引物的靶标。
52.在靶核酸的存在下,在无需任何温度循环的情况下产生扩增产物。
53.本发明的一个方面是,在第一和第二寡核苷酸探针二者与扩增产物中的至少一个分子种类特异性杂交之后产生检测物种类,而不是直接检测步骤a)的扩增产物。附着在允许其检测的部分上的第一寡核苷酸探针,与该至少一个分子种类中的第一单链检测序列杂交。附着在固体材料上或允许其附着到固体材料的部分上的第二寡核苷酸探针,与该至少一个分子种类中的第一单链检测序列的上游或下游的第二单链检测序列杂交。
54.参考图1,本领域技术人员明了,扩增产物包含许多不同的分子种类,如包含由第一引物和第二引物二者的全部或部分序列或反向互补序列组成的单链检测序列的分子种类,其中当在靶核酸中引物结合的第一和第二杂交序列被一个或多个碱基分隔开的情况下,这些单链检测序列可以被靶衍生的序列分隔开。进一步可以明了的是,可以选择所述分子种类中的任何一种与第一和第二寡核苷酸探针杂交来形成检测物种类。
55.在步骤c)中检测步骤b)中产生的检测物种类,其中检测物种类的存在指示样品中存在靶核酸。
56.通过利用两个寡核苷酸探针(一个用于检测,一个用于附着到固体材料上),本发明的方法提供了快速而有效的信号检测,其克服了对更复杂的二次检测方法的要求,并且允许对靶标存在时产生的信号进行有效可视化,如通过核酸侧流。
57.可以进行本发明的方法,其中第一和第二寡核苷酸探针之一在3'端封闭而不能通过链置换dna聚合酶延伸,并且不能被第一或第二限制酶切割。因此,根据另一实施方案,本发明提供用于检测样品中具有确定序列的单链靶核酸的存在的方法,其包括:
58.a)使样品与以下接触:
59.i.第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中的第一杂交序列杂交的区域的一条链,并且该第二引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域的一条链;
60.ii.链置换dna聚合酶;
61.iii.dntp;
62.iv.一种或多种修饰dntp;
63.v.第一限制酶,其不是切口酶,但在第一引物的识别序列和切割位点为双链时能够识别第一引物的识别序列,并仅切割具有切割位点的该第一引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;和
64.vi.第二限制酶,其不是切口酶,但在第二引物的识别序列和切割位点为双链时能够识别第二引物的识别序列,并仅切割具有切割位点的该第二引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;
65.以不经温度循环在该靶核酸的存在下产生扩增产物;
66.b)使步骤a)的扩增产物与以下接触:
67.i.第一寡核苷酸探针,所述第一探针能够与扩增产物中的至少一个分子种类中的第一单链检测序列杂交,并且所述第一探针附着在允许其检测的部分上;和
68.ii.第二寡核苷酸探针,所述第二探针能够与扩增产物中的该至少一个分子种类中的该第一单链检测序列上游或下游的第二单链检测序列杂交,并且所述第二探针附着在固体材料上或允许其附着于固体材料的部分上;
69.其中第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,其中第一和第二探针与扩增产物中的该至少一个分子种类的杂交产生检测物种类;和
70.c)检测在步骤b)中产生的检测物种类的存在,其中检测物种类的存在指示该样品中存在靶核酸。
71.在一个实施方案中,该被封闭的一个寡核苷酸探针由于存在一个或多个序列错配和/或一个或多个修饰(例如硫代磷酸酯键),而不能被第一或第二限制酶切割。在另一个实施方案中,该被封闭的一个寡核苷酸探针在步骤a)进行的同时,即在步骤a)进行的过程中接触样品,从而其存在于靶核酸存在时扩增产物产生的过程中。因此,根据另一实施方案,本发明提供用于检测样品中具有确定序列的单链靶核酸的存在的方法,其包括:
72.a)使样品与以下接触:
73.i.第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中的第一杂交序列杂交的区域的一条链,并且该第二引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域的一条链;
74.ii.链置换dna聚合酶;
75.iii.dntp;
76.iv.一种或多种修饰dntp;
77.v.第一限制酶,其不是切口酶,但在第一引物的识别序列和切割位点为双链时能够识别第一引物的识别序列,并仅切割具有切割位点的该第一引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;和
78.vi.第二限制酶,其不是切口酶,但在第二引物的识别序列和切割位点为双链时能够识别第二引物的识别序列,并仅切割具有切割位点的该第二引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;
79.以不经温度循环在该靶核酸的存在下产生扩增产物;
80.b)使步骤a)的扩增产物与以下接触:
81.i.第一寡核苷酸探针,所述第一探针能够与扩增产物中的至少一个分子种类中的第一单链检测序列杂交,并且所述第一探针附着在允许其检测的部分上;和
82.ii.第二寡核苷酸探针,所述第二探针能够与扩增产物中的该至少一个分子种类中的该第一单链检测序列上游或下游的第二单链检测序列杂交,并且所述第二探针附着在
固体材料上或允许其附着于固体材料的部分上;
83.其中第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触,并且其中第一和第二探针与扩增产物中的该至少一个分子种类的杂交产生检测物种类;和
84.c)检测在步骤b)中产生的检测物种类的存在,其中检测物种类的存在指示该样品中存在靶核酸。
85.例如,在图2所示的实施方案中,第一寡核苷酸探针被封闭,并与扩增产物中的至少一个分子种类中的第一单链检测序列杂交,以形成包含单链区域的前体检测物种类。该至少一个分子种类可通过链置换dna聚合酶延伸,延伸其3'羟基,从而进一步稳定该前体检测物种类。因此,在该实施方案中,该封闭的寡核苷酸探针包含附加区域,使得该封闭的寡核苷酸探针所杂交到的扩增产物中的分子种类的3'端可通过链置换dna聚合酶延伸。如图2所示,产生“稳定化的前体检测物种类”。本领域技术人员将理解,该封闭的寡核苷酸探针中的该附加前体检测物种类稳定化区域将位于与扩增产物中的该至少一个分子种类中的第一或第二单链检测序列杂交的区域的上游。在使用该封闭的寡核苷酸探针的实施方案中,可以优化该封闭寡核苷酸探针的杂交序列和引物的相关浓度,使得在每个循环中扩增产物中产生的一定比例的相关分子种类与该封闭寡核苷酸探针杂交,并且该分子种类的其余拷贝仍可参与循环扩增过程。例如,该寡核苷酸探针可以通过使用3'磷酸修饰而被封闭延伸,并且在此实施方案中,还附着到允许其检测的部分,如5'生物素修饰上。备选地,可以使用单独3'修饰用于阻断延伸并作为允许其检测的部分。多种其他修饰可用于封闭寡核苷酸的3'端,如c-3间隔物(c-3spacer);备选地,可利用(一个或多个)错配碱基。前体检测物种类理想地适合于有效检测,因为暴露的单链区域仍可容易地用于与第二寡核苷酸探针杂交。第二寡核苷酸探针可附着于核酸侧流试纸条的硝酸纤维素表面,使得当前体检测物种类流过它时,容易发生序列特异性杂交,并且检测物种类被定位到试纸条上确定的位置。附着在该检测部分上的染料,如附着链霉抗生物素蛋白的碳、金或聚苯乙烯颗粒,可以在核酸侧流试纸条的缀合物垫中或在扩增反应期间存在,其可以基于颜色快速可视化显示是否存在在靶核酸存在下产生的检测物种类。
86.在另一实施方案中,第二寡核苷酸探针在3'端封闭而不能通过链置换dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。该第二寡核苷酸探针可在与样品接触之前附着到固体材料,如电化学探针、96孔板、珠或阵列的表面,或可附着到允许其附着固体材料的部分上。在扩增过程中产生的一定比例的至少一个分子种类在其产生后与该第二寡核苷酸探针杂交,但不与相关反应引物杂交以进一步参与循环扩增过程。在与第二寡核苷酸探针杂交后,该分子种类通过聚合酶在该寡核苷酸探针上延伸以产生稳定化的前体检测物种类。所述第一寡核苷酸探针和检测部分也可在步骤a)进行的同时与样品接触,并且将定位在所述表面的第二寡核苷酸探针的位置处。通过在扩增过程中检测所述检测部分在该位置的累积,将获得实时信号,提供对样品中存在的靶核酸的拷贝数的定量。因此,根据本发明的实施方案,同时进行步骤a)、b)和c)中的两步或更多步。
87.在这些实施方案的实施中,其中第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品
接触,我们没有观察到对扩增速率的任何显著抑制,表明前体检测物种类实时累积而不中断最佳循环扩增过程。这与设计不对称sda的尝试形成对比,在所述sda中旨在通过利用不相等的引物比率以产生一条扩增子链超过另一条链。与试图用封闭的寡核苷酸探针来从反应中去除一条扩增子链从而增加另一条链的比例不同,本发明集中于检测物种类的产生和检测,利用封闭的探针来促进单链区域在扩增过程中的暴露。因此,我们不仅在该实施方案中未观察到对扩增过程的任何抑制作用,而且在某些实施方案中,我们观察到与检测物种类的增加量相对应的所产生信号的令人惊奇的增强,至少为100倍,参见实施例2(图6)。
88.此外,不使用封闭的探针,本发明方法的该实施方案——其中第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸、并且不能被第一或第二限制酶切割、并且在步骤a)进行的同时与样品接触,呈现了优于所报道的在多步骤过程中整合near与核酸侧流的尝试的基本优势。例如,在wo2014/164479中,需要在48℃的30分钟长时间孵育,以便使用核酸侧流来显示扩增产物,这构成一个主要障碍,阻碍了该方法用于护理点诊断装置,特别是低成本或一次性装置。形成鲜明对比的是,本发明的方法可以容易地在5分钟内和较低的孵育温度(例如40-45℃)下实现等同的扩增。在进一步的直接比较研究(参见实施例10)中,与现有技术方法(wo2014/164479)相比,本发明的方法展示了惊人的显著优越的速率,这是由于组合了非切口酶的限制酶的使用、修饰dntp碱基的使用和封闭寡核苷酸探针的使用所导致的。
89.还应理解,第一和第二寡核苷酸探针中的另一个也可以如上文所述,在3'端封闭而不能通过dna聚合酶延伸,和/或不能被第一或第二限制酶切割。
90.该方法的一个方面是使用一种或多种限制酶,该限制酶不是切口酶,但在其识别序列和切割位点为双链时能够识别该识别序列,并仅切割具有该切割位点的一条链,其中反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过链置换dna聚合酶使用一种或多种修饰dntp(例如可以在其通过聚合酶掺入后赋予核酸酶抗性的dntp)而掺入到所述反向互补链中。
[0091]“限制酶”[或“限制性内切核酸酶”]是一类广泛的酶,在结合到特异性识别序列后,在特异性切割位点处在双链核酸分子的一条或两条链上切割一个或多个磷酸二酯键。有大量限制酶可得,已报道超过3000种,市售超过600种,涉及多种不同的理化性质和识别序列特异性。
[0092]“切口酶”(nicking enzyme)[或“切口内切核酸酶”]是限制酶的一个特殊亚类,在结合到特异性识别序列后,它只能在特异性切割位点处切割双链核酸分子的一条链,使另一条链保持完整。只有极少数(c.10)切口酶可用,包括天然存在的酶和改造的酶。切口酶包括底部链切割酶nb.bbvci、nb.bsmi、nb.bsrdi、nb.bsssi和nb.btsi以及顶部链切割酶nt.alwi、nt.bbvci、nt.bsmai、nt.bspqi、nt.bstnbi和nt.cvipii。
[0093]
非切口酶的限制酶(其是本发明的方法中唯一使用的限制酶)尽管能够切割双链核酸的两条链,但在某些情况下,在结合到其识别序列后,也只能切割或切刻该双链dna切割位点的一条链。这可以通过多种方式达到。与本方法特别相关的是,这可以通过如下方式达到:用抗核酸酶抗性修饰(如硫代磷酸酯(pto)、硼磷酸、甲基磷酸或肽核苷酸间键)来修饰双链核酸靶位点的一条链,使得其中一条链上的切割位点的磷酸二酯键得到保护,从而造成双链核酸中的链之一在切割位点处不能被切割。某些经修饰的核苷酸间键,例如pto
键,可在寡核苷酸探针和引物内化学合成,或例如通过使用一种或多种α-巯基修饰的脱氧核苷酸,通过聚合酶整合到双链核酸中。因此,在一个实施方案中,所述一种或多种修饰dntp是α-巯基修饰的dntp。通常,利用s异构体,其可以更有效地掺入并且赋予核酸酶抗性。
[0094]
由于有数量非常多的不是切口酶的限制酶可得,因此,针对方法在给定应用中的使用,可以得到大量具有不同性质的酶用于基于期望性能特征(例如温度曲线、速率、缓冲液相容性、聚合酶交叉相容性、识别序列、热稳定性、可制造性)的筛选。相比之下,只有少量切口酶可用的事实限制了使用切口酶的现有技术方法的潜力,并且可以导致例如较低的反应速率(灵敏度、得到结果的时间)和较高的反应温度。选择用于本发明方法的非切口酶的限制酶可以是天然存在的酶或改造的酶。
[0095]
在选择不是切口酶的限制酶用于本发明方法中时,本领域技术人员将认识到,有必要鉴定具有适当切割位点的酶,以确保在正确位置掺入修饰来阻断相关链的切割而不阻断另一链的切割。例如,在其中使用修饰dntp(如α-巯基dntp)的实施方案中,可能优选的是,选择具有位于识别序列之外的切割位点的限制酶,如具有非回文识别序列的不对称限制酶,以便提供足够的灵活性来放置引物,使得靶核酸序列在适当位置包含修饰核苷酸碱基以在所述修饰并入后阻断相关链的切割。例如,如果使用α-巯基datp,则相关寡核苷酸引物中的限制酶切割位点的反向互补序列将在该反向互补链中的该切割位置下游包含腺苷碱基,但在引物序列中的该切割位点下游不包含腺苷碱基,以确保引物在该方法的进行中被适当地切割。因此,在其识别序列之外切割的具有非回文识别序列的不对称限制酶理想地适合用于在本发明。也可使用在其识别位点内切割的识别部分或简并回文序列的限制酶。抗核酸酶的抗性核苷酸连接修饰,例如pto,可用于阻断一系列多种不同类别的市售双链切割试剂对一链的切割,包括具有部分或简并回文和不对称限制识别序列的iis型和iig型限制酶,这使得可以将这些酶用于本发明的方法。
[0096]
在本发明方法中,限制酶(一种或多种)通常以0.1-100单位的量使用,其中一个单位定义为在给定温度(例如37℃)下在50μl的总反应体积中在1小时内消化1μg t7 dna所需的试剂量。然而,该量取决于许多因素,如所选酶的活性、酶的浓度和形式、靶核酸的预期浓度、反应体积、引物浓度和反应温度,该量不应视为以任何方式限构成限制。本领域技术人员将理解,在方法中使用的限制酶将需要合适的缓冲液和盐,例如二价金属离子(用于有效和高效的功能)、ph控制和酶的稳定化。
[0097]
在一个实施方案中,第一和第二限制酶是相同的限制酶。通过仅使用单种限制酶,方法在许多方面得到简化。例如,仅需要鉴定与其他反应组分相容的单一一种酶,针对方法性能进行优化、制造和稳定化。利用单种限制酶也简化了寡核苷酸引物的设计,并支持扩增过程的对称性。
[0098]
在本发明方法中,限制酶仅切割核酸双链体的一条链,因此在切割之后,它们呈现暴露的3'羟基,其可作为聚合酶的有效启动位点。聚合酶是一种酶,它通过延伸引物并利用碱基配对相互作用产生dna或rna模板链的反向互补“拷贝”来合成核酸链或聚合物。在实施方法中使用了具有链置换能力的聚合酶,以便适当地置换链来影响扩增过程。术语“链置换”是指聚合酶在合成过程中置换所遇到的下游dna的能力。一系列在不同温度下操作的具有链置换能力的聚合酶已被表征并可在市场上买到。例如,phi29聚合酶具有非常强的链置换能力。来自芽孢杆菌物种的聚合酶,如bst-dna聚合酶大片段,通常表现出高的链置换活
性,并且非常适合用于本发明方法。大肠杆菌(e.coli)klenow片段(exo-)是另一种广泛应用的链置换聚合酶。链置换聚合酶可以容易地改造,例如klentaq,如通过仅克隆内源性酶的相关活性聚合酶结构域和敲除任何外切核酸酶活性。对于进行其中单链靶核酸为rna的方法,还需要rna依赖性dna合成(逆转录酶)活性,该活性可由步骤a)中链置换聚合酶和/或单独的附加逆转录酶(例如m-mulv或amv)执行。
[0099]
在方法的相关步骤中通常以适当量使用聚合酶,其取决于酶、试剂浓度和所希望的反应温度而优化。例如,可以使用0.1-100单位的芽孢杆菌聚合酶,其中一个单位定义为在65℃下30分钟内将25nmol dntp掺入酸不溶性物质中的酶的量。然而,该量取决于许多因素,如聚合酶的活性、其浓度和形式、靶核酸的预期浓度、反应体积、寡核苷酸引物的数量和浓度以及反应温度,并且不应视为以任何方式构成限制。
[0100]
本领域技术人员将知道,聚合酶需要dntp单体以具有聚合酶活性,并且还需要含有诸如缓冲盐、二价离子和稳定剂等的组分的适当缓冲液。此外,在方法中使用一种或多种修饰dntp以在通过链置换聚合酶掺入该修饰dntp后阻断引物的反向互补链的切割。通常,在使用单一修饰dntp时,在方法中使用的dntp应省略掉该相应的碱基。例如,在其中修饰dntp为α-巯基datp的实施方案中,dntp应仅包括dttp、dctp和dgtp,且不应包括datp。去除相应的天然dntp碱基可确保引物的反向互补序列内所需的底链切割位点均被封闭,因为只有修饰碱基可用于通过聚合酶掺入,然而完全或部分去除相应的天然dntp碱基并不是必需的。dntp通常可在与其它聚合酶方法中所用浓度相似的浓度下用于本发明方法,如浓度范围为10微摩尔到1毫摩尔,但本发明方法的dntp浓度可针对任何给定的酶和试剂进行优化,以使活性最大化并使从头合成最小化,以避免产生背景信号。考虑到某些聚合酶用一种或多种修饰dntp碱基可显示较低的掺入速率,该一种或多种修饰碱基可以按比未修饰的dntp更高的相对浓度(如在高5倍的浓度下)用于该方法,但这不应视为构成限制。
[0101]
一种或多种修饰dntp的使用是本发明的一个必要特征,除了使得限制酶仅切割其限制性位点的一条链之外,还提供了重要的优势。例如,某些修饰dntp,如α-巯基dntp,导致其并入的dna的熔解温度(tm)降低,这意味着在该方法中使用的寡核苷酸引物和探针可以比扩增过程中产生的任何竞争的修饰dntp互补链对扩增产物内的分子种类具有更大的杂交亲和力。这一关键特征增强了扩增速率,这是因为:例如,在置换链之一与其反向补序列杂交产生“非生产性”终点分子种类时,由于一个或多个修饰碱基的存在导致杂交的tm降低,该分子种类将比该置换链与另一引物的“生产性”杂交更容易解离。据报道,硫代磷酸酯核苷酸间键可以降低tm(即双链体的正好一半单链杂交的温度),每添加一个硫代磷酸酯核苷酸间键导致tm降低1-3℃,这是理化性质的实质性变化。我们还观察到,在dna序列中存在硫代磷酸酯核苷酸键时,链置换的速率增强。此外,方法中使用的寡核苷酸探针(无论是在实施步骤a)的同时或是之后与样品接触),与任何竞争性修饰分子种类相比,都对扩增产物内的那些分子种类具有更高的亲和力,因此可以优先杂交或甚至置换杂交链以促进检测物种类的产生。扩增产物分子种类因其所含的修饰核苷酸间键而具有降低的tm和增强的置换,这在根本上增强了本发明方法的速率并降低了发生快速扩增所需的温度。
[0102]
除了由于使用一种或多种修饰核苷酸而导致的速率增强之外,本发明方法的寡核苷酸引物和探针的杂交特异性也增强。鉴于通常在扩增产物内一种特定核苷酸的所有碱基都被取代,引物和探针的杂交位点通常包含修饰碱基,而例如由硫代磷酸酯核苷酸间键引
起的tm降低意味着来自非特异性杂交的序列错配不太可能被耐受。
[0103]
因此,本发明方法使用一种或多种修饰dntp的该必要特征导致增强扩增的灵敏度和特异性的根本益处,并且与不需要修饰核苷酸的已知方法形成鲜明对比,如near(wo2009/012246),包括使用软件优化引物(wo2014/164479)或温启动或有控制的降温(wo2018/002649)的near变型。
[0104]
存在许多不同的修饰dntp,例如在其通过聚合酶掺入后赋予核酸酶抗性的修饰dntp,其可用于本发明方法中以达到对限制酶切割的抵抗,并且在一些实施方案中,赋予其它特征以针对给定应用增强方法的性能。除了提供抗核酸酶抗性和降低tm的α-巯基dntp外,据报道具有聚合酶掺入潜能并赋予核酸酶抗性的修饰dntp还包括等同的核苷酸衍生物,如硼烷衍生物、2'-o-甲基(2'ome)修饰的碱基和2'-氟碱基。可通过聚合酶掺入并在方法的实施方案中用于增强方法特定性质的其他修饰dntp或等同化合物,包括降低结合亲和力的那些,例如肌苷-5'-三磷酸或2'-脱氧泽布拉林(zebularine)-5'-三磷酸,提高结合特异性的那些,例如5-甲基-2'-脱氧胞苷-5'-三磷酸盐或5-[(3-吲哚基)丙酰胺-n-烯丙基]-2'-脱氧尿苷-5'-三磷酸,以及增强gc富集区合成的那些,例如7-脱氮-dgtp。某些修饰可以提高tm,从而在方法的实施方案中提供控制杂交事件的进一步潜力。
[0105]
步骤a)、b)和c)可在广泛的温度范围内进行。每个步骤的最佳温度由相关聚合酶和限制酶的最适温度以及寡核苷酸引物杂交区域的熔解温度决定。值得注意的是,方法在步骤a)中不使用温度循环。此外,扩增步骤a)不需要任何受控的温度振荡,也不需要任何温启动或热启动、预热或受控降温。本发明方法允许在较宽的温度范围内进行这些步骤,例如15℃到60℃,如20℃到60℃,或15℃到45℃。根据一个实施方案,步骤a)在不超过50℃或在约50℃的温度下进行。鉴于可用于该方法中的非切口酶的限制酶的范围很广,与使用切口酶的备选方法相比,可选择出在相对较低的温度下具有快速率的限制酶。一种或多种修饰核苷酸的使用也降低了所需的扩增温度。除了与已知方法相比具有较低最适温度特征的可能性之外,本发明的方法可以在异常宽的温度范围内进行。此类特征对于在低成本诊断装置中使用本发明方法具有高度吸引力,对于此类装置,受控加热构成复杂的物理约束,将使得此类装置的商品成本增加以致于一次性或无仪器装置在商业上是不可行的。使用本发明方法已经了一系列测定法,其可以在例如环境温度或大约37℃下进行靶核酸的快速检测。因此,在另一实施方案中,步骤a)在不超过45℃或约45℃的温度下执行。为了简化用户步骤和减少产生结果的总时间,优选在低于目标温度的温度下启动该方法。因此,在该方法的另一实施方案中,步骤a)的温度在扩增期间升高。例如,该方法的温度可在环境温度(如20℃)下开始,并在一段时间(如2分钟)内升高到最终温度(如约45℃或50℃)。在一个实施方案中,温度在步骤a)实施期间升高,如从环境起始温度(如在15-30℃范围内)升高到40-50℃范围内的温度。
[0106]
本发明方法的低温潜能和多功能性意味着,与已知方法相比,它与一系列其他测定所需的条件兼容,如用于检测其他生物标记物(如蛋白质或小分子)的免疫测定或酶学测定。因此,本发明方法可用于例如同时检测样品内的目的核酸和蛋白质或小分子。进行该方法所需的组分,包括不是切口酶的限制酶、链置换dna聚合酶、寡核苷酸引物、寡核苷酸探针、dntp和一种或多种修饰dntp,可冻干或冷冻干燥以稳定储存,然后可通过再水化触发反应,如在加入样品时。这种用于稳定储存的冻干或冷冻干燥通常需要在干燥组分之前添加
一种或多种赋形剂,如海藻糖。已知非常广泛范围的用于冻干或冷冻干燥的此类赋形剂和稳定剂,其可用于测试中以鉴定实施方法所需的组分的适宜组成。
[0107]
对本领域技术人员而言显而易见的是,本发明的方法是基于聚合酶的扩增方法,可通过添加一种或多种如下添加剂来增强,所述添加剂已经被证实可增强pcr或其它基于聚合酶的扩增方法。此类添加剂包括但不限于四氢噻吩1-氧化物、l-赖氨酸游离碱、l-精氨酸、甘氨酸、组氨酸、5-氨基戊酸、1,5-二氨基-2-甲基戊烷、n,n
′-
二异丙基乙二胺、四亚甲基二胺(temed)、四甲基氯化铵、四甲基氧化铵、甲基砜乙酰胺、十六烷基三甲基溴化铵、甜菜碱醛、四乙基氯化铵、(3-羧丙基)三甲基氯化铵、四丁基氯化铵、四丙基氯化铵、甲酰胺、二甲基甲酰胺(dmf)、n-甲基甲酰胺、n-甲基乙酰胺、n,n-二甲基乙酰胺、l-苏氨酸、n,n-二甲基乙二胺、2-吡咯烷酮,hep(n-羟乙基吡咯烷酮)、nmp(n-甲基吡咯烷酮)和1-甲基、1-环己基-2-吡咯烷酮(吡咯烷酮类)、δ-戊内酰胺、n-甲基丁二酰亚胺、1-甲酰基吡咯烷、4-甲酰基吗啉、dmso、环丁砜、海藻糖、甘油、吐温-20、dmso、甜菜碱和bsa。
[0108]
我们的研究揭示,本方法在宽范围的靶核酸水平内有效,包括检测低到非常低,甚至单个的拷贝数。通常以大大超过靶核酸的量提供寡核苷酸引物。通常,每种引物的浓度在10至200nm范围内,但这应视为非限制性的。较高的引物浓度可以提高杂交效率,从而提高反应速率。然而,在高浓度下也可以观察到非特异性背景效应,如引物二聚体,因此第一和第二寡核苷酸引物的浓度构成利用方法的任何给定测定的优化过程的一部分。在一个实施方案中,以相同浓度提供第一和第二寡核苷酸引物。在备选实施方案中,提供第一和第二寡核苷酸引物之一超过另一个。在提供一个引物的量超过另一个的实施方案中,由于循环扩增过程的天然对称性,反应速率可降低,然而,在某些情况下,它可用于减少方法中的非特异性背景信号和/或增强第一和第二寡核苷酸探针杂交产生检测物种类的能力。期望的是,在产生足够的检测物种类以供使用所选择的检测手段检测之前,两个引物都以不构成限制的水平存在。
[0109]
用于进行本发明方法的寡核苷酸引物的设计有多个考虑因素。第一和第二寡核苷酸引物中的每一个都必须在5'到3'方向上包含具有限制酶识别序列和切割位点以及杂交区域的一条链,其中在第一引物,该杂交区域能够与靶核酸中的第一杂交区域杂交,在第二引物的情况下,该杂交区域能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交。由此设计一对引物来扩增靶核酸的区域。这些引物的限制酶识别序列通常不存在于靶核酸序列内,因此在引入扩增子之前在初始杂交事件期间形成突出端(参见图1)。在使用不对称限制酶的情况下,切割位点通常位于识别序列的下游,因此可以可选地存在于引物的杂交序列内。
[0110]
设计寡核苷酸引物,使得其在本发明方法中被切割后,切割位点的5
′
序列形成具有足够熔解温度(tm)的上游引物,以在期望的反应条件下保持与其反向互补链杂交,并在通过链置换dna聚合酶延伸3'羟基后置换切割位点下游的链。因此,可以在寡核苷酸引物的5'端包含附加的“稳定化”区域,其最适长度由相关限制酶的切割位点相对于识别序列的位置和其他因素(如将用于步骤a)中扩增的温度)决定。因此,在一个实施方案中,第一和/或第二寡核苷酸引物在限制酶识别序列和切割位点上游(如在5'端)包含(长度为例如5或6个碱基的)稳定化序列。
[0111]
在引物设计过程中,有必要确定每个杂交区域的序列和长度,以允许最佳的序列
特异性杂交和链置换,从而确保方法中的特异性和灵敏性扩增。可以改变引物在待检测的靶核酸内(例如在病毒或细菌病原体的基因组内)的定位,以确定引物杂交区域的序列,从而选择具有最佳扩增灵敏度和特异性以及与寡核苷酸探针的相容性的引物。因此,可以筛选不同的引物对,以鉴定进行该方法的最佳序列和定位。通常,这样设计引物杂交区域的长度,使得其理论tm允许在所希望的反应温度下有效杂交,但在切割后也容易置换。在引物设计过程中,在可能的反应温度和所选择的限制酶的背景下考虑杂交序列的理论tm和置换链的序列,将其与序列长度增加可导致的源于序列的结合特异性的理论改进进行平衡。我们的多种研究表明,在方法有效使用的引物的设计上可以具有相当多的变化性。在一个实施方案中,第一和/或第二寡核苷酸引物的杂交区域长度在6到30个碱基例如9到16个碱基之间。在其他实施方案中,可在引物的杂交区域中使用修饰,如非天然碱基和替代的核苷酸间键或无碱基位点,以精细化其性质和方法在特定应用中的功能性。例如,增强tm的修饰,如pna、lna或g-clamp,可允许较短且更特异的引物杂交区域,从而允许扩增子较短并由此增强扩增速率。
[0112]
我们的多种研究揭示,可通过具有短扩增子来增强方法的速率及其灵敏度,因此在某些实施方案中,可优选的是,缩短两个引物的总长度(包括其杂交序列),并确定引物位置以使靶核酸中的第一和第二杂交序列之间仅具有短间隔,如10或15个核苷酸碱基或更少。在一个实施方案中,靶核酸中的第一和第二杂交序列由0到15个或0到6个碱基分开,在某些实施方案中,它们由3到15个或3到6个碱基分开,例如5、7或11个碱基。在另一实施方案中,杂交序列重叠例如1到2个碱基。
[0113]
在本发明方法中使用的寡核苷酸探针序列的设计有多个考虑因素。首先,通常这样设计第一寡核苷酸探针中与第一单链检测序列杂交的区域和第二寡核苷酸探针中与第二单链检测序列杂交的区域,使得它们不重叠或具有最小重叠,以允许两个寡核苷酸探针同时结合到扩增产物中的至少一个分子种类上。通常还将它们设计为主要杂交到如下序列上,所述序列位于扩增产物分子种类的一条链的切割位点的位置和其反向互补链上的切割位点相对的位置之间,以确保有效靶向扩增产物内的一个或多个分子种类,并且两个寡核苷酸探针都结合到同一条链。对于任何给定的引物对,可选择任一条链作为寡核苷酸探针的靶。鉴于寡核苷酸探针在方法中通常不通过聚合酶延伸,基于扩增产物中分子种类的相关序列(所述序列确定其tm、%gc)和获得的实验性能数据,设计杂交序列。在一个实施方案中,第一和第二寡核苷酸探针的杂交序列为9到20个核苷酸碱基长。在其中靶核酸中的第一和第二杂交序列由0个碱基分开的实施方案中,寡核苷酸探针之一的杂交区域的序列可以对应于寡核苷酸引物之一,而另一个寡核苷酸探针的杂交区域将对应于另一个寡核苷酸引物的反向互补序列。然而,可以截短杂交序列的长度,以优化用于方法的期望实施方案的寡核苷酸探针的性质,并且在步骤b)的全部或部分与步骤a)同时进行的情况下避免任何抑制效应。在第一或第二寡核苷酸探针包含第一或第二限制酶的识别序列和切割位点并且该寡核苷酸探针在步骤a)实施的同时与样品接触的情况下,通常封闭该探针内的切割位点,例如,通过在探针的化学合成期间包含经修饰的核苷酸间键,例如硫代磷酸酯键,或引入错配以去除该识别序列。除了杂交区域之外,对于寡核苷酸探针的序列以及它们可以包含的任何修饰的核苷酸碱基、核苷酸键或其他修饰而言,可以具有相当多的变化性。可化学插入寡核苷酸中以改变其性质且可用于方法实施方案的修饰碱基(如2-氨基-da、5-甲基-dc、
super2-氟碱基及g钳)提供tm的增加,而其它如iso-dc及iso-g可增强结合特异性而不增加tm。其他修饰如肌苷或无碱基位点可降低结合的特异性。已知赋予核酸酶抗性的修饰包括反向dt(inverted dt)和ddt以及c3间隔序列。在方法的实施方案中,修饰可增加或降低tm并提供控制杂交事件的潜力。在寡核苷酸探针的杂交区域内使用修饰碱基提供了改善寡核苷酸探针的性能的机会,例如增强其结合亲和力而不增加杂交区域的长度。在一个实施方案中,一个或两个寡核苷酸探针内的修饰碱基允许它们比扩增产物内与相关单链检测序列互补的任何分子种类都更有效地杂交,从而竞争胜出。
[0114]
在其中第一和第二寡核苷酸探针之一在3'端封闭而不能延伸并且不能被切割并且在进行步骤a)的同时与样品接触的实施方案中,典型地,该一个寡核苷酸探针将包含附加的5'区域,其为前体检测物种类的稳定化提供了机会(参见图2)。在一个实施方案中,该一个寡核苷酸探针包含寡核苷酸引物之一的确却序列,但在3'端包含阻断其通过链置换dna聚合酶延伸的修饰和封闭限制酶切割位点的单一硫代磷酸酯核苷酸间键。这样的实施方案简化了测定设计并确保不引入可导致非特异性背景扩增的附加序列基序。
[0115]
产生检测物种类的第一和第二寡核苷酸探针优选以这样的水平提供,其中所产生的检测物种类的拷贝数充分高于用于该检测物种类的检测手段的检测限,以容易地检测到。此外,第一和/或第二寡核苷酸探针的杂交效率受其浓度的影响。通常,在进行步骤a)的同时与样品接触的寡核苷酸探针的浓度可类似于寡核苷酸引物的浓度,例如10至200nm,但这不应视为限制性的。在一个实施方案中,提供一个或两个寡核苷酸探针的浓度超过一个或两个寡核苷酸引物的浓度,而在另一个实施方案中,提供一个或两个寡核苷酸探针的浓度低于一个或两个寡核苷酸引物的浓度。在进行扩增步骤a)之后使一个或两个寡核苷酸探针与样品接触的情况下,根据需要可允许更高的浓度以达到最有效的杂交,而无需考虑可导致对扩增步骤a)的抑制。
[0116]
杂交序列是用于进行本发明方法的寡核苷酸引物和寡核苷酸探针的关键特征。杂交是指序列特异性杂交,即寡核苷酸引物或探针通过每个核酸序列中互补碱基之间的氢键碱基配对,与靶核酸或扩增产物中的分子种类结合的能力。典型的碱基配对是腺嘌呤-胸腺嘧啶(a-t),或在rna或rna/dna杂交双链体的情况下是腺嘌呤-尿嘧啶,以及胞嘧啶-鸟嘌呤(c-g),但也已知具有特定的结合偏好的一系列天然和非天然的核酸碱基类似物。此外,在本发明中,寡核苷酸探针或引物的互补区域无需在序列上包含完全天然的核酸碱基、并与其在靶核酸或扩增产物的分子种类中的杂交序列完全和确切的互补;相反,对于本发明方法的性能而言,寡核苷酸探针/引物只需要能够与它们的靶杂交序列进行序列特异性杂交,足以形成该方法正确执行功能(包括通过限制酶切割和通过链置换dna聚合酶延伸)所需的双链序列即可。因此,这种杂交可以没有精确的互补性,也可以具有非天然碱基或无碱基位点。在一个实施方案中,方法中使用的寡核苷酸引物或寡核苷酸探针的杂交区域可具有与靶核酸或扩增产物的分子种类或其反向互补序列(视情况而定)的相关区域的序列的完全互补性。在其他实施方案中,存在一个或多个非互补碱基对。在某些情况下,在该方法中使用寡核苷酸引物和/或探针的混合物可能是有利的。因此,举例来说,在包含具有两个多态性位置的单核苷酸多态性(snp)位点的靶核酸的情况下,可采用在该位置不同的寡核苷酸引物和寡核苷酸探针的1:1混合物(每个组分与各自的snp碱基具有互补性)。在寡核苷酸的制备过程中,常规做法是在合成过程中随机化一个或多个碱基。
[0117]
本领域技术人员将理解,涉及聚合酶的扩增过程可能遭受非特异性背景扩增,如由从头合成和/或引物-引物结合产生的背景扩增。在将扩增子的长度设计为尽可能短时(例如通过最小化引物的杂交序列、靶核酸中第一和第二杂交序列之间的间隔以及任何稳定化区域的长度,达到可以但仍在给定反应温度下保持功能的程度),本发明的方法通常表现出更快速的扩增。对于较短的扩增子,由于寡核苷酸引物提供产生扩增产物分子种类所必需的所有序列,非特异性背景可能加剧。在以非靶标特异性方式产生包含通过从头合成dna或引物-引物结合而“连接”的第一寡核苷酸引物和第二寡核苷酸引物的扩增子的情况下,方法中可出现假阳性结果。通过在本方法中使用两个寡核苷酸探针,可以允许该方法的多种实施方案涵盖附加特征,以最小化非靶标特异性背景信号的任何可能性。在这方面,通过使用两个寡核苷酸探针而可行的此类实施方案呈现出相对于已知方法的实质性优势。
[0118]
一种方式是分隔开靶核酸中的第一和第二杂交序列,以使用方法的寡核苷酸探针提供基于靶标的序列特异性检查。因此,在一个实施方案中,靶核酸中的第一和第二杂交序列由3到15个碱基或3到6个碱基(例如5、7或11个碱基)分开。引物之间的这种间隔提供了最佳大小的间隔,以在保持短扩增子的增强速率的同时,允许对扩增产物内的分子种类进行附加的特异性检查。因此,在一个实施方案中,在步骤b)中,扩增产物内的至少一个分子种类中的第一或第二单链检测序列包括对应于所述3至15个或3至6个碱基的序列的至少3个碱基。例如,我们已经证明了区分特异性靶标依赖性扩增产物和非靶标特异性背景扩增产物的潜力,如实施例4(图8)中所示。
[0119]
在一个备选的方式中,降低第一和/或第二寡核苷酸引物的浓度,以降低因从头扩增和引物-引物结合产生背景的可能性。为了确保扩增速率的保持,可以使用在3'端封闭而不能通过链置换dna聚合酶延伸的附加寡核苷酸引物。在本实施方案中,虽然未封闭的第一和第二寡核苷酸引物可有足够浓度用于初始杂交和延伸事件以从靶核酸产生扩增子,但随后的扩增用优选以更高浓度提供的封闭引物进行,其中封闭引物的切割发生在其延伸和链置换之前,以去除3'封闭修饰并允许扩增过程在不受损害的情况下进行(参见图4)。因此,在一个实施方案中,在步骤a)中样品还与以下接触:(a)第三寡核苷酸引物,该第三寡核苷酸引物在5'至3'方向上包含具有第一限制酶的识别序列和切割位点以及能够与靶核酸中的第一杂交序列杂交的区域的一条链,其中该第三引物在3'端封闭而不能通过dna聚合酶延伸;和/或(b)第四寡核苷酸引物,该第四引物在5'至3'方向上包含具有第二限制酶的识别序列和切割位点以及能够与靶序列中的第二杂交序列的反向互补序列杂交的区域的一条链,其中该第四引物在3'端封闭而不能通过dna聚合酶延伸。在另一实施方案中,第三寡核苷酸引物,如果存在,则以超过第一寡核苷酸引物的量提供;并且,第四寡核苷酸引物,如果存在,则以超过第二寡核苷酸引物的量提供。通过实质性地降低第一和第二寡核苷酸引物的浓度(被第三和第四寡核苷酸引物的存在所补偿),获得在去除非靶标依赖性背景扩增方面的最大潜在益处。除了存在阻断聚合酶延伸的3'修饰之外,第三和第四引物适用第一和第二引物所采用的相同设计参数,其中所述3'修饰可以在寡核苷酸引物合成期间通过例如使用3'磷酸或c-3修饰而容易达到。
[0120]
如上文所述提供增强的特异性和去除背景扩增的本发明方法的实施方案,可以改善序列验证的严格性,允许在不损失特异性的情况下进行低温反应,和/或增加多重检测,其中可以进行多个反应以同时检测多个靶标。这种严格的特异性的好处还意味着,该方法
可以耐受广泛的温度范围和次优条件(例如试剂浓度),而不丧失特异性。例如,我们在所有组分浓度增加或减少20%的情况下进行了该方法,并且在每种情况下,我们在进行步骤a)中的扩增后在环境温度下保持了相当长的一段时间,没有观察到任何特异性损失。因此,这类实施方案代表了本发明的方法相对于已知方法的重要优势,并且意味着它理想地适合于在低成本和/或一次性诊断装置中利用。
[0121]
步骤c)中检测物种类的检测可以通过任何技术来完成,该技术可以从样品中存在的其他试剂和组分中区别性检测检测物种类的存在。备选地,可以从一个或多个反应组分(例如第一或第二寡核苷酸探针)的耗尽来推断检测物种类的存在或水平。在可用于检测该检测物种类的各种理化技术中,本发明优选使用能够产生如下灵敏信号的技术,其中所述信号仅在第一寡核苷酸探针和第二寡核苷酸探针与扩增产物的相关分子种类杂交之后才存在。对本领域技术人员而言显而易见的是,存在一系列比色或荧光染料,其可容易地附着到第一寡核苷酸探针上并形成其检测的基础,所述检测可以是目测的、或使用诸如吸光度或荧光光谱的仪器。
[0122]
因此,在一个实施方案中,允许检测第一寡核苷酸探针的部分是比色或荧光染料或能够附着比色或荧光染料的部分如生物素。
[0123]
采用比色染料的方法的实施方案的优势是不需要仪器来执行荧光激发和检测,并且潜在地允许通过目测来确定靶核酸的存在。比色检测可以通过在第一寡核苷酸探针用于本方法之前将比色染料或能够附着比色染料的部分直接连接到第一寡核苷酸探针上来达到,或者可以通过在切割后将所述染料或部分特异地附着或结合到探针片段上来达到。例如,第一寡核苷酸探针可包含生物素部分,该生物素部分将允许其结合到链霉抗生物素蛋白缀合的比色染料上以用于其后续检测。可用于检测的比色染料的一个这样的例子是金纳米颗粒。可以使用类似的方法以及大量其他固有的比色部分,大多数的这些比色部分是已知的,如碳纳米颗粒、银纳米颗粒、氧化铁纳米颗粒、聚苯乙烯小球、量子点等。高消光系数染料也提供在该方法中进行灵敏的实时定量的潜力。
[0124]
在为给定的应用选择合适的染料时,要考虑多个因素。例如,在打算在溶液中进行可见比色检测的实施方案中,通常有利的是选择较大尺寸的颗粒和/或具有较高消光系数的颗粒以便于检测,而对于并入侧流膜用于可见检测的实施方案,可能将得益于较小尺寸的颗粒更快地沿膜扩散的能力。虽然可以获得多种尺寸和形状的金纳米颗粒,但是也可以获得许多其他有意义的比色部分,包括聚苯乙烯或基于乳胶的微球/纳米颗粒。这种性质的颗粒也有多种颜色,可用于在本发明实施过程中标记和区别性地检测不同的检测物种类,或在检测反应中产生“多重”的比色信号。
[0125]
荧光检测可以通过使用任何可以在适当的激发刺激下发出荧光信号从而导致随后对检测物种类的检测的染料来实现。例如,用于直接荧光检测的染料包括但不限于:量子点、alexa染料、荧光素、atto染料、罗丹明和得克萨斯红。在使用附着到寡核苷酸探针的荧光染料部分的方法的实施方案中,还可基于荧光共振能量转移(fret)进行检测,如在用于核酸检测的taqman定量pcr或基于分子信标的策略中使用,由此在染料附着到检测物种类后信号会增加或减少。通常,在使用荧光测量方法时,可以使用许多不同的检测装置来记录荧光信号的产生,例如ccd相机、荧光扫描仪、基于荧光的微板读数仪或荧光显微镜。
[0126]
在另一实施方案中,允许检测第一寡核苷酸探针的部分是在与底物接触后产生可
检测信号(如比色或荧光信号)的酶。对本领域技术人员而言显而易见的是,有许多酶-底物系统可得,并且常规地使用在诊断领域,如在elisa和免疫组织化学检测中。辣根过氧化物酶(hrp)就是一个实例。在步骤c)中,利用附着到第一寡核苷酸探针的酶来检测该检测物种类提供了许多潜在的优势,例如通过涉及添加底物的单独步骤来提高检测灵敏度和增加对信号产生的控制。其他合适的比色酶可包括:糖基水解酶、肽酶或淀粉酶、酯酶(例如羧基酯酶)、糖苷酶(例如半乳糖苷酶)和磷酸酶(例如碱性磷酸酶)。该列表不应视为以任何方式构成限制。
[0127]
在另一种方法中,步骤c)中检测物种类的存在通过电检测,如通过在检测物种类存在的情况下阻抗的变化或电导、安培、伏安或电位信号的变化来检测。因此,在一个实施方案中,通过电信号的变化来检测检测物种类。电信号变化可由允许检测第一寡核苷酸探针的部分促进,如导致电信号变化增强的化学基团。由于电信号检测可以是如此敏感,该检测部分可以仅仅是寡核苷酸序列,但在某些实施方案中,通过存在已知增强电信号的化学基团如金属(如金)和碳来增强信号。
[0128]
虽然在一个实施方案中,可在扩增期间在水性反应中检测由于检测物种类的累积而导致的电信号变化,但在其他实施方案中,通过将检测物种类定位到特定位置(如电化学探针的表面)以进行其检测来促进电信号检测,其中该定位由第二寡核苷酸探针介导。
[0129]
常规用于检测核酸(如检测物种类)并且也可以用于本发明方法中的其他检测技术包括:质谱(如maldi或lc-tof)、发光光谱或光谱分析、荧光光谱或光谱分析、液相色谱和荧光偏振。
[0130]
在一个实施方案中,步骤c)使用碳或金(优选碳)产生比色或电化学信号。
[0131]
在一个实施方案中,通过核酸侧流检测该检测物种类。核酸侧流(其中核酸通过其扩散通过通常由硝酸纤维素制成的膜而与其他反应组分分离)是一种快速且低成本的检测方法,能够与一系列信号读出耦合,包括比色、荧光和电信号。核酸侧流非常适合用于本发明方法中检测物种类的检测,并且提供了许多优势。在一个实施方案中,进行核酸侧流检测,其中检测物种类中的第一寡核苷酸探针用于附着比色或荧光染料,检测物种类中的第二寡核苷酸探针用于将该染料定位到侧流条上确定的位置。通过这种方式,可以进行快速检测,通过肉眼或读出仪器读取结果。核酸侧流可以使用抗原作为第二寡核苷酸探针中的检测部分,相关抗体固定在侧流条上。或者,在本方法中,可以通过前体检测物种类或检测物种类杂交到侧流条上,容易地进行序列特异性检测,提供具有改进的多重检测潜力的、对基于抗体的测定的简单、低成本替代方案。不使用本发明方法的两个寡核苷酸探针的已知方法如sda,通常产生不能用于基于序列特异性杂交检测的双链dna产物。与之不同,在本发明方法中,使用基于位置特异性杂交的检测,检测物种类特别适合于多重检测。碳或金纳米颗粒可容易地用于核酸侧流。检测物种类的定位导致碳或金的局部集中,分别导致出现黑色或红色。在一个实施方案中,第一寡核苷酸探针包含允许其在通过序列特异性杂交定位于试纸条上之前与比色染料结合的部分,例如生物素。
[0132]
因为允许例如检测物种类基于杂交结合在特定位置,检测物种类的空间定位与用于检测该检测物种类的技术密切相关。除了有助于快速和特异性检测之外,这种物理附着可以增强本发明方法在多重检测多种不同靶核酸中的用途。在一个实施方案中,第二寡核苷酸探针附着在核酸侧流条上或电化学探针、96孔板、小球的表面或阵列表面上。因此,扩
增产物内的至少一个分子种类会定位于第二寡核苷酸探针的物理位置,在此位置形成检测物种类之后可以容易地进行检测。备选地,有利的是,使用单链寡核苷酸作为附着到第二寡核苷酸探针的部分,其允许第二寡核苷酸探针附着到固体材料上。这样,固相附着的寡核苷酸的序列可以独立于靶核酸序列来定义,以增强结合效率。因此,在一个实施方案中,允许第二寡核苷酸探针附着到固体材料的部分是单链寡核苷酸。该单链寡核苷酸可设计为具有改进的亲和力和杂交效率,以增强方法的性能。例如,在方法的某些实施方案中,不是将第二寡核苷酸探针直接附着到侧流条,而是采用具有针对侧流条上杂交优化的序列的分开的寡核苷酸,其能够与第二寡核苷酸探针内存在的单链寡核苷酸部分有效杂交。
[0133]
在多种研究中,我们通过核酸侧流,使用单链寡核苷酸作为第二寡核苷酸探针的附着部分(这允许增强侧流条的杂交序列),显著增强了方法的性能。例如,可以使用富含g-c的序列来进行侧流条上杂交,或者可以使用具有较高tm的较长序列来补充第二寡核苷酸探针的长度。或者,该单链寡核苷酸部分可包含一个或多个修饰碱基或核苷酸间键以增强其亲和力,如pna、lna或g-钳(g-clamp)。我们已经观察到,在单链寡核苷酸部分中使用重复序列基序时,观察到杂交效率的惊人增强,这是其预测的tm所不能预测的。因此,在一个实施方案中,单链寡核苷酸部分的序列包含2到4个碱基dna序列基序的三个或更多个重复拷贝。例如,在采用这种序列基序的多种研究中,我们观察到通过核酸侧流的检测灵敏度显著增强,通常具有100倍或更高的信号增强。
[0134]
因此,在其中通过核酸侧流检测所述检测物种类的存在的实施方案中,核酸侧流可以利用一种或多种核酸,所述核酸能够与允许第二寡核苷酸探针附着到固体材料的部分进行序列特异性杂交。
[0135]
通过将靶核酸序列与用于附着的固体材料或与检测手段解偶联(这可以通过使用单链寡核苷酸作为第一寡核苷酸探针内的检测部分和/或第二寡核苷酸探针的附着部分来实现),可以赋予另一个优势。这样,可以优化和定义用于附着的相关固体材料或包含该固体材料的装置,如核酸侧流条和/或检测手段,而无需考虑待检测的靶核酸的序列。这种“通用”检测装置可以在不同的应用和靶标之间使用,而无需改变。例如,可独立于用于检测多个靶核酸序列的方法的寡核苷酸引物和探针的开发,来定义、优化和有效制造这样的核酸侧流条,所述的测流条具有与能够实现有效的侧流条上杂交且无意外串扰的一组兼容寡核苷酸序列相对应的打印线。
[0136]
在许多实施方案中,可以以定量方式进行检测。因此,可在步骤c)中定量样品中单链靶核酸的水平。定量可以例如,通过在反应时程中在多个时间点而不是在单个终点、通过比色法、荧光法或电学方法测量检测物种类来达到。定量的替代策略包括样品的系列稀释,类似于液滴数字pcr。在另一实施方案中,可半定量测定样品中单链靶核酸的水平。例如,核酸侧流条上的比色信号强度将对应于样品中单链靶核酸的近似水平。或者,可以使用抑制剂,其中单链核酸靶标的拷贝数必须超过某个确定的拷贝数来克服抑制剂并产生检测物种类的可检测拷贝数。
[0137]
在本发明的方法中,第二寡核苷酸探针附着在固体材料上或附着在允许其附着到固体材料的部分上。可选地,在一些实施方案中,一个或多个其他寡核苷酸引物和探针也可附着在固体材料或允许其附着到固体材料的部分上。对本领域技术人员而言显而易见的是,寡核苷酸与固体材料的附着可以以多种不同的方式来达到。例如,可获得许多不同的固
体材料,其已经或可以以足够密度的官能团附着或官能化,以用于连接适当修饰的寡核苷酸探针或与所述寡核苷酸探针反应的目的。此外,这类固体材料的形状、尺寸和形式多种多样,包括小球、树脂、表面包被的平板、载玻片和毛细管。用于共价附着寡核苷酸的此类固体材料的实例包括但不限于:载玻片、玻璃小球、铁氧体芯聚合物包被的磁性微球、二氧化硅微粒或磁性二氧化硅微粒、基于二氧化硅的毛细管、3d反应性聚合物载玻片、微孔板、聚苯乙烯小球、聚乳酸(pla)颗粒、聚甲基丙烯酸甲酯(pmma)微粒、控孔玻璃树脂、氧化石墨烯表面和官能化琼脂糖或聚丙烯酰胺表面。诸如聚丙烯酰胺的聚合物具有进一步的优势,即在用于产生聚合物的单体(例如丙烯酰胺单体)之间的聚合反应期间,可以共价连接官能化的寡核苷酸。在聚合反应中包括官能化的寡核苷酸以产生包含共价连接的寡核苷酸的固体聚合物。这种聚合是一种将寡核苷酸附着到固体材料上的高效手段,并可以控制所产生的附着寡核苷酸的固体材料的大小、形状和形式。
[0138]
通常,为了将寡核苷酸探针附着到任何此类固体材料上,可以合成在3'或5'端带有官能团的寡核苷酸;但官能团也可在寡核苷酸的生产过程中添加到几乎任何的碱基位置上。然后可在寡核苷酸的官能团与相关固体材料上的官能团之间进行特异性反应以形成稳定的共价键,从而导致寡核苷酸附着到固体材料。通常,这种寡核苷酸通过5'或3'端附着到固体材料上。举例来说,两种常用且可靠的附着化学利用巯基(sh)或胺(nh3)基团和寡核苷酸中的该官能团。巯基可与固体支持物上的马来酰亚胺部分反应以形成硫酯键,而胺可与丁二酰亚胺酯(nhs酯)修饰的羧酸反应以形成酰胺键。许多其他化学物质也可以使用。除了寡核苷酸探针与固体材料的化学缀合之外,在固体材料上直接合成寡核苷酸探针以用于进行本发明方法,是可能的并且潜在有利的。
[0139]
在其他实施方案中,第二寡核苷酸探针附着在允许其附着到固体材料的部分上。一种策略是采用亲和结合的方法,其中允许特异性结合的部分可以附着在寡核苷酸探针上,以促进其附着到相关亲和配体。这可以例如使用抗体-抗原结合或亲和标签(例如聚组氨酸标签)来进行,或者通过使用基于核酸的杂交来进行,其中互补核酸附着到固体材料,例如硝酸纤维素核酸侧流条。示例性的此类部分是生物素,其能够与链霉抗生物素蛋白或亲和素高亲和力结合,而链霉抗生物素蛋白或亲和素本身附着于小球或另一固体表面。
[0140]
可在同一样品中检测两种或多种不同的具有确定序列的靶核酸的存在。在该方法的一个实施方案中,对两种或多种靶核酸中的每一种使用不同的寡核苷酸引物和寡核苷酸探针进行一系列分开的步骤a)、b)和c),这些分开的步骤可以同时进行。例如,在一个实施方案中,一组寡核苷酸引物和寡核苷酸探针将用于检测样品中的一种靶核酸,另一组寡核苷酸引物和寡核苷酸探针将用于检测同一样品中的另一种靶核酸。从两组或多组不同的引物/探针产生的检测物种类的检测可各自偶联特定信号,如不同的比色或荧光染料或酶,以允许多重检测。或者,多重检测可以通过将第二寡核苷酸探针直接或间接地(通过允许其附着到固体材料的部分)附着在固体材料上来达到。这种方法利用从不同系列的步骤a)、b)和c)产生的检测物种类的物理分离,而不是依赖于不同的检测手段。因此,例如,可在核酸侧流上使用单一染料来检测多种不同的靶核酸,其中产生的每种不同的检测物种类定位于侧流条的特定印刷线上,并且其中与第二寡核苷酸探针的直接或间接的基于序列的杂交形成差异检测的基础。或者,可以使用电检测阵列,其中多种不同的第二寡核苷酸探针附着在阵列的特定区域上,因此在同时产生多种不同的检测物种类的多重反应中,每个检测物种类
可以通过杂交到阵列的离散区域而定位,从而允许多重检测。
[0141]
前述检测过程,如核酸侧流和电检测,以及它们能够容易地检测在同一样品内的多种不同靶核酸的能力,是由本发明方法对两个寡核苷酸探针的内在要求所实现的。因此,它们有力地证明了本发明方法相对于已知方法的优势。
[0142]
本发明对于需要检测样品中具有确定序列的靶核酸的多种领域和应用具有广泛的实用性。它代表了一种快速、廉价和方便的测定样品内靶核酸序列的存在的手段。作为非限制性应用的例子,我们设想本发明在诸如以下的领域具有价值:诊断学、法医学、农业、动物健康、环境、国防、人类遗传检测、产前检测、血液污染筛查、药物基因组学或药代动力学和微生物学、临床和生物医学研究。适宜地,样品是生物样品,如人类样品。该样品可以是人类样品、法医样品、农业样品、兽医样品、环境样品或生物防御样品。
[0143]
靶核酸的检测可用于疾病或病态的诊断、预后或监测,如感染性疾病,包括但不限于hiv、流感、rsv、鼻病毒、诺如病毒、结核病、hpv、脑膜炎、肝炎、mrsa、埃博拉、艰难梭菌、epstein-barr病毒、疟疾、鼠疫、脊髓灰质炎、衣原体、疱疹、淋病、麻疹、腮腺炎、风疹、霍乱或天花,或癌症,包括但不限于结直肠癌、肺癌、乳腺癌、胰腺癌、前列腺癌、肝癌、膀胱癌、白血病、食管癌、卵巢癌、肾癌、胃癌或黑色素瘤,或用于人类遗传检测、产前检测、血液污染筛查、药物遗传学或药代动力学领域。
[0144]
本发明适用于多种样品类型,例如:鼻拭子或抽吸物、鼻咽拭子或抽吸物、咽喉拭子或抽吸物、面颊拭子或抽吸物、血液或源自血液的样品、尿液或源自尿液的样品、痰或源自痰的样品、粪便或源自粪便的样品、脑脊液(csf)或源自csf的样品、胃液或源自胃液的样品、源自任何形式组织活检物或体液的人或动物样品。我们已经在广泛的样品中进行了本发明方法,包括至少10-20%的以下临床样品:vtm中的鼻拭子、vtm中的鼻咽拭子、thinprep media、液体amies中的喉拭子、m4介质中的hsv疮拭子(sore swab)、滑液、2m naoh/异丙醇处理后经dna捕获珠处理的痰、te中的直肠拭子、经均化和dna捕获珠处理的粪便样品、csf、aptima拭子、羊水、液体amies中的口腔拭子、尿液、te中的vre拭子、胸腔液、全血、k2edta血浆、l.heparin血浆和血清。这些实验证明了本发明方法对不同临床应用具有显著通用性并在相关样品中未观察到抑制作用。这与受生物样品中的抑制剂(如抑制pcr的肝素和植酸)抑制的其他方法形成鲜明对比,因此证明了可以在低成本或一次性装置中使用本发明方法而不需要任何复杂的样品制备程序。
[0145]
靶核酸可以是(a)病毒或源自病毒的核酸材料,(b)细菌或源自细菌的核酸材料,(c)从癌细胞释放的循环无细胞dna,(d)从胎儿细胞释放的循环无细胞dna,或(e)micro rna或源自micro rna,等。
[0146]
用于本发明方法的单链靶核酸可以是天然存在的或非天然存在的。靶核酸可原位产生或在进行方法之前从天然存在的核酸产生。可通过在步骤a)之前或与步骤a)同时进行的一个或多个附加步骤来制备用于方法的单链靶核酸,所述附加步骤可包括一种或多种酶,如聚合酶和限制酶。以这种方式产生用于方法的靶核酸具有许多潜在优势,如允许更高度多重化的测定和/或克服从头背景。例如,在步骤a)中的扩增之前,可在不进行扩增的情况下进行生物样品中核酸材料的高特异性转化。例如,可以对样品进行处理、纯化、更换缓冲液、进行外显子组捕获、部分去除污染物质、和/或转化为用于本发明方法的包含一种或多种修饰dntp的单链靶核酸。当待检测样品中的“真实”靶核酸以可靠的转换率(可以为<1:
1、1:1或1:>1,即可能地带有某些扩增元素)转换为“替代”靶核酸用于本发明方法时,则检测“替代”靶核酸将允许检测和/或定量“真实”的核酸。此外,通过以这种方式从天然存在的靶标产生替代靶标,可以特定方式产生用于本发明方法的具有任何期望序列的靶核酸。在单链靶核酸源自双链dna(在两条链解离后,例如通过链侵入)的实施方案中,存在两个互补的单链核酸靶标,其可以通过相同的寡核苷酸引物和探针在对应过程中扩增和检测。在靶标为负链单链rna病毒的基因组时,正链转录本也可存在于样品中,并且任一链或两条链均可以在使用相同寡核苷酸引物和探针的本发明方法中作为单链靶核酸被扩增和检测。
[0147]
还设想本发明可以用于样品中筛选无细胞dna和表观遗传修饰(例如dna序列的cpg甲基化)。特定癌症相关靶基因的这种表观遗传修饰可以作为许多疾病和病态的有用生物标记物。鉴于人们越来越认识到表观遗传修饰在人类疾病中的重要性,本发明可以基于链置换dna聚合酶和/或限制酶的差异活性,用于特异性评估特定靶核酸生物标记物的表观遗传修饰。因此,在一个实施方案中,靶核酸包含表观遗传修饰如甲基化的位点。或者,如上所述,用于产生实施本发明方法的“替代”靶核酸的“真实”核酸可以包含表观遗传修饰的位点。
[0148]
本发明的另一方面涉及用于检测样品中具有确定序列的核酸的试剂盒。因此,本发明还提供试剂盒,其包含:
[0149]
a)第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含限制酶识别序列和切割位点以及能够与具有确定序列的单链靶核酸中的第一杂交序列杂交的区域,并且该第二引物在5'至3'方向上包含限制酶识别序列和切割位点以及能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域;
[0150]
b)第一限制酶,其不是切口酶,能够识别第一引物的识别序列并切割第一引物的切割位点;以及第二限制酶,其不是切口酶,能够识别第二引物的识别序列并切割第二引物的切割位点;
[0151]
c)链置换dna聚合酶;
[0152]
d)dntp;
[0153]
e)一种或多种修饰dntp;
[0154]
f)第一寡核苷酸探针,其能够与在该靶核酸存在下产生的扩增产物中的至少一个分子种类中的第一单链检测序列杂交,并且附着在允许其检测的部分上;和
[0155]
g)第二寡核苷酸探针,其能够与扩增产物中该至少一个分子种类中的第一单链检测序列上游或下游的第二单链检测序列杂交,并且附着在固体材料上或允许其附着于固体材料的部分上。
[0156]
在一个实施方案中,试剂盒的第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,例如,由于存在一个或多个序列错配和/或一个或多个修饰,如硫代磷酸酯键。
[0157]
在一个实施方案中,试剂盒的第一和第二寡核苷酸探针之一具有5个或更多个与第一或第二引物的杂交区域或杂交区域的反向互补序列互补的碱基。
[0158]
在另一个实施方案中,试剂盒的第一寡核苷酸探针与第一和第二寡核苷酸引物之一的杂交区域具有一些互补性,例如5个或更多个碱基的互补性,和/或试剂盒的第二寡核苷酸探针与第一和第二寡核苷酸引物之另一的杂交区域的反向互补序列具有一些互补性,
例如5个或更多个碱基的互补性。
[0159]
在进一步的实施方案中,第一和/或第二寡核苷酸探针可与如上所述的靶核酸中的第一和第二杂交序列之间的间隔具有一些互补性或反向互补性。
[0160]
试剂盒还可包含逆转录酶。
[0161]
试剂盒还可包括检测在目标核酸存在的情况下产生的检测物种类的存在的手段。例如,试剂盒可另外包括核酸侧流条、电化学探针、96孔板、小球或阵列表面、和/或比色或荧光染料、和/或用于检测电信号变化的装置、和/或碳或金。
[0162]
在多种实施方案中,靶核酸和试剂盒的组分,如包含在试剂盒中的第一寡核苷酸引物和/或第二寡核苷酸引物和/或第一限制酶和/或第二限制酶和/或dna聚合酶和/或dntp和/或一种或多种修饰dntp和/或第一寡核苷酸探针和/或第二寡核苷酸探针和/或扩增产物内的至少一个分子种类中的第一或第二单链检测序列,如本文针对本发明方法中所定义。例如,试剂盒可包含本文所述的此类组分的特征的任何组合,例如但不限于以下:第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,其中可选地所述不能切割是由于存在一个或多个序列错配和/或一个或多个修饰,例如硫代磷酸酯键;第一限制酶和第二限制酶是相同的限制酶;一种或多种修饰dntp是α-巯基修饰的dntp;允许检测第一寡核苷酸探针的部分是比色或荧光染料或能够附着比色或荧光染料的部分如生物素;允许第二寡核苷酸探针附着到固体材料的部分是单链寡核苷酸,可选地,其包含2到4个碱基的dna序列基序的三个或更多个重复拷贝;第一和第二寡核苷酸引物在限制酶识别序列和切割位点上游,如在5'端,包含例如长度为5或6个碱基的稳定化序列;第一和/或第二寡核苷酸引物的杂交区域长度在6到30个碱基之间,例如9到16碱基;并且靶核酸中的第一和第二杂交序列由0到15个或0到6个碱基分开,在某些实施方案中,它们由3到15个或3到6个碱基,例如5、7或11个碱基分开,或者它们重叠如1到2个碱基。
[0163]
试剂盒可包括检测在存在靶核酸的情况下产生的检测物种类的存在的手段,如核酸侧流条。在另一个实施方案中,试剂盒另外包含如本文所定义的第三和/或第四寡核苷酸引物。
[0164]
试剂盒还可包括试剂,如反应缓冲剂、盐(例如二价金属离子)、添加剂和赋形剂。
[0165]
本发明的试剂盒可以与用于实施本发明方法的说明书一起提供。
[0166]
本发明还提供本发明的试剂盒在检测样品中具有确定序列的单链靶核酸中的用途。
[0167]
应当理解,本文中描述的关于本发明方法的所有可选和/或优选的发明实施方案也适用于本发明的试剂盒及其用途,反之亦然。
[0168]
如前所述,本发明的方法和试剂盒理想地适合在装置诸如一次性诊断装置中使用。因此,本发明还提供了包含如上所述试剂盒的装置,尤其是其中所述试剂盒包括了检测在存在靶核酸的情况下产生的检测物种类的存在的手段,如核酸侧流条。该装置可以是动力装置,例如电动装置,该装置还可以包括加热手段并且可以是自洽装置,即不需要辅助测试仪器的装置。
[0169]
本发明的方法也可独立于检测步骤c)用于扩增来自具有确定序列的靶核酸的核酸信号,例如,可以使用这样的方法,其中将扩增的信号存储和/或传输以根据需要在未来
日期和/或替代位置检测靶核酸。所述扩增的信号包括通过实施方法产生的前体检测物种类或检测物种类。因此,在另一个实施方案中,本发明提供了扩增来自样品中具有确定序列的靶核酸的核酸信号的方法,其包括本发明方法的步骤a)和步骤b)的全部或部分,例如部分i.或ii.。
[0170]
本发明还提供本发明的试剂盒在如上所定义的扩增来自具有确定序列的靶核酸的核酸信号中的用途。
[0171]
应理解,本文中描述的、与用于检测样品中具有确定序列的靶核酸的存在的本发明方法有关的所有可选和/或优选的发明实施方案,也适用于扩增来自具有确定序列的靶核酸的核酸信号的方法。
[0172]
以下实施例用于进一步举例说明本文所述方法的多个方面和实施方案。这些实施例不应视为有任何限制。
实施例
[0173]
材料和方法
[0174]
除非另有说明,在以下实施例中使用以下材料和方法。
[0175]
寡核苷酸:除非另有说明,定制寡核苷酸由integrated dna technologies用亚磷酰胺法制备。
[0176]
核酸侧流:碳纳米颗粒通过非共价吸附缀合到多种生物素结合蛋白,例如链霉抗生物素蛋白。通常,在硼酸盐缓冲液中制备胶体碳悬浮液,然后使用探头超声仪进行超声处理。随后通过在室温下孵育使碳吸附到生物素结合蛋白上。碳要么直接用于反应混合物,要么应用于玻璃纤维缀合物垫。按照厂家的指南,通过将含有冻干糖和用于改善外观的添加剂的缀合物垫与样品垫、硝酸纤维素膜和吸附垫(merck millipore)组合,来构建侧流条。在将其用于侧流条之前,将含有待在本发明方法中检测的序列的反向互补序列的相关寡核苷酸印刷在硝酸纤维素膜上的确定位置上,并通过uv交联而附着在膜上。
[0177]
实施例1
[0178]
其中第二寡核苷酸探针附着在固体材料硝酸纤维侧流条上的方法的性能
[0179]
此实施例展示方法的性能,其中第二寡核苷酸探针附着在固体材料硝化纤维素侧流条上,并且第一寡核苷酸探针不在扩增步骤a)进行的同时与样品接触。
[0180]
设计了总长度为24个碱基的第一寡核苷酸引物,其在5
′
到3
′
方向上包含:7碱基的稳定化区;不是切口酶的限制酶的5碱基识别序列;以及12碱基杂交区域,其包含靶核酸中第一杂交序列的反向互补序列。第二寡核苷酸引物设计为包含相同的稳定化区和限制酶识别序列,但具有能够与靶核酸中的第二杂交序列的反向互补序列杂交的12碱基杂交区域。在本实施例中,第一限制酶和第二限制酶是相同的限制酶。该限制酶是不对称双链切割限制酶,具有在其5碱基识别序列下游的顶部链切割位点。靶核酸中的第一和第二杂交序列由1个碱基分开。
[0181]
寡核苷酸引物是利用靶核酸设计的,使得在引物的反向互补序列中切割位点下游的核苷酸碱基是腺苷,从而在该方法中采用α-巯基datp作为修饰dntp。通过链置换聚合酶插入硫代磷酸酯修饰以阻断该反向互补链的切割。
[0182]
设计总长度为20个碱基的第一寡核苷酸探针,其在5'至3'方向上包含:与扩增产
物中的至少一个分子种类互补的12碱基区;6碱基中性间隔区;以及在合成期间添加的3'生物素修饰,其中该生物素修饰允许第一寡核苷酸探针附着到比色染料碳纳米颗粒上。制备吸附在生物素结合蛋白上的碳,并用第一寡核苷酸探针饱和。总长度为49个碱基的第二寡核苷酸探针设计为在5'至3'方向上包含:含有10个胸腺嘧啶核苷碱基的中性间隔区;能够与扩增产物中的该至少一个分子种类中的第一单链检测序列下游的第二单链检测序列杂交的13碱基区的3个重复。将约30pmol的该第二寡核苷酸探针打印在核酸流动条上。
[0183]
制备包含以下的反应:1.6pmol第一引物;0.1pmol第二引物;250μm 2'-脱氧腺苷-5'-o-(1-硫代三磷酸)sp异构体(sp-datp-α-s),来自enzo life sciences;各60μm的dttp、dctp和dgtp;2u限制酶;2u芽孢杆菌链置换dna聚合酶。将核酸靶标(单链dna靶标)以多种水平(++=1amol,+=10zmol,ntc=无靶标对照)添加到10μl总反应体积的适当反应缓冲液中。将反应在45℃下孵育7分钟或10分钟。然后将6.5μl终止的反应混合物加到60μl含有0.056mg ml-1
缀合碳的侧流缓冲液中,然后上样到第二寡核苷酸探针附着在其打印线中的核酸侧流条上。
[0184]
图5显示了在进行此实施例时获得的侧流条的照片。箭头指示第二寡核苷酸探针已经打印在硝酸纤维素条上并因此出现阳性信号的位置。在两个靶标水平和两个时间点,都仅在存在靶核酸的情况下观察到对应于碳信号存在的清晰黑线,表明本发明的方法快速且灵敏地检测到靶核酸序列。
[0185]
实施例2
[0186]
其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸并且不能被第一或第二限制酶切割并且在步骤a)中与样品接触的方法的性能
[0187]
此实施例展示了方法的实施方案的性能,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。在此实施方案中,我们没有观察到对扩增速率的任何显著抑制,表明前体检测物种类实时累积,没有干扰最佳循环扩增过程。我们不仅没有在该实施方案中观察到对扩增过程的任何抑制效应,而且我们还观察到与检测物种类的增加量相对应的所产生信号的令人惊奇的增强,至少为100倍。
[0188]
实施例2.1:利用方法的该实施方案设计了实施例1中所用测定法的变型形式,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。使用与实施例1中相同的寡核苷酸引物、限制酶、dntp、修饰dntp和聚合酶,但是,设计了总长度为21个碱基的替代第一寡核苷酸探针,其在5'到3'方向上包含:5'生物素修饰;8碱基中性区;能够与扩增产物中的至少一个分子种类杂交的13碱基区;以及3'磷酸修饰,其中该生物素修饰允许第一寡核苷酸探针附着到比色染料碳纳米颗粒上,并且该磷酸修饰阻断其通过链置换dna聚合酶延伸。制备吸附在生物素结合蛋白上的碳,并用第一寡核苷酸探针饱和。
[0189]
设计总长度为51个碱基的替代第二寡核苷酸探针,其在5'至3'方向上包含:能够与扩增产物中的该至少一个分子种类中的第一单链检测序列上游的第二个单链检测序列杂交的14碱基区域;6碱基中性间隔区序列;14碱基杂交区域的重复序列;第二6碱基中性间隔区序列;和10个胸腺嘧啶核苷碱基间隔区。将约30pmol的该第二寡核苷酸探针打印在核酸流动条上。
[0190]
制备包含以下的反应:0.8pmol第一引物;0.8pmol第二引物;0.6pmol第一寡核苷酸探针;300μm sp-datp-α-s;各60μm的dttp、dctp和dgtp;2u限制酶;2u芽孢杆菌链置换dna聚合酶。将核酸靶标(单链dna靶标)以多种水平(++=1amol,+=10zmol,ntc=无靶标对照)添加到10μl总反应体积的适当反应缓冲液中。反应在45℃下孵育6分钟。然后将5μl终止的反应混合物加到60μl含有0.03mg ml-1
缀合碳的侧流运行缓冲液中,然后上样到核酸侧流条上。进行对照反应,以证明在反应期间不存在第一寡核苷酸探针的情况下不产生检测物种类。在步骤a)之后将同等水平(0.6pmol)的探针加至该对照,以控制在侧流条检测期间存在探针的任何非预期的影响。
[0191]
图6a展示了核酸侧流条在其显影后的照片。在反应过程中提供第一寡核苷酸探针时,在两个靶标水平都观察到了与碳纳米颗粒沉积相对应的清晰信号。正如预期的那样,在反应期间不提供第一寡核苷酸探针时,在任一个靶标水平都没有检测到信号。此实验清楚地证明了,在方法的该实施方案中实质性增强检测物种类的产生的潜力,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。值得注意的是,与实施例1相比,提供了同等浓度的第一和第二寡核苷酸引物,这使得能够更快速地扩增。
[0192]
实施例2.2:接下来使用完全不同的靶核酸设计了单独的测定试验,以证明所述方法实施方案的通用性。以实施例1和2.1中所述类似的方式,为相关靶核酸(单链dna)设计寡核苷酸引物和寡核苷酸探针。
[0193]
制备包含以下的反应:0.8pmol第一引物;0.4pmol第二引物;0.6pmol第一寡核苷酸探针;300μm sp-datp-α-s;各60μm的dttp、dctp和dgtp;2u限制酶;2u芽孢杆菌链置换dna聚合酶。将核酸靶标(单链dna靶标)以多种水平(+=1amol,ntc=无靶标对照)添加到10μl总反应体积的适当反应缓冲液中。将反应在45℃下孵育6分钟。然后将5μl终止的反应混合物加到60μl含有0.08mg ml-1
缀合碳的侧流运行缓冲液中,然后上样到核酸侧流条上。进行包含第一寡核苷酸探针的截短变体的对照反应,该截短变体也在步骤a)进行的同时与样品接触。
[0194]
图6b展示了核酸侧流条在其显影后的照片。清晰的阳性信号在靶核酸存在时可见,而在无靶标对照中不可见,证明了该测定试验的正确设计和功能以及该方法实施方案的可靠潜力,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并在步骤a)进行的同时与样品接触。如预期的那样,在采用第一寡核苷酸探针的截短形式的对照测定中,仅观察到非常微小的信号,表明检测物种类的有效产生需要在步骤a)扩增进行的同时第一寡核苷酸探针正确杂交。
[0195]
实施例3
[0196]
在同一样品中检测两种或多种不同的具有确定序列的靶核酸存在的方法的性能
[0197]
本实施例展示了方法用于检测样品中两种或多种不同的具有确定序列的靶核酸的潜力。除了引物之外,方法中还使用两个寡核苷酸探针,这使得可以提供一个完整的在方法中检测扩增产物的方案,其中所述方法理想地适合于检测相同样品中的两种或多种不同的靶核酸。在本实施例中,证明了基于第二寡核苷酸探针的序列特异性杂交来差异检测可选检测物种类的能力。
[0198]
首先,为了证明方法用于检测两种或多种不同的靶核酸的能力,我们开发了多套
用于检测两种不同靶标(a和b)的兼容寡核苷酸引物和探针。在每种情况下,第一寡核苷酸探针设计为在5'-3'方向包含以下特征:5'生物素修饰,7碱基稳定化区域,5碱基限制性内切核酸酶识别位点,在限制酶切割位点处包含硫代磷酸键的与靶标a或b的3'端互补的11-13碱基区域,以及3'磷酸修饰。第二寡核苷酸探针设计为在5'-3'方向包含:与靶标a或b的5'端互补的12-14碱基区域,5个胸腺嘧啶核苷碱基的中性间隔区,以及12个碱基的单链寡核苷酸部分作为允许第二寡核苷酸探针附着到固体材料上的部分。利用不同的序列设计了用于每个靶标的该单链寡核苷酸附着部分的序列,以允许每个检测物种类分别附着在侧流条上的不同位置。制备核酸侧流条,其在分开的位置含有30pmol寡核苷酸的离散点,各离散点的所述寡核苷酸分别含有各单链寡核苷酸检测部分的反向互补序列。
[0199]
在65μl含有0.032mgml-1
吸附到生物素结合蛋白上的碳的适当缓冲液中,组装包含以下的反应:0.5pmol用于靶标a和靶标b的第一寡核苷酸探针;0.5pmol用于靶标a和靶标b的第二寡核苷酸引物。将不同水平的每个靶标(+=0.1pmol;++=1pmol)分别添加到分开的反应中,以及将两个靶标一起添加。还进行了无靶标对照(ntc)。
[0200]
图7a显示了在实验中获得的侧流条的照片。在两个靶标水平和两个测定中都观察到了与含碳检测物种类的沉积相对应的清晰黑点。此外,在两个反应同时进行时,观察到对应于靶标a和b两者的信号。未观察到背景信号或不同测定之间的串扰。
[0201]
为了证明该方法的稳健性,继续进行进一步实验,开发三种分开的测定来证明该方法用于检测样品中三种不同的具有确定序列的靶核酸的潜力。采用了如上所述的类似方法。图7b显示所获得的侧流条的照片。按所示单独地及以多种组合加入靶标p1、p2和p3。将第二寡核苷酸探针的单链寡核苷酸检测部分的反向互补序列印刷在核酸侧流条上的分开行中。黑色信号指示碳附着的检测物种类的沉积在所有情况下都定位到预期的位置用于快速灵敏检测,在测定之间无非预期的串扰,也没有任何背景信号。包含四个分开的测定的等同实验证明了该方法用于检测样品中四种不同的具有确定序列的靶核酸(p1、p2、p3和p4)的潜力,结果如图7c所示。在这个四靶标实验中,p4作为阳性对照存在于所有反应中,将其他靶标单独添加至分开的反应。所显示的侧流条的照片显示在预期位置有清晰的黑色条带,对应于与碳结合的相关检测物种类的存在。这类多重测定证明了该方法用于由多种不同病原体引起的疾病的诊断试验的潜力,其中对照测定中检测到检测物种类的存在指示该方法已经成功地进行,并且一种或多种其他检测物种类在侧流条上的显示指示适当的临床样品中存在相关的致病病原体。虽然在此类诊断应用中(如在感染性疾病领域)很少观察到在同一样品中存在一种以上病原体的共感染,但本发明的方法对于在多重反应中检测靶标的任何组合是高度通用的。图7d显示了添加四种靶标(p1、p2、p3和p4)的不同组合的实验的结果。在没有非特异性背景的情况下,能够单独检测到每个靶标的能力以及能够在省略各单个靶标时检测到其他三个靶标的能力,证明了本发明方法的显著检测特异性。
[0202]
在上述和多种其他实验中,我们还进行了在非常低的靶标浓度(例如1zmol(600个拷贝)或17ymol(10个拷贝))下检测3-5个靶标的多重测定。在这个实施例中,我们已经清楚地证明了该方法检测样品中两种或多种不同的具有确定序列的靶核酸存在的潜力、以及其例如通过核酸侧流用于进行快速、低成本信号检测的潜力。本发明方法的不寻常且有利的特征是,在同一样品中可以容易地检测到两种或多种不同的具有确定序列的靶核酸。对于待检测的每个附加靶标,需要一组附加的寡核苷酸引物,这在没有温度循环的现有技术方
法中对检测两种或多种不同的靶核酸的存在提出了重大挑战,因为附加的引物导致形成非特异性扩增产物的倾向性增加。在本发明的方法中,通过特异性增强来克服这一挑战,这种特异性的增强可归于例如使用修饰碱基、改进的酶选择、和使用寡核苷酸探针来形成检测物种类,其中所述探针采用附加序列特异性杂交事件。
[0203]
实施例4
[0204]
靶核酸中的第一和第二杂交序列由5个碱基分开的方法的性能
[0205]
此实施例展示方法的性能,其中靶核酸中的第一和第二杂交序列由5个碱基分开。在两个寡核苷酸引物设计为在第一和第二杂交序列之间具有间隔时,使用寡核苷酸引物中不存在且仅以靶标依赖性方式在扩增产物中产生的靶标衍生序列的能力,提供了在方法实施方案中增强特异性的潜力,可以克服从头合成或引物-引物结合产生的任何背景信号。在该实施方案中,第一或第二寡核苷酸探针的序列特异性杂交设计为利用两个杂交区域之间的间隔,以仅在扩增产物包含正确的靶标衍生序列时产生检测物种类。
[0206]
在本实施例中,我们设计了一系列测定来证明第二寡核苷酸探针与多种不同的扩增产物的杂交,这些扩增产物仅在靶核酸内的第一和第二杂交序列之间的间隔序列上不同。第二寡核苷酸探针设计为在其5'端包含用于扩增产物中的至少一个分子种类的11碱基杂交区域。该区域由一个7碱基序列和一个5碱基序列组成,该7碱基序列是第一寡核苷酸引物的反向互补序列,该5碱基序列是从两个引物之间的间隔衍生的扩增产物中的附加靶标衍生序列的反向互补序列。第二寡核苷酸探针在5'到3'方向上还包含5个胸腺嘧啶核苷碱基的中性间隔区和用于附着到固体材料的12碱基单链寡核苷酸部分。制备了硝酸纤维素核酸流动条,其上打印有30pmol的具有该部分的反向互补序列的寡核苷酸。第一寡核苷酸探针设计为包含与第二寡核苷酸引物相同的序列,但具有5'生物素修饰、3'磷酸修饰和限制酶切割位点的位置处的硫代磷酸酯核苷酸间键。
[0207]
设计了四种不同的人工靶核酸序列(t1、t2、t3和t4),每个序列都具有与第一和第二杂交序列对应的精确序列,但在第一和第二杂交序列之间的五个碱基中不同:t1包含与第二寡核苷酸探针的11碱基杂交区域完全互补的用于检测的正确碱基;t2在间隔的五个碱基中包含四个错配;设计t3使得间隔的五个碱基中的四个碱基被去除,因此扩增产物的分子种类缩短了四个碱基。t4在间隔的五个碱基中包含两个错配。
[0208]
在总反应体积60μl的适当反应缓冲液中组装包含以下的反应:3.6pmol第一寡核苷酸引物;1.8pmol第二寡核苷酸引物;2.4pmol第一寡核苷酸探针;300μm sp-datp-α-s、60μm dttp、dctp、dgtp;12u限制酶;12u芽孢杆菌链置换dna聚合酶。将1amol靶标(t1、t2、t3或t4)添加到每个反应中,然后在45℃孵育6.5分钟,然后在侧流条上运行60μl反应中的53.5μl。在将反应物加到侧流条上之前,将1.5pmol第二寡核苷酸探针和2μg吸附到生物素结合蛋白上的碳沉积在缀合物垫上并干燥5分钟。
[0209]
图8显示了在实验中获得的核酸侧流条的照片。用靶标t1获得的侧流条显示了一条清晰的黑线,对应于附着在硝酸纤维素固体材料上的碳附着的检测物种类,并证明本实施例中开发的包括寡核苷酸引物和探针的测定实验功能正确,具有进行快速和灵敏检测的潜力。用靶标t2和t3进行的反应没有显示出任何与阳性信号对应的碳,证明四个错配和四个碱基的去除都会去除第二寡核苷酸与反应中产生的前体检测物种类有效杂交的能力。在使用t4产生的侧流条上观察到非常微弱的信号,表明仅两个错配碱基的存在导致第二寡核
苷酸探针与前体检测物种类成功杂交以产生能够结合到侧流条线上的检测物种类的能力出现实质性丧失。用重复反应进行聚丙烯酰胺凝胶电泳来确认所有靶标的所有反应均正确进行,并产生了大量扩增产物。在用四碱基截短靶标t3进行的反应中,可以看到预期的大小迁移。
[0210]
本实施例展示了作为本发明的一个整体特征的第一和第二寡核苷酸探针如何不仅提供快速和灵敏的扩增产物检测,还可用于提供对扩增产物进行进一步的基于靶序列的特异性检查,而不仅仅是由引物杂交得到的结果。这种有力的技术克服了现有技术方法的已知问题,这些问题在某些测定中由从头合成或引物-引物结合引起的非靶标特异性背景扩增引起。证明了与现有技术方法相比,本发明的方法表现出增强的特异性,同时保持灵敏的检测和快速、低成本的结果显示。
[0211]
实施例5
[0212]
其中允许第二寡核苷酸探针附着到固体材料的部分是抗原并且相应的抗体附着在固体表面硝酸纤维素侧流条的方法的性能
[0213]
在本发明的方法中,可以使用许多不同的部分作为用于将第二寡核苷酸探针附着到固体材料的部分。本实施例证明可以进行该方法,其中允许第二寡核苷酸探针附着到固体材料的部分是抗原,并且相应的抗体附着在固体表面,即硝酸纤维素侧流条上。
[0214]
第二寡核苷酸探针设计为包含32碱基序列,该序列包含与扩增产物中的至少一个分子种类同源的区域和在合成期间添加的3'地高辛nhs酯修饰。通过点样和空气干燥来将从绵羊纯化的fab片段抗地高辛抗体(sigma-aldrich)固定到核酸侧流条上。
[0215]
第二寡核苷酸探针的性能在实验中得到证明,其中将多种水平的靶标(+++=1pmol;++=0.1pmol;+=10fmol;ntc=无靶标对照)添加到60μl设计的反应缓冲液中,该缓冲液包含使用碳核酸侧流反应进行检测所需的试剂,包括吸附在生物素结合蛋白上的0.016mgml-1
碳。在0.2μl含有2.5mm硼酸盐和0.5%吐温20的缓冲液中,将0.5μg抗地高辛fab片段点到侧流条上,制备了侧流条。使溶液干燥进入侧流条的硝酸纤维素膜中2h。使反应在45℃下孵育2分钟以形成设计的检测物种类,然后将每个反应的整个反应混合物施加到侧流条上。
[0216]
图9显示了实验中产生的侧流条的照片。与侧流条上的碳沉积相对应的黑斑在每个靶标水平都可见,而在ntc中不可见,表明检测物种类的特异性检测。已证明用于附着检测部分(碳)的基于生物素的亲和相互作用和用于固体材料附着部分的基于抗体的亲和相互作用的组合。通过本实施例证明,就用于将第二寡核苷酸探针附着到固体材料的不同方式而言,本发明方法具有通用性。
[0217]
实施例6
[0218]
其中允许第二寡核苷酸探针附着到固体材料的部分是包含三碱基dna序列基序的四个重复拷贝的单链寡核苷酸并且该单链寡核苷酸序列的反向互补序列附着在固体材料上的方法的性能
[0219]
此实施例展示方法的性能,其中允许第二寡核苷酸探针附着到固体材料的部分是包含三碱基dna序列基序的四个重复拷贝的单链寡核苷酸。如上所述,采用单链寡核苷酸作为第二寡核苷酸探针的检测部分的方法实施方案呈现了该方法的简单和通用方面,其有助于通过核酸侧流进行检测,并且容易地使得能够检测同一样品中的多种不同的靶核酸。此
外,单链寡核苷酸检测部分可预先定义并优化用于有效的侧流条上杂交,以增强检测的灵敏度并提供核酸侧流条的有效放大制造。
[0220]
在本发明的一个方面中,我们观察到,通过使用由dna序列基序的多个重复拷贝组成的单链寡核苷酸检测部分可以令人惊奇地改进侧流条上的杂交。本实施例呈现多重并排实验的结果,其中通过使用包含三碱基dna序列基序的四个重复拷贝的单链检测部分且该单链寡核苷酸序列的反向互补序列附着到侧流条上,可以显著增强以第二寡核苷酸直接附着到侧流条的测定试验的性能。
[0221]
实施例6.1:利用该方法实施方案设计了测定试验,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被所述第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。第一寡核苷酸探针设计为总长度为25个碱基,在5'至3'方向上包含:5'生物素修饰;7碱基中性区域;5碱基不是切口酶的限制酶的识别位点;在限制酶切割位点处包含硫代磷酸酯键的能够与靶标中的第一杂交区域杂交的13碱基区域;以及3'磷酸修饰,其中生物素修饰允许第一寡核苷酸探针附着到比色染料碳纳米颗粒上,磷酸修饰阻断其通过链置换dna聚合酶延伸。
[0222]
设计了两个替代的第二寡核苷酸探针来检测同一靶标种类(i和ii)。第二寡核苷酸探针“i”设计为在5'至3'方向上包含:能够与靶标中的第二杂交序列的反向互补序列杂交的14碱基区域的3个重复;以及9个胸腺嘧啶核苷碱基间隔区。制备含有30pmol探针斑点的核酸侧流条。
[0223]
替代的第二寡核苷酸探针“ii”设计为在5'-3'方向上包含:能够与靶标中的第二杂交区域的反向互补序列杂交的14碱基区域;5个胸腺嘧啶核苷碱基的中性间隔区;以及包含3碱基序列基序的4个重复的12碱基单链寡核苷酸部分,其作为允许第二寡核苷酸探针附着到固体材料的部分。
[0224]
设计了另一单链寡核苷酸,其在5'至3'方向上包含:11个胸腺嘧啶核苷碱基间隔区;包含3碱基序列基序的反向互补序列的12个重复的36碱基区域,其形成允许第二寡核苷酸ii附着到固体材料的部分。对于第二寡核苷酸探针ii,用30pmol的该另一单链寡核苷酸点斑点,制备核酸侧流条。
[0225]
进行测试寡核苷酸探针i和ii的性能的反应,其在60μl含有0.016mgml-1
吸附到生物素结合蛋白上的碳的适当缓冲液中包含0.5pmol的第一寡核苷酸探针。ii的反应以相同的方式组装,但添加0.5pmol的第二寡核苷酸探针ii。按多种水平(+++=1pmol,++=0.1pmol,ntc=无靶标对照)添加核酸靶标(单链dna靶标,代表由所设计的测定试验试剂产生的扩增产物内的至少一个分子种类)。组装的反应物在45℃下孵育2分钟,然后将整个反应混合物上样到适当的核酸侧流条上。
[0226]
图10a显示了在实验中获得的侧流条的照片,左图显示第二寡核苷酸探针i的结果,右图显示第二寡核苷酸探针ii的结果。在有靶标存在的情况下,观察到与碳附着的检测物种类的沉积相对应的黑斑。对于包含重复序列基序的第二寡核苷酸探针ii,在所有靶标水平都观察到更强的信号。
[0227]
实施例6.2:接下来针对完全不同的靶核酸设计了分开的测定试验,来证明该方法实施方案的通用性及其广泛的适用性。以实施例6.1中所述类似的方式,为相关靶核酸(单链dna)设计寡核苷酸探针;同样有称为“i”和“ii”的两种版本的第二寡核苷酸探针和多种
靶标水平(+++=1pmol,++=0.1pmol,+=0.001pmol)。如图10b中所产生的侧流条的照片中所示,观察到了甚至更显著的效果。在较低的两个靶标水平,第二寡核苷酸探针i未产生任何信号,而相应的重复序列寡核苷酸探针ii产生了由沉积碳的黑斑所示的清晰的阳性信号。
[0228]
本实施例揭示了利用包含dna序列基序的重复拷贝的第二寡核苷酸检测部分可以显著地改善基于侧流杂交的检测。结果表明,检测物种类基于核酸侧流检测的灵敏度可以获得100倍提高。信号的强度得到增强,并且信号产生得更快,证明了本发明的该实施方案可容易地适用于涉及快速检测的应用(例如通过核酸侧流)的潜力。此外,举例说明了使用单链寡核苷酸作为附着在第二寡核苷酸探针上的检测部分的潜力。
[0229]
实施例7
[0230]
方法在检测临床样品中的rna病毒中的用途
[0231]
此实施例展示了方法在检测临床样品中的rna病毒中的性能,其中使用如下方法实施方案,其中第一寡核苷酸探针在扩增步骤a)进行的同时与样品接触,并且允许第二寡核苷酸探针附着到固体材料的部分是包含三碱基dna序列基序的四个重复拷贝的单链寡核苷酸,并且该单链寡核苷酸序列的反向互补序列附着在固体材料上。在多种研究中,我们已经常规地检测到了非常低拷贝的rna靶标,如病毒基因组提取物。例如,使用经过定量的病毒基因组提取物,我们采用本发明的方法在10分钟内出结果的总时间中检测少于100个病毒基因组当量拷贝的病毒,扩增步骤a)小于5分钟。这种显著的速率和灵敏度证明了该方法在诊断领域的应用中的潜力。因此,在本实施例中,我们开发了检测致病性单链rna病毒的测定试验,并用感染病毒的临床样品证明了该测定试验的性能。
[0232]
设计了总长度为25个核苷酸碱基的第一寡核苷酸引物,其在5'至3'方向上包含:合成为在各碱基之间包含硫代磷酸酯键的8碱基稳定化区域;不是切口酶的限制酶的5碱基识别位点;以及12碱基杂交区域,其包含靶核酸中的第一杂交序列的反向互补序列,设计用于靶向单链rna病毒基因组内的区域。第二寡核苷酸引物设计为包含相同的稳定化区域但不含硫代磷酸酯键,以及包含相同的限制酶识别序列,但具有能够与第二杂交序列的反向互补序列杂交的12碱基杂交区域。在本实施例中,第一限制酶和第二限制酶是相同的限制酶。靶核酸中的第一和第二杂交序列由0个碱基分开。
[0233]
使用靶核酸设计寡核苷酸引物,使得在引物的反向互补序列中切割位点下游的核苷酸碱基是腺苷,由此将α-巯基datp用作该方法中的修饰dntp。通过链置换dna聚合酶或逆转录酶插入硫代磷酸酯修饰,以阻断该反向互补链的切割。
[0234]
设计了总长度为24个碱基的第一寡核苷酸探针,其在5'至3'方向上包括:在合成期间添加的5'生物素修饰,其中所述生物素修饰允许第一寡核苷酸探针附着到比色染料碳纳米颗粒上;8碱基稳定化区域;不是切口酶的限制酶的5碱基识别序列,其中第一寡核苷酸探针中该限制酶的切割位点由合成期间添加的硫代磷酸酯核苷酸间键保护;能够与扩增产物中的至少一个分子种类杂交的11碱基区域;以及阻止通过链置换dna聚合酶延伸的3'磷酸修饰。
[0235]
设计了总长度为31个碱基的第二寡核苷酸探针,其在5'至3'方向上包含:能够与扩增产物中的该至少一个分子种类中的第一单链检测序列下游的第二单链检测序列杂交的14碱基区域;包含5个胸腺嘧啶核苷碱基的间隔区;三碱基dna序列基序的4个重复,其反
钳修饰的能够与靶标中的第一杂交区域杂交的10碱基区域;以及3'磷酸修饰,其中生物素修饰允许第一寡核苷酸探针附着到比色染料碳纳米颗粒上,并且磷酸修饰阻断了其通过链置换dna聚合酶延伸。
[0243]
第二寡核苷酸探针设计为在5'至3'方向上包含:能够与靶标中的第二杂交序列的反向互补序列杂交的11碱基区域;4个胸腺嘧啶核苷碱基的间隔区;以及包含3碱基序列基序的4个重复的12个碱基,其作为允许第二寡核苷酸探针附着到固体材料的部分。设计了另一单链寡核苷酸,其在5'至3'方向上包含:11个胸腺嘧啶核苷碱基的间隔区;包含3碱基序列基序的反向互补序列的11个重复的33碱基区域,其形成允许第二寡核苷酸附着到固体材料的部分。对于第二寡核苷酸探针,用30pmol的该另一单链寡核苷酸点斑点,制备核酸侧流条。
[0244]
在适当缓冲液中制备包含以下的反应:1.5pmol第一引物;1.0pmol第二引物;1pmol第一寡核苷酸探针;60μm来自enzo life sciences的sp datp-α-s;各60μm的dttp、dctp和dgtp;以及多种水平的靶dna(++=1amol,+=10zmol,ntc=无靶标对照)。组装反应在目标温度(i=37℃;ii=45℃、iii=50℃、iv=55℃)下孵育2分钟,然后通过最终添加5u限制酶和5u芽孢杆菌链置换dna聚合酶来启动,最终反应体积为25μl。然后在相关目标温度下孵育反应5分钟(t1)或8分钟(t2)。孵育后,将每个反应转移到75μl缓冲液中,该缓冲液含有1.5pmol第二寡核苷酸探针和8μg吸附到生物素结合蛋白上的碳,然后应用到核酸侧流条的样品垫上。
[0245]
图12a显示了在每个靶标水平、温度和时间点的实验中获得的侧流条的照片。观察到的清晰黑线对应于在存在靶标的情况下产生的碳附着的检测物种类的沉积。在所有温度下,在靶标存在时,在8分钟内,在两个靶标水平都出现了非常强信号,证明了该方法的有效扩增的宽温度范围。在ntc样品中未观察到非特异性扩增。在45℃和50℃下仅5分钟后也观察到强扩增,表明该测定的最适温度可能在40℃和50℃之间。
[0246]
实施例8.2:利用该方法实施方案设计了第二测定试验,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。第一和第二引物都设计为在5'到3'方向上包含:6碱基中性区域;限制酶识别位点;以及针对靶核酸的12碱基杂交区域。这样设计引物,使得靶标中的第一和第二杂交序列由10个碱基分开。
[0247]
设计了总长度为23个碱基的第一寡核苷酸探针,其在5'至3'方向上包含:5'生物素修饰;6碱基中性区域;在第4位含有错配的限制酶识别位点的碱基;能够与靶标中的第一杂交区域杂交的12碱基区域;以及3'磷酸修饰,其中生物素修饰允许第一寡核苷酸探针附着到比色染料碳纳米颗粒上,并且磷酸修饰阻断其通过链置换dna聚合酶延伸。
[0248]
第二寡核苷酸探针设计为在5’至3’方向上包含:能够与靶标中的第二杂交序列的反向互补序列的3个碱基以及第一和第二杂交序列之间的10碱基间隔杂交的13碱基区域;3胸腺嘧啶核苷碱基的间隔区;以及包含3碱基序列基序的4个重复的12个碱基,其作为允许第二寡核苷酸探针附着到固体材料的部分。设计了另一单链寡核苷酸,其在5'至3'方向上包含:11胸腺嘧啶核苷碱基的间隔区;以及包含3碱基序列基序的反向互补序列的12个重复的36碱基区域,其形成允许第二寡核苷酸附着到固体材料的部分。对于第二寡核苷酸探针,用30pmol的该另一单链寡核苷酸点斑点,制备核酸侧流条。
[0249]
在适当缓冲液中制备包含以下的反应:6pmol第一寡核苷酸引物;8pmol第二寡核苷酸引物;6pmol第一寡核苷酸探针;60μm sp-datp-α-s(来自enzo life sciences);各60μm的dttp、dctp和dgtp;60μg吸附到生物素结合蛋白上的碳;以及(如适用)靶标。组装反应在起始温度(i=15℃;ii=45℃)下孵育2分钟,然后通过最终添加20u限制酶、20u芽孢杆菌链置换dna聚合酶和40u逆转录酶至最终反应体积为100μl来启动反应。添加酶后,立即将15℃起始温度的反应连同其他反应转移到45℃。
[0250]
然后将反应在45℃下孵育6分钟。孵育后,将每个反应转移到核酸侧流条的样品垫上,该样品垫含有3pmol的第二寡核苷酸探针。图12b显示了在每个温度孵育条件下的实验中获得的侧流条的照片。观察到的清晰黑线对应于在存在靶标的情况下产生的碳附着的检测物种类的沉积。在扩增步骤a)期间温度从15℃升高到45℃的反应中未观察到任何差异。与在预热反应中一样,存在同样显著的扩增速率,在ntc样品中没有观察到非特异性扩增。
[0251]
此实施例8证明,与已知方法相比,本发明的方法可用于容易地开发具有较低最适温度特征的测定试验,并且可用于在异常宽的温度范围内进行灵敏的检测。它还证明,本发明的方法可以在不预热的情况下进行,其中在步骤a)进行期间升高温度。此类特征对于在低成本诊断装置中使用该方法具有高度吸引力,在此装置中高温和精确控制的加热会造成复杂的物理约束性,从而将这种装置的商品成本增加到一次性或无仪器装置在商业上不可行的程度。此外,通过避免在启动扩增之前对样品进行预热的已知方法的要求,可以用更少的使用步骤和更简单的操作顺序来进行本发明的方法,从而提高这种诊断装置的可用性并减少产生结果的总时间。
[0252]
实施例9
[0253]
其中靶核酸通过链侵入自双链dna产生的方法的性能
[0254]
本实施例展示该方法的用途,其中单链靶核酸是待检测的双链dna内的单链位点,其中无需特别动作(例如温度变性、凸点引物或使用附加酶(例如解旋酶或重组酶))来分离dna链。使用本发明方法可以容易地检测单链rna和双链dna靶标的能力,使得其在诊断应用中具有高度的通用性,而无需对用于进行该方法的装置施加附加的使用步骤、组件或物理要求。
[0255]
实施例9.1:针对病毒靶标的双链dna基因组内的蛋白质编码区开发了测定试验。在临床诊断中,可能用双链基因组或mrna转录物作为病毒存在的生物标志物。该测定试验利用如下方法实施方案设计,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。寡核苷酸引物和寡核苷酸探针的设计遵循其他实施例中描述的相似方式,靶核酸中的第一和第二杂交序列之间没有间隔。
[0256]
在适当缓冲液中制备包含以下的反应:4pmol第一寡核苷酸引物;2pmol第二寡核苷酸引物;2pmol第一寡核苷酸探针;60μm来自enzo life sciences的sp-datp-α-s;各60μm的dttp、dctp和dgtp;60μg吸附到生物素结合蛋白上的碳;双链dna靶标(i)或单链rna靶标(ii)或无靶标。组装反应在45℃下孵育2分钟,然后通过最终添加20u限制酶、20u芽孢杆菌链置换dna聚合酶和25u逆转录酶至最终反应体积为100μl来启动。添加酶后,将反应在45℃下孵育7分钟。
[0257]
孵育后,向每个反应中加入1.5pmol的第二寡核苷酸探针,并将整个反应体积转移
到核酸侧流条的样品垫上。所有样品中还添加了核酸侧流对照靶标。图13a显示了在每个靶标的实验中获得的侧流条的照片。观察到的清晰黑线对应于在存在靶标的情况下产生的碳附着的检测物种类的沉积,较微弱的信号对应于比较高的靶标水平(++)低的靶标水平(+)。未观察到扩增速率在单链rna和双链dna靶标之间存在差异。
[0258]
实施例9.2:针对细菌病原体的c.2.5兆碱基双链dna基因组内的单链靶核酸设计了测定试验。该测定试验利用如下方法实施方案设计,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。寡核苷酸引物和寡核苷酸探针的设计遵循与其他实施例中描述的方式相似的方式进行,在靶核酸中的第一和第二杂交序列之间有4个碱基的间隔。
[0259]
在适当缓冲液中制备包含2pmol第一寡核苷酸引物和0.5pmol第二寡核苷酸引物的反应。由于使用双链dna靶标,两种单链靶核酸事实上同时被添加,并且推测也将发生第二对应过程,其中用于检测靶核酸的第二寡核苷酸引物是用于检测第二靶核酸(即,靶核酸的反向互补序列)的第一寡核苷酸引物。这一事实对方法的性能几乎没有影响。2pmol第一寡核苷酸探针;60μm来自enzo life sciences的sp-datp-α-s;各60μm的dttp、dctp和dgtp;15μg吸附到生物素结合蛋白上的碳;以及多种水平(++=1amol;+=10zmol;ntc=无靶标对照)的含有靶标的细菌基因组提取物。还进行了包含1amol大肠杆菌基因组提取物的另一特异性对照反应。组装反应在45℃下孵育3分钟,然后通过最终添加4u限制酶和2u芽孢杆菌链置换dna聚合酶至最终反应体积为25μl来启动。添加酶后,将反应在45℃下孵育6分钟。
[0260]
孵育后,将75μl含有3pmol第二寡核苷酸探针的缓冲液添加到每个反应中,然后将整个体积转移到核酸侧流条的样品垫。图13b显示了在每个靶标的实验中获得的侧流条的照片。在测试的两个靶标水平上,均观察到与存在靶标时产生的碳附着的检测物种类的沉积相对应的清晰黑线。在无靶标对照中或在存在大肠杆菌基因组dna的情况下未观察到非特异性信号,表明该方法可用于在仅6分钟内特异性检测临床相关拷贝数的复杂双链dna基因组。
[0261]
本实例证明本发明的方法可容易地用于检测双链dna内的单链核酸靶标。值得注意的是,针对单链rna靶标和双链dna内相同的靶序列观察到了相似的扩增速率,而不需要任何特定动作如温度变性来分开dna双链体。相反,单链位点可以充分暴露以供第一寡核苷酸引物的杂交和延伸,从而通过“链侵入”来启动该方法,其中在双链dna内一个或多个dna碱基对的瞬时开放足以允许第一寡核苷酸引物的杂交和3'羟基的延伸。这与诸如sda的已知方法形成了对比,在所述sda方法中对于双链核酸,在测定中利用热变性和凸点引物。除了在单链dna和单链rna内的靶标之外,使用本发明的方法可以容易检测双链dna内的靶标的能力,使得其在诊断应用中,如在检测具有双链dna基因组的细菌、真菌和病毒病原体中,具有高度的通用性。该方法不需要复杂的附加使用步骤、酶、组分或物理限制来检测具有双链dna基因组的生物体的事实,意味着它特别适合在简单、低成本的诊断装置中用于检测。例如,针对已知方法报告的在进行扩增之前进行热变性的要求,将使得昂贵的附加组件成为必要,并增加这种装置的商品成本和产生结果的总时间,这意味着一次性或自洽的无仪器的装置将是不可行的。
[0262]
实施例10
[0263]
本发明的方法与已知方法的性能比较
[0264]
本实例呈现本发明方法与wo2014/164479中公开的用于检测病毒靶标的已知方法的比较性评价。已知方法与本发明方法的根本不同在于,它需要切口酶并且不需要使用一种或多种修饰dntp。本发明的方法证明具有非常优越的灵敏度和特异性。
[0265]
对于此比较评价,首先使用本发明的方法针对具有单链rna基因组的病毒靶标开发了测定试验。该测定试验利用如下方法实施方案设计,其中第一寡核苷酸探针在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,并且在步骤a)进行的同时与样品接触。寡核苷酸引物和寡核苷酸探针的设计遵循与其他实施例中描述的方法相似的方法进行,靶核酸中的第一和第二杂交序列之间有6个碱基的间隔。
[0266]
对于使用已知方法的测定,设计了类似的引物,其包含与本发明方法中使用的等同引物相同的5'端6碱基中性区域和相同的3'端杂交区域。通过这种方式,尽可能确保两种测定之间的一致性,以对方法进行准确的比较。然而,将限制酶识别位点的碱基替换为wo2014/164479中报道的示例性切口酶nt.bbvci的碱基(参见第20-21页实施例5)。
[0267]
实施例10.1:在第一种情况下,每种方法的反应均使用相同的引物比率进行。对于本发明的方法,在适当缓冲液中制备包含以下的反应:2pmol第一寡核苷酸引物;2pmol第二寡核苷酸引物;1.6pmol第一寡核苷酸探针;60μm来自enzo life sciences的sp-datp-α-s;各60μm的dttp、dctp和dgtp;以及作为靶标的多种水平(+++=10zmol;++=100拷贝;+=10拷贝;ntc=无靶标对照)的病毒基因组rna提取物。组装反应在环境条件(c.20℃)下预孵育5分钟,然后通过在25μl的最终反应体积中添加5u限制酶、5u芽孢杆菌链置换dna聚合酶和10u逆转录酶来启动反应。添加酶后,将反应在45℃下孵育8分钟(t1)或15分钟(t2)。孵育后,将75μl缓冲液中的60μg吸附到生物素结合蛋白上的碳添加到每个反应中,并将整个100μl体积转移到含有1.5pmol第二寡核苷酸探针的核酸侧流条的样品垫上。
[0268]
对于已知方法,在适当缓冲液中制备包含以下的反应:6.25pmol第一寡核苷酸引物;6.25pmol第二寡核苷酸引物;各200μm的datp、dttp、dctp和dgtp;以及作为靶标的多种水平(+++=10zmol;++=100拷贝;+=10拷贝;ntc=无靶标对照)的病毒基因组rna提取物。组装反应在环境条件(c.20℃)下预孵育5分钟,然后通过在25μl的最终反应体积中添加4u nt.bbvci、20u bst大片段dna聚合酶和10u m-mulv逆转录酶来启动反应。添加酶后,将反应在45℃孵育8分钟(t1)和15分钟(t2)。孵育后,将75μl含有60μg吸附到生物素结合蛋白上的碳和5pmol第一寡核苷酸探针的缓冲液添加到每个反应中,并将整个100μl体积转移到含有5pmol第二寡核苷酸探针的核酸侧流条的样品垫上。
[0269]
图14a显示了,在所示的多种靶标水平和时间点,在使用本发明的方法(i)和已知的方法(ii)的实验中获得的侧流条的照片。观察到的黑线对应于在存在靶标的情况下产生的碳附着的检测物种类的沉积。在使用已知方法可观察到任何信号之前,需要进行多次尝试,并且有必要使用酶和缓冲液的特定组合以及显著更高水平的引物、dntp和酶。对于本发明的方法(i),即使在没有预热的情况下仅8分钟后的最短时间点,也可清楚地看到甚至在仅10个靶标拷贝的最低靶标水平下产生的检测物种类。即使在努力优化已知方法(这对技术人员而言并非显而易见)之后,在最高靶标水平(+++=10zmol)和最长时间点(15分钟)也仅观察到微弱信号。
[0270]
实施例10.2:在进行了广泛的进一步非显而易见的尝试之后,可以提高已知方法的性能,但仅在使用第一和第二寡核苷酸引物的2:1比例、以及非常高浓度的第一引物时,
如本实施例10.2所述。如实施例10.1所述,再次实施本发明方法。对于已知方法,除了第一寡核苷酸引物的水平增加到12.5pmol之外,反应如实施例10.1所述进行。在每种情况下,使用以下靶标水平:+++=1zmol;++=100拷贝;+=10拷贝;ntc=无靶标对照。
[0271]
图14b显示了,在所示的多种靶标水平和时间点,在使用本发明的方法(i)和已知的方法(ii)的实验中获得的侧流条的照片。观察到的黑线对应于在存在靶标的情况下产生的碳附着的检测物种类的沉积。同样,本发明的方法(i)展示了即使在最短的时间点和仅10个靶标拷贝的最低靶标水平下信号可见的显著速率。对于已知方法,在最高靶标水平(+++=1zmol)仅观察到微弱信号,在最长时间点(15分钟)在100拷贝样品中可见非常微弱的信号。然而,在ntc侧流条中也观察到微弱的信号,由于使该方法工作需要非常高的寡核苷酸引物水平和酶水平,这可能相应于非特异性产物。这些数据与wo2014/164479中报道的孵育时间为30分钟的数据一致。为了加速使用这种已知方法进行的扩增,需要添加异常高的引物水平,这将极大地限制其应用于检测同一样品中的两种或更多种不同靶标的潜力,因为在不加剧非特异性产物问题的情况下,总引物水平可以进一步提高的范围非常有限。
[0272]
此实施例14展示了本发明的方法相对于wo2014/164479中公开的已知方法的显著优越性,其中扩增进行得更快,具有更高的灵敏度,并且产生更清晰的结果信号。在没有预孵育的情况下仅8分钟内,本发明的方法就以仅100拷贝的靶标产生了比已知方法在最高靶标水平(60倍靶标水平)下15分钟所能产生的信号更强的信号。本发明的方法相对于该已知方法的优势源自其对不同种类的酶的要求,该酶是非切口酶的限制酶,并且源自其对使用一种或多种修饰dntp如硫代磷酸酯碱基的要求,该修饰dntp可以增强扩增的灵敏度和特异性。此外,其中第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸并且不能被第一或第二限制酶切割并且在步骤a)进行的同时与样品接触的本发明方法实施方案,使得扩增与信号检测有效耦合,有利于在检测物种类形成期间从有效的基于序列的杂交得到增强的特异性。这些优势使得本发明的方法理想地适合用于诊断领域,以及开发简单、超快速、以用户为中心、低成本的诊断装置,例如一次性或无仪器的分子诊断测试装置。在整个说明书和所述权利要求书中,除非另有说明,否则词语“包含”以及诸如“包括”和“含有”的变形将理解为意味着包括所陈述的整数、步骤、整数组或步骤组,但不排除任何其他整数、步骤、组整数或步骤组。
[0273]
本发明的其他方面包括下文所列的那些:
[0274]
1.一种用于检测样品中具有确定序列的单链靶核酸的存在的方法,其包括:
[0275]
a)使样品与以下接触:
[0276]
i.第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中的第一杂交序列杂交的区域的一条链,并且该第二引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域的一条链;
[0277]
ii.链置换dna聚合酶;
[0278]
iii.dntp;
[0279]
iv.一种或多种修饰dntp;
[0280]
v.第一限制酶,其不是切口酶,但在第一引物的识别序列和切割位点为双链时能够识别第一引物的识别序列,并仅切割具有该切割位点的该第一引物链,而反向互补链的
切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;和
[0281]
vi.第二限制酶,其不是切口酶,但在第二引物的识别序列和切割位点为双链时能够识别第二引物的识别序列,并仅切割具有该切割位点的该第二引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;
[0282]
以不经温度循环在该靶核酸的存在下产生扩增产物;
[0283]
b)使步骤a)的扩增产物与以下接触:
[0284]
i.第一寡核苷酸探针,所述第一探针能够与扩增产物中的至少一个分子种类中的第一单链检测序列杂交,并且所述第一探针附着在允许其检测的部分上;和
[0285]
ii.第二寡核苷酸探针,所述第二探针能够与扩增产物中的该至少一个分子种类中的该第一单链检测序列上游或下游的第二单链检测序列杂交,并且所述第二探针附着在固体材料上或附着在允许其附着到固体材料的部分上;
[0286]
其中第一和第二探针与扩增产物中的该至少一个分子种类的杂交产生检测物种类;和
[0287]
c)检测在步骤b)中产生的检测物种类的存在,其中检测物种类的存在指示该样品中存在靶核酸。
[0288]
2.方面1的方法,其中该第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,并且不能被该第一或第二限制酶切割。
[0289]
3.方面2的方法,其中由于存在一个或多个序列错配和/或一个或多个修饰(如硫代磷酸酯键),使得该一个寡核苷酸探针不能被第一或第二限制酶切割。
[0290]
4.方面2或3的方法,其中该一个寡核苷酸探针在步骤a)进行的同时与样品接触。
[0291]
5.前述方面中任一个的方法,其中样品在步骤a)中还与以下接触:(a)第三寡核苷酸引物,该第三寡核苷酸引物在5'至3'方向上包含具有第一限制酶的识别序列和切割位点以及能够与靶核酸中的第一杂交序列杂交的区域的一条链,其中该第三引物在3'端封闭而不能通过dna聚合酶延伸;和/或(b)第四寡核苷酸引物,该第四寡核苷酸引物在5'至3'方向上包含具有第二限制酶的识别序列和切割位点以及能够与靶序列中的第二杂交序列的反向互补序列杂交的区域的一条链,其中该第四引物在3'端封闭而不能通过dna聚合酶延伸。
[0292]
6.方面5的方法,其中第三寡核苷酸引物在存在时以超过第一寡核苷酸引物的量提供,并且第四寡核苷酸引物在存在时以超过第二寡核苷酸引物的量提供。
[0293]
7.前述方面中任一个的方法,其中该一种或多种修饰dntp是α-巯基修饰的dntp。
[0294]
8.前述方面中任一个的方法,其中该第一和第二限制酶是相同限制酶。
[0295]
9.前述方面中任一个的方法,其中步骤a)、b)和c)中的两步或更多步同时进行。
[0296]
10.前述方面中任一个的方法,其中步骤(a)在不超过50℃的温度进行。
[0297]
11.前述方面中任一个的方法,其中允许检测第一寡核苷酸探针的所述部分是比色或荧光染料或是能够附着比色或荧光染料的部分如生物素。
[0298]
12.前述方面中任一个的方法,其中通过电信号的变化来检测该检测物种类。
[0299]
13.前述方面中任一个的方法,其中允许检测第一寡核苷酸探针的部分是在与底物接触后产生可检测信号(如比色或荧光信号)的酶。
[0300]
14.前述方面中任一个的方法,其中允许第二寡核苷酸探针附着到固体材料的部分是单链寡核苷酸。
[0301]
14.方面14的方法,其中单链寡核苷酸部分的序列包含2至4碱基dna序列基序的三个或多个重复拷贝。
[0302]
16.前述方面中任一个的方法,其中在步骤c)中,通过核酸侧流检测该检测物种类的存在。
[0303]
17.方面16的方法,其中该核酸侧流利用一种或多种核酸,其中所述核酸能够与允许该第二寡核苷酸探针附着到固体材料的部分进行序列特异性杂交。
[0304]
18.前述方面中任一个的方法,其中步骤c)使用碳或金(优选碳)产生比色或电化学信号。
[0305]
19.前述方面中任一个的方法,其中该第一和/或第二寡核苷酸引物在该限制酶识别序列和切割位点上游包含长度为例如5个碱基的5'端稳定化序列。
[0306]
20.前述方面中任一个的方法,其中该第一和/或第二寡核苷酸引物的杂交区域长度在9到16个碱基之间。
[0307]
21.前述方面中任一个的方法,其中该第一和第二寡核苷酸引物之一以超过另一个的量提供。
[0308]
22.前述方面中任一个的方法,其中靶核酸中的第一和第二杂交序列由0到6个碱基分开。
[0309]
23.前述方面中任一个的方法,其中靶核酸中的第一和第二杂交序列由3到6个碱基分开。
[0310]
24.前述方面中任一个的方法,其中在步骤b)中,扩增产物内的该至少一个分子种类中的第一或第二单链检测序列包括对应于方面23中定义的该3到6个碱基的序列。
[0311]
25.前述方面中任一个的方法,其中在步骤c)中定量样品中靶核酸的水平。
[0312]
26.前述方面中任一个的方法,其中靶核酸为单链rna,包括从双链rna衍生的单链rna和从双链dna衍生的单链rna,或单链dna,包括从单链rna衍生的单链dna和从双链dna衍生的单链dna。
[0313]
27.方面26的方法,其中该单链dna通过使用核酸酶(如限制性内切核酸酶或外切核酸酶iii)从双链dna产生,或通过使用逆转录酶从单链rna产生。
[0314]
28.前述方面中任一个的方法,其中在同一样品中检测两种或多种不同的具有确定序列的靶核酸的存在。
[0315]
29.前述方面中任一个的方法,其中样品是生物样品,如鼻或鼻咽拭子或抽吸物、血液或来自血液的样品、或尿液。
[0316]
30.前述方面中任一个的方法,其中靶核酸是病毒或源自病毒的核酸材料,是细菌或源自细菌的核酸材料,是从癌细胞或胎儿细胞释放的循环无细胞dna,是micro rna或源自micro rna。
[0317]
31.前述方面中任一个的方法,其中靶核酸包含表观遗传修饰如甲基化的位点。
[0318]
32.前述方面中任一个的方法,其中靶核酸的检测用于疾病或病态的诊断、预后或监测。
[0319]
33.方面32的方法,其中疾病是感染性疾病,包括但不限于hiv、流感、rsv、鼻病毒、
诺如病毒、肺结核、hpv、脑膜炎、肝炎、mrsa、埃博拉、艰难梭菌、epstein-barr病毒、疟疾、鼠疫、脊髓灰质炎、衣原体、疱疹、淋病、麻疹、腮腺炎、风疹、霍乱或天花。
[0320]
34.方面32的方法,其中疾病是癌症,包括但不限于结直肠癌、肺癌、乳腺癌、胰腺癌、前列腺癌、肝癌、膀胱癌、白血病、食管癌、卵巢癌、肾癌、胃癌或黑色素瘤。
[0321]
35.前述方面中任一个的方法,其中靶核酸的检测用于人类遗传检测、产前检测、血液污染筛查、药物基因组学或药代动力学。
[0322]
36.前述方面中任一个的方法,其中样品是人样品、法医样品、农业样品、兽医样品、环境样品或生物防御样品。
[0323]
37.试剂盒,其包含:
[0324]
a)第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含限制酶识别序列和切割位点以及能够与具有确定序列的单链靶核酸中的第一杂交序列杂交的区域,并且该第二引物在5'至3'方向上包含限制酶识别序列和切割位点以及能够与该靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域;
[0325]
b)第一限制酶,其不是切口酶,能够识别第一引物的识别序列并切割第一引物的切割位点;以及第二限制酶,其不是切口酶,能够识别第二引物的识别序列并切割第二引物的切割位点;
[0326]
c)链置换dna聚合酶;
[0327]
d)dntp;
[0328]
e)一种或多种修饰dntp;
[0329]
f)第一寡核苷酸探针,其与该第一和第二寡核苷酸引物之一的杂交区具有一定互补性,并且附着于允许其检测的部分上;和
[0330]
g)第二寡核苷酸探针,其与该第一和第二寡核苷酸引物中的另一个的杂交区的反向互补序列具有一定互补性,并且附着在固体材料上或允许其附着到固体材料的部分上。
[0331]
38.方面37的试剂盒,其还包含用于检测存在检测物种类的手段。
[0332]
39.方面37或38的试剂盒,其中该第一寡核苷酸引物和第二寡核苷酸引物和/或该第一限制酶和/或第二限制酶和/或该dna聚合酶和/或该dntp和/或该一种或多种修饰dntp和/或该第一寡核苷酸探针和/或该第二寡核苷酸探针如方面2、3、7、8、11、13至17、19、20或22至24的任一个中所定义。
[0333]
40.方面37至39中任一个的试剂盒,其还包含如方面5或6中所定义的第三和/或第四寡核苷酸引物。
[0334]
41.用于检测样品中具有确定序列的单链靶核酸的存在的方法,其包括:
[0335]
a)使样品与以下接触:
[0336]
i.第一寡核苷酸引物和第二寡核苷酸引物,其中该第一引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中的第一杂交序列杂交的区域的一条链,并且该第二引物在5'至3'方向上包含具有限制酶识别序列和切割位点以及能够与靶核酸中第一杂交序列上游的第二杂交序列的反向互补序列杂交的区域的一条链;
[0337]
ii.链置换dna聚合酶;
[0338]
iii.dntp;
[0339]
iv.一种或多种修饰dntp;
[0340]
v.第一限制酶,其不是切口酶,但在第一引物的识别序列和切割位点为双链时能够识别第一引物的识别序列,并仅切割具有该切割位点的该第一引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;和
[0341]
vi.第二限制酶,其不是切口酶,但在第二引物的识别序列和切割位点为双链时能够识别第二引物的识别序列,并仅切割具有切割位点的该第二引物链,而反向互补链的切割因一种或多种修饰的存在而被阻断,其中所述一种或多种修饰通过所述dna聚合酶使用一种或多种修饰dntp而掺入到所述反向互补链中;
[0342]
以不经温度循环在该靶核酸的存在下产生扩增产物;
[0343]
b)使步骤a)的扩增产物与以下接触:
[0344]
i.第一寡核苷酸探针,所述第一探针能够与扩增产物中的至少一个分子种类中的第一单链检测序列杂交,并且所述第一探针附着在允许其检测的部分上;和
[0345]
ii.第二寡核苷酸探针,所述第二探针能够与扩增产物中的该至少一个分子种类中的该第一单链检测序列上游或下游的第二单链检测序列杂交,并且所述第二探针附着在固体材料上或允许其附着于固体材料的部分上;
[0346]
其中第一和第二寡核苷酸探针之一在3'端封闭而不能通过dna聚合酶延伸,并且不能被第一或第二限制酶切割,其中第一和第二探针与扩增产物中的该至少一个分子种类的杂交产生检测物种类;和
[0347]
c)检测在步骤b)中产生的检测物种类的存在,其中检测物种类的存在指示该样品中存在靶核酸;
[0348]
并且其中使步骤b)中定义的第一或第二寡核苷酸探针在步骤a)进行的同时与样品接触。
[0349]
本文提到的所有专利和专利申请以其整体引入作为参考。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1