改善植物中基因组工程化和再生的方法与流程
1.本文描述了新的再生加强子(booster)基因和多肽,以及用于真核细胞中基因组工程化的方法和材料,尤其是用于通过加强子多肽和加强基因与基因组工程化组分的递送来提高基因组工程化(即,转化或基因组编辑)效率的方法。
2.发明背景
3.传统育种已提供了驯养的植物和动物,而现代生物技术(尤其是基因组工程化)正在扩大育种能力,并实现仅传统近缘种的杂交无法实现的改善。利用生物技术,已将诸如高产、除草剂抗性和昆虫抗性的多种特性导入作物,导致全球农业和粮食安全的巨大进步。但是,此类生物技术产品中存在外来dna会引发生物安全和环境问题。
4.通过分离出任何整合的dna,基因组编辑技术可用于生成靶基因组的位点特异性修饰,无需在最终植物中存在外来dna的。此外,通过瞬时表达,基因组编辑可涉及瞬时编辑活性,以产生位点特异性修饰,无需在过程的任何点进行dna整合。基因组编辑的植物,特别是那些源自瞬时活性的植物,将与常规的基因组修饰植物有显着不同,并且可能不会作为经遗传修饰的(gm)植物受到监管。因此,基因组编辑技术(特别通过瞬时编辑方法)可以在农业中提供高准确、安全和强大的植物育种和开发工具。
5.然而,基于瞬时活性的基因组工程化面临更多挑战。与稳定转化相比,瞬时工程化通常会导致更少的修饰细胞。如果没有整合的可选择标记,鉴定工程化化的细胞并在再生植物中实现同种修饰(homogenous modification)是高度挑战的。这些挑战阻碍了瞬时基因编辑作为改良植物的育种工具的常规实施。因此,非常需要增强基因组工程化效率的新方法和材料。
技术实现要素:
6.在一方面,提供了一种(再生)加强子多肽,其包含seq id no:2或48的氨基酸序列或与seq id no:2或48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。
7.在另一方面,提供了编码包含seq id no:2或48的氨基酸序列,或与seq id no:2或48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸。在一些实施方案中,编码包含seq id no:2的氨基酸序列、与seq id no:2至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸包含选自以下的编码序列:(i)包含seq id no:1的核苷酸序列的核酸;(ii)包含与seq id no:1至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(ii)中定义的核酸的互补链杂交
的核酸。在一些实施方案中,编码包含seq id no:48的氨基酸序列或与seq id no:48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸包含选自以下的编码序列:(i)包含seq id no:47的核苷酸序列的核酸;(ii)包含与seq id no:47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(ii)中定义的核酸的互补链杂交的核酸。
8.在另一方面,提供了包含编码包含seq id no:2或48的氨基酸序列,或与seq id no:2或48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸的重组基因。在一些实施方案中,编码包含seq id no:2的氨基酸序列或与seq id no:2至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸包含选自以下的编码序列:(i)包含seq id no:1的核苷酸序列的核酸;(ii)包含与seq id no:1至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(ii)中定义的核酸的互补链杂交的核酸。在一些实施方案中,编码包含seq id no:48的氨基酸序列,或与seq id no:48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸包含选自以下的编码序列:(i)包含seq id no:47的核苷酸序列的核酸;(ii)包含与seq id no:47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(ii)中定义的核酸的互补链杂交的核酸。
9.在一些实施方案中,所述核酸可操作地连接至异源启动子。所述异源启动子可以是强组成型启动子、组织特异性启动子、发育特异性启动子或诱导型启动子。
10.在另一方面,提供了一种dna构建体,优选为载体,其包含任何上述核酸或重组基因。在一些实施方案中,所述核酸包含选自以下的编码序列:(i)包含seq id no:1或47的核苷酸序列的核酸;(ii)包含与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(ii)中定义的核酸的互补链杂交的核酸。
11.在另一方面,提供了一种植物细胞,其包含上述加强子多肽、核酸、重组基因或dna构建体,特别是作为转基因或作为异源多肽或异源核酸。在一些实施方案中,所述加强子多肽包含seq id no:2或48的氨基酸序列。在一些实施方案中,所述加强子多肽包含与seq id no:2或48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。在一些实施方案中,所述核酸包含选自以下的编码序列:(i)包含seq id no:1或47的核苷
酸序列的核酸;(ii)包含与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(ii)中定义的核酸的互补链杂交的核酸。
12.还提供了一种植物、所述植物的部分、种子、胚胎或愈伤组织,其包含所述植物细胞。
13.在另一方面,提供了一种在植物细胞中进行遗传修饰的方法。所述方法包含(a)向植物细胞导入(i)上述所述加强子多肽、核酸、重组基因或dna构建体中的任何一项;和(ii)转基因和/或基因组工程化组分;(b)任选地,在允许从所述核酸、所述重组基因或所述dna构建体合成所述加强子多肽的条件下,培养所述植物细胞;和(c)任选地,在允许所述植物细胞的基因组在所述加强子多肽存在时通过感兴趣的转基因的整合和基因组工程化组分的活性进行遗传修饰的条件下,培养所述植物细胞。
14.在一些实施方案中,所述加强子多肽在植物细胞中瞬时存在、瞬时有活性和/或瞬时表达。在一些实施方案中,所述编码所述加强子多肽的核酸在植物细胞中瞬时存在、瞬时有活性和/或瞬时表达。
15.在在植物细胞中进行遗传修饰的方法的步骤(i)中,将选自plt5多肽、plt7多肽、rkd4多肽和rkd2多肽的另外一个或多个多肽,和/或选自编码plt5多肽、plt7多肽、rkd4多肽和rkd2多肽的核酸的一个或多个核酸,和/或适合于瞬时提高内源性plt5多肽、内源性plt7多肽、内源性rkd4多肽或内源性rkd2多肽的表达的一个或多个定点转录激活子,和/或编码这种定点转录激活子的核酸导入植物细胞。
16.在一些实施方案中,所述plt5多肽或plt7多肽在植物细胞中瞬时存在,瞬时有活性和/或瞬时表达,或编码所述plt5多肽或所述plt7多肽的核酸在植物细胞中瞬时存在,瞬时有活性的和/或瞬时表达。
17.在一些实施方案中,将所述加强子多肽或编码所述加强子多肽的核酸以及所述plt5多肽或编码所述plt5多肽的核酸一起导入或共同递送到所述植物细胞中,优选地同一个植物细胞,并任选地瞬时共表达。在一些实施方案中,将所述加强子多肽或编码所述加强子多肽的核酸以及所述plt7多肽或编码所述plt7多肽的核酸一起导入所述植物细胞中,并任选地瞬时共表达。
18.在一些实施方案中,所述plt5多肽包含seq id no:4或6的氨基酸序列,或与seq id no:4或6至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列,或编码plt5多肽的核酸编码这种多肽。所述plt7多肽包含seq id no:8或10的氨基酸序列,或与seq id no:8或10至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列,或编码plt7多肽的核酸编码这种多肽。在一些实施方案中,所述rkd4多肽包含seq id no:12、14或16的氨基酸序列,或与seq id no:12、14或16至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列,或编码rkd4多肽的核酸编码这种多肽。在一些实施方案中,rkd2多肽包含seq id no:18、20或22的氨基酸序
列,或与seq id no:18、20或22至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列,或编码rkd2多肽的核酸编码这种多肽。
19.在一些实施方案中,编码plt5多肽的核酸包含具有选自以下的编码序列的核酸:(i)包含seq id no:3或5的核苷酸序列的核酸;(ii)包含与seq id no:3或5至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(ii)中定义的核酸的互补链杂交的核酸。在一些实施方案中,编码plt7多肽的核酸包含具有选自以下的编码序列的核酸:(i)包含seq id no:7或9的核苷酸序列的核酸;(ii)包含与seq id no:7或9至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(iii)在严格杂交条件与(i)或(iii)中定义的核酸的互补链杂交的核酸。在一些实施方案中,编码rkd4多肽的核酸包含具有选自以下的编码序列的核酸:(1)包含seq id no:11、13或15的核苷酸序列的核酸;(2)包含与seq id no:11、13或15至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和(3)在严格杂交条件与(1)或(2)中定义的核酸的互补链杂交的核酸。在一些实施方案中,编码rkd2多肽的核酸包含具有选自以下的编码序列的核酸:a)包含seq id no:17、19或21的核苷酸序列的核酸;b)包含与seq id no:17、19或21至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸;和c)在严格杂交条件与a)或b)中定义的核酸的互补链杂交的核酸。
20.在一些实施方案中,所述基因组工程化组分包含a)双链断裂(dsb)诱导酶或编码其的核酸,以及任选地修复核酸分子,其中所述dsb诱导酶优选地识别所述细胞的基因组中的预定位点;b)单链断裂(ssb)诱导酶或编码其的核酸,以及任选地修复核酸分子,其中所述ssb诱导酶优选地识别所述细胞的基因组中的预定位点;c)碱基编辑器酶,其任选地与解除武装的dsb诱导酶或ssb诱导酶融合,其中所述碱基编辑器酶优选地识别所述细胞的基因组中的预定位点;或d)影响dna甲基化、组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化,组蛋白磷酸化、组蛋白核糖基化或组蛋白瓜氨酸化的酶,其优选地与解除武装的dsb诱导酶或ssb诱导酶融合,其中所述酶优选地识别所述细胞的基因组中的预定位点。
21.在一些实施方案中,包含dsb诱导酶或ssb诱导酶或其变体的基因组工程化组分是crispr/cas内切核酸酶、crispr/cas9内切核酸酶、crispr/cpf1内切核酸酶、crispr/csm1内切核酸酶、锌指核酸酶(zfn)、归巢内切核酸酶、大范围核酸酶或tal效应物核酸酶。
22.在一些实施方案中,步骤(b)中的基因组工程化组分的活性包含在植物细胞的基因组中诱导一个或多个双链断裂,在植物细胞的基因组中诱导一个或多个单链断裂,在植物细胞的基因组中诱导一个或多个碱基编辑事件,或在植物细胞的基因组中诱导一个或多个dna甲基化、组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化,组蛋白磷酸化、组氨酸sumo化、组蛋白核糖基化或组蛋白瓜氨酸化。
23.在一些实施方案中,在诱导一个或多个双链断裂或一个或多个单链断裂之后进行
非同源末端连接(nhej)和/或通过同源重组机制(hdr)对断裂进行同源性定向修复。
24.在一些实施方案中,步骤(a)(ii)中的转基因选自编码对非生物胁迫具有抗性或耐受性的基因,所述非生物胁迫包括干旱胁迫、渗透胁迫、热胁迫、冷胁迫、氧化胁迫、重金属胁迫、氮缺乏,磷缺乏、盐胁迫或涝渍,编码除草剂抗性的基因,所述除草剂抗性包括对草甘膦、草铵膦/草丁膦、潮霉素、原卟啉原氧化酶(ppo)抑制剂、als抑制剂和dicamba的抗性,编码对生物胁迫具有抗性或耐受性的基因,所述对生物胁迫具有抗性或耐受性的基因包括病毒抗性基因、真菌抗性基因、细菌抗性基因、昆虫抗性基因,或编码与产量相关的性状的基因,所述性状包括倒伏抗性、开花时间、抗落粒性(shattering resistance)、种子颜色、胚乳组分或营养成分。
25.在一些实施方案中,在步骤(c)中,所述基因组的修饰选自i)置换至少一个核苷酸;ii)缺失至少一个核苷酸;iii)插入至少一个核苷酸;iv)dna甲基化的改变;v)组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化,组蛋白磷酸化、组氨酸sumo化、组蛋白核糖基化或组蛋白瓜氨酸化的改变;或vi)i)
‑
v)的任何组合。
26.在一些实施方案中,所述方法有效地促进细胞增殖或细胞再生,优选在遗传修饰/基因组的修饰之后有效地促进细胞增殖或细胞再生,或有效地提高转基因、基因编辑或碱基编辑的植物的再生的效率。
27.在一些实施方案中,所述方法有效地从单个细胞优选胚胎细胞、体细胞或原生质体,或从愈伤组织细胞诱导直接或间接的胚胎发生,优选地在遗传修饰/基因组的修饰之后。
28.在一些实施方案中,所述方法有效地提高转基因向植物细胞中的稳定转化效率或有效地提高转基因的植物的产生的效率。
29.在一些实施方案中,所述方法有效地提高了基因组工程化组分编辑植物细胞的基因组的效率或有效地提高转基因、基因编辑或碱基编辑的植物的产生的效率。
30.在一些实施方案中,所述方法有效地改善源自顽抗基因型的植物的再生效率,有效地改善非常规组织类型的植物的再生效率,或有效地加速再生过程,优选在遗传修饰/基因组的修饰之后。
31.在一些实施方案中,所述定点转录激活子或编码其的核酸包含至少一个识别结构域和至少一个激活结构域,其中所述定点转录激活子被配置为提高内源性plt5多肽、内源性plt7多肽、内源性rkd4多肽或内源性rkd2多肽的表达,优选地通过结合至位于与内源性plt5多肽、内源性plt7多肽、内源性rkd4多肽或内源性rkd2多肽的起始密码子一定距离的调控区域。
32.在一些实施方案中,所述至少一个识别结构域是选自以下的分子或其片段:至少一个tal效应物、至少一个解除武装的crispr/核酸酶系统、至少一个锌
‑
指结构域、和至少一个解除武装的归巢内切核酸酶或其任何组合。在一些实施方案中,所述至少一个解除武装的crispr/核酸酶系统选自crispr/dcas9系统、crispr/dcpf1系统、crispr/dcsm1系统、crispr/dcasx系统或crispr/dcasy系统或其任何组合,其中所述至少一个解除武装的crispr/核酸酶系统包含至少一个导向rna。在一些实施方案中,所述至少一个激活结构域是酸性转录激活结构域,优选地,其中所述至少一个激活结构域来自稻白叶枯病黄杆菌的tal效应物基因、来自单纯疱疹的vp16或四聚体vp64、vpr、sam、scaffold、suntag、p300、
vp160或其任何组合。
33.在另一方面,提供了一种用于改善植物再生效率或提高植物细胞再生能力的方法,所述方法包含将上述加强子多肽、核酸、重组基因或dna构建体中的任一项导入植物细胞。
34.在另一方面,提供了根据上述方法获得或可获得的经遗传修饰的植物细胞。还提供了一种植物或植物部分,其包含所述经遗传修饰的植物细胞。
35.在另一方面,提供了一种用上述加强子多肽、核酸、重组基因或dna构建体中的至少一个包被的微粒。在一些实施方案中,所述微粒还被基因组工程化组分包被。
36.在另一方面,提供了一种用于通过微弹轰击对植物基因组进行遗传修饰的试剂盒,所述试剂盒包含(i)一个或多个微粒,和(ii)包被微粒的工具。在一些实施方案中,所述试剂盒还包含用基因组工程化组分包被所述微粒的工具。
37.在另一方面,提供了一种生产经遗传修饰的植物的方法,其包含以下步骤:(a)根据上述方法遗传修饰植物细胞,和(b)从步骤(a)的修饰的植物细胞再生植物。
38.在一些实施方案中,所产生的植物不含有在步骤(a)中共同导入的基因组工程化组分、加强基因和加强子多肽中的任一项。
39.在另一方面,提供了一种通过上述用于生产经遗传修饰的植物的方法获得或可获得的经遗传修饰的植物或其部分,或其后代植物。
40.还提供了上述加强子多肽、核酸、重组基因、dna构建体、微粒或试剂盒在改善植物再生效率或提高植物细胞再生能力中的用途。
附图说明
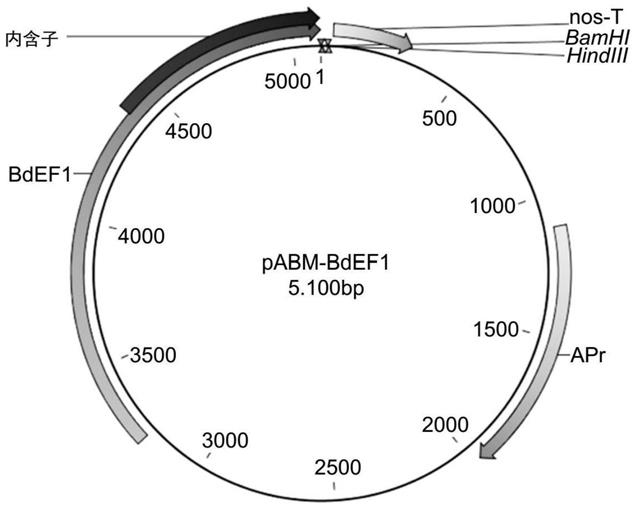
41.图1显示了加强基因表达载体pabm
‑
bdef1(seq id no:24)的图。bdef1和nos
‑
t分别定义了来自短柄草属(brachypodium)ef1基因的强组成型启动子和nos终止子。bamhi和hindiii说明了克隆位点。
42.图2显示了玉米plt5表达构建体pabm
‑
bdef1_zmplt5(seq id no:25)的图。玉米plt5基因(zmplt5)由短柄草属(pbdef1)的强组成型ef1启动子驱动。
43.图3显示了玉米plt7表达构建体pabm
‑
bdef1_zmplt7(seq id no:26)的图。玉米plt7基因(zmplt7)由短柄草属(pbdef1)的强组成型ef1启动子驱动。
44.图4显示了kws
‑
rbp1表达构建体pabm
‑
bdef1
‑
kws
‑
rbp1(seq id no:27)的图。kws
‑
rbp1基因由来自短柄草属(pbdef1)的强组成型ef1启动子驱动。
45.图5显示了小麦rkd4表达构建体pabm
‑
bdef1
‑
tarkd4(seq id no:28)的图。小麦rkd4(tarkd4)基因是由来自短柄草属(pbdef1)组成的强组成型ef1启动子驱动。
46.图6显示了编辑基因组的crispr cpf1表达构建体pgep359(seq id no:29)的图。tdtomato定义了tdtomato基因(tdt)。zmlpcpf1定义了毛螺菌科细菌crispr/cpf1(lbcpf1)基因的玉米优化了密码子的cds。
47.图7显示了编辑基因组的crispr rna构建体pgep324(seq id no:30)的图。crgep05定义了靶向玉米hmg13基因的crrna5。zmubi1定义了来自玉米泛素1基因的启动子和内含子。tnos定义了nos终止子。
48.图8显示了在zmplt5(图2)与pgep359(图6)和pgep324(图7)质粒共同轰击后18小
时,a188未成熟胚胎的荧光图像。轰击后18小时获取图像。
49.图9显示了在hi ii未成熟胚胎中促进胚胎发生的zmplt5和kws
‑
rbp1或zmplt7和kws
‑
rbp1的瞬时共表达。图像显示了与加强基因构建体共同轰击后5天,从玉米hi ii胚胎诱导的胚胎发生结构(b)。图9a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图9b显示了zmplt5(图2)和kws
‑
rbp1(图4)与ge构建体(ge构建体加zmplt5+kws
‑
rbp1)的共同递送。图9c显示了zmplt7和kws
‑
rbp1与ge构建体(ge构建体加上zmplt7+kws
‑
rbp1)的共同递送。轰击后5天获取图像。
50.图10显示了zmplt5和kws
‑
rbp1或zmplt7和kws
‑
rbp1的瞬时共表达促进了玉米hi ii胚胎中共同递送的tdt报告基因的稳定转化。红色荧光图像显示了共同轰击后12天从玉米hi ii胚胎产生的稳定的tdt表达结构(图10a至10c)。图10a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图10b显示了zmplt5和kws
‑
rbp1与ge构建体(ge构建体加上zmplt5+kws
‑
rbp1)的共同递送。图10c显示了zmplt7和kws
‑
rbp1与ge构建体(ge构建体加上zmplt7+kws
‑
rbp1)的共同递送。图10d是显示zmplt5或zmplt7与kws
‑
rbp1的共同递送提高了tdt报告基因的稳定转化频率的图。轰击后12天获取结果。
51.图11显示zmplt5和kws
‑
rbp1或zmplt7和kws
‑
rbp1的瞬时共表达促进a188未成熟胚胎中的胚胎发生。图像显示用加强基因构建体共同轰击后7天,从玉米a188胚胎诱导的胚胎发生结构。图11a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图11b显示了zmplt5和kws
‑
rbp1与ge构建体(ge构建体加上zmplt5+kws
‑
rbp1)的共同递送。图11c显示了zmplt7和kws
‑
rbp1与ge构建体(ge构建体加上zmplt7+kws
‑
rbp1)的共同递送。轰击后7天获取图像。
52.图12显示了zmplt5和kws
‑
rbp1的瞬时共表达促进了玉米a188胚胎中共同递送的tdt报告基因的稳定转化。红色荧光图像显示了共同轰击(a到c)后16天从玉米a188胚胎产生的稳定的tdt表达结构。图12a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图12b显示了zmplt5和kws
‑
rbp1与ge构建体(ge构建体加上zmplt5+kws
‑
rbp1)的共同递送。图12c显示了zmplt7和kws
‑
rbp1与ge构建体(ge构建体加上zmplt7+kws
‑
rbp1)的共同递送。图12d显示了zmplt5或zmplt7和kws
‑
rbp1的共同递送提高了tdt报告基因的稳定转化频率。轰击后12天获取结果。
53.图13显示了玉米wus2(zmwus2)启动子报告构建体pamk
‑
zmwus2
‑
tdt
‑
nost(seq id no:43)的图。tdtoma定义了荧光tdt报告基因,其由玉米wuschel2启动子(pzmwus2)驱动。
54.图14显示小麦tarkd4基因通过玉米未成熟胚胎ie(上图)和叶(下图)中的瞬时共同轰击而激活玉米wus2启动子。图14a仅显示了玉米wus2启动子报告构建体(图13;seq id no:46)(仅pzmwus2报告)。图14b显示了玉米wus启动子报告构建体和小麦rkd4构建体的共同轰击(图5)(pzmwus2报告和tarkd4)。轰击后44小时获取图像。
55.图15显示了在hi ii未成熟胚胎中促进胚胎发生的小麦rkd4(tarkd4)和kws
‑
rbp1的瞬时共表达。图像显示了与加强基因构建体共同轰击后5天,从玉米hi ii胚胎诱导的胚胎发生结构。图15a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图15b显示了tarkd4和kws
‑
rbp1与ge构建体(ge构建体加kws_rgb1+tarkd4)的共同递送。轰击后5天获取图像
56.图16显示小麦rkd4(tarkd4)和kws
‑
rbp1的瞬时共表达促进了玉米hi ii胚胎中共
同递送的tdt报告基因的稳定转化。红色荧光图像显示了共同轰击后12天从玉米hi ii胚胎产生的稳定的tdt表达结构(图16a至16c)。图16a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图16b显示了tarkd4和kws
‑
rbp1与ge构建体(ge构建体加上tarkd4+kws
‑
rgb1)的共同递送。图16c显示了在hi ii未成熟胚胎中tarkd4和kws
‑
rbp1的共同递送提高了tdt报告基因的稳定转化频率。轰击后12天获取结果。
57.图17显示小麦rkd4和kws
‑
rbp1的瞬时共表达促进a188未成熟胚胎中的胚胎发生。图像显示用加强基因构建体共同轰击后5天,从玉米hi ii胚胎诱导的胚胎发生结构。图17a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图17b显示了tarkd4和kws
‑
rbp1与ge构建体(ge构建体加上tarkd4+kws
‑
rbp1)的共同递送。轰击后5天获取图像。
58.图18显示了小麦rkd4和kws
‑
rbp1的瞬时共表达促进了玉米a188胚胎中共同递送的tdt报告基因的稳定转化。红色荧光图像显示了共同轰击(a到c)后14天从玉米a188胚胎产生的稳定的tdt表达结构。图18a显示了仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅ge构建体)的轰击。图18b显示了kws
‑
rbp1和tarkd4与ge构建体(ge构建体加上tarkd4+kws
‑
rbp1)的共同递送。图18c显示了tarkd4和kws
‑
rbp1的共同递送提高了在玉米a188未成熟胚胎中tdt报告基因的稳定转化频率。轰击后14天获取结果。
59.图19显示了zmplt5或zmplt7的瞬时共表达促进了玉米中的瞬时基因组编辑。将基因组编辑构建体pgep359和pgep324与加强基因构建体共同轰击进玉米hi ii未成熟胚胎中。编辑效率定义为100个再生植物中具有位点特异性修饰的植物数目。瞬时编辑用于描述没有遗传物质的整合的由基因组编辑的瞬时活动所导致位点特异性修饰。
60.图20描述了droplet digital pcr结果,其显示了无需选择通过加强基因和基因组编辑组分的瞬时共表达在再生植物中的同种基因组编辑。约50%和100%的位点特异性indel比率分别表明单等位基因和双等位遗传修饰。图20a显示了使用水(底部)或野生型dna(wt液滴)的droplet digital pcr的阴性对照结果。图20b显示了源自加强子和基因组编辑组分的瞬时共表达的编辑的t0植物的droplet digital pcr结果。顶部和中间的图显示了来自两个编辑的t0植物的接近100%的indel比率,其表明同种双等位遗传修饰,而下图说明了同种单等位基因编辑事件。
61.图21描绘了通过sanger测序分析,来自编辑的t0植物的靶区域的多序列比对。图21a和21b分别显示了双等位基因事件cb0113
‑
t
‑
591和cb0113
‑
t
‑
632。图21c显示了单等位基因事件cb0113
‑
t
‑
303。标记了pam和预期的切割位点。也标记了pam位点(ttta)附近的snp(a188的g和b73等位基因的a)。测序结果证实在这些t0植物中发生了同种修饰。具体而言,cb0113
‑
t
‑
591具有分别从a188和b73等位基因中5bp和2bp缺失的双等位遗传修饰。cb0113
‑
t
‑
632包含分别a188和b73等位基因中的6bp和5bp缺失的双等位基因编辑。cb0113
‑
t
‑
303具有a188等位基因8bp缺失,而b73等位基因未修饰。cb0113
‑
t
‑
591和cb0113
‑
t
‑
632源自zmplt5和kws
‑
rbp1的共表达,且cb0113
‑
t
‑
303来自zmplt7和kws
‑
rbp1与基因组编辑构建体的共表达。
62.图22显示了kws
‑
rbp2表达构建体(pabm
‑
bdef1_kws_rbp2)图。kws
‑
rbp2基因自其蛋白质序列中进行了玉米密码子优化且由integrated dna technologies(idt,san diego,ca,usa)合成,并在bamhi和bamiii的克隆位点克隆进表达载体pabm
‑
bdef1(图1)中。
pkws
‑
rbp2基因由来自短柄草属(pbdef1)的强组成型ef1启动子驱动。
63.图23说明了zmplt5和kws
‑
rbg1或zmplt5和kws
‑
rbp2的共同递送促进了玉米a188的再生比率。仅基因组工程化构建体pgep359(图6)和pgep324(图7)(仅tdt)轰击玉米未成熟胚胎,或与zmplt5和kws_rbp1(tdt加上zmplt5和kws_rbp1)或与zmplt5和kws_rbp2(tdt加上zmplt5和kws_rbp2)共同轰击玉米未成熟胚胎。
64.图24显示zmplt5和kws_rbg1或zmplt5和kws_rbp2的共同递送促进了tdtomato报告基因在玉米a188中的稳定转化效率。红色荧光图像显示了共同轰击(a至c)后10天从玉米a188胚胎产生的稳定的tdt表达结构(亮点/区域)。a:仅基因组工程化(ge)构建体pgep359(图6)和pgep324(图7)(仅tdt)轰击;b:ge构建体与zmplt5和kws
‑
rbp1(tdt加zmplt5和kws_rbp1)的共同轰击;c:ge构建体与zmplt5和kws
‑
rbp2(tdt加zmplt5和kws_rbp2)的共同轰击。轰击后10天获取图像。
65.图25显示了zmplt5和kws
‑
rbg1或zmplt5和kws_rbp2的共同递送促进了tdtomato报告基因在玉米a188中的稳定转化效率。红色荧光图像显示了共同轰击(a到c)后16天从玉米a188胚胎产生的稳定的tdt表达结构(亮点/区域)。a:仅基因组工程化(ge)构建体pgep359(图6)和pgep324(图7)(仅tdt)轰击;b:ge构建体与zmplt5和kws
‑
rbp1(tdt加zmplt5和kws_rbp1)的共同轰击;c:ge构建体与zmplt5和kws
‑
rbp2(tdt加zmplt5和kws_rbp2)的共同轰击。d:zmplt5和kws
‑
rbp1或zmplt5和kws
‑
rbp2的共同递送提高了tdt报告基因的稳定转化频率。轰击后16天记录数据。轰击后16天获取图像。
66.发明详述
67.定义
68.除非另有定义,否则本文使用的技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。
69.如在本申请的上下文中使用的,术语“约”是指该值的+/
‑
10%,优选地该值的+/
‑
5%。例如,应将约100个核苷酸(nt)理解为介于90nt和110nt之间的值,优选介于95nt和105nt之间。
70.如本文所用,术语“加强子”、“加强子基因”、“加强子多肽”、“加强多肽”、“加强基因”和“加强因子”是指蛋白质/肽或编码蛋白质/多肽的(多)核酸片段,其可导致改善的基因组工程化和/或改善的转化或基因编辑植物细胞的植物再生。这样的蛋白质/多肽可以提高植物细胞的性能或能力,该植物细胞优选地源自体细胞组织、胚组织、愈伤组织或原生质体,以在整个植物,优选地在可育植物中再生。因此,它们可以调节体细胞胚的形成(体细胞胚胎发生)和/或可以提高植物细胞的增殖速率。示例性的加强子多肽包括但不限于kws
‑
rbp1(例如,seq id no:2)和变体。其变体是例如kws
‑
rbp2(seq id no:48),其具有在氨基酸序列水平93%的序列同一性。转化的或基因编辑的植物细胞的再生可包括体细胞胚胎发生的过程,其是一种人工过程,其中植物或胚源自单个体细胞或一组体细胞。体细胞胚是从通常不参与胚发育的植物细胞(即如萌芽(bud)、叶、芽(shoot)等植物组织)形成的。该过程的应用可包括:克隆繁殖遗传上均一的植物材料;消除病毒;提供用于基因转化的源组织;从单个细胞(诸如原生质体)生成完整植物;发展合成种子技术。可以培养源自感受态的源组织的细胞以形成愈伤组织。可以操纵组织培养基中的植物生长调节剂,例如植物生长素或细胞分裂素以诱导愈伤组织形成,以及随后改变该植物生长调节剂以诱导从愈伤组织形
成胚。已经以直接或间接两种方式描述了体细胞胚胎发生的发生。当直接从外植体组织产生相同克隆的胚胎时发生直接胚胎发生。当外植体产生未分化或部分分化的细胞(即愈伤组织),然后其维持或分化成植物组织(如叶,茎或根)时,发生间接胚胎发生。
71.根据本发明公开的术语“转基因的(transgenic)”是指包含基因或遗传构建体的植物、植物细胞、组织、器官或材料,其包含通过自然手段或另一生物的转化技术已转移至植物、植物细胞、组织、器官或材料中的“转基因”。术语“转基因”包含核酸序列(包括dna或rna)或氨基酸序列,或其组合或混合。因此,术语“转基因”不限于通常被识别为“基因”的序列,即编码蛋白质的序列。它也可以指,例如,非编码蛋白质的dna或rna序列。因此,术语“转基因的”通常意味着相应的核酸或氨基酸序列不是天然存在于相应的靶细胞(包括植物、植物细胞、组织、器官或材料)。因此,本文所用的术语“转基因”或“转基因的”是指核酸序列或氨基酸序列,其从一种生物的基因组获得或合成产生,然后通过分子生物学,遗传学等人工技术其以瞬时或稳定方式导入另一种生物。如本文所用,“植物材料”是指可以在任何发育阶段从植物获得的任何材料。植物材料可以在植物中或从植物或其植物组织或器官的体外培养物中获得。因此,该术语包含植物细胞、组织和器官以及发育的植物结构以及亚细胞组分,如核酸、多肽以及可以在植物细胞或区室内找到和/或可以由植物产生或可以从处于任何发育阶段的任何植物细胞、组织或植物的提取物中获得的所有化学植物物质或代谢物。该术语还包含植物材料(例如原生质体)的衍生物,其衍生自植物材料所包含的至少一个植物细胞。因此,该术语还包含植物的分生组织细胞或分生组织。
72.本文使用的术语“基因组工程化”是指用于植物细胞的任何遗传信息或基因组的遗传修饰的策略和技术,其包含基因组转化、基因组编辑。因此,“基因组编辑”是指用于对植物细胞的任何遗传信息或基因组进行靶向、特异性修饰的技术。因此,该术语既包含基因编码区域的基因编辑,还包含除基因组的基因编码区域以外的区域的编辑。它还包含植物细胞的核(如果存在)以及其他遗传信息的编辑或工程化。此外,“基因组工程化”还包含表观遗传编辑或工程化,即例如甲基化、组蛋白修饰或可能引起基因表达可遗传改变的非编码rna的靶向修饰。
73.如本文所用,术语“基因组编辑”是指用于植物细胞的任何遗传信息或基因组的靶向、特异性修饰的策略和技术。因此,这些术语既包含基因编辑,也包含基因组中除基因编码区域以外的区域的编辑,例如内含子序列、非编码rna、mirna、调节元件序列(如启动子、终止子、转录激活子结合位点、顺式或反式作用原件)。另外,“基因组编辑”可以包含针对单个核碱基的靶向置换的碱基编辑。它可以进一步包含植物细胞的核基因组以及其他遗传信息(即线粒体基因组或叶绿体基因组以及mirna、mrna前体或mrna)的编辑。此外,“基因组编辑”可以包含可能导致基因表达的遗传改变的表观遗传编辑或工程化,即例如dna甲基化或组蛋白修饰(诸如组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化)的靶向修饰。“基因组编辑”还可包含可能导致基因表达的遗传改变的非编码rna的表观遗传编辑或工程化。
74.如本文所用,“碱基编辑器(base editor)”是指蛋白质或其片段(该片段具有与其衍生的蛋白质相同催化活性),该蛋白质或其片段单独或以分子复合物(在本文中称为碱基编辑复合物)形式提供时具有介导靶向碱基修饰的能力,即如果碱基转换未引起沉默突变而是引起由包含要用碱基编辑器转换的位置的密码子所编码的氨基酸的转换,感兴趣的碱
基的转换导致感兴趣的点突变,进而能导致靶向突变。
75.如本文所用,“调节元件”是指核苷酸序列,其不是编码蛋白质的核苷酸序列的一部分,而是介导编码蛋白质的核苷酸序列的表达。调节元件包括例如启动子、顺式调节元件、增强子、内含子或终止子。根据调节元件的类型,它位于编码蛋白质的核苷酸序列之前(即其5')或之后(即其3')的核酸分子上。术语“可操作地连接”是指调节元件以这种方式与编码蛋白质的核苷酸序列连接,即,相对于编码蛋白质的核苷酸序列以这种方式定位在例如核酸分子上,使得在活细胞中可发生调节元件的控制下的该编码蛋白的核苷酸序列的表达。
76.如本文所用,“上游”表示核酸分子上更靠近该核酸分子的5'端的位置。同样地,术语“下游”是指核酸分子上更靠近该核酸分子的3'端的位置。为避免疑问,核酸分子及其序列通常以其5'至3'方向(从左至右)表示。
77.如本文所用,“侧翼区域”是具有与位于预选位点侧翼(即上游或下游)的dna区域的核苷酸序列同源的核苷酸序列的修复核酸分子的区域。
78.如本文所用,“瞬时表达”是指这样的现象,其中转移的蛋白/多肽和编码该蛋白/多肽的核酸片段在细胞中瞬时地表达和/或有活性,并不久后随细胞生长而关闭和/或降解。
79.如本文所用,“双链dna断裂诱导酶”、“诱导双链断裂的酶”或“dsbi酶”是能够在被称为“识别位点”或“预定位点”的特定核苷酸序列诱导双链dna断裂的酶。因而,“单链dna或rna断裂诱导酶”、“诱导单链断裂的酶”或“ssbi酶”是能够在被称为“识别位点”或“预定位点”的特定核苷酸序列诱导单链dna断裂的酶。
80.如本文所用,“修复核酸分子”是单链或双链dna分子或rna分子,其用作在切割位点或其邻近基因组dna或rna修饰的模板。如本文所用,“用作基因组dna修饰的模板”是指通过预选位点侧翼的在靶基因组中的侧翼区域和相应同源区域之间的同源重组,任选地与修复核酸分子的两端之一的非同源末端连接(nhej)组合(例如仅有一个侧翼区域)来在预定位点复制或整合修复核酸分子。
81.如本文所用,“基因组的修饰”是指在至少一个核苷酸或通过至少一次表观遗传编辑改变了基因组。
82.如本文所用,“预选位点”、“预定位点”或“预定义位点”表示在基因组(例如核基因组或叶绿体基因组)中期望插入、置换和/或缺失一个或多个核苷酸的位置上的特定核苷酸序列。
83.如本文所用,“植物激素”或“植物生长调节剂”指促进植物细胞分裂和/或植物形态发生的天然存在或合成的任何材料和化学物质。如本文所用,“再生”是指单个或多个细胞增殖并发展成组织、器官最终为整个植物的过程。
84.如本文所用,术语“载体”或“质粒(载体)”是指尤其包含用于导入或转化,转染或转导进任何真核细胞(包括植物、植物细胞、组织、器官或材料)中的质粒或(质粒)载体、粘粒、人工酵母染色体或细菌人工染色体(yac和bac)、噬菌粒、基于噬菌体的载体、表达盒、分离的单链或双链核酸序列(其包含线性或环状形式的序列)、或氨基酸序列、病毒载体(包括修饰的病毒)及其组合或混合。
85.在重组基因的背景下的“重组体”可以包含调节序列和/或定位序列。根据本发明
no:47的核苷酸序列的核酸(其编码seq id no:48的序列)一起导入至植物细胞中。
95.kws
‑
rbp2加强子多肽的序列
96.mesgsgtaagsgyvyrqsgstrwnptaeqlsllkelyyrngirtpsadqirqisarlsrygkiegknvfywfqnhkarerqkkrlstvgcdpaliemgnvaslefgtesaleslssgpsselreaptrkfyekktvgenstiinpveqnctlscgtsqefqyavdsrrvmkameekqatddepdgnkwtesnrhvktlplfplhnnedqtliksdkeiyclgscekkmdlsplghsgsqrasaldlclslgnescglhdn(seq id no:48)
97.编码kws
‑
rbp2加强子多肽的核酸序列
98.atggaatcgggctccggcacggcggcagggtctggttatgtctatcggcagagcggaagcacccggtggaatccaacagcagaacagttgtcgctgctcaaggaactttattaccggaatggaattcggacaccgtcggcagatcaaattaggcaaatttcggcccggctgtccagatacggcaaaatagaagggaaaaacgtcttttactggtttcaaaatcataaagcacgggaacggcagaagaaaagactttccacggtcggctgcgaccctgctctcatagaaatgggtaacgtcgcgagcttggaatttgggaccgaaagcgctcttgaatctctcagctcaggcccgtccagcgagttgcgcgaggctcctacccgcaagttttatgagaagaaaaccgttggtgagaacagcaccataatcaatcctgttgagcagaactgcacactttcttgcggtacttcgcaggaatttcagtatgctgttgatagccgccgggtgatgaaggcaatggaagagaagcaagcaacggatgatgaaccggacggaaacaaatggacggagtcgaacaggcatgtgaagaccctccctcttttccccttgcataataatgaagatcagaccttgatcaagtcggacaaggaaatttattgccttgggagctgtgaaaaaaaaatggatctgtccccattgggacactcgggctctcagagggcgtcggcactggatttgtgcctgtctttgggtaatgaatcttgtggcctccacgacaattga(seq id no:47)
99.还提供了编码包含seq id no:2或48的氨基酸序列的加强子多肽。还提供了编码包含与seq id no:2或48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸。
100.所述编码包含seq id no:2的氨基酸序列或与seq id no:2至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽可包含包含seq id no:1的核苷酸序列的核酸。核酸可包含与seq id no:1至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列。或者,该核酸可以在严格杂交条件与包含seq id no:1核苷酸序列的核酸或与包含与seq id no:1至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸的互补链进行杂交。
101.编码包含seq id no:48的氨基酸序列的加强子多肽或与seq id no:48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸还可包含包含seq id no:47的核苷酸序列的核酸。所述核酸可包含与47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列。或者,该核酸可以在严格杂交条件与包含seq id no:47的核苷酸序列的核酸或与包含与seq id no:47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、
93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸的互补链进行杂交。
102.提供一种包含编码包含seq id no:2或48的氨基酸序列或与seq id no:2或48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的加强子多肽的核酸的重组基因。该核酸可可操作地与一个或多个调节元件连接。该调节元件可以是启动子、顺式调节元件、增强子、内含子或终止子。该调节元件可以是核酸序列的5'。该调节元件可以是核酸序列的3'。该核酸可包含包含seq id no:1或47的核苷酸序列的核酸。该核酸可包含与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列。该核酸可以在严格的杂交条件与包含seq id no:1或47的核苷酸序列的核酸的互补链进行杂交或与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸的互补链进行杂交。
103.在一些实施方案中,核酸与异源启动子可操作地连接。异源启动子可以是强组成型启动子(诸如双35s启动子(d35s))、组织特异性启动子、发育特异性启动子或诱导型启动子。异源启动子可以是来自ef1基因的启动子(诸如短柄草属ef1基因(pbdef1,seq id no:22)、来自泛素1基因的启动子(诸如玉米泛素1基因)、wuschel2启动子(诸如玉米wushcel2启动子(pzmwus2))。异源启动子可以是美国专利号6,528,701描述的泛素启动子,该专利以引用的方式并入本文。可以使用的各种组织特异性启动子描述于美国专利号7,763,774和7,767,801,其各自通过引用并入本文。
104.还提供了包含以上任何核酸或重组基因的dna构建体,优选为载体。该核酸可包含seq id no:1或47的核苷酸序列的的核酸。所述核酸可包含与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列。另外,该核酸可以在严格杂交条件与包含seq id no:1或47的核苷酸序列的核酸的互补链杂交或与包含与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸的互补链杂交。在一些实施方案中,dna构建体是质粒。
105.植物细胞
106.在另一方面,提供了一种植物细胞,其包含本文所述的加强子多肽、核酸、重组基因和dna构建体中的一个或多个,优选地作为转基因。在一些实施方案中,加强子多肽包含seq id no:2或48的氨基酸序列。在一些实施方案中,加强子多肽包含与与seq id no:2或48至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。该核酸可包含包含seq id no:1或47的核苷酸序列的核酸。该核酸可包含包含与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的核苷酸序列的核酸。该核酸可以在严格杂交条件与包含seq id no:1或47的核苷酸序列的核酸的互补链杂交或与包含与seq id no:1或47至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、
rapa)、萝卜(raphanus sativus)、芥菜(brassica juncacea)、黑芥(brassica nigra)、芝麻菜亚种sativa(eruca vesicaria subsp.sativa)、甜橙(citrus sinensis)、麻风树(jatropha curcas)、毛果杨(populus trichocarpa)、蒺藜状苜蓿(medicago truncatula)、山下鹰嘴豆(cicer yamashitae)、cicer bijugum、鹰嘴豆(cicer arietinum)、网状鹰嘴豆(cicer reticulatum)、cicer judaicum、木豆(cajanus cajanifolius)、蔓草虫豆(cajanus scarabaeoides)、菜豆(phaseolus vulgaris),大豆(glycine max)、棉花(gossypium sp.)、紫云英(astragalus sinicus)、百脉根(lotus japonicas)、夏堇(torenia fournieri)、洋葱(allium cepa)、葱(allium fistulosum)、蒜(allium sativum)、向日葵(helianthus annuus)、菊芋(helianthus tuberosus)和/或韭菜(allium tuberosum)。特别优选地是甜菜(beta vulgaris)、玉米(zea mays)、小麦(triticum aestivum)、大麦(hordeum vulgare)、黑麦(secale cereale)、向日葵(helianthus annuus)、马铃薯(solanum tuberosum)、两色高粱(sorghum bicolor)、芜菁(brassica rapa)、欧洲油菜(brassica napus)、芥菜(brassica juncacea)、甘蓝(brassica oleracea)、萝卜(raphanus sativus)、水稻(oryza sativa)、大豆(glycine max)和/或棉花(gossypium sp.)。
110.经遗传修饰的植物细胞可以是整个植物的部分或其一部分。因此,本发明还涉及包含上述经遗传修饰的植物细胞的植物或植物部分。
111.在允许该植物细胞的基因组在至少一个加强因子存在时通过整合感兴趣的转基因和基因组工程化组分的活性进行遗传修饰的条件下,培养已(共)导入基因组工程化组分的植物细胞。
112.植物细胞的遗传修饰
113.还提供了一种在植物细胞中进行遗传修饰的方法。该方法包括将(i)本文所述的任何加强子多肽、核酸、重组基因或dna构建体和(ii)转基因和/或基因组工程化组分导入植物细胞。可以在允许从核酸、重组基因或dna构建体合成加强子多肽的条件培养植物细胞。可在允许该植物细胞的基因组在加强子多肽存在下通过基因组工程化组分的活性进行遗传修饰的条件下培养植物细胞。
114.基因组工程化组分可以作为蛋白质和/或编码基因组工程化组分的核酸导入,特别是作为dna诸如质粒dna、rna、mrna或rnp。基因组工程化可用于生产转基因、基因编辑或碱基编辑的植物材料。
115.对于要修饰的植物细胞,可以使用基于生物学方法的转化方法,诸如农杆菌属转化或病毒载体介导的植物转化。一种常见的生物学手段是用农杆菌转化。其几十年来已用于各种不同的植物材料。病毒载体介导的植物转化也可以用于将遗传物质导入感兴趣的细胞。农杆菌属介导的转化是指使用根癌农杆菌(一种作为天然基因工程化载体的土壤细菌)将外来dna递送到植物细胞中的方法。根癌农杆菌可侵袭植物并将外来dna转移进非常广泛的植物。
116.或者,可以使用基于物理递送方法的转化方法,如粒子轰击或显微注射。粒子轰击包括基因枪法转染(biolistic transfection)或微粒介导的基因转移,其是指将包含感兴趣的核酸或遗传构建体的包被微粒或纳米粒子转移到靶细胞或组织中的物理递送方法。物理导入手段适合于导入核酸,即rna和/或dna,以及蛋白质。粒子轰击和显微注射已发展成
为将遗传物质导入感兴趣的植物细胞或组织的突出技术。helenius等人,“gene delivery into intact plants using the helios
tm gene gun”,plant molecular biology reporter,2000,18(3):287
‑
288公开了一种粒子轰击作为将材料导入植物细胞的物理方法。因此,存在多种植物转化方法以将遗传构建体形式的遗传物质导入感兴趣的植物细胞,包含植物生物技术领域技术人员已知的并且可以用于将编码至少一个与壁相关的激酶的至少一个基因导入植物细胞、组织、器官或完整植物中至少一个的至少一个细胞中的生物和物理手段。
117.如本文所用,术语“粒子轰击”,也称为“基因枪法转染”或“微粒介导的基因转移”,是指一种用于将包含加强基因、加强子多肽、基因组工程化组分和/或转基因的包被微粒或纳米颗粒转移进靶细胞或组织中的物理递送方法。微米或纳米粒子起射弹的作用,并使用合适的装置(通常称为基因枪)在高压下发射到感兴趣的靶结构上。通过粒子轰击进行的转化使用包被有感兴趣的构建体的金属微粒,然后使用称为“基因枪”的设备(sandford等,1987)以足够快的高速(~1500km/h)将其发射到靶细胞上,以使其能够穿透靶组织细胞壁,但不够严酷以导致细胞死亡。对于原生质体,其细胞壁被完全去除,条件在逻辑上是不同的。至少一个微粒上的沉淀的核酸或遗传构建体在轰击后释放到细胞中。微粒的加速是通过高压放电或压缩气体(氦气)来实现的。关于所使用的金属颗粒,必须无毒,无反应,并且其直径小于靶细胞的直径。最常用的是金或钨。基因枪及其相关系统的制造商和供应商可以公开获得大量有关其一般用途的信息。
118.在微粒轰击的一个特别优选的实施方案中,一种或多种加强基因、加强子多肽、基因组工程化组分和/或转基因是通过包含具有0.4
‑
1.6微米(μm)范围大小,优选0.4
‑
1.0μm范围大小的金颗粒的微载体共同递送的,。在示例性方法中,每一次轰击使用10
‑
1000μg的金颗粒,优选50
‑
300μg。
119.可以使用例如bio
‑
rad pds
‑
1000/he粒子枪或手持式helios基因枪系统将加强基因、加强子多肽、基因组工程化组分和/或转基因递送进靶细胞中。当使用pds
‑
1000/he粒子枪系统时,轰击破裂压力为450psi至2200psi,优选为450
‑
1100psi,而helios基因枪系统的破裂压力为100
‑
600psi。可以将一种以上的化学物质或构建体与基因组工程化组分共同递送到进细胞中。
120.可以将上述用于转化和转染的递送方法同时应用于导入本发明的工具。同样,存在用于将感兴趣的核酸或氨基酸构建体特异性地导入植物细胞的特异性转化或转染方法,包括电穿孔、显微注射、纳米颗粒和细胞穿透肽(cpp)。此外,存在基于化学的转染方法以导入遗传构建体和/或核酸和/或蛋白质,尤其包含用磷酸钙转染、使用脂质体(例如阳离子脂质体)转染或使用阳离子聚合物(包括dead
‑
右旋糖酐或聚乙烯亚胺或其组合)转染。单独或组合使用以上递送技术可用于体内(包括植物中)或体外方法。
121.在一些实施方案中,基因组工程化组分包含:
122.a)双链断裂(dsb)诱导酶或编码其的核酸,以及任选地修复核酸分子,其中所述dsb诱导酶优选地识别所述细胞的基因组中的预定位点;
123.b)单链断裂(ssb)诱导酶或编码其的核酸,以及任选地修复核酸分子,其中所述ssb诱导酶优选地识别所述细胞的基因组中的预定位点;
124.c)碱基编辑器酶,其任选地与解除武装的dsb诱导酶或ssb诱导酶融合,其中所述
binding specificity of tal
‑
type iii effectors,science,326(5959),509
‑
1512;moscou&bogdanove(2009)。a simple cipher governs dna recognition by tal effectors,science,326(5959),1501
‑
1501;以及wo2010/079430、wo2011/072246、wo2011/154393、wo2011/146121、wo2012/001527、wo2012/093833、wo2012/104729、wo2012/138927、wo2012/138939)。wo2012/138927还描述了单体(紧凑型)talen和具有各种催化结构域的tale及其组合。
130.最近,已经描述了一种新型的可定制内切核酸酶系统,即所谓的crispr/cas系统。crispr系统在其自然环境中描述了一种分子复合物,该分子复合物包含至少一个与可制备特异性dna双链断裂的cas核酸酶或另一种crispr核酸酶(如cpf1核酸酶)或csm1核酸酶(zetsche等,“cpf1是2类crispr
‑
cas系统的单rna指导内切核酸酶”,细胞(cell),163,第1
‑
13页,2015年10月;us 2017/0233756 a1)结合的非编码rna。目前,crispr系统分为两类,包括五种类型的crispr系统,例如用cas9作为效应物的ii型系统,以及用cpf1作为效应分子的v型系统(makarova等,nature rev.microbiol.,2015)。在人工crispr系统中,可以将合成的非编码rna和crispr核酸酶和/或可选的修饰的crispr核酸酶(修饰用作切口酶或缺乏任何核酸酶功能)与至少一种合成或人工导向rna或grna和/或tracrrna结合使用(makarova等,2015,同上)。crispr/cas在自然系统中介导的免疫应答需要crispr
‑
rna(crrna),其中控制crispr核酸酶特异性激活的该导向rna的成熟在迄今为止已表征的各种crispr系统之间存在显著差异。首先,将入侵dna(也称为间隔区域)整合到crispr基因座近端的两个相邻重复区域之间。ii型crispr系统将cas9核酸酶编码为干扰步骤的关键酶,该系统既包含crrna,又包含反式激活rna(tracrrna)作为指导基序。这些杂交并形成双链(ds)rna区域,其被rnaseiii识别并可以进行裂解以形成成熟的crrna。然后,这些反过来又与cas分子缔合,以便将核酸酶特异性地引导至靶核酸区域。重组grna分子既可包含可变dna识别区域,也可包含cas相互作用区域,因此可以独立于特异性靶核酸和所需的cas核酸酶进行专门设计。
131.作为另一种安全机制,靶核酸区域中必须存在pam(与前间隔区域邻近基序);这些是直接来自cas9/rna复合物识别dna的dna序列。来自酿脓链球菌的cas9的pam序列已被描述为“ngg”或“nag”(标准iupac核苷酸代码)(jinek等,“a programmable dual
‑
rna
‑
guided dna endonuclease in adaptive bacterial immunity”,science 2012,337:816
‑
821)。来自金黄色葡萄球菌的cas9的pam序列是“nngrrt”或“nngrr(n)”。其他变体crispr/cas9系统是公知的。因此,脑膜炎双球菌cas9在pam序列nnnngatt处裂解。嗜热链球菌cas9在pam序列nnagaaw处裂解。最近,已经描述了用于弯曲杆菌的crispr系统的另一种pam基序nnnnryac(wo2016/021973a1)。对于cpf1核酸酶,与通常由cas9系统识别的富含g的pam相反,没有tracrrna的cpf1
‑
crrna复合物有效地识别和裂解由较短的富tpam进行的靶dna(zetsche等,同上)。此外,通过使用修饰的crispr多肽,可以获得特异性单链断裂。cas切口酶与各种重组grna的组合使用还可通过双dna切口诱导高度特异性dna双链断裂。此外,通过使用两个grna,可以优化dna结合的特异性,从而可以优化dna裂解。同时,还有其他最初针对细菌描述的crispr效应物,如casx和casy效应物,它们代表了其他效应物,可用于基因组工程化目的(burstein等,“new crispr
‑
cas systems from uncultivated microbes”,nature,2017,542,237
‑
241)。
132.dsbi/ssbi酶的裂解位点与dna或rna上诱导断裂的确切位置有关。裂解位点可包含在(重叠)dsbi/ssbi酶的识别位点中,也可以不包含在(重叠)该位点上,因此可以说dsbi/ssbi酶的裂解位点位于其识别位点处或附近。dsbi/ssbi酶的识别位点,有时也称为结合位点,是由dsbi/ssbi酶(特异性)识别并确定其结合特异性的核苷酸序列。例如,talen或znf单体具有分别由其rvd重复或zf重复确定的识别位点,而其裂解位点由其核酸酶结构域(例如,foki)确定,并且通常位于识别位点之外。在二聚talen或zfn的情况下,裂解位点位于相应单体的两个识别/结合位点之间,其中发生裂解的中间dna或rna区域称为间隔子区域。
133.本领域技术人员将能够选择识别特定识别位点并在预选/预定位点处或附近的裂解位点诱导dsb或ssb的dsbi/ssbi酶,或设计此类dsbi/ssbi酶。或者,可以使用任何常规转化方法或通过与在其基因组中具有dsbi/ssbi酶识别位点的生物体杂交,将dsbi/ssbi酶识别位点导入靶基因组中,然后可以在dsbi/ssbi酶的裂解位点处或附近导入任何所需的核酸。
134.在各种实施方案中,在基因组的修饰中包含以下一种或多种:i)至少一个核苷酸的置换;ii)至少一个核苷酸的缺失;iii)至少一个核苷酸的插入;iv)dna甲基化的改变;以及v)组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化的改变。
135.在一些实施方案中,基因组工程化组分的活性诱导植物细胞的基因组中的一个或多个双链断裂、植物细胞的基因组中的一个或多个单链断裂、植物细胞的基因组中的一个或多个碱基编辑事件或植物细胞的基因组中的dna甲基化、组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化中的一种或多种。
136.在一些实施方案中,在诱导一个或多个双链断裂或一个或多个单链断裂之后进行非同源末端连接(nhej)和/或通过同源重组机制(hdr)对断裂进行同源性定向修复。nhej和hdr是修复断裂的两个主要及显著的途径。同源重组需要作为模板的同源序列(例如,修复核酸分子或“供体”)的存在以指导细胞修复过程,并且修复的结果是无错误且可预测的。在用于同源重组的模板(或修复核酸分子或“供体”)序列缺失时,细胞通常尝试通过非同源末端连接(nhej)过程修复断裂。
137.在该实施方案的特别优选的方面,将修复核酸分子另外导入植物细胞中。“修复核酸分子”是单链或双链dna分子或rna分子,其用作修饰裂解位点处或附近的预选位点的基因组dna或rna的模板。在一些实施方案中,修复核酸分子用作修饰基因组dna的模板,其中通过在预选位点两侧的侧翼区域和相应的同源区域之间的同源重组,可选地与修复核酸分子的两端中的一端处的非同源末端连接(nhej)组合(例如在只有一个侧翼区域的情况下),而在预定位点复制或整合修复核酸分子。通过同源重组的整合使得修复核酸分子能够精确地连接至靶基因组直至核苷酸水平,而nhej可导致修复核酸分子与基因组dna之间的连接处的小插入/缺失。
138.在本文所描述方面的各种实施例中,发生基因组的修饰,其中基因组已经由至少一个核苷酸改变。可以通过插入转基因,优选地表达包含感兴趣的转基因的表达,置换至少一个核苷酸和/或缺失至少一个核苷酸和/或插入至少一个核苷酸而发生基因组的修饰,只
要与修饰前的预选基因组靶位点的核苷酸序列相比导致至少一个核苷酸发生总改变,从而可以鉴定修饰,例如通过本领域技术人员熟知的诸如测序或pcr分析等的技术。
139.基因组的修饰可发生在预选位点、预定位点或预定义位点,即在基因组(例如,核基因组或叶绿体基因组)中期望插入、置换和/或缺失一个或多个核苷酸的特定核苷酸序列。例如,预选位点、预定位点或预定义位点可以是在先前导入的外来dna、rna或转基因中或与之连接的内源基因座或特定核苷酸序列。该预选位点可以是特定的核苷酸位置,该位置意在插入一个或多个核苷酸。预选位点还可以包含一个或多个要交换(置换)或缺失的核苷酸的序列。
140.在各种实施例中,选择侧翼区域的长度和序列同一性百分比,以使得能够在该侧翼区域与它们在预选位点上游或下游的相应dna区域之间进行同源重组。与修复核酸分子的侧翼dna区域具有同源性的位于预选位点侧翼的dna区域也被称为基因组dna中的一个或多个同源区域。
141.为了具有足够的重组同源性,修复核酸分子的侧翼dna区域的长度可有所不同,并且长度应至少为约10nt、约15nt、约20nt、约25nt、约30nt、约40nt或约50nt。然而,侧翼区域可以尽可能长(例如,高达约100
‑
150kb,例如完整的细菌人工染色体(bac))。优选地,侧翼区域将为约50nt至约2000nt,例如约100nt、200nt、500nt或1000nt。此外,位于感兴趣的dna两侧的区域不必与同源区域(位于预选位点两侧的dna区域)相同,并且可具有与预选位点两侧的dna区域约80%至约100%的序列同一性,优选地为约95%至约100%的序列同一性。侧翼区域越长,对同源性的要求越不严格。此外,为了在不改变相邻dna序列的dna序列的情况下实现预选位点处的靶dna序列的交换,侧翼dna序列应优选与在预选位点两侧的上游和下游dna区域相同。
142.为了在预选位点处进行靶序列修饰,必须选择侧翼区域,使得上游侧翼区域的3'端和/或下游侧翼区域的5'端与预定义位点的端部对齐。这样,上游侧翼区域的3'端确定预定义位点的5'端,而下游侧翼区域的5'端确定预定义位点的3'端。
143.该预选位点位于该裂解(和/或识别)位点之外或远离该裂解(和/或识别)位点,使得欲进行基因组修饰的位点(预选位点)不包含裂解位点和/或dsbi/ssbi酶的识别位点,使得预选位点与裂解(和/或识别)位点不重叠。因此,在这方面之外/远离这方面是指裂解(和/或识别)位点的上游或下游。
144.在各种实施方案中,根据本发明的至少一种碱基编辑器与至少一种位点特异性dsbi/ssbi酶复合物或至少一种修饰的位点特异性dsbi/ssbi酶复合物或任选地与该至少一种位点特异性dsbi/ssbi酶复合物的部分暂时或永久连接。该连接可以是共价和/或非共价的。可以将本文公开的任何碱基编辑器或位点特异性dsbi/ssbi酶复合物或其催化活性片段,或碱基编辑器复合物或位点特异性dsbi/ssbi酶复合物的任何部分作为代表或编码dna、rna或蛋白质效应物的核酸片段导入细胞,或其可以作为dna、rna和/或蛋白质或其任何组合导入。
145.碱基编辑器是具有介导靶碱基修饰能力的蛋白质或其片段,即,感兴趣的碱基的转变导致感兴趣的点突变。优选地,在本发明的上下文中,将至少一种碱基编辑器暂时或永久地融合至至少一种dsbi/ssbi酶,或任选地融合至至少一种dsbi/ssbi的部分。融合可以是共价和/或非共价的。多个出版物已显示,使用crispr/cas9切口酶或与胞苷脱氨酶结构
域连接的非功能性核酸酶,载脂蛋白b mrna编辑酶催化多肽(apobec1)(例如来自大鼠的apobec)的靶碱基转变,主要从胞嘧啶(c)转变为胸腺嘧啶(t)。由胞嘧啶脱氨酶催化胞嘧啶(c)的脱氨基,并产生具有胸腺嘧啶(t)的碱基配对特性的尿嘧啶(u)。大多数已知的胞苷脱氨酶作用于rna上,并且已知接受dna的少数实例需要单链(ss)dna。对dcas9
‑
靶dna复合物的研究揭示了,在形成cas9
‑
导向rna
‑
dna“r
‑
环”复合物后,置换的dna链的至少九个核苷酸(nt)不配对(jore et等,nat.struct.mol.biol.,18,529
‑
536(2011))。确实,在cas9 r
‑
环复合物的结构中,被置换的dna链上的前间隔序列的前11个nt是无序的,其表明它们的运动不被高度限制。还已经推测,cas9切口酶诱导的在非模板链的胞嘧啶中的突变可能是由细胞胞嘧啶脱氨酶对它们的可及性引起。有理由认为,r
‑
环中此ssdna片段的子集可以作为dcas9
‑
连接的胞苷脱氨酶的有效底物以实现dna中c到u的直接可编程转变(komor等,同上)。最近,goudelli等(programmable base editing of a
·
t to g
·
c in genomic dna without dnacleavage,nature,2017,551(7681),464,描述了介导基因组dna中的a
·
t至g
·
c转变的腺嘌呤碱基编辑器(abe)。
146.在本领域中已经鉴定了影响dna甲基化的酶以及组蛋白修饰酶。组蛋白翻译后修饰在调节染色质结构和基因表达中起重要作用。例如,在sterner d.e.,berger s.l(2000年6月):“acetylation of histones and transcription
‑
related factors”,microbiol.mol.biol.rev.64(2):435
–
59中描述的用于组蛋白乙酰化的酶。影响组蛋白甲基化的酶描述于zhang y.,reinberg d(2001):“transcription regulation by histone methylation:interplay between different covalent modifications of the core histone tails”,genes dev.15(18):2343
–
60。组蛋白的泛素化描述于shilatifard a(2006):“chromatin modifications by methylation and ubiquitination:implications in the regulation of gene expression”,annu.rev.biochem.75:243
–
69。用于组蛋白磷酸化的酶描述于nowak s.j.,corces v.g.(2004年4月):“phosphorylation of histone h3:a balancing act between chromosome condensation and transcriptional activation”,trends genet.20(4):214
–
20。用于组蛋白sumo化的酶描述于nathan d.,ingvarsdottir k.,sterner d.e.等,(2006年4月):“histone sumoylation is a negative regulator in saccharomyces cerevisiae and shows dynamic interplay with positive
‑
acting histone modifications”,genes dev.20(8):966
–
76。用于组蛋白核糖基化的酶描述于hassa p.o.,haenni s.s.,elser m.,hottiger m.o.(2006年9月):“nuclear adp
‑
ribosylation reactions in mammalian cells:where are we today and where are we going?”,microbiol.mol.biol.rev.70(3):789
–
829。组蛋白瓜氨酸化被例如称为肽基精氨酸脱亚胺酶4(pad4,也称为padi4)的酶催化,其将组蛋白精氨酸(arg)和单甲基精氨酸残基均转化为瓜氨酸。
147.可将影响dna甲基化的酶和组蛋白修饰酶与解除武装的dsb或ssb诱导酶融合,所述解除武装的dsb或ssb诱导酶优选识别该细胞的基因组中的预定位点。
148.示例性转基因
149.在植物细胞中用于遗传修饰的方法的各种实施方案中,转基因选自编码对非生物胁迫具有抗性或耐受性的基因,该非生物胁迫包括干旱胁迫、渗透胁迫、热胁迫、冷胁迫、氧化胁迫、重金属胁迫、氮缺乏、磷缺乏、盐胁迫或涝渍,编码除草剂抗性的基因,该除草剂抗
性包括对草甘膦、草铵膦/草丁膦、潮霉素、原卟啉原氧化酶(ppo)抑制剂、als抑制剂和dicamba的抗性,编码对生物胁迫具有抗性或耐受性的基因,该对生物胁迫具有抗性或耐受性的基因包括病毒抗性基因、真菌抗性基因、细菌抗性基因、昆虫抗性基因,或编码与产量相关的性状的基因,该性状包括倒伏抗性、开花时间、抗脱粒性、种子颜色、胚乳组分或营养成分。
150.在植物细胞中用于遗传修饰的方法的各种实施方案中,该方法有效地促进细胞增殖或细胞再生,或有效地提高转基因、基因编辑或碱基编辑的植物的再生效率。该方法优选在遗传修饰/基因组修饰后有效。在植物细胞中用于遗传修饰的方法的各种实施方案中,该方法有效地诱导来自单个细胞(优选胚胎细胞、体细胞或原生质体)或来自愈伤组织细胞或来自愈伤组织细胞的直接或间接(体细胞)胚胎发生。该方法优选在遗传修饰/基因组修饰后有效。在各种实施方案中,该方法有效地提高转基因进入植物细胞的稳定转化效率,或者有效地提高产生经遗传修饰的植物的效率。在各种实施方案中,该方法有效地提高基因组工程化组分编辑植物细胞的基因组的效率,或者有效地提高产生转基因、基因编辑或碱基编辑的植物的效率。
151.在一些实施方案中,该方法有效地改善源自顽抗基因型的植物的再生效率,有效地改善非常规组织类型的植物的再生效率,或有效地加速再生过程,优选地在遗传修饰/基因组的修饰之后。
152.加强子多肽和加强基因的瞬时表达
153.还提供了植物细胞中瞬时表达加强子多肽和/或加强基因的方法。该方法包含将(i)加强子多肽、本文所述的核酸、重组基因或dna构建体;和(ii)转基因和/或基因组工程化组分导入植物细胞中。
154.在一些实施方案中,加强子多肽和加强基因中的一个或多个被瞬时共表达。共表达可能有效地促进细胞增殖。这种共表达可能有效地促进细胞再生。共表达可以有效地诱导来自单个细胞的胚胎发生,并因此提供无需选择可再生同种植物的能力。共表达可以通过与基因组编辑组分共同递送来改善基因组编辑效率。共表达可以包含瞬时共导入加强多肽(例如,kws
‑
rbp
‑
1)以及一个或多个编码加强基因(例如,plt5、plt7、rkd4和rkd2)的核酸。
155.加强子多肽和/或一个或多个加强基因的瞬时共同递送可以如美国临时申请no.62/685,626(通过引用整体并入本文)中进行。
156.在各种实施方案中,如美国临时申请no.62/685,626中所述,可以递送其他加强因子诸如化学物质hdaci和植物激素。
157.在一些实施方案中,加强子多肽在植物细胞中瞬时存在、有瞬时活性的和/或瞬时表达。在一些实施方案中,编码加强子多肽的核酸在植物细胞中瞬时存在、有瞬时活性的和/或瞬时表达。可将选自plt5多肽、plt7多肽的一种或多种多肽和/或选自编码plt5多肽、多肽和rkd2多肽的核酸的一种或多种核酸和/或适合于瞬时提高内源性plt5多肽、内源性plt7多肽或内源性rkd2多肽的表达的一个或多个定点转录激活子和/或编码这种定点转录激活子的核酸导入植物细胞。
158.瞬时表达可以通过加强蛋白质/多肽或编码该蛋白质/多肽的核酸片段的瞬时转化/转染来进行,优选在强组成型启动子下表达。编码plt5多肽的核酸、编码plt7多肽的核
酸和/或适合于瞬时提高内源性plt5多肽、内源性plt7多肽的表达的一个或多个定点转录激活子的瞬时表达也可通过在组织和发育特异性启动子或诱导型启动子的控制下稳定转化加强基因来实现。该加强基因可以被表达且然后有瞬时活性的。然后,当植物细胞发育改变或诱导条件消除时,可以很快关闭并降解加强基因。例如,来自短柄草属ef1基因的强组成型启动子pbdef1(seq id no:23)可用于驱动加强基因以进行瞬时转化(参见,例如实施例1)。
159.瞬时表达可产生自瞬时转染、瞬时转化和稳定转化中的任何一种。“瞬时转化”和“瞬时转染”包含将外来材料[即核酸片段、蛋白质、核糖核蛋白(rnp)等]转移进宿主细胞,从而导致无需整合和稳定遗传外来材料的基因表达和/或活性。外来组分不是永久性地掺入细胞基因组中,而是提供暂时的作用导致基因组的修饰。瞬时转化事件可能不能传递给下一代,及因此是不可遗传的。“稳定转化”是指转移的核酸片段被整合到宿主细胞的基因组(包括核和细胞器基因组)中导致核酸片段稳定遗传的事件。
[0160]
例如,瞬时表达可用于瞬时基因组编辑。基因组工程化组分在植物细胞中的瞬时活性和/或瞬时存在可导致在植物细胞的基因组中导入一个或多个双链断裂、在植物细胞的基因组中导入一个或多个单链断裂、或在植物细胞的基因组中导入dna甲基化、组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化中的一个或多个。在植物细胞的基因组中所产生的修饰可以例如选自至少一个核苷酸的置换,至少一个核苷酸的缺失,至少一个核苷酸的插入、dna甲基化的改变,组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化的改变,或其组合。
[0161]
定点转录激活子意指美国临时申请no.62/609,508(其通过引用并入本文)中描述的合成转录因子。合成转录因子可以包含至少一个识别结构域和至少一个基因表达调节结构域,特别是激活结构域,其中合成转录因子被配置为调节植物或植物细胞的基因组中内源基因的表达。这种内源基因优选是(天然)形态发生基因,其编码参与植物发育过程如根形成或芽形成的多肽。在一些实施方案中,内源性形态发生基因选自编码plt5多肽的内源核酸、编码plt7多肽的内源核酸、编码rkd4多肽的内源核酸或编码rkd2多肽的内源核酸的组合。在一些实施方案中,至少一个识别结构域是选自以下的分子的片段:至少一个tal效应物、至少一个解除武装的crispr/核酸酶系统、至少一个锌指结构域和至少一种解除武装的归巢内切核酸酶,或其任何组合。
[0162]
在一些实施方案中,至少一个解除武装的crispr/核酸酶系统是crispr/dcas9系统、crispr/dcpf1系统、crispr/dcsm1系统、crispr/dcasx系统或crispr/dcasy系统、或其任何组合,并且其中至少一个解除武装的crispr/核酸酶系统包含至少一个导向rna。
[0163]
在一些实施方案中,该至少一个激活结构域选自酸性转录激活结构域,优选地,该至少一个激活结构域来自稻白叶枯病黄杆菌的tal效应物基因,来自单纯疱疹的vp16或四聚体vp64,vpr、sam、scaffold、suntag、p300、vp160或其任何组合。在一些实施例中,激活结构域是vp64。
[0164]
在一些实施方案中,合成转录因子被配置为通过结合至位于与起始密码子一定距离的调控区域来调节形态发生基因的表达,优选地转录。在优选的实施方案中,合成转录因子被配置为通过结合至位于与起始密码子一定距离的调控区域来提高形态发生基因的表
达,优选地转录
[0165]
在一些实施方案中,定点转录激活子/合成转录因子或其编码的核酸包含至少一个识别结构域和至少一个激活结构域,其中定点转录激活子被配置为提高内源性plt5多肽、内源性plt7多肽、内源性rkd4多肽或内源性rkd2多肽的表达,优选地通过结合至位于与内源性plt5多肽、内源性plt7多肽、内源性rkd4多肽或内源性rkd2多肽的起始密码子一定距离的调控区域。
[0166]
如本文所用的,“调控区域”是指至少一个识别结构域与基因组中感兴趣的形态发生基因处或附近的靶序列的结合位点。取决于本文进一步公开的至少一个激活结构域和至少一个识别结构域的性质,可存在两个离散调控区域,或可存在重叠调控区域,本发明的合成转录因子的不同结构域可以以模块化的方式进行组装。
[0167]
在某些实施方案中,该至少一个识别结构域可靶向相对于感兴趣的基因的起始密码子的至少一个序列(识别位点),该序列可以是至少1000bp,相对于感兴趣的基因起始密码子的上游(
‑
)或下游(+)
‑
700bp至+700bp、
‑
550bp至+500bp或
‑
550bp至+425bp。在某些实施方案中,识别启动子附近的识别结构域可能是优选的,而这表示了本发明的特异性stf的优点,即,stf的靶向范围比常规或天然存在的tf进行了高度扩展。由于识别和/或激活结构域可以被专门设计和构建以特异性识别和靶向调控的热点。
[0168]
在某些实施方案中,该至少一个识别位点可以是相对于感兴趣的基因的起始密码子
‑
169bp至
‑
4bp、
‑
101bp至
‑
48bp、
‑
104至
‑
42bp或
‑
175至+450bp(上游(
‑
)或下游(+)),以提供最佳的空间结合环境,从而实现最佳的调控(优选地是转录激活)活性。特别是对于根据本发明的基于crispr的合成转录因子,其与作为识别部分的导向rna一起起作用,该结合位点也可位于感兴趣的基因的编码区域内(感兴趣的基因的起始密码子的下游)。
[0169]
在其他实施方案中,本发明的合成转录因子的识别结构域可结合至感兴趣的基因的5'和/或3'非翻译区域(utr)。在实施方案中,在采用不同的识别结构域的情况下,至少两个识别结构域可结合至感兴趣的形态发生基因的不同靶区域,包括5'和/或3'utr,但是它们也可以在基因区域之外结合,但是仍然在最多1到1500bp的特定距离内。可以结合识别结构域的一个优选区域位于感兴趣的形态发生基因的起始密码子上游约
‑
4bp至约
‑
300bp,优选地约
‑
40bp至约
‑
170bp。此外,识别结构域的长度以及由此感兴趣基因组中的相应识别位点的长度可以因此取决于所述合成转录因子和所应用的识别结构域的性质而变化。基于至少一个识别结构域的分子特征,这还将确定相应的至少一个识别位点的长度。例如,在单个锌指可以为约8bp至约20bp,其中三至六个锌指基序之间的阵列可能是优选的,在这种情况下,单个tale识别位点可以为约11至约30bp,或更多。基于crispr的stf的grna的识别位点包含与感兴趣的基因组区域杂交的grna的靶向序列或“间隔子”序列,而grna包含其他结构域,包括与根据本发明的解除武装的crispr效应物相互作用的结构域。基于解除武装的crispr效应物的stf的识别位点将包含一个pam基序,因为pam序列对于任何crispr效应物的靶标结合都是必需的,确切的序列取决于crispr效应物(即,本文公开的解除武装的crispr效应物)的种类。
[0170]
加强基因和加强多肽的导入
[0171]
加强子和/或基因组工程化组分可以作为蛋白质/多肽或作为编码蛋白质/多肽的核酸,特别是作为蛋白质/多肽或诸如质粒dna、rna、mrna或rnp之类的dna导入。
[0172]
加强子可以与一个或多个基因组工程化组分共同递送。如本文所用,“共同递送”或“共同
‑
递送”和“共同导入”或“共同
‑
导入”可互换使用。就本发明而言,“共导入”是指这样的过程,其中至少两个不同的组分同时被递送进同一植物细胞中。因此,基因组工程化组分和加强因子被一起导入同一植物细胞。优选地,通过单独的构建体导入两种类型的组分,加强子和感兴趣的基因。可以通过粒子轰击、显微注射、农杆菌属介导的转化、电穿孔、电融合、农杆菌浸润或真空浸润来共同导入进植物细胞。
[0173]
再生加强基因
[0174]
据信转化的细胞比野生型细胞具有较差的可再生性。由于细胞内存在外来dna,转化的细胞容易受到程序性细胞死亡。递送(例如轰击破坏)引起的应激也可能引发细胞死亡。因此,促进细胞分裂对于再生修饰的细胞至关重要。此外,基因组工程化效率很大程度上由宿主细胞状态控制。像植物分生组织中一样经历快速细胞分裂的细胞是基因组工程化的最合适受体。促进细胞分裂可能会提高dna复制和分裂过程中的dna整合或修饰,及因而提高基因组工程化效率。
[0175]
根据本发明的加强基因和加强多肽、kws
‑
rbp1(seq id no:2)和kws
‑
rbp2(seq id no:48)是人造的,并且已被设计用来改善基因组工程化组分的活性。当将加强子多肽与转基因一起导入植物细胞,加强子多肽可以提高转基因和该转基因编码的多肽的表达。当将加强子多肽与基因组工程化组分和转基因一起导入植物细胞时,基因组工程化组分的活性可能提高。这种提高可以导致转基因更有效地整合进植物细胞的基因组中。一个或多个加强基因可以与加强子多肽共表达。一个或多个加强基因可以与加强子多肽共转染。
[0176]
基于它们在促进细胞分裂和植物形态发生中所起的作用来选择这些额外加强基因。每个候选基因均由强组成型启动子克隆和驱动,并通过瞬时表达在玉米细胞中进行评估而无需选择。增强基因的实例是plt5(plethora5;seq id no:4和6)、plt7(plethora7;seq id no:8、10)和rkd2(seq id no:18、20和22)。
[0177]
plt(plethora),也称为ail(aintegument
‑
like)基因,是转录调节子ap2家族的成员。转录因子ap2家族成员在植物的细胞增殖和胚胎发生中起重要作用(el ouakfaoui,s.,schnell,j.,abdeen,a.,colville,a.,labb
é
,h.,han,s.,baum,b.,laberge,s.,miki,b(2010)control of somatic embryogenesis and embryo development by ap2 transcription factors.plant molecular biology 74(4
‑
5):313
‑
326.)。plt基因主要在芽和根的发育组织中表达,是干细胞稳态、细胞分裂和再生,以及器官原基模式化所必需的。
[0178]
plt家族包含由六个成员的ap2子分支。四个plt成员,plt1/ail3、plt2/ail4、plt3/ail6和bbm/plt4/ail2在根尖分生组织(ram)中部分重叠表达,并且在干细胞微环境内在正确的位置表达qc(静态中心)标记是必需的。这些基因对维持根尖分生组织的细胞分裂和防止细胞分化起冗余作用。
[0179]
三个plt基因,plt3/ail6,plt5/ail5和plt7/ail7在芽分生组织(shoot apical meristem)(sam)中表达,它们在侧器官的定位和向外生长中起冗余作用。plt3、plt5和plt7通过控制两个不同的发育事件来调节拟南芥中的新生芽再生。plt3、plt5和plt7在分生组织的外围维持高水平的pin1表达是必需的,并调节sam中央区域的局部生长素生成,这是叶序转换(phyllotactic transitions)的基础。这三个基因功能的累积丧失导致中间细胞
团、愈伤组织不能形成芽祖细胞,而诱导plt5或plt7则可以以激素非依赖性方式使芽再生。plt3,plt5,plt7调节并需要芽促进因子cup
‑
shaped cotyledon2(cuc2)来完成芽形成程序。plt3,plt5和plt7也在侧根生成细胞中表达,在侧根生成细胞中它们冗余地激活plt1和plt2的表达,并接着调节侧根形成。
[0180]
额外加强基因可以来自本领域已知的任何数量的植物。这样的植物包括但不限于玉米、拟南芥和小麦。在一些实施方案中,加强基因是玉米plt5。在一些实施方案中,加强基因是拟南芥plt5。在一些实施方案中,加强基因可以是plt7。在一些实施方案中,加强基因是拟南芥plt7。在一些实施方案中,加强基因是小麦rkd4。在一些实施方案中,加强基因是拟南芥rkd4。在一些实施方案中,加强基因是玉米rkd4。在一些实施方案中,加强基因是小麦rkd2。在一些实施方案中,加强基因是拟南芥rkd2。在一些实施方案中,加强基因是玉米rkd2。
[0181]
在一些实施方案中,将编码根据本发明的加强子多肽和plt5多肽(由plt5加强基因编码)的核酸导入植物细胞中,并且任选地瞬时共表达。在一些实施方案中,将编码根据本发明的加强子多肽和plt7多肽(由plt7加强基因编码)的核酸导入植物细胞中,并且任选地瞬时共表达。
[0182]
由plt5加强基因编码的多肽可包含与seq id no:4至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。由plt5加强基因编码的多肽可包含seq id no:4的序列。由plt5加强基因编码的多肽可包含与seq id no:6至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。由plt5加强基因编码的多肽可包含seq id no:6的序列。
[0183]
由玉米plt5加强基因编码的多肽可以包含与seq id no:4至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。由玉米plt5加强基因编码的多肽可以包含seq id no:4的序列。
[0184]
拟南芥plt5加强基因编码的多肽可包含与seq id no:6至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。拟南芥plt5加强基因编码的多肽可包含seq id no:6的序列。
[0185]
由plt7加强基因编码的多肽可以包含与seq id no:8至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。由plt7加强基因编码的多肽可以包含seq id no:8的序列。plt7多肽可以包含与seq id no:10至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。由plt7加强基因编码的多肽可以包含seq id no:10的序列。
[0186]
由玉米plt7加强基因编码的多肽可以包含与seq id no:8至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、
93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。由玉米plt7加强基因编码的多肽可以包含seq id no:8的序列。
[0187]
由拟南芥plt7加强基因编码的多肽可以包含与seq id no:10至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。由拟南芥plt7加强基因编码的多肽可以包含seq id no:10的序列。
[0188]
rkd4加强基因编码的多肽可包含与seq id no:12至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。rkd4加强基因编码的多肽可包含seq id no:12的序列。rkd4加强基因编码的多肽可包含与seq id no:14至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。rkd4加强基因编码的多肽可包含seq id no:14的序列。rkd4加强基因编码的多肽可包含与seq id no:16至少60%,65%,70%,至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的相同的氨基酸序列。rkd4加强基因编码的多肽可包含seq id no:16的序列。
[0189]
小麦rkd4加强基因编码的多肽可包含与seq id no:12至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。小麦rkd4加强基因编码的多肽可包含seq id no:12的序列。
[0190]
拟南芥rkd4加强基因编码的多肽可包含与seq id no:14至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。拟南芥rkd4加强基因编码的多肽可包含seq id no:14的序列。
[0191]
玉米rkd4加强基因编码的多肽可包含与seq id no:16至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。玉米rkd4加强基因编码的多肽可包含seq id no:16的序列。
[0192]
rkd2加强基因编码的多肽可包含与seq id no:18至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。rkd2加强基因编码的多肽可包含seq id no:18的序列。rkd2加强基因编码的多肽可包含与seq id no:20至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。rkd2加强基因编码的多肽可包含seq id no:20的序列。rkd2加强基因编码的多肽可包含与seq id no:22至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。rkd2加强基因编码的多肽可包含seq id no:22的序列。
[0193]
小麦rkd2加强基因编码的多肽可包含与seq id no:18至少60%、65%、70%、
75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。小麦rkd2加强基因编码的多肽可包含seq id no:18的序列。
[0194]
拟南芥rkd2加强基因编码的多肽可包含与seq id no:20至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。拟南芥rkd2加强基因编码的多肽可包含seq id no:20的序列。
[0195]
玉米rkd2加强基因编码的多肽可包含与seq id no:22至少60%、65%、70%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列。玉米rkd2加强基因编码的多肽可包含seq id no:22的序列。
[0196]
在一些实施方案中,编码plt5多肽的核酸包含seq id no:3或5的核苷酸序列的核酸。在一些实施方案中,编码plt5多肽的核酸包含与与seq id no:3或5至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸的互补链杂交的核酸,或包含seq id no:3或5的核苷酸序列。
[0197]
在一些实施方案中,编码plt7多肽的核酸包含seq id no:7或9的核苷酸序列的核酸。在一些实施方案中,编码plt7多肽的核酸包含与seq id no:7或9至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸。在一些实施方案中,编码plt7多肽的核酸包含与与seq id no:7或9至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸的互补链杂交的核酸,或包含seq id no:7或9的核苷酸序列。
[0198]
在一些实施方案中,编码rkd4多肽的核酸包含seq id no:11、13或15的核苷酸序列的核酸。在一些实施方案中,编码rkd4多肽的核酸包含与seq id no:11、13或15至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸。在一些实施方案中,编码rkd4多肽的核酸包含与与seq id no:11、13或15至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸的互补链杂交的核酸,或包含seq id no:11、13或15的核苷酸序列。
[0199]
在一些实施方案中,编码rkd2多肽的核酸包含seq id no:17、19或21的核苷酸序列的核酸。在一些实施方案中,编码rkd2多肽的核酸包含与seq id no:17、19或21至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸。在一些实施方案中,编码rkd2多肽的核酸包含与与seq id no:17、19或21至少75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%相同的氨基酸序列的核酸的互补链杂交的核酸,或
包含seq id no:17、19或21的核苷酸序列。
[0200]
为了本发明的目的,两个相关核苷酸或氨基酸序列的“序列同一性”(以百分比表示)是指在两个具有相同残基(x100)的最优比对序列中的位置数除以比较的位置数。缺口,即在一个序列中存在而另一个序列不存在的残基的比对中的位置,被认为是具有非相同残基的位置。通过needleman和wunsch算法(needleman和wunsch 1970)进行两个序列的比对。上面的计算机辅助序列比对可以使用标准软件程序诸如在european molecular biology open software suite(emboss)如版本6.3.1.2(trends in genetics 16(6),276(2000))(其默认参数例如为对于蛋白质矩阵=eblosum62,gapopen=10.0,gapextend=0.5)中实施的needle程序方便地进行。
[0201]
如本文所用,术语“杂交”是指通过互补核苷酸的碱基配对在两个核酸分子之间杂交体的形成。术语“在严格条件杂交”是指在特定条件的杂交。这样的条件的一个实例包括这样的条件,在该条件,基本互补性的链(即由具有至少80%互补性的核苷酸序列组成的链)与给定的链杂交,而较低互补性的链不杂交。或者,这些条件是指钠盐浓度、温度和洗涤条件的特定杂交条件。例如,高度严格的条件包含在42℃、50%甲酰胺、5x ssc(150mm nacl、15mm柠檬酸三钠)、50mm磷酸钠、5x denhardt溶液、10x硫酸葡聚糖、20mg/1ml剪切的鲑鱼精子dna并在约65℃的0.2x ssc(ssc代表0.15m氯化钠和0.015m柠檬酸三钠缓冲液)中洗涤。或者,高度严格的条件可意指在68℃于0.25m磷酸钠、ph 7.2、7%sdds、1mm edta和1%bsa中杂交16小时,并在68℃用2x ssc和0.1%sdds洗涤两次。进一步可选地,高度严格的杂交条件例如是:在65℃在4
×
ssc中杂交,然后在65℃在0.1
×
ssc中多次洗涤总共约1小时,或在68℃在0.25m磷酸钠、ph 7.2、7%sds、1mm edta和1%bsa中杂交16小时,然后在68℃用2x ssc和0.1%sds洗涤两次。
[0202]
表观遗传调控化学物质
[0203]
表观遗传调控化学物质,例如蛋白质脱乙酰基酶抑制剂(ii.1),可以与基因组工程化组分共同导入。根据本发明使用的示例性表观遗传调控化学物质包括但不限于组蛋白脱乙酰基酶抑制剂(hdacis)诸如制滴菌素a(trichostatin a)(tsa)和dna甲基转移酶抑制剂。
[0204]
据假设共同递送的表观遗传调控化学物质(ii.1)(特别是hdacis)松弛植物的染色质结构,促进轰击细胞中dna对基因组工程化组分的可及性,因而接着促进基因组工程化(即转化和基因组编辑)效率。这种假设的原因是:遗传物质的基本结构和功能单元是核小体,其中带负电荷的dna包裹在带正电荷的组蛋白八聚体和相关的连接子组蛋白周围。核小体单元进一步折叠并堆积成染色质(andrews,a.j.,和luger,k.(2011).nucleosome structure(s)and stability:variations on a theme.annu.rev.biophys.40:99
–
117)。dna的可及性很大程度上取决于核小体和染色质的紧密度。染色质重塑酶可动态修饰组蛋白的赖氨酸或其他氨基酸,其导致它们电荷以及与dna和其他蛋白质的相互作用的改变,并导致染色质折叠或解折叠(bannister a.j.,kouzarides t.(2011)regulation of chromatin by histone modifications.cell res21:381
–
95)。通过添加或去除乙酰基,组蛋白中赖氨酸残基的乙酰化和脱乙酰化通常参与真核生物染色质结构的可逆调节,并介导染色质可及性和基因表达调控。组蛋白脱乙酰基酶(hdac)是从位于组蛋白的n末端尾部的赖氨酸残基去除乙酰基的酶,其使组蛋白带更多正电荷,并因此使组蛋白更紧地包裹dna。
抑制hdac可能有助于染色质解折叠,并使dna更易接近。
[0205]
染色质重塑和其他表观遗传修饰无疑在调控细胞全能和再生中起重要作用(zhang,h.,和ogas,j.(2009).an epigenetic perspective on developmental regulation of seed genes.mol.plant 2:610
–
627)。已经证明组蛋白脱乙酰基酶(hdac)活性的抑制与植物再生和小孢子胚胎发生有关(miguel,c.,和marum,l.,2011.an epigenetic view of plant cells cultured in vitro:somaclonal variation and beyond.j.exp.bot.62:3713
–
3725.,li hui et al.(2014)the histone deacetylase inhibitor trichostatin a promotes totipotency in the male gametophyte plant cell,26:195
–
209)。hdac活性或下游hdac介导的途径的抑制在应激诱导的单倍体胚胎发生中起主要作用。一种这样的hdaci是制滴菌素a(tsa)。已证明tsa在欧洲油菜的雄配子体中诱导大量的胚胎发生细胞增殖。tsa处理导致培养的小孢子和花粉中高频率的孢子体细胞分裂。
[0206]
在一种或多种表观遗传调节化学物质例如蛋白脱乙酰酶抑制剂特别是hdaci存在下,可以使用各种方法来进一步提高基因组工程化效率。这样的hdaci可以是制滴菌素a(tsa)、n
‑
羟基
‑7‑
(4
‑
二甲基氨基苯甲酰基)
‑
氨基庚酰胺(m344)、辛二酰苯胺异羟肟酸(saha)或其他。这些hdac选自基于异羟肟酸(ha)的化学物质,其目标是锌依赖性hdac。
[0207]
植物激素
[0208]
在各种实施方案中,将一种或多种植物激素,例如植物生长素和细胞分裂素,例如2,4
‑
d、6
‑
苄基氨基嘌呤(6
‑
ba)玉米素,与一种或多种加强基因、加强子多肽、基因组工程化组分和一个转基因共同递送。
[0209]
植物体细胞能够通过体细胞胚胎发生或器官发生而在体外培养中恢复细胞分裂并再生为整个植物,这主要取决于植物激素诸如植物生长素和细胞分裂素。在本发明中,发现植物激素促进细胞增殖,提高植物细胞对基因组工程化的敏感性,并因此改善基因组工程化(即转化和基因组编辑)的效率。
[0210]
植物生长素之一是2,4
‑
二氯苯氧基乙酸(2,4
‑
d),其对于单子叶植物例如玉米和小麦的体细胞胚胎发生和细胞再生几乎是必不可少的。同时,细胞分裂素例如6苄基氨基嘌呤(6
‑
ba)或玉米素对植物器官发生、芽分生组织的形成和发育至关重要。改善基因组工程化效率的方法可以包括与基因组工程化组分共同递送一种或多种植物激素(2,4
‑
d、6
‑
ba、玉米素等)。
[0211]
基因组工程化组分和至少一种表观遗传调控的化学物质和植物激素可以共导入一个植物细胞中。
[0212]
如本文所用,“共同递送”或“共同
‑
递送”和“共同导入”或“共同
‑
导入”可互换使用。就本发明而言,“共导入”是指这样的过程,其中至少两个不同的组分同时被递送进同一植物细胞中。因此,可以将基因组工程化组分和至少一种表观遗传调节的化学物质和植物激素一起导入同一植物细胞中。
[0213]
可以通过粒子轰击、显微注射、农杆菌属介导的转化、电穿孔、农杆菌浸润或真空浸润来共同导入进植物细胞。根据本发明,基于物理递送(如粒子轰击、显微注射、电穿孔、纳米颗粒和细胞穿透肽(cpp))的方法特别优选用于共同导入加强基因、加强子多肽、基因组工程化组分和/或转基因。特别优选的是通过粒子轰击共同导入。
[0214]
植物细胞再生为完整植物
[0215]
根据本发明的另一方面,经遗传修饰的植物细胞可以再生为完整(可育)植物。因此,在本发明的优选方面,在植物细胞的遗传修饰之后是再生植物的步骤。因此,本发明提供了一种生产经遗传修饰的植物的方法,包括以下步骤:
[0216]
a)根据上述用于在植物细胞中进行遗传修饰的任何方法对植物细胞进行遗传修饰,和
[0217]
b)从步骤a)的修饰的植物细胞再生植物,
[0218]
单个细胞或多细胞增殖并发展成组织、器官、及最后是整个植物。在一些实施方案中,产生的植物不包含在步骤a)中导入或共同导入的任何基因组工程化组分、加强基因和加强子多肽。再生植物的步骤b)可以例如包含在再生培养基上培养来自步骤a)的经遗传修饰的植物细胞。
[0219]
植物再生的效率或提高植物细胞再生能力的方法可以通过将本文所述的任何加强子多肽、加强基因、核酸、重组基因和dna构建体结合导入植物细胞中来改善。
[0220]
产生经遗传修饰的植物
[0221]
本发明还提供了通过上述产生经遗传修饰的植物或其后代植物的方法获得或可获得的经遗传修饰的植物。经遗传修饰的植物可包含本文所述的任何经遗传修饰的植物细胞。
[0222]
在各种实施方案中,所产生的植物不包含导入或共同导入用于产生所产生的植物的植物细胞中的任何基因组工程化组分、加强基因和加强子多肽。
[0223]
本发明还提供了无需常规选择的源于上述经遗传修饰的细胞的植物或种子。如本文所用,“常规选择”是指通过使用整合的选择标记例如抗生素(例如卡那霉素、潮霉素)或除草剂(例如草丁膦(phosphinothricin)、草甘膦)抗性基因,从野生型细胞中选择和纯化转化的细胞的任何方法。没有常规选择,此类植物或种子可能没有任何整合的基因组工程化组分,从而导致无转基因的遗传修饰植物。
[0224]
遗传修饰可以是植物细胞基因组中的永久且可遗传的改变。可以使用含有微粒轰击、农杆菌属转化、电穿孔等在内的当前可用方法来进行植物组织培养和基因组工程化。可以通过使用可见报告基因,例如红色荧光tdtomato基因(tdt)(其编码异常亮的红色荧光蛋白,最大激发波长为554nm,最大发射波长为581nm)来监测转化和转基因表达。基因组编辑效率可以例如通过下一代测序(ngs)、qpcr、标记毛细管电泳分析和droplet digital pcr来分析。通过sanger测序进一步证实了位点特异性修饰。
[0225]
培养步骤
[0226]
在加强基因、加强子多肽和一种或多种转基因存在下,通过基因组工程化组分的活性,在允许该植物细胞的基因组的遗传修饰的条件,可培养已导入或共同导入了加强基因、加强子多肽、基因组工程化组分和/或转基因的植物细胞。
[0227]
如本文所用,“基因组的遗传修饰”包括任何类型的操作,使得内源核苷酸已被改变以包括突变诸如缺失、插入、转换、颠换或其组合。例如,可以缺失内源编码区域。此类突变可导致多肽具有与内源多核苷酸编码的氨基酸序列不同的氨基酸序列。遗传修饰的另一个实例是调控序列诸如启动子的改变以导致提高或减少可操作连接的内源编码区域的表达。
[0228]“适合”植物基因组的遗传修饰发生的条件诸如多核苷酸的切割,或“适合”条件是不能阻止此类事件发生的条件。因此,这些条件允许、增强、促进和/或有助于该事件。根据各个基因组工程化组分(i),这些条件可不同。
[0229]
在本发明的方法中,优选用基因组工程化组分(i)和至少一种化合物(ii)瞬时转化植物细胞。如本文所用,“瞬时转化”是指外来材料[即核酸片段、蛋白质、核糖核蛋白(rnp)等]转移进宿主细胞从而导致基因表达和/或活性,而没有整合和稳定遗传该外来材料。因此,基因组工程化组分(i)在植物细胞中有瞬时活性的和/或瞬时存在。基因组工程化组分不是永久性地掺入细胞基因组中而是提供暂时的作用以导致基因组的修饰。例如,基因组工程化组分在植物细胞中的瞬时活性和/或瞬时存在可导致在植物细胞的基因组中导入一个或多个双链断裂、在植物细胞的基因组中导入一个或多个单链断裂、或在植物细胞的基因组中导入dna甲基化、组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化中的一个或多个。
[0230]
优选在导入一个或多个双链断裂或一个或多个单链断裂之后进行非同源末端连接(nhej)和/或通过同源重组机制对断裂进行同源定向修复(hdr)。
[0231]
植物细胞的基因组中的所得修饰可以例如选自转基因优选地包含感兴趣的基因的表达盒的插入,至少一个核苷酸的置换,至少一个核苷酸的缺失,至少一个核苷酸的插入,dna甲基化的改变,组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化的改变,或其组合。根据本发明的一个特别优选的方面,没有与所应用的基因编辑机制/系统有关的外源遗传物质被稳定地整合进植物细胞的基因组中。
[0232]
遗传修饰可以是植物细胞基因组中的永久且可遗传的改变。
[0233]
任选的预处理
[0234]
在各种实施方案中,可以包括用美国临时申请no.62/685,626中描述的一种或多种化学物质对植物材料进行预处理,该专利通过引用并入本文。因此,用于在植物细胞中进行遗传修饰的方法可以进一步包含对植物细胞进行预处理的步骤,该预处理包含在含有(1)表观遗传调控化学物质或其活性衍生物,特别是组蛋白脱乙酰基酶抑制剂(hdaci)或dna甲基转移酶抑制剂,或(2)植物激素或其活性衍生物,或其任何组合的培养基中培养植物细胞或包含其的植物材料。
[0235]
在预处理步骤之后,可以从含有化合物(1)和(2)中的至少一种的培养基中提取处理过的植物细胞,并用于共导入。
[0236]
作为示例,对于组蛋白脱乙酰基酶抑制剂tsa,hdacis预处理的持续时间为10分钟至2天,优选2.0小时至24小时。用于预处理的tsa浓度为1.0nm至1000nm,优选10nm至100nm。此后,将处理过的植物材料转移至无hdaci的培养基中,并立即用于tsa共导入(长时间的tsa预处理可能会造成非选择性地增强细胞再生,这可能会提高回收被轰击和修饰的细胞的难度)。
[0237]
相似的预处理条件可以应用于所有类型的化合物(1)和(2)。植物组织培养和基因组工程化可以使用目前可用的方法进行。可以使用红色荧光报告基因tdtomato(其编码异常亮的红色荧光蛋白,最大激发波长为554nm,最大发射波长为581nm)或绿色荧光报告基因mneongreen(其编码最亮的单体绿色或黄色荧光蛋白,最大激发波长为506nm,最大发射波
长为517nm)监测瞬时转化和转基因表达。基因组编辑效率可以例如通过下一代测序(ngs)来分析。
[0238]
微粒
[0239]
在另一方面,提供了用上述加强子多肽、核酸、重组基因和dna构建体中至少一个所包被的微粒。在一些实施方案中,微粒进一步用基因组工程化组分包被。
[0240]
在另一方面,提供了一种通过微粒轰击对植物基因组进行遗传修饰的试剂盒,包括
[0241]
(i)一种或多种微粒,以及
[0242]
(ii)包被该微粒的工具。
[0243]
在一些实施方案中,试剂盒还包括用于用基因组工程化组分包被微粒的工具。
[0244]
在各种实施方案中,微粒至少用以下包被:
[0245]
(i)加强子多肽、或编码加强子多肽的核酸;
[0246]
(ii)转基因;和/或基因组工程化组分。
[0247]
微粒轰击的一个特别优选的实施方案中,通过包含具有0.4
‑
1.6微米(μm)范围大小,优选0.4
‑
1.0μm范围大小的金颗粒的微载体,将加强多肽、和/或一种或多种加强基因与基因组工程化组分共同递送的。在示例性方法中,每一次轰击使用包被在10
‑
1000μg金颗粒,优选50
‑
300μg金颗粒上的10ng
‑
10μgdna,优选50
‑
1000ngdna。可使用每一个样品板最多10次轰击(发射),优选1
‑
4次发射将外来分子递送进植物细胞中。
[0248]
可以使用例如bio
‑
rad pds
‑
1000/he粒子枪或手持式helios基因枪系统将加强因子(例如,加强多肽或编码这种加强多肽的多核苷酸)和基因组工程化组分递送进靶细胞中。当使用pds
‑
1000/he粒子枪系统时,轰击破裂压力为450psi至2200psi,优选为450
‑
1100psi,而helios基因枪系统的破裂压力为100
‑
600psi。可以将一种以上的化学物质或构建体与基因组工程化组分共同递送到进细胞中。
[0249]
微粒包被可以进一步包含一个或多个包被层。例如,微粒可含有包含加强因子的第一包被层和包含基因组工程化组分和转基因的第二包被层。或者,微粒可含有包含加强因子以及转基因或基因组工程化组分的包被层。
[0250]
此外,本发明提供了一种通过微粒轰击对植物基因组进行遗传修饰的试剂盒,其包括
[0251]
(i)一种或多种微粒,以及
[0252]
(ii)用于用至少基因组工程化组分以及(1)表观遗传调控化学物质,例如dna甲基转移酶抑制剂或蛋白质脱乙酰基酶抑制剂或其活性衍生物,特别是组蛋白脱乙酰基酶抑制剂(hdaci),和/或(2)植物激素或其活性衍生物包被微粒的工具。
[0253]
本发明的另一方面是如上该的微粒在植物细胞的基因枪法转化中的用途。
[0254]
本发明的主题还是通过上述方法获得或可获得的植物细胞。因此,本发明的一个实施方案是通过上述在植物细胞中进行遗传修饰的方法获得或可获得的经遗传修饰的植物细胞。与原始植物细胞相比,这些植物细胞中的遗传修饰例如可包括转基因优选地包含感兴趣的基因的表达盒的插入,至少一个核苷酸的置换,至少一个核苷酸的缺失,至少一个核苷酸的插入,dna甲基化的改变,组蛋白乙酰化、组蛋白甲基化、组蛋白泛素化、组蛋白磷酸化、组蛋白sumo化、组蛋白核糖基化或组蛋白瓜氨酸化的改变,或其组合。优选地,经遗传
修饰的植物细胞不包含任何稳定整合进植物细胞基因组中的外源遗传物质。
[0255]
经遗传修饰的植物细胞可以是整个植物的部分或其一部分。因此,本发明还涉及包含上述经遗传修饰的植物细胞的植物或植物部分。
[0256]
根据本发明的另一方面,经遗传修饰的植物细胞可以再生为完整(可育)植物。因此,在本发明的优选方面,在植物细胞的遗传修饰之后是再生植物的步骤。因此,本发明提供了一种生产经遗传修饰的植物的方法,包括以下步骤:
[0257]
a)根据上述用于在植物细胞中进行遗传修饰的方法对植物细胞进行遗传修饰,和
[0258]
b)从步骤a)的修饰的植物细胞再生植物。
[0259]
再生植物的步骤b)可以例如包含在再生培养基上培养来自步骤a)的经遗传修饰的植物细胞。
[0260]
再生技术依赖于组织培养基生长培养基中某些植物激素的处理,偶尔依赖于可以导入的抗微生物剂和/或除草剂标记。再生可以得自植物体细胞、愈伤组织细胞或胚胎细胞以及来自不同外植体(例如愈伤组织、未成熟或成熟的胚胎、叶、芽、根、花、小孢子、胚胎组织、分生组织、器官或其任何部分)的原生质体。此种再生技术在klee(1987)ann.rev.of plant phys.38:467486中有一般描述。来自培养的原生质体的植物再生描述于evans等,protoplasts isolation and culture,handbook of plant cell culture,pp.124
‑
176,macmillan publishing company,new york,1983;和binding,regeneration of plants,plant protoplasts,pp.21
‑
73,crc press,boca raton,1985。要从转化或基因编辑的细胞中获得完整的植物,可以在一系列含有营养和激素受控的环境条件进行生长,该过程称为组织培养。一旦生成完整植物并产生种子,就开始评估后代。
[0261]
本发明还提供通过上述生产经遗传修饰的植物或其后代植物的方法获得或可获得的经遗传修饰的植物。
[0262]
本发明的另一主题是源自上述经遗传修饰的植物的植物细胞或种子。
[0263]
本发明的另一主题是无需基于标记基因的选择的源自上述经遗传修饰的细胞的植物、植物细胞或种子。如本文所用,“基于标记基因的选择”是指通过使用整合的选择标记(基因),例如抗生素抗性基因(例如卡那霉素抗性基因、潮霉素抗性基因)或除草剂抗性基因(例如草丁膦抗性基因、草甘膦抗性基因)从野生型细胞中选择,鉴定和/或纯化修饰的细胞,特别是转化的、基因编辑的或碱基编辑的细胞的任何方法。没有这样的选择,这种植物、植物细胞或种子可能没有整合任何基因组工程化组分,从而可能产生(i)无转基因的经遗传修饰植物或(ii)仅整合了感兴趣的基因的修饰植物。
[0264]
除非在实施例中另有说明,否则所有重组dna技术均根据如在以下文献中所述的标准方案进行:sambrook等(1989),(1989)molecular cloning:a laboratory manual,second edition,cold spring harbor laboratory press,ny;以及ausubel等(1994),current protocols in molecular biology,current protocols,usa的第1卷和第2卷。bios scientific publications(uk)和英国布莱克威尔出版公司(blackwell)联合出版的r.d.d.cray的plant molecular biology labfax(1993)中描述了用于植物分子研究的标准材料和方法。标准分子生物学技术的其他参考包括sambrook and russell(2001)molecular cloning:a laboratory manual,third edition,cold spring harbor laboratory press,ny,brown(1998)molecular biology labfax,second edition,
academic press(uk)的第i卷和第ii卷。用于聚合酶链反应的标准材料和方法可参见dieffenbach和dveksler(1995)pcr primer:a laboratory manual,cold springharbor laboratory press,以及mcpherson等,(2000)pcr
‑
basics:frombackground to bench,first edition,springer verlag,germany。
[0265]
序列
[0266]
seq id no:
ꢀꢀꢀ
描述
[0267]1ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
kws
‑
rbp1的cdna
[0268]2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
kws
‑
rbp1的蛋白质
[0269]3ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmplt5(基因型a188)的cdna
[0270]4ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmplt5(基因型a188)的蛋白质
[0271]5ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atplt5的cdna
[0272]6ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atplt5的蛋白质
[0273]7ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmplt7(基因型a188)的cdna
[0274]8ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmplt7(基因型a188)的蛋白质
[0275]9ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atplt7的cdna
[0276]
10
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atplt7的蛋白质
[0277]
11
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
tarkd4的cdna
[0278]
12
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
tarkd4的蛋白质
[0279]
13
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atrkd4的cdna
[0280]
14
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atrkd4的蛋白质
[0281]
15
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmrkd4的cdna
[0282]
16
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmrkd4的蛋白质
[0283]
17
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
tarkd2的cdna
[0284]
18
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
tarkd2的蛋白质
[0285]
19
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atrkd2的cdna
[0286]
20
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
atrkd2的蛋白质
[0287]
21
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmrkd2的cdna
[0288]
22
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmrkd2的蛋白质
[0289]
23
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
bdef1的启动子
[0290]
24
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pabm
‑
bdef1
[0291]
25
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pabm
‑
bdef1_zmplt5
[0292]
26
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pabm
‑
bdef1_zmplt7
[0293]
27
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pabm
‑
bdef1_kws
‑
rbp1
[0294]
28
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pabm
‑
bdef1_tarkd4
[0295]
29
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pgep359
[0296]
30
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pgep324
[0297]
31
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pamk
‑
bdef_zmwus2
[0298]
32
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
bdef1::zmplt5_表达盒
[0299]
33
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
bdef1::zmplt7_表达盒
[0300]
34
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
bdef1::kws
‑
rbp1_表达盒
[0301]
35
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
bdef1::tarkd4_表达盒
[0302]
36
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
bdef1::zmwus2_表达盒
[0303]
37
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pubi::lpcpf1_表达盒
[0304]
38
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pubi::crrna5_表达盒
[0305]
39
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
lbcpf1的cdna
[0306]
40
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
lbcpf1的蛋白质
[0307]
41
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
crrna5_靶_hmg13
[0308]
42
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
crrna5_靶_序列
[0309]
43
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pamk
‑
zmwus2
‑
tdt
‑
nost
[0310]
44
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmplt7(基因型b73)的cdna
[0311]
45
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
zmplt7(基因型b73)的蛋白质
[0312]
46
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pzmwus2::tdt
‑
nost表达盒
[0313]
47
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
kws
‑
rbp2
[0314]
48
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
kws
‑
rbp2的蛋白质
[0315]
49
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
pabm
‑
bdef1_kws
‑
rbp2
[0316]
50
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
bdef1::kws
‑
rbp2_表达盒
[0317]
本文引用或援引的所有专利、专利申请和出版物或公共公开内容(包括互联网上的出版物)均通过引用全文并入本文。
具体实施方式
[0318]
通过以下实施例进一步说明本发明。然而,应当理解,本发明不限于这些示例。在说明书中任何地方使用这些和其他示例仅是说明性的,绝不限制本发明或任何示例性术语的范围和含义。同样,本发明不限于这里描述的任何特定的优选实施例。实际上,在阅读本说明书后,本发明的许多修改和变化对本领域技术人员而言是显而易见的,并且在不脱离本发明的精神或范围的情况下,可以进行这种变化。因此,本发明仅由所附权利要求的条款以及那些权利要求所赋予的等价物的全部范围来限制。
[0319]
实施例1.利用共同轰击的加强基因和感兴趣的基因(goi)的瞬时共表达。
[0320]
基因克隆和构建体制备
[0321]
通过使用从玉米a188未成熟胚胎中分离的总rna的rt
‑
pcr克隆了玉米plt5(zmplt5(zmwus2)和plt7(zmplt7)基因。小麦rkd4和kws
‑
rbp1基因自其蛋白质序列进行了玉米密码子优化,并通过integrated dna technologies(idt,圣地亚哥,加利福尼亚,美国)合成。加强基因片段在bamhi和hindiii的克隆位点克隆到表达载体pabm
‑
bdef1(图1)中,并在bdef1启动子(pbdfe1)和nos终止子(nos
‑
t)的控制下表达。pbdfe1是来自短柄草属的强组成型启动子。测序确认的构建体图显示在图2至8中。
[0322]
制备用以轰击的玉米未成熟胚胎
[0323]
授粉后9
‑
12天,收获具有0.8
‑
1.8mm,优选1.0
‑
1.5mm大小的未成熟胚胎的玉米穗(即a188或hi ii)。将穗用70%乙醇消毒10
‑
15分钟。在层状通风橱(laminar hood)中短暂风干后,用鲨鱼解剖刀将~1/3的果仁从穗上去除,然后用刮刀小心地将未成熟的胚胎从果
仁中取出。将新鲜的分离的胚胎置于盾片面朝上的渗透培养基板(见下文)中的轰击靶区域上。将板用石蜡膜包裹,在轰击之前在黑暗中于25℃孵育4小时。
[0324]
粒子共同轰击
[0325]
使用粒子轰击枪和具有大小为0.4或0.6微米(μm)的金粒子将dna递送到玉米未成熟胚胎的盾片细胞中。将加强基因质粒与感兴趣的基因(goi)预混合,例如,具有crispr核酸酶cpf1和tdt报告基因的基因组编辑构建体pgep359(图6),以及针对pgep324的含有crispr导向rna crrna5靶标的hmg13(图7)。对于10次发射,将总体积为100微升(μl)的50%(v/v)甘油中的1毫克金颗粒(每针100克金颗粒)吸移到透明的低滞留微离心管中。将混合物超声处理15秒以悬浮金颗粒。在低速涡旋的同时,向每个100μl金颗粒中依次添加以下物质:(a)最多10μldna(1.0
‑
10.0μg预混合的总dna,每个发射100
‑
1000ng,(b)100μl的2.5m cacl2(在冰上预冷),以及(c)40μl的0.1m冷亚精胺。
[0326]
关闭盖子,并将管在0
‑
10℃下涡旋2
‑
30分钟,然后将dna包被的金颗粒离心下来。用500μl 100%乙醇洗涤两次后,将沉淀重悬于120μl 100%乙醇中。在低速涡旋的同时,将10μl包被的金颗粒从管中以宽阔的20μl尖端平均地吸移到大载体的中心。由于此时颗粒倾向于形成团块,因此将金颗粒尽快放置在大载体上,然后进行空气干燥。使用bio
‑
rad pds
‑
1000/he粒子枪进行轰击。轰击条件是:28mm/hg真空,450或650psi破裂盘,6mm的间隙距离,样品平台在距腔室底部60mm距离的第二位置,每个样品(玉米未成熟的胚胎)平板三次发射。
[0327]
轰击后观察和胚胎培养
[0328]
轰击后,胚胎在渗透培养基上再保留16个小时。轰击后16
‑
20小时,使用荧光显微镜检查瞬时转化的tdt表达,其最大激发波长为554nm且最大发射波长为581nm。选择在荧光显微镜下具有密集荧光信号的胚胎(图8),并将其从n6osm转移到n6
‑
5ag平板上(每个平板~15个胚胎),将盾片正面朝上以诱导愈伤组织(参见下文)。
[0329]
渗透培养基:n6盐、n6维生素、1.0mg/l的2,4
‑
d、100mg/l的酪蛋白、0.7g/l的l
‑
脯氨酸、0.2m的甘露醇(36.4g/l)、0.2m的山梨醇(36.4g/l)、20g/l蔗糖、15g/l细菌琼脂、ph 5.8。
[0330]
n6
‑
5ag:n6盐、n6维生素、1.0mg/l的2,4
‑
d、100mg/l的酪蛋白、2.9g/l的脯氨酸、20g/l的蔗糖、5g/l的葡萄糖、5mg/l的agno3、8g/l的琼脂、ph 5.8。
[0331]
实施例2.zmplt5或zmplt7基因和kws
‑
rbp1的瞬时共表达促进玉米hi ii未成熟胚胎的早期胚胎发生和再生。
[0332]
在上文实施例1中描述了瞬时共同递送、胚胎制备和培养。对于每次轰击,将四个预混合的dna质粒包被在100μg大小为0.4μm的金颗粒上,并在650psi的破裂压力共同导入hi ii未成熟胚胎的盾片细胞中。如下将四种质粒进行预混,进行一次轰击:
[0333]
‑
100ng加强zmplt5或zmplt7(图2和图3)
[0334]
‑
200ng kws
‑
rbp1(图4)
[0335]
‑
100ng pgep359(图6)
[0336]
‑
150ng pgep324(图7)
[0337]
选择在荧光显微镜下具有密集荧光信号的胚胎(图8),并将其从n6osm转移到n6
‑
5ag上以诱导胚胎愈伤组织。选择的胚胎在n6
‑
5ag平板中培养,盾片面朝上(每个平板大约
15个胚胎)在27℃黑暗中培养14在黑暗中。通过在解剖显微镜下观察来监测胚胎发生的愈伤组织的诱导。具体地,通过在荧光显微镜下目视观察轰击后5
‑
7天的诱导胚胎形成的能力来测量对细胞分裂和再生的加强作用。
[0338]
图9显示了通过微粒轰击的共表达zmplt5(图9b)或zmplt7(图9c)和kws
‑
rbp1显着促进了玉米hi ii未成熟胚胎中的胚胎发生愈伤组织诱导。相比于没有加强子轰击的图9a中的图像,图9b和图9c的图像显示了粒子轰击5天后形成并出现的多个胚胎结构。
[0339]
实施例3.zmplt5或zmplt7和kws
‑
rbp1的瞬时共表达改善了玉米hi未成熟胚胎中共同递送的报告基因的稳定转化
[0340]
实施例1和2描述了玉米胚胎的制备、瞬时轰击和胚胎愈伤组织的诱导。将胚胎在n6
‑
5ag培养基中于27℃在黑暗中培养14天。通过在荧光显微镜下观察将tdt荧光用于监测胚胎发生的愈伤组织的诱导和稳定转化。具体地,加强作用是通过无选择地轰击后12天提高tdt报告基因的转化频率(tf)的能力来衡量的。
[0341]
来自图10中新兴胚胎结构的强而均匀的tdt荧光信号表明tdt基因的整合和稳定转化。稳定转化频率定义为从最初使用的100个胚胎中诱导出的具有至少一个稳定的tdt荧光结构的胚胎数。轰击后12天测量稳定转化频率。
[0342]
zmplt5和kws
‑
rbp1基因的瞬时共表达导致tdt基因的转化频率达到65%(与没有加强子的对照相比,提高了26倍),而tdt与zmplt7和kws
‑
rbp1的共递送使tdt基因的转化频率为72.8%(与对照相比提高超过29倍)(图10d)。图10的结果表明(i)zmplt5或zmplt7和(ii)kws
‑
rbp1的瞬时共表达促进了玉米hi ii未成熟胚胎中稳定转化频率。
[0343]
稳定转化发生在单个细胞水平,其中最初转移的dna被整合到宿主细胞的基因组中。为了恢复同种经遗传修饰的植物,需要多轮选择以鉴定和纯化具有稳定dna整合的细胞。如果没有加强子,稳定转化的发育要花多周时间(取决于细胞增殖的速度),例如玉米中4
‑
8周。与没有加强子的传统转化相比,在用加强子轰击后仅12天实现了图10所示的稳定转化。因此,zmplt5或zmplt7与kws
‑
rbp1基因的瞬时共表达减少了产生稳定转化所需的时间,并导致了玉米中快速且高效的转化。
[0344]
实施例4.1zmplt5或zmplt7基因和kws
‑
rbp1的瞬时共表达促进玉米a188未成熟胚胎中的早期胚胎发生和再生
[0345]
如实施例2中所述进行实验过程。轰击后7天记录结果。结果显示在图11中,其表明通过微粒轰击的zmplt5(图11b)或zmplt7(图11c)和kws
‑
rbp1的瞬时共表达显着促进了玉米a188未成熟胚胎的胚胎发生结构诱导。相比于没有加强子的图11a中的图像,图11b和图11c中的图像显示形成了多个胚胎结构。这些结构在粒子轰击7天后出现。
[0346]
实施例4.2zmplt5基因和kws
‑
rbp2的瞬时共表达促进玉米a188未成熟胚胎中的早期胚胎发生和再生
[0347]
如实施例2中所述进行实验过程。轰击10天后记录结果。结果显示在图23中,其表明通过微粒轰击的zmplt5和kws
‑
rbp2的瞬时共表达显着促进了玉米a188未成熟胚胎的胚胎发生结构诱导。zmplt5基因和kws
‑
rbp2共表达后的再生比率(%)甚至高于zmplt5基因和kws
‑
rbp1共表达后的再生比率。再生比率定义为从最初使用的100个胚胎中再生出至少一个植物的胚胎数目。轰击后10天记录数据。
[0348]
实施例5.1zmplt5或zmplt7基因和kws
‑
rbp1的瞬时共表达促进了玉米a188未成熟
胚胎中共递送的报告基因的早期稳定转化。
[0349]
如实施例3中所述进行实验过程。轰击后16天记录结果。来自图12b和12c中出现的胚胎结构的强且均匀的tdt荧光信号表明了tdt基因的整合和稳定转化。相比于图12a中的图像,图12b和12c中的红色荧光图像说明zmplt5(图12b)或zmplt7(图12c)与kws
‑
rbp1的共表达显着改善了玉米a188未成熟胚胎中报告基因的稳定转化。
[0350]
未选择的轰击a188未成熟胚胎后16天,从没有加强子的对照中未观察到稳定转化。相比于对照,在玉米a188轰击后16天,tdt构建体与zmplt5和kws
‑
rbp1的共同轰击导致了12.2%的转化频率,而与zmplt7和kws
‑
rbp1的共同轰击(图12d)产生了7.1%的tdt报告的转化频率。
[0351]
实施例5.2zmplt5和kws
‑
rbp2的瞬时共表达促进了玉米a188未成熟胚胎中共递送的报告基因的早期稳定转化。
[0352]
如实施例3中所述进行实验过程。轰击10天后记录结果。来自图24b和24c中出现的胚胎结构的强且均匀的tdt荧光信号表明了tdt基因的整合和稳定转化。相比于图24a中的图像,图24b和24c中的红色荧光图像说明zmplt5与kws
‑
rbp1的共表达以及zmplt5与kws
‑
rbp2的共表达显着改善了玉米a188未成熟胚胎中报告基因的稳定转化。
[0353]
未选择的轰击a188未成熟胚胎后16天,从没有加强子的对照(仅tdt;图25a)中未观察到稳定转化。相比于对照,在玉米a188轰击后16天,tdt构建体与zmplt5和kws
‑
rbp1的共同轰击(图25b)导致了9.8%的转化频率,而与zmplt5和kws
‑
rbp2的共同轰击(图25c)产生了79.2%的tdt报告的转化频率(图25d)。
[0354]
实施例6.小麦rkd4激活玉米wuschel(wus)表达。
[0355]
同源盒结构域转录因子wuschel(wus)在建立和维持芽分生组织中起重要作用。为了鉴定促进内源性wus2表达的加强因子,玉米wuschel2启动子报告构建体(pamk
‑
zmwus2
‑
tdt
‑
not)(seq id no:43;图13)用于说明玉米wus2启动子活性。玉米wus2启动子(pzmwus2)驱动tdt报告基因在该报告构建体中的表达(图13)。wus2启动子报告构建体分别与在玉米未成熟胚胎和叶节中的加强因子共同轰击。
[0356]
从体外培养的10
‑
14天大的玉米a188幼苗中制备长度为1
‑
2cm的新鲜叶节,然后放置在背面侧朝上的渗透培养基中4小时。为了进行共同轰击,将两个质粒(100ng zmwus2启动子报告(图13)和100ng加强构建体(例如tarkd4)(图5))预混合并包被在100μg大小为0.4μm的金颗粒上。如实施例1和实施例2中所述进行未成熟的胚胎制备、轰击和轰击后培养。使用轰击后16小时开始的荧光显微镜监测显示tdt表达的红色荧光。
[0357]
wus专门在植物芽尖分生组织(sam)的组织中心(oc)中转录并控制sam中的干细胞身份。
[0358]
在轰击后培养期间的任何时间(16小时至7天),仅使用zmwus2启动子报告(仅pzmwus2报告)的轰击不会导致轰击的叶样品产生任何tdt荧光信号。但是,当与小麦rkd4构建体共同轰击时(图5),轰击后约36小时在叶节中检测到tdt信号,轰击后约44小时达到峰值(图14b的底部)。与仅使用wus启动子报告子进行的对照轰击相比,在未成熟的胚胎中仅观察到了微弱的tdt信号(图14a的顶部),在用wus启动子报告子和小麦rkd4构建体共同轰击的胚胎中观察到了异常强的红色荧光信号(图14b的顶部)。这些结果表明小麦rkd4强烈激活玉米wus2基因。轰击后44小时拍摄图像。
[0359]
实施例7.tarkd4和kws
‑
rbp1的瞬时共表达促进了来自玉米hi ii未成熟胚胎的早期胚胎发生。
[0360]
图15显示了通过微粒轰击的共表达小麦rkd4(图5)和kws
‑
rbp1(图4)显着促进了玉米hi ii未成熟胚胎中的胚胎发生结构诱导。如实施例2所述进行实验过程,轰击后5天记录结果。相比于没有加强子的图15a中的图像,图15b中的图像显示在粒子轰击后5天形成并出现的多个胚胎结构。粒子轰击后5天获取图像。
[0361]
实施例8.tarkd4和kws
‑
rbp1的瞬时共表达促进了来自玉米hi ii未成熟胚胎的共递送的报告基因的早期稳定转化。
[0362]
如实施例3所述进行实验,且轰击后12天记录结果。
[0363]
来自图16b中出现的胚胎结构的强且均匀的tdt荧光信号表明了tdt基因的整合和稳定转化。相比于图16a中的图像,图16b中的红色荧光图像说明了tarkd4和kws
‑
rbp1的共递送显着改善了玉米hi ii未成熟胚胎中报告基因的稳定转化。
[0364]
未选择的轰击hi ii未成熟胚胎后12天,从没有加强子的对照中未观察到稳定转化。相比于对照,tdt构建体与taplt4和kws
‑
rbp1的共同轰击导致了23.5%的tdt报告的转化频率(图16c)。
[0365]
实施例9.tarkd4和kws
‑
rbp1的瞬时共表达促进了玉米a188未成熟胚胎的早期胚胎发生
[0366]
如实施例3中所述进行实验,且轰击后5天记录结果。图17显示了通过微粒轰击的共同递送tarkd4(图5)和kws
‑
rbp1(图4)显着促进了玉米a188未成熟胚胎中的胚胎发生结构诱导。相比于没有加强子的图17a中的图像,图17b中的图像显示了在粒子轰击后5天形成并出现的多个胚胎结构。粒子轰击后5天获取图像。
[0367]
实施例10.tarkd4和kws
‑
rbp1的瞬时共表达促进了来自玉米a188未成熟胚胎的共递送的报告基因的早期稳定转化
[0368]
如实施例3中所述进行实验,且轰击后14天记录结果。来自图18b中产生的胚胎结构的强且均匀的tdt荧光信号表明tdt基因的整合和稳定转化。相比于图18a中的图像,图18b中的红色荧光图像说明tarkd4和kws
‑
rbp1的共递送显着改善了玉米a188未成熟胚胎中报告基因的稳定转化。
[0369]
未选择的轰击a188未成熟胚胎后14天,从没有加强子的对照轰击中未观察到稳定tdt荧光结构。相比于对照,tdt构建体与tarkd4和kws
‑
rbp1的共同轰击导致35.5%的a188未成熟胚胎的tdt报告的转化频率(图18c)。
[0370]
实施例11.加强基因与基因组编辑组分的共表达促进玉米中瞬时基因组的编辑。
[0371]
对于胚胎制备、轰击和轰击后胚胎培养进行实施例1和实施例2中所述的程序。在n6
‑
5ag培养基中诱导愈伤组织14天(hi ii)或18天(a188)之后,从轰击的胚胎的盾片表面挑选迅速生长的胚胎性愈伤组织,并转移到mrm1培养基中(见下文)进行胚胎成熟。在黑暗中于25℃在mrm1培养基中培养约两周后,将成熟的胚胎移至mso培养基(见下文)中以在25℃的光照下在植物托盘中进行胚胎发芽。在mso培养基中培养约10天后,再生的小植株已准备好进行分子分析并转移到土壤中。从再生小植株的所有叶中收集大约5mm的叶尖用于dna提取。通过taqman qpcr、标记毛细管电泳从再生植物中筛选出特定位点的基因组修饰,并通过digital pcr、下一代测序(ngs)和sanger测序进行确认。通过qpcr检查dna整合。
[0372]
如果没有加强子,通过选择的瞬时表达(仅ge),使用cpf1(pgep359)和crrna5(pgep324)的基因组编辑不会导致任何可检测的编辑事件(图19)。但是,通过与zmplt5和kws
‑
rbp1(ge加zmplt5和kws
‑
rbp1)共表达,实现了1%的瞬时基因组编辑效率(图19a),以及当与zmplt7和kws
‑
rbp1(ge加zmplt5和kws
‑
rbp1)共表达时还可以获得0.8%的瞬时基因组编辑效率(图19b)。这些结果表明增强子zmplt5、zmplt7和kws
‑
rbp1改善了瞬时基因组编辑。
[0373]
培养基
[0374]
mrm1:ms盐+ms维生素+100mg/l肌醇+6%蔗糖+9g/l细菌琼脂、ph 5.8
[0375]
ms0:ms盐+ms维生素+2g/l的肌醇+2%蔗糖+8克/升的细菌琼脂、ph 5.8
[0376]
实施例12.可以通过在玉米中基因组编辑组分与加强基因的瞬时共表达恢复同种编辑的植物。
[0377]
进行了无需选择的加强基因和基因组编辑组分的瞬时共表达的droplet digital pcr(ddpcr)。约50%和100%的位点特异性indel比率分别表明单等位基因和双等位遗传修饰。图20a中的数据是通过使用水(底部)或野生型dna(wt液滴)的droplet digital pcr的阴性对照得到的结果。图20b显示了对源自加强子和基因组编辑组分的瞬时共表达的编辑的t0植物所进行droplet digital pcr的结果。顶部和中间的图显示了来自两个编辑的t0植物的接近100%的indel比率,其表明同种双等位遗传修饰,而下图说明了同种单等位基因编辑事件。
[0378]
不希望受到理论的束缚,遗传修饰发生在单个细胞水平。为了恢复同种修饰的植物,通常需要进行选择以分离具有修饰的细胞并去除野生型细胞。常规选择通常涉及使用整合的选择标记例如抗生素(例如卡那霉素、潮霉素)或除草剂(例如膦丝菌素、草甘膦)抗性基因。如果在瞬时基因组编辑中没有整合的选择标记,再生植物很可能是嵌合体。
[0379]
相反,图20所示的droplet digital pcr(ddpcr)结果表明,通过无需选择的基因组编辑组分与加强基因的瞬时共表达可实现同种基因组编辑。来自所有编辑的植物的约50%或100%的indel比率表明是同种单等位基因或双等位遗传修饰。sanger测序结果进一步证实了ddpcr结果(图21)。这些结果表明,与加强基因的瞬时共表达可以导致单个细胞的植物再生。
[0380]
***
[0381]
本发明不限于本文所述的具体实施方案的范围。实际上,除了本文描述的那些之外,根据前述描述和附图,本发明的各种修改对于本领域技术人员将变得明显。这样的修改旨在落入所附权利要求的范围内。还应理解,所有值都是近似值,并提供用以描述。
[0382]
在整个本申请中援引了专利、专利申请、出版物、产品描述和协议,出于所有目的,其公开内容通过引用整体并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1