用于制备病毒载体的组合物和方法与流程
用于制备病毒载体的组合物和方法
1.相关申请的交叉引用
2.本申请要求于2018年10月9日提交的美国临时申请号62/743,362的优先权,其全部内容通过引用合并于此。
技术领域
3.本申请总体上涉及使用衣壳化缺陷型辅助病毒产生重组病毒载体的方法和组合物。
背景技术:
4.当前的重组病毒产生方法通常利用腺病毒辅助功能来制备重组病毒载体以有效地递送基因。常规方法通常采用转染方法,导致低于最佳病毒效价且难以扩大规模。当使用辅助腺病毒时,重组载体制剂被辅助病毒污染。
5.因此,需要提供更有效的方法来产生高效价的病毒制剂,所述制剂不被衣壳化的辅助病毒污染或没有其他不期望的作用。
技术实现要素:
6.本申请的一个方面涉及用于产生重组病毒载体的衣壳化缺陷型腺病毒(edad)。edad在其基因组中包含一个或多个突变,其导致(1)一种或多种衣壳化必需蛋白的显著降低的产生或不产生,和/或(2)一种或多种缺陷型衣壳化必需蛋白的产生。
7.本申请的另一方面涉及用于产生本申请的edad的包装细胞系。包装细胞能够产生一种或多种基因产物,其允许在包装细胞内的edad的衣壳化。
8.本申请的另一方面涉及产生重组病毒(rv)的方法。所述方法包括以下步骤:(a)用一种或多种edad感染生产细胞以产生感染的生产细胞,(b)在允许产生具有rv基因组的rv的条件下孵育感染的生产细胞;以及(c)收获所述重组病毒,其中所述edad或所述生产细胞包含所述rv基因组。
9.本申请的另一方面涉及用于产生重组病毒的生产细胞。所述生产细胞包含(a)所述重组病毒的基因组,或(b)编码产生所述重组病毒所需的产物的基因,或(a)和(b)两者。
附图说明
10.图1a和1b描绘了腺病毒颗粒及其结构组分。图1c显示了腺病毒转录单元,包括由其编码的多肽。晚期单元编码蛋白,所述蛋白构成突变靶标以产生衣壳化缺陷型ad(edad)。
11.图2是描述与用包装感受态ad(pcad)或edad感染宿主细胞相关的功能结果的示意图。具体而言,pcad会产生感染性的包装好的腺病毒颗粒;而edad则不会。
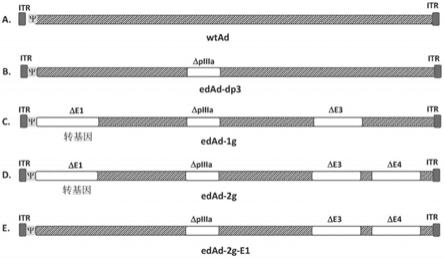
12.图3是描绘wt(分图a)和突变ad(edad,分图b
‑
e)基因组的示意图。分图b
‑
e中的突变ad包括piiia缺失,这使它们衣壳化有缺陷。edad
‑
dp3(分图b)具有野生型e1区,其允许在宿主细胞中进行dna复制而无需e1a和e1b的表达。edad
‑
1g和edad
‑
2g(分图c和d)包括e1和
e3中的缺失,并且只能在表达e1a和e1b蛋白的细胞系(例如293细胞)中复制其dna。edad
‑
2g另外具有e4缺失,以进一步提高包装容量。edad
‑
2g病毒能够在具有piiia表达的911e4细胞系中生长。edad
‑
2g
‑
e1(分图e)在e3、e4和piiia中具有另外缺失,但具有野生型e1区。
13.图4是描绘分图a
‑
e中的几种不同的edad的示意图,每种edad均具有piiia缺失,使它们衣壳化有缺陷。此外,每种edad均具有整合的aav载体,用于产生表达期望靶基因的复制缺陷型aav颗粒。aav载体序列显示为替换ad e3序列(分图a、b、d)或ad e1序列(分图c、e)。分图c中的edad1g
‑
aav
‑
i1
‑
cre在ad e3区插入cmv
‑
cre表达单元,用于提供raav产生所必须的辅助基因功能的cre介导的激活。辅助基因功能的表达可通过cre介导的缺失或反转(inversion)终止序列而被激活。
14.图5是描绘了edad的产生的示意图。在此,edad中缺失的结构元件(例如piiia)由被稳定转化以反式表达缺失产物的宿主细胞提供。
15.图6是描绘在表达e1a和e1b辅助功能的宿主细胞(例如293细胞)中产生raav颗粒的常规三质粒转染方法的示意图。
16.图7是示意图,其描绘当以下情况时产生raav载体和pcad或wt ad:用含有具有aav itr的缺陷型aav基因组(其经工程改造以表达期望靶基因)的质粒和共表达rep和cap(以为raav产生提供辅助功能)的质粒共转染宿主细胞,以及还用wt ad或pcad(其为raav产生提供辅助功能)感染相同的宿主细胞。还产生wtad和pcad的副产物。
17.图8是描绘通过用edad感染宿主细胞来产生raav载体的示意图。在这种情况下,宿主细胞(hela)用aav rep和cap表达质粒以及带有aav itr的缺陷型aav基因组稳定地转化,所述缺陷型aav基因组经工程改造以表达期望的靶基因。尽管将具有e1区的感染性edad
‑
dp3施加于宿主细胞,但所得的raav不受腺病毒污染。
18.图9是描绘通过用edad(例如图4的分图c中的edad1g
‑
aav
‑
i1
‑
cre)感染293细胞(其被稳定转化以表达e1a、e1b和可诱导型rep
‑
capcap)来产生raav的示意图。在这种情况下,来自edad的cre的表达会切除构建入rep表达单元中的内含子/聚a中的loxed片段,从而激活rep表达。edad还包含带有aav itr的缺陷型aav基因组,所述基因组经工程改造以表达期望的靶基因。所得的raav不受ad污染。cre可以用其他表达诱导系统替代。
19.图10是描绘通过在hela或a549宿主细胞中感染具有wt e1a/e1b区的edad(edad1g
‑
aav
‑
e1)来产生raav的示意图。edad还包含带有aav itr的缺陷型aav基因组,所述基因组经工程改造以表达期望的靶基因。稳定转化hela和a549宿主细胞以表达aav rep和cap。所得的raav不受ad污染。
20.图11是描绘在提供e1a/e1b、e2和e4辅助功能的293细胞中用具有e1a/e1b、e2、e3和e4缺失的edad产生raav的示意图。具有cre基因的edad2g
‑
aav
‑
cre被设计用于去除构建入rep中的内含子中的loxed片段,从而激活rep表达。edad2g
‑
aav/(cre)还包含带有aav itr的缺陷型aav基因组,所述基因组经工程改造以表达期望的靶基因。所得的raav不受ad污染。
21.图12是描绘产生第一代(分图a)、第二代(分图b)和第三代(分图c)慢病毒载体颗粒所必须的组分的示意图。
22.图13是描绘通过用所描绘的三种edad感染宿主细胞(其被稳定转化以表达e1a和e1b)来产生第一代慢病毒颗粒的示意图。所得的慢病毒颗粒不受ad污染。多种腺病毒编码
的元件之一也可以整合到宿主细胞系中。可以通过以下来修改该示例:仅使用一种edad,所述edad带有用于产生载体的必要元件的组合,而其余元件整合到宿主细胞系中。
23.图14是描绘通过用所描绘的三种edad感染宿主细胞(其被稳定转化以表达e1a和e1b)来产生第二代慢病毒颗粒的示意图。所得的慢病毒颗粒不受ad污染。多种腺病毒编码的元件之一也可以整合到宿主细胞系中。可以通过以下来修改该示例:仅使用一种edad,所述edad带有用于产生载体的必要元件的组合,而其余元件整合到宿主细胞系中。
24.图15是描绘通过用经工程改造以表达慢病毒env
‑
gag
‑
pol
‑
tat
‑
rev基因的edad1g
‑
gen2pl
‑
env颗粒感染宿主细胞(其被稳定转化以表达e1a/e1b)来产生第二代慢病毒颗粒的示意图。在这种情况下,在宿主细胞中稳定转化经工程改造以表达期望的转基因的缺陷型慢病毒基因组。所得的慢病毒颗粒不受ad污染。可以通过以下来修改该示例:仅使用一种edad,所述edad带有用于产生载体的必要元件的组合,而其余元件整合到宿主细胞系中。
25.图16是描绘用包含四种edad的tat非依赖性系统来产生第三代慢病毒颗粒的示意图。在这种情况下,用所示的四种edad感染被稳定转化以表达e1a/e1b的宿主细胞。edad1g
‑
转基因颗粒包括缺陷型慢病毒自灭活(sin)转移载体,其包含在所有慢病毒基因组中存在的聚嘌呤束(tract)顺式活性序列(cppt)的中央拷贝(用于有效的核输入)、mscv ltr启动子(mu3)(作为驱动转基因表达的内部启动子)、以及用于高水平转基因表达的wpre(w)元件。其他三种edad经工程改造以提供来自慢病毒gag
‑
pol和rev蛋白以及来自水泡性口炎病毒(vsv)
‑
g包膜糖蛋白的辅助功能。可以通过以下来修改该示例:仅使用一种edad,所述edad带有用于产生载体的必要元件的组合,而其余元件整合到宿主细胞系中。
26.图17是描绘用包含如先前在图16中所述的四种edad(例外是edad中的一种或多种包括e1a/e1b)的tat非依赖性系统来产生第三代慢病毒颗粒的示意图。在这种情况下,宿主细胞(例如hela或a549)不表达任何辅助功能;相反,辅助功能仅由所描绘的edad(未描绘包含e1a/e1b序列)的组合提供。仅需要一种带有野生型e1区的腺病毒。可以通过以下来修改该示例:仅使用一种edad,所述edad带有用于产生载体的必要元件的组合,而其余元件整合到宿主宿主细胞系中。
27.图18是描绘通过用所描绘的两种edad感染宿主细胞(其被稳定转化以表达e1a和e1b)来产生第一代慢病毒颗粒的示意图。慢病毒基因组现已整合到宿主染色体中。所得的慢病毒颗粒不受ad污染。可以通过以下来修改该示例:仅使用一种edad,所述edad带有用于产生载体的必要元件的组合,而其余元件整合到宿主宿主细胞系中。
28.图19是描绘通过用所描绘的一种edad感染宿主细胞(其被稳定转化以表达e1a、e1b、e4)来产生第三代慢病毒颗粒的示意图。慢病毒基因组现已整合到宿主染色体中。所得的慢病毒颗粒不受ad污染。
29.尽管现在将详细描述本公开,并且结合说明性实施方式进行描述,但是本公开不受限于附图和所附权利要求中示出的特定实施方式。
具体实施方式
30.将详细参考本申请的某些方面和示例性实施方式,示出了所附结构和附图中的示例。将结合示例性实施方式,包括方法、材料和示例来描述本申请的各方面,这种描述是非
限制性的,并且本申请的范围旨在涵盖通常已知的或并入此处的所有等同物、替代物和修改。除非另外定义,否则本文所用的全部技术术语和科学术语具有与本申请所属领域的普通技术人员通常所理解的相同意义。本领域的技术人员会认识到许多与此处描述的技术和材料相似或等同的技术和材料,其可以用于本申请的方面和实施方式的实践中。本申请的所描述的方面和实施方式不限于所描述的方法和材料。
31.除非上下文另外清楚地规定,否则在本说明书和所附权利要求中所使用时,不使用数量词限定和单数形式“一个(a)”、“一种(an)”和“所述(the)”包括复数个指示物。
32.在本文中范围可以表述为从“约”一个具体值,和/或至“约”其他具体值。当表述这样的范围时,另一个实施方式包括从一个具体值和/或到另一个具体值。类似地,当通过使用先行词“约”将值表示为近似值时,将理解所述特定值形成另一个实施方式。将进一步理解,每个范围的端点相关于另外的端点以及独立于另外的端点都是有意义的(significant)。还应当理解,本文公开了许多值,并且除了值本身之外,每个值在本文中也被公开为“约”该特定值。例如,如果公开了值“10”则也公开了“约10”。还应理解,如本领域技术人员适当理解的那样,当公开值时,“小于或等于“所述值”,大于或等于所述值”以及值之间的可能范围也被公开。例如,如果公开了值“10”,则还公开了“小于或等于10”以及“大于或等于10”。
33.除非另外定义,否则本文所用的全部技术和科学术语具有与本申请所属领域的普通技术人员通常所理解的相同的含义。通常,本文所用的命名法和下文所述的细胞培养、分子遗传学、核酸化学和杂交中的实验室程序是本领域众所周知的和常用的。标准技术用于重组核酸方法、多核苷酸合成以及微生物培养和转化(例如电穿孔、脂转染)。通常,酶促反应和纯化步骤根据制造商的说明书进行。技术和程序通常根据本领域的常规方法和各种一般参考文献进行(一般参见,sambrook等人molecular cloning:a laboratory manual[分子克隆:实验室手册],第2版(1989)cold spring harbor laboratory press[冷泉港实验室出版社],cold spring harbor[冷泉港],纽约(其通过引用并入本文),其贯穿本文档中提供。单位、前缀和符号可以用它们的si接受形式表示。除非另有说明,否则核酸以5’至3’方向从左向右书写;氨基酸序列分别以氨基至羧基方向从左至右书写。数值范围包括定义范围的数字,并且包括定义范围内的每个整数。氨基酸在本文中可以用它们众所周知的三字母符号或iupac
‑
iub生化命名委员会推荐的单字母符号来表示。同样,核苷酸可以用它们通常被接受的单字母代码来指代。
[0034]
定义
[0035]
本文所用的术语“核酸”涵盖rna和dna两者,包括cdna、基因组dna和合成的(例如,化学合成的)dna。核酸可以是双链或单链的。单链核酸可以是有义链或反义链。另外,核酸可以是环形或线性的。
[0036]“分离的核酸”是指与病毒基因组中存在的其他核酸分子(包括通常位于病毒基因组中核酸一侧或两侧的核酸)分开的核酸。本文关于核酸使用的术语“分离的”还包括任何非天然存在的核酸序列,因为这种非天然存在的序列在自然界中不存在并且在天然存在的基因组中不具有紧密连续的序列。
[0037]
分离的核酸可以是例如dna分子,条件是通常在天然存在的基因组中紧密侧接该dna分子的核酸序列之一被去除或不存在。因此,分离的核酸包括但不限于作为独立于其他
序列的单独分子(例如化学合成的核酸或cdna或通过pcr或限制性内切核酸酶处理产生的基因组dna片段)存在的dna分子,以及掺入载体、自主复制质粒、病毒(例如任何副粘病毒、逆转录病毒、慢病毒、腺病毒或疱疹病毒)中或掺入原核生物或真核生物的基因组dna中的dna。另外,分离的核酸可以包括(经)工程改造的核酸,例如作为杂合或融合核酸的一部分的dna分子。存在于例如cdna文库或基因组文库或含有基因组dna限制性消化物的凝胶切片中的数百至数百万其他核酸中的核酸不被认为是分离的核酸。
[0038]
在一些实施方式中,核酸分子可以编码腺病毒的基因组,但所述基因组缺少至少一种腺病毒多肽编码序列的全部或一部分。可以使用任何适当的分子克隆技术(例如重组或定点诱变)来生成缺少纤维蛋白编码序列、v蛋白编码序列、六邻体(hexon)蛋白编码序列、五邻体基底(penton base)蛋白编码序列,va rna编码序列或piii蛋白编码序列的全部或一部分的腺病毒核酸分子。同样,可以使用任何适当的分子克隆技术(例如,pcr、重组或限制性位点克隆)将核酸序列引入腺病毒的核酸分子中。可以通过标准技术将本文提供的核酸分子并入病毒中。例如,重组技术可用于将本文提供的核酸分子插入质粒或其他载体内的感染性病毒基因组或亚基因组中。在一些情况下,质粒或其他载体可以另外表达萤光素酶或其他报告基因。然后可以将病毒基因组转染到哺乳动物细胞中,以拯救经修饰的腺病毒。可替代地,可以将经修饰的亚基因组序列与其他亚基因组序列一起共转染到细胞中,从而使哺乳动物细胞将亚基因组重组为完整的基因组,从而产生新病毒。
[0039]“基因转移”或“基因递送”是指用于将外来(foreign)dna插入宿主细胞的方法或系统。基因转移可导致非整合的转移的dna的瞬时表达,转移的复制子(例如附加体)的染色体外复制和表达,或转移的遗传物质整合到宿主细胞的基因组dna中。
[0040]“载体”是指任何遗传元件,例如质粒、噬菌体、转座子、粘粒、染色体、人工染色体、病毒、病毒粒子等,其当与适当的控制元件相关联时能够复制并且其能够在细胞之间转移基因序列。因此,所述术语包括克隆载体和表达载体,以及病毒载体。
[0041]“腺相关病毒反向末端重复序列”或“aav itr”是指在aav基因组的每一端发现的本领域公认的区域,这些区域以顺式一起起作用,作为dna复制的起点和病毒基因组的包装信号。aav itr与aav rep编码区一起提供了两个侧翼itr之间插入的核苷酸序列的有效切除和拯救,以及将其整合到哺乳动物细胞基因组中。
[0042]
aav itr区的核苷酸序列是已知的。对于aav
‑
2序列,参见,例如,kotin,r.m.(1994)human gene therapy[人类基因疗法]5,793
‑
801;bems,k.i.“parvoviridae and their replication”in fundamental virology[基本病毒学中的“细小病毒科及其复制”],第2版(b.n.fields和d.m.knipe,编辑)。如本文所用,“aav itr”不必具有先前引用的参考文献中描述的野生型核苷酸序列,而是可以例如通过核苷酸的插入、缺失或取代而改变。此外,aav itr可以衍生自几种aav血清型中的任何一种,包括但不限于aav
‑
1、aav
‑
2、aav
‑
3、aav
‑
4、aav
‑
5、aav
‑
6、aav
‑
7、aav
‑
9、aav
‑
10、aav
‑
11、aav
‑
12和aav
‑
13。此外,在aav载体中位于选定核苷酸序列侧翼的5’和3’itr不必相同或衍生自相同的aav血清型或分离株,只要它们按预期发挥功能即可,即允许从宿主细胞基因组或载体中切除和拯救感兴趣的序列,并且当细胞中存在aav rep基因产物时,允许将异源序列整合到接受体(recipient)细胞基因组中。
[0043]“aav rep编码区”是指编码病毒的复制蛋白的aav基因组的本领域公认区域,在潜
伏感染期间,所述复制蛋白对于复制病毒基因组并将病毒基因组插入宿主基因组中是必需的。该术语还包括其功能同源物,例如人疱疹病毒6(hhv
‑
6)rep基因,也已知其介导aav
‑
2dna复制(thomson等人(1994)virology[病毒学]204,304
‑
311)。有关aav rep编码区的进一步说明,请参见例如,muzyczka,n.(1992)current topics in microbiol,and immunol.[微生物和免疫学的最新主题]158,97
‑
129;kotin,r.m.(1994)human gene therapy[人类基因疗法]5,793
‑
801。如本文所用,rep编码区可以衍生自任何病毒血清型,例如上述的aav血清型。所述区(域)不必包括所有野生型基因,但是可以例如通过核苷酸的插入、缺失或取代而被改变,只要存在的rep基因在合适的接受体细胞中表达时提供足够的整合功能即可。
[0044]
术语“rep的长形式”是指aav rep编码区的rep 78和rep 68基因产物,包括其功能同源物。rep的长形式通常在aav p5启动子的指导下表达。
[0045]
术语“rep的短形式”是指aav rep编码区的rep 52和rep 40基因产物,包括其功能同源物。rep的短形式在aav p19启动子的指导下表达。
[0046]“aav cap编码区”是指aav基因组的本领域公认的区域,其编码包装病毒基因组所需的病毒外壳蛋白。有关cap编码区的进一步说明,请参见例如,muzyczka,n.(1992)current topics in microbiol,and immunol.[微生物和免疫学的最新主题]158,97
‑
129;kotin,r.m.(1994)human gene therapy[人类基因疗法]5,793
‑
801。如本文中所使用的,aav cap编码区可以衍生自如上所述的任何aav血清型。所述区(域)不必包括所有野生型cap基因,但可以例如通过核苷酸的插入、缺失或取代而被改变,只要所述基因与aav载体一起存在于宿主细胞中时能提供足够的包装功能即可。
[0047]
术语“aav编码区”是指包括与aav rep和cap编码区相对应的两个主要的aav开放阅读框的核酸分子;例如,包含与野生型aav基因组的碱基对310至4,440基本同源的核苷酸序列的核酸分子。因此,出于本申请的目的,aav编码区不包括与aav p5启动子区相对应的那些序列,并且不包括aav itr。
[0048]“aav载体”是指衍生自腺相关病毒血清型的载体,包括但不限于aav
‑
1、aav
‑
2、aav
‑
3、aav
‑
4、aav
‑
5、aav
‑
6、aav
‑
7、aav
‑
9、aav
‑
10、aav
‑
11、aav
‑
12和aav
‑
13。aav载体可以具有一种或多种全部或部分缺失的aav野生型基因,优选是rep和/或cap基因,但保留功能性侧翼itr序列。功能性itr序列是aav病毒粒子的拯救、复制和包装所必须的。因此,本文将aav载体定义为至少包括病毒的复制和包装所需的那些顺式序列(例如,功能性itr)。itr不必是野生型核苷酸序列,并且可以改变,例如通过核苷酸的插入、缺失或取代,只要所述序列提供功能性拯救、复制和包装即可。
[0049]“aav辅助功能”是指aav衍生的编码序列,所述编码序列可被表达以提供aav基因产物,所述aav基因产物反过来以反式方式起作用用于生产性aav复制。因此,aav辅助功能包括rep和cap区。rep表达产物已被证明具有许多功能,其中包括:aav dna复制起点的识别、结合和切刻(nicking);dna解旋酶活性;以及来自aav(或其他异源)启动子的转录的调节。cap表达产物提供必要的包装功能。本文使用aav辅助功能来以反式补充aav载体中缺失的aav功能。
[0050]
术语“aav辅助构建体”一般是指包括提供从aav载体中缺失的aav功能的核苷酸序列的核酸分子,所述aav载体将用于产生转导载体以递送感兴趣的核苷酸序列。aav辅助构建体通常用于提供aav rep和/或cap基因的瞬时表达,以补充裂解aav复制所必要的缺失的
aav功能;然而,辅助构建体缺少aav itr,并且既不能复制也不能包装自身。aav辅助构建体可以是质粒、噬菌体、转座子、粘粒、病毒或病毒粒子的形式。已经描述了许多aav辅助构建体,例如常用的质粒paav/ad和pim29+45,它们编码rep和cap表达产物二者。参见,例如,samulski等人(1989)j.virology[病毒学杂志]63,3822
‑
3828;mccarty等人(1991)j.virology[病毒学杂志]65,2936
‑
2945。已经描述了编码rep和/或cap表达产物的许多其他载体。参见例如美国专利号5,139,941。
[0051]
术语“附属功能”是指非aav衍生的病毒和/或细胞功能,aav依赖其进行复制。因此,该术语囊括aav复制所需的dna、rna和蛋白,包括参与aav基因转录激活、阶段特异性aav mrna剪接、aav dna复制、cap表达产物的合成和aav衣壳装配的那些部分。基于病毒的附属功能可以衍生自任何已知的辅助病毒,例如腺病毒、疱疹病毒(除单纯疱疹病毒1型以外)和牛痘病毒。
[0052]
例如,已经广泛研究了腺病毒衍生的附属功能,并且已经鉴定并部分表征了许多参与附属功能的腺病毒基因。具体来说,早期腺病毒e1a、e1b 55k、e2a、e4和va rna基因区域被认为参与了辅助过程。已经描述了疱疹病毒衍生的附属功能。参见,例如,young等人(1979)prog.med.virol.[医药病毒学进展]25,113。还已经描述了牛痘病毒衍生的附属功能。参见,例如,carter,b.j.(1990),同上,schlehofer等人(1986)virology[病毒学]152,110
‑
117。
[0053]
术语“附属功能载体”通常是指包括提供附属功能的核苷酸序列的核酸分子。附属功能载体可以被转染到合适的宿主细胞中,其中所述载体然后能够支持宿主细胞中aav病毒粒子的产生。该术语明确排除了自然界中存在的感染性病毒颗粒,例如腺病毒、疱疹病毒或牛痘病毒颗粒。因此,附属功能载体可以是质粒、噬菌体、转座子、粘粒或已从其天然存在形式修饰的病毒的形式。
[0054]“重组病毒”是指已被遗传改变的病毒,例如通过向所述颗粒中添加或插入异源核酸构建体。
[0055]“aav病毒粒子”是指完整的病毒颗粒,例如野生型(wt)aav病毒颗粒(包含与aav衣壳蛋白外壳相关的线性、单链aav核酸基因组)。就这一点而言,具有互补的有义(即“正义”)链或“反义”链的单链aav核酸分子可被包装到任何一个aav病毒粒子中,并且两条链具有同等的感染性。
[0056]“重组aav病毒粒子”或“raav病毒粒子”在本文中定义为感染性的复制缺陷型病毒,其由以下构成:aav蛋白壳,所述aav蛋白壳包封了两侧翼有aav itr的感兴趣的异源核苷酸序列。在包含aav载体、aav附属功能和附属功能的合适宿主细胞中产生raav病毒粒子。以这种方式,使宿主细胞能够编码aav多肽,所述多肽是以下所需的:将aav载体(包含感兴趣的重组核苷酸序列)包装进入感染性重组病毒粒子颗粒以用于随后的基因递送。
[0057]
术语“转染”用于指细胞摄取外来dna。当将外源dna引入细胞膜内部时,细胞已经被“转染”。许多转染技术在本领域中是公知的。参见,例如,graham等人(1973)virology[病毒学],52,456;sambrook等人(1989)molecular cloning:a laboratory manual[分子克隆:实验室手册],cold spring harbor laboratories[冷泉港实验室],纽约;davis等人(1986)basic methods in molecular biology[分子生物学的基本方法],elsevier[爱思唯尔];chu等人(1981)gene[基因]13,197。此类技术可用于将一个或多个外源dna部分,例
如核苷酸整合载体和其他核酸分子,引入合适的宿主细胞中。所述术语涵盖化学、电和病毒介导的转染程序。
[0058]
术语“宿主细胞”表示例如微生物、酵母细胞、昆虫细胞和哺乳动物细胞,其可以或已经用作aav辅助构建体、aav载体质粒、附属功能载体或其它转移dna的接受体。所述术语包括已被转染的原始细胞的后代。因此,本文所用的“宿主细胞”一般指已用外源dna序列转染的细胞。可以理解,由于自然的、偶然的或故意的突变,单个亲代细胞的后代可能不一定在形态上或在基因组或总dna互补序列方面与原始亲代完全相同。
[0059]
如本文所用,术语“细胞系”是指能够在体外连续或延长生长和分裂的细胞群体。通常,细胞系是衍生自单个祖细胞的克隆群体。在本领域中还已知的是,在这样的克隆群体的储存或转移过程中,核型可以发生自发的或诱导的变化。因此,衍生自所述细胞系的细胞可能与祖先细胞或培养物不完全相同,并且所述细胞系包括这样的变体。
[0060]
术语“异源”在涉及核酸序列(例如编码序列和控制序列)时表示通常不连接在一起和/或通常不与特定细胞相关的序列。因此,核酸构建体或载体的“异源”区域是在自然界中未发现与其他分子相关联的另一核酸分子内或附接至其的核酸区段。例如,核酸构建体的异源区域可以包括这样的编码序列,所述编码序列侧翼有在自然界中与所述编码序列不相关的序列。异源编码序列的另一个实例是这样的构建体,其中在自然界中未发现所述编码序列本身(例如,具有不同于天然基因的密码子的合成序列)。类似地,出于本申请的目的,用正常情况下不存在于细胞中的构建体转化的细胞将被认为是异源的。如本文所用,等位基因变异或自然发生的突变事件不会产生异源dna。
[0061]“编码序列”或“编码”特定蛋白的序列是核酸序列,所述核酸序列当放置在适当的调控序列的控制下时在体外或体内被转录(在dna情况下)和翻译(在mrna情况下)成多肽。编码序列的边界由5’(氨基)末端的起始密码子和3’(羧基)末端的翻译终止密码子确定。编码序列可以包括但不限于来自原核或真核mrna的cdna、来自原核或真核dna的基因组dna序列、甚至是合成dna序列。转录终止序列通常位于编码序列的3’。
[0062]“核酸”序列是指dna或rna序列。所述术语涵盖包括dna和rna的任何已知碱基类似物的序列,例如但不限于4
‑
乙酰胞嘧啶、8
‑
羟基
‑
n6
‑
甲基腺苷、叠氮基胞嘧啶、假异胞嘧啶、5
‑
(羧基羟甲基)尿嘧啶、5
‑
氟尿嘧啶、5
‑
溴尿嘧啶、5
‑
羧甲基氨基甲基
‑2‑
硫尿嘧啶、5
‑
羧甲基氨基甲基尿嘧啶、二氢尿嘧啶、肌苷、n6
‑
异戊烯腺嘌呤、1
‑
甲基腺嘌呤、1
‑
甲基假尿嘧啶、1
‑
甲基鸟嘌呤、1
‑
甲基肌苷、2,2
‑
二甲基鸟嘌呤、2
‑
甲基腺嘌呤、2
‑
甲基鸟嘌呤、3
‑
甲基胞嘧啶、5
‑
甲基胞嘧啶、n6
‑
甲基腺嘌呤、7
‑
甲基鸟嘌呤、5
‑
甲基氨基甲基尿嘧啶、5
‑
甲氧基
‑
氨基甲基
‑2‑
硫尿嘧啶、β
‑
d
‑
甘露糖基q核苷(beta
‑
d
‑
mannosylqueosine)、5
’‑
甲氧基羰基甲基尿嘧啶、5
‑
甲氧尿嘧啶、2
‑
甲硫基
‑
n6
‑
异戊烯基腺嘌呤、尿嘧啶
‑5‑
氧乙酸甲酯、尿嘧啶
‑5‑
氧乙酸、氧丁氧苷(oxybutoxosine)、假尿嘧啶、queosine、2
‑
硫胞嘧啶、5
‑
甲基
‑2‑
硫尿嘧啶、2
‑
硫尿嘧啶、4
‑
硫尿嘧啶、5
‑
甲基尿嘧啶、n
‑
尿嘧啶
‑5‑
氧乙酸甲酯、尿嘧啶
‑5‑
氧乙酸、假尿嘧啶、2
‑
硫胞嘧啶和2,6
‑
二氨基嘌呤。
[0063]
术语dna“控制序列”统指启动子序列、聚腺苷酸化信号、转录终止序列、上游调节结构域、复制起点、内部核糖体进入位点(“ires”)、增强子等,它们共同提供在接受体细胞中编码序列的复制、转录和翻译。只要选择的编码序列能够在合适的宿主细胞中复制、转录和翻译,并非总是需要存在所有这些控制序列。
[0064]
术语“启动子区”在本文中以其一般意义使用,是指这样的dna调节序列,rna聚合酶与其结合,从而启动下游(3’方向)编码序列的转录。
[0065]
短语“可操作地连接”是指元件的布置,其中如此描述的组分被配置为执行其通常的功能。因此,与编码序列可操作地连接的控制序列能够影响编码序列的表达。控制序列不必与编码序列邻接,只要它们具有指导其表达的功能即可。因此,例如,在启动子序列和编码序列之间可以存在中间的未翻译但被转录的序列,并且仍然可以认为所述启动子序列与所述编码序列“可操作地连接”。
[0066]
当提及核苷酸序列时,“分离的”是指所指示的分子在基本上不存在相同类型的其他生物大分子的情况下存在。因此,“编码特定多肽的分离的核酸分子”是指基本上不含不编码主题多肽的其他核酸分子的核酸分子;然而,所述分子可以包括一些不会有害地影响组合物的基本特性的另外的碱基或部分。
[0067]
为了描述整个本申请中特定核酸分子中核苷酸序列的相对位置,例如当特定核苷酸序列被描述为相对于另一序列位于“上游”、“下游”、“3
’”
或“5
’”
时,应当理解,如本领域中常规的那样,所指的是序列在dna分子的“有义”或“编码”链中的位置。
[0068]“同源性”是指两个多核苷酸或两个多肽部分之间的同一性百分比。可以通过本领域已知的技术确定来自一个部分的序列与来自另一部分的序列之间的对应性。例如,可以通过比对序列信息并使用容易获得的计算机程序,通过直接比较两个多肽分子之间的序列信息来确定同源性。可替代地,可以通过以下来确定同源性:在允许在同源区域之间形成稳定的双链体的条件下杂交多核苷酸,然后用一种或多种单链特异性核酸酶消化,并确定消化片段的大小。如使用上述方法确定,当至少约80%,优选至少约90%,最优选至少约95%的核苷酸或氨基酸在分子的限定长度上匹配时,两个dna或两个多肽序列彼此“基本上同源”。
[0069]
给定多肽的“功能同源物”或“功能等同物”包括衍生自天然多肽序列的分子,以及重组产生或化学合成的多肽,其以类似于参考分子的方式起作用以实现期望的结果。因此,aav rep68或rep78的功能同源物涵盖那些多肽的衍生物和类似物,包括具有在内部或在其氨基或羧基末端存在的任何单个或多个氨基酸添加、取代和/或缺失的衍生物和类似物,只要整合活性保留即可。
[0070]
给定腺病毒核苷酸区域的“功能同源物”或“功能等同物”包括衍生自异源腺病毒血清型的相似区域,衍生自另一病毒或细胞来源的核苷酸区域,以及重组产生或化学合成的多核苷酸,其以类似于参考核苷酸区域的方式起作用以实现期望的结果。因此,腺病毒va rna基因区域或腺病毒e2a基因区域的功能同源物涵盖这样的基因区域的衍生物和类似物
‑
包括具有在所述区域内存在的任何单个或多个核苷酸碱基添加、取代和/或缺失的衍生物和类似物,只要同源物保留提供其固有的附属功能的能力,以在高于背景的可检测水平上支持aav病毒粒子产生即可。
[0071]
如本文所用,术语“野生型aav”是指野生型和假(pseudo
‑
)野生型aav两者。“假野生型aav”是具有复制能力的aav病毒粒子,其通过携带itr的aav载体与携带rep和cap基因的aav辅助载体之间的同源或非同源重组产生。假野生型aav具有与野生型aav序列不同的核酸序列。
[0072]
术语“衣壳化必需基因产物”是指对于衣壳化腺病毒基因组以产生感染性腺病毒
颗粒而言必需的腺病毒基因产物。衣壳化通常包括“晚期”腺病毒基因产物。示例性的衣壳化必需腺病毒基因产物包括衣壳蛋白ix、衣壳化蛋白iva2、蛋白13.6、衣壳化蛋白52k、衣壳蛋白前体piiia、五邻体基底(衣壳蛋白iii)、核心蛋白前体pvii、核心蛋白v、核心蛋白前体px、衣壳蛋白前体pvi、六邻体(衣壳蛋白ii)、蛋白酶、六邻体组装蛋白100k、蛋白33k、衣壳化蛋白22k、衣壳蛋白前体pviii、蛋白uxp和纤维(衣壳蛋白iv)。
[0073]
术语“衣壳化非必需基因产物”是指对于衣壳化腺病毒基因组以产生感染性腺病毒颗粒而言非必要的腺病毒基因产物。衣壳化非必需腺病毒基因产物通常从腺病毒e1、e2、e3和e4转录单元翻译而来。因此,衣壳化非必需腺病毒基因产物可以包括从腺病毒e1转录单元(例如,e1a、e1b
‑
19k、e1b
‑
55k)表达的基因产物;从腺病毒e2/e2a转录单元(例如iva2、pol、ptp、dbp)表达的基因产物;从腺病毒e3转录单元(例如,e3 cr1α0、e3 gp19、e3 14.7k、e3 rid
‑
β)表达的基因产物;从e4转录单元(例如e4 34k、e4 orf1、e4 orfb、e4 orf3、e4 orf4、e4 orf6/7)表达的基因产物;或其组合。
[0074]
术语“edad”是指在一种或多种衣壳化必需腺病毒基因产物中具有一个或多个突变的腺病毒突变体。
[0075]
如本文所用,术语“异源”核酸序列是指源自外来物种的序列,或者如果来自相同物种,则其可以从原始形式被实质上修饰。可替代地,在细胞中通常不表达的未改变的核酸序列是异源核酸序列。优选地,异源序列与启动子可操作地连接,从而产生嵌合基因。异源核酸序列优选在病毒ltr启动子
‑
增强子信号或内部启动子的控制下,并且逆转录病毒ltr内保留的信号仍然能够引起转基因的有效表达。
[0076]
启动子序列可以与期望的基因序列同源或异源。可以使用广泛范围的启动子,包括病毒或哺乳动物启动子。细胞或组织特异性启动子可用于基因序列在特定细胞群体中的靶向表达。用于本申请的合适的哺乳动物和病毒启动子是本领域中可获得的。合适的启动子是可诱导型或条件型启动子。
[0077]
任选地,在克隆阶段,具有包装信号和异源克隆位点的称为转移载体的核酸构建体还含有选择标记基因。标记基因用于测定载体的存在,从而确认感染和整合。标记基因的存在确保仅表达插入物的那些宿主细胞的选择和生长。典型的选择基因编码赋予对抗生素和其他有毒物质(例如,组氨醇、嘌呤霉素、潮霉素、新霉素、甲氨蝶呤等)有抗性的蛋白和细胞表面标记。
[0078]
本申请的重组病毒能够将核酸序列转移到哺乳动物细胞中。术语“核酸序列”是指任何核酸分子,优选dna,如本文中详细讨论的。核酸分子可以衍生自各种来源,包括dna、cdna、合成的dna、rna或其组合。这样的核酸序列可以包含基因组dna,其可以包括或可以不包括天然存在的内含子。此外,这样的基因组dna可以与启动子区域、聚a序列或其他相关序列一起获得。可以通过本领域众所周知的手段从合适的细胞中提取和纯化基因组dna。可替代地,可以从细胞中分离信使rna(mrna),并通过逆转录或其他手段将其用于产生cdna。
[0079]
衣壳化缺陷型腺病毒(edad)
[0080]
本申请的一个方面涉及用于产生重组病毒载体的衣壳化缺陷型腺病毒(edad)。在一些实施方式中,edad在其基因组中包含一个或多个突变,其导致(1)一种或多种衣壳化必需蛋白的显著降低的产生或不产生,和/或(2)一种或多种缺陷型衣壳化必需蛋白的产生。这样的突变可包括相关基因中核苷酸的取代、插入或缺失。这样的突变还可包括相关基因
的调节区域中核苷酸的取代、插入或缺失,其导致这些基因的转录下调或消除。
[0081]
edad还包括具有温度敏感性突变的腺病毒类型,其在允许温度(permissive temperature)下能够包装其基因组,但在非允许温度(non
‑
permissive temperature)下不能包装其基因组。因此,这类edad的产生在允许温度下进行。因此,在不支持edad包装但仍促进重组病毒载体产生的非允许温度下进行应用这些edad来产生重组载体。
[0082]
这里描述的腺病毒可以是任何腺病毒亚型或来自任何物种。在这里,为了清楚和方便起见,我们主要使用5型人腺病毒。
[0083]
如下文进一步所述,本申请的edad可用于产生其他重组病毒。
[0084]
图1a和1b描绘了腺病毒颗粒及其结构组分。图1c显示了腺病毒转录单元,包括由其编码的多肽。晚期转录单元编码蛋白,所述蛋白是突变靶标以产生衣壳化缺陷型ad(edad)。如图2所示,用edad感染宿主细胞能够允许腺病毒dna复制,但不会导致包装的腺病毒病毒颗粒。
[0085]
表1列出了产生衣壳化的病毒基因组所必要的许多腺病毒基因产物,以及它们相应的蛋白登录号。对应于这些蛋白的核酸登录号包括但不限于genbank gi号209842、58478或2935210中列出的和/或genbank登录号m73260、x17016或af030154中注释的那些。
[0086]
表1
[0087]
蛋白名称蛋白识别符转录单元衣壳蛋白ixyp_068021.1ix衣壳化蛋白iva2yp_068022.1iva2蛋白13.6kyp_001661328.1l1衣壳化蛋白52kyp_068025.1l1衣壳蛋白前体piiiayp_068026.1l1五邻体基底(衣壳蛋白iii)yp_068027.1l2核心蛋白前体pviiyp_068028.1l2核心蛋白vyp_068029.1l2核心蛋白前体pxyp_068030.1l2衣壳蛋白前体pviyp_068031.1l3六邻体(衣壳蛋白ii)yp_068032.1l3蛋白酶yp_068033.1l3六邻体组装蛋白100kyp_068035.1l4蛋白33kyp_068036.1l4衣壳化蛋白22kyp_068037.1l4衣壳蛋白前体pviiiyp_068038.1l4蛋白uxpyp_068047.1u纤维(衣壳蛋白iv)yp_068048.1l5
[0088]
衣壳化所必要的基因产物的列表包括衣壳蛋白ix、衣壳化蛋白iva2、蛋白13.6、衣壳化蛋白52k、衣壳蛋白前体piiia、五邻体基底(衣壳蛋白iii)、核心蛋白前体pvii、核心蛋白v、核心蛋白前体px、衣壳蛋白前体pvi、六邻体(衣壳蛋白ii)、蛋白酶、六邻体组装蛋白100k、蛋白33k、衣壳化蛋白22k、衣壳蛋白前体pviii、蛋白uxp和纤维(衣壳蛋白iv)。如本文
所用,这些基因产物构成衣壳化必不可少的基因产物(或“衣壳化必需基因产物”),并且有别于不与衣壳化直接相关的其他腺病毒基因产物,如下文进一步描述。另外,本申请的edad有别于在衣壳化所必要的顺式作用序列中包含突变的腺病毒基因组。除了参与腺病毒衣壳化的蛋白的功能丧失之外,这些蛋白的温度敏感性突变也可用于产生重组病毒载体。衣壳化缺陷型腺病毒具有三个主要特征以用于重组病毒载体产生:1.避免通过edad感染进行转染。2.复制edad基因组并增加基因的拷贝,这可帮助重组载体产生的产量。3.减少或消除生产宿主细胞中包装的腺病毒的生成。可以通过在edad中保留必要的早期基因(例如(e1、e2、e4))来维持复制特性,或者在整合了这样的基因的宿主细胞系的情况下完成不具有这样的基因的edad;例如edad
‑
1ag能够在293细胞中复制;edad
‑
2g能够在911e4细胞系中复制,而edad
‑
dp3能够在adad
‑
dp3能够感染而不会产生包装的腺病毒的任何细胞系中复制。
[0089]
在一个实施方式中,用于产生重组病毒载体的宿主细胞缺乏腺病毒的受体。腺病毒受体例如整联蛋白、car、cd46、cd80、cd86和其他腺病毒受体可以在宿主细胞中表达,以使其与腺病毒感染相容。
[0090]
在一些实施方式中,本申请的edad包含在一个或多个衣壳化必需基因中具有突变的病毒基因组,并且所述突变导致不产生衣壳化必需基因产物或产生缺陷型衣壳化必需基因产物。示例性的一个或多个突变包括编码任何一个或多个衣壳化必需腺病毒产物和/或衣壳化非必需腺病毒基因产物的一个或多个核酸序列中的一个或多个缺失、一个或多个插入、一个或多个序列替换和一个或多个取代。如本文所用,取代突变包括温度敏感性突变。
[0091]
图3中的分图b
‑
d显示了各种edad,它们各自在腺病毒基因被缺失和/或被其他序列(包括例如转基因或缺陷型病毒基因组)替换的程度上不同。因此,edad基因组可另外包含一个或多个突变,其阻止与衣壳化不直接相关的一种或多种腺病毒基因产物,即“衣壳化非必需”腺病毒基因产物的表达。ad衣壳化非必需产物包括,例如,从腺病毒e1转录单元(例如,e1a、e1b
‑
19k、e1b
‑
55k)表达的蛋白;从腺病毒e2/e2a转录单元(例如iva2、pol、ptp、dbp)表达的蛋白;从腺病毒e3转录单元(例如,e3 cr1α0、e3 gp19、e3 14.7k、e3 rid
‑
β)表达的蛋白;以及从e4转录单元(例如e4 34k、e4 orf1、e4 orfb、e4 orf3、e4 orf4、e4 orf6/7)表达的蛋白。
[0092]
在一个实施方式中,edad包含阻止ad piiia表达的突变。在其他实施方式中,edad包含阻止其他衣壳化必需蛋白表达的突变。
[0093]
在一些实施方式中,edad进一步包括阻止一个或多个ad衣壳化非必需蛋白表达的一个或多个突变,包括但不限于仅在e1中的缺失或序列替换(图4,分图b、c、d、e);仅在e3中的缺失或序列替换(图4,分图a);e1和e3两者中的缺失或序列替换(图3,分图c、d和图4,分图b、c、d、e);以及e1、e2和e3中的缺失(图3,分图d和图4,分图d和e)。
[0094]
在又另一个实施方式中,edad包含阻止ad六邻体装配蛋白100k表达的突变。在其他实施方式中,具有100k缺失的edad包含阻止piiia的突变。在进一步的实施方式中,edad包含阻止其他衣壳化必需蛋白表达的突变。edad进一步包括阻止一个或多个ad衣壳化非必需蛋白表达的一个或多个突变,包括但不限于仅在e1中的缺失或序列替换;仅在e3中的缺失或序列替换;e1和e3两者中的缺失或序列替换;以及e1、e3和e4中的缺失。
[0095]
在一些实施方式中,如图4分图a
‑
e所示,将某些腺病毒基因序列替换为经工程改造以表达期望的靶基因的缺陷型病毒基因组。在某些优选的实施方式中,缺陷型病毒基因
adenovirus as a single
‑
cycle genome replicating vector[iiia缺失的腺病毒作为单周期基因组复制载体].virology[病毒学].2014;462
‑
463:158
‑
165.doi:10.1016/j.virol.2014.05.030)。可替代地,通过使用设计的grna和cas9消化使六邻体基因部分缺失。通过连接或在适当的细菌中使用pshuttle载体和cre重组酶将aav基因组和其他基因引入腺病毒基因组。在具有转染的质粒或整合的基因的宿主细胞中拯救所得的腺病毒质粒,所述宿主细胞提供对于腺病毒复制和包装必需的缺失元件。然后,使用相应的包装细胞系扩增拯救的edad。
[0104]
用于edad的包装细胞系
[0105]
在另一方面,本发明提供了用于产生感染性edad的包装细胞系。在一些实施方式中,包装细胞能够提供一种或多种基因产物,所述基因产物允许在宿主包装细胞内edad的复制和衣壳化。
[0106]
可以通过瞬时或稳定的转染或感染来生成包装细胞,以产生一种或多种基因产物,所述基因产物允许在包装细胞内的edad的衣壳化。包装细胞可以衍生自任何合适的细胞系。用于本文所述方法的示例性生产细胞系包括但不限于293、911e4、a549、per.c6、hela、bhk、cos和cho。在一些实施方式中,包装细胞衍生自哺乳动物细胞。在一些实施方式中,包装细胞衍生自293细胞。在另一个实施方式中,包装细胞衍生自hela细胞。在另一个实施方式中,包装细胞衍生自cho细胞。
[0107]
在一些实施方式中,包装细胞表达或能够表达在edad基因组中缺少或有缺陷的必需衣壳化基因产物。在一些实施方式中,包装细胞表达或能够表达在edad基因组中缺少或有缺陷的必需衣壳化基因产物和非必需衣壳化基因产物。
[0108]
在又另一个实施方式中,具有温度敏感性突变的edad能够在允许温度下生长。温度敏感性突变的实例包括但不限于如人腺病毒2型温度敏感性突变体的分离和表型表征(isolation and phenotypic characterization of human adenovirus type 2temperature
‑
sensitive mutants)中所述的e3区中的缺失。martin gr,warocquier r,cousin c,d'halluin jc,boulanger pa.j gen virol.[普通病毒学杂志]1978年11月;41(2):303
‑
14。温度敏感性(ts)突变体可能无法在39”5℃下生长,但在33℃下正常发育。在限制性温度下双重感染的细胞培养物中的互补试验可用于鉴定它们。根据其可溶性衣壳抗原的产生在表型上对它们进行表征。它们可以在可溶性六邻体产生、总五邻体(五邻体基底+纤维)和其他阻止其包装病毒的基因方面存在缺陷。此特性能够补充edad以进行aav产生。
[0109]
包装细胞可以通过转染或病毒感染产生。在一些实施方式中,用补充edad基因组中一种或多种缺陷(即,影响衣壳化必需产物和衣壳化非必需产物的突变)的一种或多种腺病毒基因产物稳定地转化包装细胞系。
[0110]
用edad产生重组病毒的方法
[0111]
本申请的另一方面涉及产生重组病毒(rv)的方法。所述方法包括以下步骤:(a)用一种或多种edad感染宿主细胞以产生感染的宿主细胞,(b)在允许产生具有rv基因组的rv的条件下孵育感染的宿主细胞;以及(c)收获所述重组病毒,其中所述edad或所述宿主细胞包含所述rv基因组。
[0112]
rv可以是dna病毒、rna病毒、脊髓灰质炎病毒、痘病毒、逆转录病毒、辛德毕斯(sindbis)病毒、α病毒、星状病毒、冠状病毒、正粘病毒、乳头瘤病毒、副粘病毒、细小病毒、
细小核糖核酸病毒(picomavirus)、痘病毒、披膜病毒或任何其他病毒,包括其血清型,以及其假型。
[0113]
在一些实施方式中,rv是重组自主细小病毒。重组细小病毒可以是自主细小病毒的任何成员。示例性细小病毒包括小鼠微小病毒(mvm)、h1、luiii、b19、cpv、博卡(boca)病毒、fpv以及其他。携带来自所选ns、vp基因、诱导基因(例如cre、tet
‑
on、tet
‑
off等)或载体基因组的元件中的至少一个的edad可用于感染宿主细胞,所述宿主细胞将提供从edad缺失的元件,以用于细小病毒的复制和包装。宿主细胞还将提供缺失的腺病毒早期基因,以用于腺病毒基因组的复制。
[0114]
重组aav载体的产生
[0115]
在一些实施方式中,rv是重组aav。重组aav可以是任何血清型。示例性aav血清型包括aav
‑
1、aav
‑
2、aav
‑
3、aav
‑
4、aav
‑
5、aav
‑
6、aav
‑
7、aav
‑
9、aav
‑
10、aav
‑
11、aav
‑
12和aav
‑
13。携带来自所选aav
‑
rep
‑
cap、腺病毒e1、e2或e4;或诱导元件(例如cre、cas9/grna、tet
‑
on、tet
‑
off)或载体基因组的元件中的至少一个的edad可用于感染宿主,所述宿主细胞将提供从edad缺失的元件,以用于aav复制和包装中。宿主细胞还将提供缺失的腺病毒早期基因,以用于腺病毒基因组的复制。
[0116]
产生用于基因递送的复制缺陷型病毒颗粒的常规方法是进行质粒的双重或三重转染。举例来说,图6显示了在被稳定转化以表达e1a和e1b指定的辅助功能的细胞(例如293细胞)中产生感染性复制缺陷型raav的方法。一种质粒包含缺陷型病毒基因组,所述缺陷型病毒基因组包含用于复制的必需顺式作用序列,例如itr或ltr,其中期望的感兴趣的转基因或靶基因插入侧翼itr或侧翼ltr之间以进行其表达。设计其他质粒以表达产生raav所需的其他辅助功能,例如aav rep、aav cap、ad e2a、varna和e4。图7显示当通过用wtad(或具有包装能力的ad,pcad)感染宿主细胞来提供ad辅助功能时,回收的病毒颗粒包括raav和wtad。
[0117]
在一些实施方式中,使用本申请的edad产生重组aav载体。编码edad的核酸分子包括腺病毒(例如ad5病毒)的所有天然存在的序列,但缺少以下腺病毒序列中至少一种的全部或一部分:纤维蛋白编码序列、v蛋白编码序列、六邻体编码序列、五邻体基底编码序列、piii蛋白编码序列或其他早期或晚期基因产物编码序列。编码多肽的腺病毒核酸序列的实例包括但不限于在genbank gi号209842、58478或2935210中列出和/或在genbank登录号m73260、x17016或af030154中注释的那些。
[0118]
在一些实施方式中,将编码以下多肽中的一种或多种的核酸的全部或一部分的突变或缺失工程改造到编码腺病毒的核酸中:纤维蛋白编码序列、v蛋白编码序列、六邻体编码序列、五邻体基底编码序列、va rna编码序列、piii蛋白编码序列或其他早期或晚期基因产物编码序列。这样的缺失可以是导致一种或多种编码的氨基酸缺失的任何长度。例如,可以去除腺病毒的核酸序列的部分,使得编码的多肽缺少5、6、7、8、9、10、15、20、25、30或更多个氨基酸残基)。可以从沿序列长度的任何位置去除要缺失的一个或多个部分。例如,可以在腺病毒核酸(例如纤维蛋白编码序列、v蛋白编码序列、六邻体编码序列、五邻体基底编码序列、va rna编码序列、piii蛋白编码序列或其他早期或晚期基因产物编码序列)的5’端、3’端或内部区域去除腺病毒核酸序列的部分。
[0119]
可以使用任何适当的分子生物学和生化方法(例如,核酸测序)来鉴定引入腺病毒
核酸中的缺失的存在和位置。例如,可以使用凝胶电泳按大小将核酸分开,以确认相对于原始核酸的长度已去除了部分。在一些情况下,识别编码的多肽(例如,纤维多肽)上的各种表位的抗体能够用于检测靶向缺失的多肽的存在与否。
[0120]
在一些实施方式中,使用腺病毒作为辅助物来产生aav载体。当前,有两种使用腺病毒辅助来产生aav的方法。一种是使用腺病毒dna,其依赖于转染方法且不能扩展。另一种是野生型(wt)腺病毒或e1a/e1b区缺失的腺病毒。这导致腺病毒被衣壳化的dna污染,衣壳化的dna很难从aav制剂中除去。
[0121]
edad为aav产生提供了一种或多种必要的辅助功能,包括e1a、e1b、va rna、e2、e4和其他腺病毒基因。edad补充了aav复制和包装,而edad本身不会在aav生产宿主细胞中产生带有衣壳化的基因组的腺病毒。
[0122]
在一些实施方式中,edad被进一步修饰以具有能够在不同条件下补充aav产生的更多特征。可以缺失e1/e1b或e3以产生edad1g,这允许aav载体基因组被携带在edad1g和生产系统必需的其他因子中。例如,cre、flp和crisper元件也可以由所述腺病毒携带。可以在腺病毒基因组中进行进一步的缺失,以容纳其他必需元件。那些对于aav产生必需的元件可以整合到宿主细胞中。
[0123]
在一些实施方式中,将aav基因组构建到edad中。在某些情况下这是期望的,并且当edad进行大量复制时,aav基因组拷贝将急剧增加。可以将对于诱导rep和cap表达重要的其他基因构建到edad中。在一些实施方式中,将aav基因组克隆到edad中。在其他实施方式中,用于控制整合的宿主基因的基因也被构建到edad中。这样的基因包括cas9/grna或flp重组酶、cre重组酶、crispr酶的其他变体和能够调节基因表达的其他蛋白。
[0124]
在一些实施方式中,edad用于aav载体产生。aav生产宿主细胞被edad感染。对于aav产生必需但不由edad携带的元件通过转染以反式方式提供,或整合到生产宿主细胞中。aav生产宿主细胞不具有恢复edad包装的因子/元件,因此没有腺病毒基因组被包装到腺病毒衣壳中。
[0125]
edad病毒可以具有不同的配置。例如,在基于293细胞的宿主细胞中,可以使用edad1g,因为当其在宿主细胞中提供时可以除去e1a和e1。相反,为了在基于cho的宿主细胞中生产,edad病毒中必须包括e1a和e1b区。
[0126]
本文还提供了用于产生raav病毒粒子的宿主细胞。在某些实施方式中,本发明的宿主细胞包含编码aav辅助功能的核酸。在宿主细胞中引入aav载体并表达附属功能后,产生raav病毒粒子。在某些优选的实施方式中,本发明的宿主细胞还包括一种或多种附属功能。
[0127]
本发明进一步提供了使用附属功能载体产生raav的方法和通过这种方法产生的raav病毒粒子。在某些实施方式中,本发明的方法包括以下步骤:(1)将aav载体基因组引入合适的宿主细胞;(2)将本发明的aav辅助病毒引入所述宿主细胞;(3)在所述宿主细胞中表达附属功能;以及(4)培养所述宿主细胞以产生raav病毒粒子。可以使用众所周知的技术将aav载体和aav辅助功能载体依次或同时转染到宿主细胞中。附属功能可以以几种方式中的任何方式表达,包括用合适的辅助病毒(例如腺病毒、疱疹病毒或牛痘病毒)感染宿主细胞,或通过将一种或多种附属功能载体转染到宿主细胞中。本领域还众所周知,某些细胞系,例如293细胞,固有地表达一种或多种附属功能。
[0128]
利用本发明产生的raav病毒粒子可用于将遗传物质引入动物(包括人)或分离的动物细胞中,以用于各种研究和治疗用途。例如,使用本发明的方法产生的raav病毒粒子可以用于在动物中表达蛋白以收集临床前数据或筛选潜在的候选药物。可替代地,可以使用raav病毒粒子将遗传物质转移到人中以治愈遗传缺陷或实现期望的治疗。
[0129]
使用edad产生细小病毒载体的一般方法遵循如下程序:在已经用aav rep&cap或aav载体质粒转染的细胞中,edad用于递送aav产生所需的辅助功能。然后可以在不同时间在培养基或细胞中收获载体。rep&cap功能可以整合到宿主细胞中,也可以通过病毒或非病毒载体进行递送。aav载体质粒也可以整合到宿主细胞系中或通过病毒载体递送。在一个特定的实施方式中,aav载体序列在edad的基因组中。如果需要的话,携带另外因子的多个edad可以用于raav繁殖。
[0130]
在一些实施方式中,感染性edad病毒颗粒与用于在生产细胞系中复制aav的一种或多种辅助功能(例如,aav rep和/或aav cap)共表达。为了促进aav的复制,将生产细胞用包含必需的顺式活性序列例如aav itr的aav载体构建体转染或以其他方式包括所述aav载体构建体,以产生复制缺陷型aav颗粒。aav rep和cap基因可以稳定地整合到生产细胞系中,或者他们可以通过病毒或非病毒载体进行递送。aav载体质粒也可以整合到生产细胞系中或通过病毒或非病毒载体递送。在一个特定的实施方式中,将aav载体序列克隆到edad dna构建体中以产生adad病毒颗粒。多个edad可用于产生给定的raav或多个不同的raav。
[0131]
在特定的实施方式中,产生raav的方法包括用edad感染宿主细胞,其中所述宿主细胞被稳定转化以表达aav rep和cap,并被缺陷型aav基因组(其经工程改造以表达期望的靶基因)稳定转化,如图8所示。
[0132]
在另一个实施方式中,产生raav的方法包括用edad感染宿主细胞,其中edad基因组包含经工程改造以表达期望的靶基因的缺陷型aav基因组,并且其中所述宿主细胞(例如hela或a549)被稳定转化以表达ad e1a、ad e1b、aav rep和aav cap蛋白,如图9所示。在一些实施方式中,edad是edad
‑
100k。
[0133]
在另一个实施方式中,产生raav的方法包括用edad感染宿主细胞,其中edad基因组包含经工程改造以表达cre重组酶和期望的感兴趣的靶基因的缺陷型aav基因组,并且其中所述宿主细胞被ad e1、e2和e4基因稳定转化,并被稳定转化以表达aav rep和aav cap蛋白,如图11所示。在这种情况下,来自edad的cre重组酶的表达会切除构建入rep
‑
cap表达单元中的内含子中的“loxed片段”,从而激活rep
‑
cap蛋白的表达。loxed片段包含位于内含子中片段侧翼的loxp位点,所述片段充当cre介导的切除的底物,从而导致aav rep/cap表达的激活。
[0134]
本文提供的aav病毒可在0.01到106的广泛moi范围内使用。它可用于在用于产生病毒载体的其他元件的诱导之前或之后感染细胞。
[0135]
其他重组病毒
[0136]
在一些实施方式中,rv是重组慢病毒。在一些实施方式中,重组慢病毒是hiv
‑
1、hiv
‑
2或siv。
[0137]
在一个实施方式中,rv是重组逆转录病毒。在一些实施方式中,重组慢病毒是莫洛尼鼠(moloney murine)白血病病毒。
[0138]
在一些实施方式中,rv是重组牛痘病毒。
[0139]
在一些实施方式中,rv是重组疱疹病毒。示例性疱疹病毒包括但不限于单纯疱疹病毒(hsv)
‑
1、hsv
‑
2、人疱疹病毒(hhv)
‑
1、hhv
‑
2、hhv
‑
3、hhv
‑
4、hhv
‑
7、hhv
‑
8和水痘带状疱疹、人巨细胞病毒(hcmv)。
[0140]
为了产生原料(stock)感染性复制缺陷型重组病毒颗粒(也称为病毒载体),例如重组aav(raav)、重组慢病毒等,将edad与来自重组病毒(例如,aav、慢病毒等)的结构元件组合使用,以产生与重组病毒相对应的感染性病毒颗粒。与涉及质粒的双重或三重转染的其他方法不同,用一种或多种edad感染宿主细胞会显著提高转导效率,从而导致更高的效价和极少或没有污染。
[0141]
在一些实施方式中,生产细胞经核酸稳定转化,所述核酸经工程改造以表达一种或多种ad辅助功能、一种或多种aav辅助功能或其组合。在特定的实施方式中,宿主细胞是293细胞。在其他实施方式中,宿主细胞是hela细胞或a549细胞。
[0142]
在一些实施方式中,生产细胞经核酸稳定转化,所述核酸经工程改造以表达ad e1a和ad e1b。在其他实施方式中,生产细胞经核酸稳定转化,所述核酸经工程改造以表达aav rep和/或aav cap。在其他实施方式中,生产细胞经核酸稳定转化,所述核酸经工程改造以表达对于产生感染性慢病毒颗粒必需的一种或多种辅助功能。在其他实施方式中,生产细胞经缺陷型病毒基因组稳定转化,所述缺陷型病毒基因组经工程改造以表达感兴趣的靶基因。
[0143]
在一些实施方式中,生产细胞被多种不同的edad感染。在一个实施方式中,多种edad中的每一种都表达一种或多种辅助功能。
[0144]
在一个实施方式中,将生产细胞用第一edad和第二edad共感染,所述第一edad经工程改造以表达cre重组酶,所述第二edad包含rep
‑
cap表达单元,所述rep
‑
cap表达单元包含内含子中的“loxed片段”,所述“loxed片段”充当cre介导的切除的底物,从而导致aav rep/cap表达的激活。
[0145]
在另一个实施方式中,可使用成簇规则间隔短回文重复/cas(crispr/cas9)系统激活一种或多种辅助基因的表达。通过该系统,cas9核酸酶可以由短rna引导,以在dna的特定位点诱导精确切割,并可以通过允许在单个crispr阵列中编码几个序列来编辑基因组中的多个位点。单个cas酶可以通过短rna分子(称为“指导”rna)进行编程,以识别目标dna。换句话说,可以使用短rna分子作为指导rna将cas酶招募到特定的靶dna,以提供crispr介导的核酸切割的特异性。本发明中还包括任何其他crispr系统,例如cpf1、cas13等。
[0146]
crispr有三种类型,迄今为止,最常用于基因校正或破坏的类型是ii型。例如,crispr rna靶向序列是从crispr阵列中成簇的dna序列转录而来。为了进行操作,转录crispr靶向rna或前体crrna(pre
‑
crrna),并根据与crispr重复序列具有序列互补性的反式激活crispr rna(tracrrna)的存在,对rna进行加工以分离单独的rna(crrna)。当反式rna与crispr重复序列杂交时,它会通过双链rna特异性核糖核酸酶rna酶iii启动加工,形成串联tracrrna:crrna双链体,其可以被合成地制成单指导rna(sgrna),用于基因组工程改造目的。cas9核酸酶,其被激活并通过切割而特异性响应与crrna互补的dna序列。靶序列必须在其3’端包含特定序列,所述序列被称为待切割dna中的原间隔子相邻基序(pam),其在识别靶序列的crispr rna中不存在。
[0147]
除了天然存在的指导rna外,合成的指导rna可与crispr载体融合。描述了使用生
物信息学方法设计具有靶标识别序列和其他必需元件(例如发夹和支架序列)的指导rna(参见例如mali等人,science[科学]339:823
‑
826(2013))。
[0148]
在一个实施方式中,将生产细胞用编码功能性ii型crispr
‑
cas9蛋白的第一edad和编码靶向一种或多种辅助基因的指导rna序列的第二edad共感染,以用于一种或多种辅助基因的crispr介导的激活,类似于上面的cre/lox系统。
[0149]
在上述方法的变型中,crispr
‑
cas9系统可以与本申请的edad一起使用,以提供缺失宿主序列、用野生型宿主序列替换突变的宿主序列或靶向激活宿主基因的手段。在这种变型中,将宿主细胞用第一edad和第二edad共感染,所述第一edad包含经工程改造以表达功能性ii型crispr
‑
cas9蛋白的缺陷型病毒基因组,所述第二edad包含靶向宿主基因的指导rna序列,用于crispr介导的宿主序列缺失、突变的宿主序列被野生型宿主序列替换或宿主基因的靶向激活。
[0150]
在一些实施方式中,本申请提供了产生能够感染非分裂细胞的重组慢病毒的方法,所述方法包括用携带由gag、pol和env、以及rev和tat编码的包装功能的一种或多种edad感染合适的生产细胞。例如,第一edad病毒可提供编码病毒gag和病毒pol的核酸,并且同一edad或另一edad可提供编码病毒env的核酸以产生生产细胞。将经工程改造以表达异源基因的缺陷型慢病毒载体(在此被鉴定为转移载体)引入该生产细胞,会产生释放携带外来感兴趣的基因的感染性病毒颗粒的生产细胞。
[0151]
在一个实施方式中,edad可用于产生重组疱疹载体。用于疱疹载体产生的必需基因可以使用edad来携带并感染疱疹载体生产细胞以促进疱疹载体产生。
[0152]
疱疹病毒(hsv)补充系统。当前基于hsv的设计通常包含两种复制缺陷型hsv菌株,这些菌株经过工程改造以分别包含rep/cap和aav载体序列。本领域普通技术人员可以理解,衣壳化缺陷型疱疹可以类似地用于产生raav或慢病毒载体或其他重组载体。可以通过在疱疹结构基因中产生突变或缺失来制备衣壳化缺陷型和包装缺陷型疱疹病毒。衣壳化缺陷型和包装缺陷性疱疹病毒可用于产生本文公开的利用rv的方法,其可适用于基于hsv的系统。
[0153]
鉴于上述,本申请提供了产生高效价重组病毒的组合物和方法。可以使用本领域已知的技术将病毒颗粒制剂用于感染靶细胞。因此,本申请将可用于体内基因疗法应用以及离体基因疗法应用两者中,其中,从宿主中移出靶细胞,并进行转化培养,然后返回宿主。
[0154]
生产细胞系
[0155]
本申请的另一方面涉及用于产生重组病毒的生产细胞。所述生产细胞包含(a)所述重组病毒的基因组,或(b)编码产生所述重组病毒所需的产物的基因,或(a)和(b)两者。
[0156]
生产细胞可以通过瞬时或稳定的转染或感染来生成。在一些实施方式中,生产细胞系用以下进行稳定转化:(a)重组病毒的基因组,或(b)编码产生重组病毒所需的产物的基因,或(a)和(b)两者。
[0157]
生产细胞可以衍生自任何合适的细胞系。用于本文所述方法的示例性生产细胞系包括但不限于293、911e4、hela、cos、a549、cho、per.c6和bhk。在一些实施方式中,生产细胞衍生自哺乳动物细胞。在一些实施方式中,生产细胞衍生自293细胞。在另一个实施方式中,生产细胞衍生自hela细胞。在另一个实施方式中,生产细胞衍生自cho细胞。
[0158]
生产细胞系与其相应的edad结合用于病毒载体产生。通常,从edad缺失的必需早
期基因用生产细胞系中的整合拷贝补充,因此edad能够复制腺病毒基因组,但由于衣壳化基因中的缺陷,仍不能包装腺病毒基因组。
[0159]
与第二病毒相对应的一种或多种病毒基因产物,其是产生与第二病毒相对应的感染性的复制缺陷型病毒颗粒所必要的。更具体地,用edad感染生产细胞系导致产生与第二病毒相对应的感染性的复制缺陷型病毒颗粒。假定生产细胞系用edad病毒颗粒感染,则生产细胞系必须是允许腺病毒颗粒的进入和/或复制或经遗传修饰以支持腺病毒颗粒的进入和/或复制。产生包装细胞系的方法是本领域众所周知的,不需要进一步讨论。
[0160]
通过以下实施例进一步说明本申请,不应将所述实施例视为限制。贯穿本申请引用的所有参考文献、专利和公开的专利申请的内容以及附图和表格通过引用并入本文。
[0161]
实施例
[0162]
实施例1:示例性edad基因组
[0163]
图3的分图b
‑
d和图4的分图a
‑
e显示了edad基因组的几个示例。可以使用本领域众所周知的标准重组dna技术来生成edad基因组。基于edad的起始腺病毒5质粒是ptg3602、pfg140、padeasy质粒。用设计的cas9/grna消化期望的要缺失的基因,例如piiia、六邻体、五邻体、纤维等,然后通过自身连接将得到的片段连接。在具有缺失的腺病毒衣壳化基因的相应宿主细胞中拯救获得的质粒。病毒载体的其他组分的进一步添加是通过在细菌或与拯救edad相容的相应细胞系中使用穿梭载体通过同源重组或cre介导的重组来进行的。
[0164]
实施例2:edad的产生
[0165]
图5显示了用于产生edad的两种示例性方法。对于每种edad,产生特定的生产细胞系,以便edad中缺失或有缺陷的一种或多种基因在生产细胞系中表达。
[0166]
edad
‑
d100k的生成
[0167]
edad
‑
d100k如下产生:用bamhi消化padeasy
‑
1,分离含有ad5序列21696至35995的子片段,并亚克隆到puc19中的bamhi处,得到puc19
‑
ad
‑
bamhi。通过从puc19
‑
ad
‑
bamhi中去除100k基因的nhei片段(ad5序列24999至25686)来制备puc19
‑
ad
‑
bamhi/δ100k。然后用bamhi从puc19
‑
ad
‑
bamhi/a100k质粒中释放出含有100k基因中的缺失的腺病毒片段,并连接回padeasy
‑
1的大bamhi子片段,从而获得pad
‑
easy
‑
d100。然后在细胞系293
‑
100k中拯救腺病毒edad
‑
d100k。
[0168]
293
‑
100k细胞的生成
[0169]
通过将化学合成的100k基因克隆到pcdna3(pcdna3
‑
100k)中处于cmv启动子的控制下来生成细胞系293
‑
100k。将两微克的pcdna3
‑
100k质粒用clai限制酶消化线性化,并通过阳离子脂质体(lipofectamine)转染到293细胞中。在具有600μg/ml g
‑
418的dmem培养基中选择转染的细胞。通过pcr和蛋白质印迹确认获得的克隆。证实了293
‑
100k克隆在39℃的非允许温度下支持温度敏感性(ts)ad5 100k突变体h5ts116(最初由h.ginsberg制备)的生长的能力。
[0170]
edad
‑
e1
‑
d100k的生成
[0171]
edad
‑
d100k用于感染表达100k的hela细胞,所述细胞用ad5的左臂片段(cla i片段)转染。选择噬菌斑以确认是否存在e1和100k缺失。
[0172]
edad
‑
d100k
‑
cre的生成
[0173]
将包含cre基因的sali片段连接到pshuttlecmv的sali位点,生成
pshuttlecmvcre。将携带cre的穿梭质粒用pmei线性化,并与pad
‑
easy
‑
d100共电穿孔到大肠杆菌bj5183中。以这种方式,两个质粒之间的靶向重组在细菌质粒内生成了全长edad
‑
d100
‑
cre载体基因组,其为e1
‑
、e3
‑
和100k
‑
。类似地,将pshuttle
‑
aav
‑
cmvlacz质粒与padeasy
‑
1共电穿孔,以生成含[e1
‑
,e3
‑
]ad
‑
aav
‑
cmv
‑
lacz
‑
的质粒。然后将这些腺病毒从293
‑
100k细胞中拯救。
[0174]
实施例3:用edad产生重组aav载体
[0175]
用于raav产生的iiia衣壳化缺陷型腺病毒的生成
[0176]
起始材料是ptg3602,其包含全长ad5基因组(journal of virology[病毒学杂志],1996年7月,第4805
‑
4810页chartier等人)。通过使用典型的分子生物学技术去除e3或e1和e3区,以获得pad
‑
d3或pad
‑
d13。通过使用crispr核酸酶消化和质粒pad
‑
d3或pad
‑
d13的自连接,从质粒中去除iiia区,以获得pdiiia
‑
d3(seq id no:1)和pdiiia
‑
d13(seq id no:2),因此从腺病毒中去除了iiia功能。通过测序确认所得构建体,然后将其用于拯救293
‑
iiia中的感染性腺病毒。
[0177]
为了反式提供iiia,使用ad5 iiia cdna生成293稳定细胞系(293
‑
iiia)。通过在293
‑
iiia细胞中转染并繁殖来拯救具有iiia缺失的ad5。
[0178]
pdiiia
‑
d3和pdiiia
‑
d13中的iiia缺失与ad6
‑
iiia缺失相似,如crosby cm和barry ma在virology[病毒学].2014年8月;462
‑
463:158
‑
65.doi:10.1016/j.virol.2014.05.030.(2014年7月2日电子发表)中所述。
[0179]
使用crosby cm和barry ma(同上)描述的类似方法进行功能测试。
[0180]
为了确认iiia缺失的腺病毒有能力用于aav产生,将带有侧翼有aav itr的gfp基因的aav表达盒克隆到piiia
‑
d3或pad
‑
d13中的e1区(可以使用e3或其他区域)中,并在293
‑
iiia细胞系中拯救感染性iiia
‑
d13
‑
aav
‑
gfp(seq id no:3)和iiia
‑
d3
‑
aav
‑
gfp。在以下条件下产生aav载体。iiia
‑
d13
‑
aav
‑
gfp病毒dna在产生过程中被扩增了1e+5倍,而没有产生感染性腺病毒。
[0181][0182]
raav的一个限制是它们的基因组包装能力仅为~5kb。对于某些疾病,aav的包装限制不允许通过单个aav载体递送全长治疗性蛋白。考虑到由aav的包装能力施加的限制,可以使用双重载体方法,其中转基因跨越两个单独的raav载体分开。然后,将细胞用这两种raav共感染会导致无法通过单个aav载体编码(由于aav的dna包装限制)的组装mrna的转录。普通技术人员将理解,当前公开的方法能够适于产生这样的双重载体,用于表达超过腺相关病毒衣壳的包装能力的转基因。用paav
‑
cb
‑
egfp转染b50细胞系,并将具有可拯救的aav
‑
cb
‑
egfp的细胞克隆命名为b50
‑
aav
‑
cb
‑
egfp,其具有aav rep&cap序列和aav基因组两者。然后使用edad
‑
e1
‑
d100k以moi 1、5和10感染b50
‑
aav
‑
cb
‑
egfp。
[0183]
edad
‑
d100k
‑
dp3的生成
[0184]
为了在腺病毒中进行100k和piiia双重缺失,将pad
‑
easy
‑
d100用cas9/grna消化,从而释放piiia基因片段。将所得的大片段自连接以获得pad
‑
easy
‑
d100dp3。在293
‑
100k
‑
piiia细胞系中拯救并扩增edad
‑
d100k
‑
dp3。
[0185]
edad
‑
d100k
‑
dp3
‑
cre的生成
[0186]
制备质粒pshuttle
‑
cmv
‑
cre,并使用ad
‑
easy试剂盒将其与pad
‑
easy
‑
d100dp3重组。在293
‑
100k
‑
piiia细胞中拯救并扩增所得的腺病毒。
[0187]
使用edad
‑
d100k
‑
dp3
‑
cre产生aav
[0188]
具有整合的aav基因组以及cre可激活的rep和cap的细胞系293
‑
dsgfp
‑
12(由xiao xiao提供)感染edad
‑
d100k
‑
dp3
‑
cre。
[0189]
实施例4:使用edad产生重组慢病毒载体
[0190]
本申请还提供了产生能够感染非分裂细胞的重组慢病毒的方法以及制备所述重组慢病毒的方法和手段。所述病毒可用于核酸序列的体内和离体转移和表达。
[0191]
慢病毒基因组和前病毒dna具有在逆转录病毒中发现的三个基因;gag、pol和env,
其侧翼有两个ltr序列。gag基因编码内部结构(基质、衣壳和核衣壳)蛋白;pot基因编码rna指导的dna聚合酶(逆转录酶)、蛋白酶和整合酶;并且env基因编码病毒包膜糖蛋白。5’和3’ltr用于促进病毒粒子rna的转录和聚腺苷酸化。ltr包含病毒复制所需的所有其他顺式作用序列。慢病毒具有另外的基因,包括vif、vpr、tat、rev、vpu、nef和vpx(在hiv
‑
1、hiv
‑
2和/或siv中)。
[0192]
与5’ltr相邻的是基因组逆转录所必需的序列(trna引物结合位点)和有效将病毒rna衣壳化到颗粒中所需的序列(psi位点)。如果病毒基因组中缺少衣壳化(或将逆转录病毒rna包装到感染性病毒粒子中)所需的序列,则顺式缺陷会阻止基因组rna的衣壳化。但是,所得的突变体仍然能够指导所有病毒粒子蛋白的合成。
[0193]
本申请提供了产生能够感染非分裂细胞的重组慢病毒的方法,所述方法包括用携带包装功能,即gag、pol和env,以及rev和tat的一种或多种edad感染合适的宿主细胞。例如,第一edad病毒能够提供编码病毒gag和病毒pol的核酸,并且同一edad或另一edad能够提供编码病毒env的核酸以产生包装细胞。将提供异源基因的载体(在此被鉴定为转移载体)引入该包装细胞,产生了释放携带外来感兴趣的基因的感染性病毒颗粒的生产细胞。
[0194]
本文所述的慢病毒载体可以通过三种不重叠的表达构建体来包装,两种表达hiv蛋白,另一种表达不同病毒的包膜。此外,除了有助于hiv
‑
1包装基序的茎环结构的gag基因的部分之外,构建体中没有已知对衣壳化和逆转录所需的所有hiv序列。
[0195]
改善载体生物安全性的第二种策略利用了慢病毒基因组的复杂性。鉴定了生成有效载体所需的最小hiv
‑
1基因集合,并从系统中消除了所有其他hiv阅读框。由于去除的基因的产物对于病毒生命周期的完成和致病机理很重要,因此没有重组体能够获取亲本病毒的致病特征。hiv的所有四个附属基因都能够从包装构建体中缺失,而不会影响基因转导。tat基因对于hiv复制至关重要。tat基因产物是已知最强大的转录激活因子之一,并且在表征hiv诱导的疾病的极高复制速率方面起着关键作用。
[0196]
逆转录病毒衍生的env基因的示例包括但不限于莫洛尼鼠白血病病毒(momulv或mmlv)、哈维(harvey)鼠肉瘤病毒(hamusv或hsv)、鼠乳腺肿瘤病毒(mumtv或mmtv)、长臂猿白血病病毒(galv或galv)、人类免疫缺陷病毒(hiv)和劳斯(rous)肉瘤病毒(rsv)。可以使用的其他env基因包括水泡性口炎病毒(vsv)蛋白g(vsv
‑
g),以及肝炎和流感病毒的那些。
[0197]
提供病毒env核酸序列的载体与调节序列,例如启动子或增强子可操作地相关联。调节序列可以是任何真核启动子或增强子,包括例如莫洛尼鼠白血病病毒启动子
‑
增强子元件、人巨细胞病毒(hcmv)增强子或牛痘p7.5启动子。在一些情况下,例如莫洛尼鼠白血病病毒启动子
‑
增强子元件,启动子
‑
增强子元件位于ltr
‑
序列内或附近。
[0198]
优选地,调节序列是对于由其构建载体的慢病毒而言不是内源的序列。因此,如果载体是由siv制成的,则在siv ltr中发现的siv调节序列将被不源自siv的调节元件替换。
[0199]
尽管vsv c蛋白是期望的env基因,因为vsv g赋予重组病毒广泛的宿主范围,但是vsv g对宿主细胞可能有害。因此,当使用基因,诸如vsv g的基因时,优选采用可诱导的启动子系统,使得当不需要表达vsv c时,能够调节vsv g的表达以最小化宿主毒性。
[0200]
例如,当从转移细胞中撤出(withdrawn)四环素时,可以使用gossen&bujard(proc.natl.acad.sci.[美国国家科学院院刊](1992)89:5547
‑
5551)的四环素可调节的基因表达系统来提供vsv g的可诱导表达。因此,tet/vp16反式激活子存在于第一载体上,并
且vsv c编码序列被克隆到另一载体上由tet操纵子序列控制的启动子的下游。
[0201]
可以将这种杂合启动子插入转移载体的ltr的3’u3区。由于通过使用这种转移载体产生的载体颗粒对靶细胞的转导,杂合启动子将在逆转录时被拷贝到5’u3区。在靶细胞中,只有在存在tta的情况下,例如在转导表达tta的合适包装细胞系后,才能激活基因的这种条件表达,以表达全长可包装载体转录物。
[0202]
在生产细胞中使用这样的载体允许仅在需要时才以高水平“开启”可包装载体mrna信息(message)的产生。相反,在不表达tta的细胞的转导时,杂合启动子在转录上变得沉默。即使存在hiv tat蛋白(已知能够上调异源启动子的基础转录活性),这种转录沉默也得以维持。即使转导的细胞被野生型hiv
‑
1感染,启动子系统也显著降低了载体基因组活动化(mobilization)的机会。
[0203]
另一种实施方式涉及基于慢病毒的逆转录病毒载体系统,其中消除了包装和转移载体构建体的编码序列之间的序列同源性(序列重叠)。重要的是,通过使用这种构建体产生的载体颗粒保留了高水平的转导潜力。预期在载体生产系统中使用这样的构建体将最显著降低重组事件的频率,这是与这样的载体系统相关的生物安全性的重大进步。
[0204]
已知在整个gag
‑
pol编码mrna中,存在几个顺式作用抑制序列(crs)。所述序列阻止了mrna转运到细胞质,因此阻止了编码的蛋白表达。为了抑制crs的作用,hiv
‑
1mrna含有称为rre的抗抑制信号,rev蛋白可与之结合。然后hiv
‑
1mrna
‑
rev复合物被有效地转运到细胞质中,在那里复合物解离,mrna变得可用于翻译。
[0205]
至少有两种方法可用于选择在表达gag和gag
‑
pol的包装载体中所需的最少量hiv序列。首先,仅能插入gag
‑
pol基因。在那种情况下,所有或至少大多数crs将需要被鉴定和突变而不影响编码的氨基酸序列。如果实现的话,则可以从载体系统中消除rev基因。
[0206]
第二,可以将最小的rre元件引入gag
‑
pol表达盒,以使其序列成为所得mrna的一部分。在那种情况下,gag和gag
‑
pol多蛋白的表达将需要抗阻遏物rev的存在。然而,rev蛋白本身不需要是gag
‑
pol表达载体的一部分,但是可以与gag
‑
pol表达盒独立且优选不重叠地反式提供。
[0207]
在不需要rev蛋白以有效产生转移载体mrna的系统中,可以将rev基因和rre元件从载体系统中消除,作为进一步的生物安全措施。然而,在这样的系统中,如果由于同源或非同源重组事件将gag
‑
pol基因整体或部分转移到载体接受体中,则可能发生表达。
[0208]
相比之下,其中gag
‑
pol基因表达依赖于rev的载体系统可能是有价值的安全替代。因此,如果设计了利用rev的载体系统,使得所有组分都不具有同源序列,则在不太可能的重组事件中,重组将导致gag
‑
pol序列转移到载体接受体上,发生其表达的可能性要小得多,因为转移的重组体必须包含rre元件和能够被表达的rev编码序列二者。
[0209]
鉴于对hiv衍生载体的主要兴趣在于其转导非分裂和缓慢分裂的细胞和组织的能力,因此检测了非重叠载体在细胞周期停滞细胞中的转导。与momlv载体相比,最小的hiv衍生载体在分裂和生长停滞的细胞中均保持了转导潜能。
[0210]
此外,观察到:在一定条件下,包装载体gag
‑
pol mrna中存在的hiv
‑
1rna元件导致大量信使被特异性地衣壳化到释放的载体颗粒中。所述元件充当hiv
‑
1主要剪接供体位点(sd),并且至少由核苷酸gacuggugag(seq id no:1)构成。在没有转移载体表达的情况下,仅由pmdlg/prre包装构建体生成的载体颗粒没有可检测到的gag
‑
pol rna信使。从产生载
体颗粒的细胞中提取的总rna的分析表明,在所有情况下表达水平都相似。当比较所测试的包装载体的5’mrna区时,显然上述指定序列是提供信使的特异性衣壳化的决定因素。
[0211]
优选地,通过本申请的方法产生的重组慢病毒是人免疫缺陷病毒(hiv)的衍生物。但是,env优选衍生自hiv以外的病毒。
[0212]
在一些实施方式中,本申请的方法提供了至少一种edad和多达四种edad病毒,它们提供了包装重组慢病毒病毒粒子所需的所有功能,例如gag、pol、env、tat和rev,如上文所讨论。参见图13
‑
17。如本文所述,可以在功能上将其缺失以获得意想不到的益处。使用的载体的数量没有限制,只要所述载体用于转化并产生包装细胞系以产生重组慢病毒即可。
[0213]
将edad载体感染引入生产细胞系,同时将另外的元件整合到生产细胞中以避免转染。生产细胞系产生包含载体基因组的病毒颗粒。转染或感染的方法是本领域技术人员众所周知的。将edad病毒感染或共感染生产细胞系后,从培养基中回收重组病毒,并通过本领域技术人员使用的标准方法进行滴定。
[0214]
其中生产功能被配置为由合适的生产细胞表达的稳定细胞系是已知的。例如,参见美国专利号5,686,279;和ory等人,proc.natl.acad.sci.[美国国家科学院院刊](1996)93:11400
‑
11406,其描述了包装细胞。这种稳定的细胞系将与至少一种本申请的edad一起使用。
[0215]
zufferey等人,同上,描述了一种慢病毒生产细胞,其中缺失了包括hiv
‑
1env基因的pol的3’序列。构建体包含tat和rev序列,并且3’ltr被聚a序列替换。5’ltr和psi序列被另一种启动子替换,例如可诱导的启动子。例如,可以使用cmv启动子或其衍生物。
[0216]
感兴趣的生产载体包含包装功能的另外改变,以增强慢病毒蛋白表达并增强安全性。例如,可以去除gag上游的所有hiv序列。同样,env下游的序列也可以去除。此外,可以采取措施来修饰载体以增强rna的剪接和翻译。
[0217]
为了提供具有甚至更遥远的生成具有复制能力的慢病毒的可能性的edad,本申请的一个方面提供了慢病毒包装edad,其中tat序列(其是通过转录机制促进病毒表达的调节蛋白)在功能上被缺失。因此,可以使tat基因部分或整体缺失,或者可以对tat序列进行各种点突变或其他突变以使所述基因无功能。技术人员可以实践已知的技术来使tat基因无功能。
[0218]
因此,根据本申请,使慢病毒包装edad包含启动子和由技术人员确定的其他任选或必需的调节序列(gag、pol、rev、env或其组合),以及tat的特定功能切除或实际切除,和任选的其他慢病毒附属基因。
[0219]
可以通过用异源增强子/启动子代替u3区的部分或全部转录调节元件来修饰转移载体构建体的5’ltr。所述变化可以增强转移载体rna在生产细胞中的表达;在没有hiv tat基因的情况下允许载体产生;并用于去除可与3’缺失版本重组以“拯救”上述sin载体的hiv ltr的上游野生型拷贝。因此,在5’ltr处含有上述改变的载体(5’载体)可用作转移载体,因为所述序列增强表达并与不表达tat的包装细胞组合。
[0220]
这样的5’载体还可以如上讨论在3’ltr处携带修饰以产生改善的转移载体,其不仅具有增强的表达并且可以用于不表达tat但也可以自灭活的包装细胞中。
[0221]
从hiv ltr的转录高度依赖于tat蛋白的反式激活子功能。在通常由生产细胞中存在的核心包装构建体表达的tat的存在下,强烈刺激了从hiv ltr的载体转录。鉴于全长“病
毒”rna具有完整的包装信号互补,因此rna被有效地衣壳化到载体颗粒中并转移至靶细胞。可用于包装在生产细胞中的载体rna的量是感染性载体产生中的限速步骤。
[0222]5’
ltr的增强子或增强子和启动子区可以分别被人巨细胞病毒(cmv)或劳斯肉瘤病毒(rsv)的增强子或增强子和启动子取代,参见图12,其为杂合载体的构建体和代号示意图。ccl和rrl载体的5’u3区被完全取代。
[0223]
在用转移载体转染的生产细胞中,在有或没有提供tat反式激活子的包装构建体的情况下,比较了对照慢病毒载体hr2和5’杂合体组。在存在和不存在包装构建体的情况下,四种嵌合载体的转录水平均高于对照慢病毒载体的转录水平。所有嵌合载体均有效地将转基因转移至靶细胞中,并且rrl载体表现与对照hr2载体一样好。最后,通过在转导后的早期和晚期检查转导的细胞来确认载体在靶细胞中的整合。没有观察到转基因阳性细胞百分比的降低,这表明载体已经整合。
[0224]
在没有包装构建体的情况下,在生产细胞中获得的5’ltr修饰的转移载体rna的高水平表达表明,在没有功能性tat基因的情况下,生产载体是有功能的。如关于上文公开的包装质粒所指出的,鉴于与tat蛋白相关的致病活性的数目,tat基因的功能性缺失将赋予慢病毒载体系统更高水平的生物安全性。因此,具有显著改善的生物安全性的慢病毒载体是sin转移载体,其在5’或3’端均不含d型拷贝的hiv ltr,与如本文所述的tat较少的包装载体结合使用。
[0225]
可以使用标准技术收获病毒上清液,例如转染后48小时过滤上清液。病毒效价可以通过在8μg/ml聚凝胺(sigma chemical co.,st.louis,mo.)存在下用适量的病毒上清液感染例如106nih 3t3细胞或105hela细胞来确定。四十八小时后,可以测定转导效率。
[0226]
为了说明的目的,本发明仅说明了vsv0g包膜的使用。假型慢病毒载体由带有衍生自其他包膜病毒的糖蛋白(gp)的载体颗粒构成。假型慢病毒载体的替代gp的列表在不断增加。这些go已在cronin的curr gene ther.[当前基因疗法]2005年8月;5(4):387
‑
398中进行了综述。其他gp包括但不限于lcmv、rrv、sev f、ebola、marburg、hn、jsrv、rabies、mokola、rd 114、galv等。由于gp通常具有毒性,因此edad可以携带它进行高水平表达并补充慢病毒产生。
[0227]
在图13
‑
19中示出了生成每一代慢病毒载体的示例。
[0228]
可能期望通过包膜蛋白与抗体或特定配体(用于靶向特定细胞类型的受体)的连接来靶向重组病毒。通过将感兴趣的序列(包括调节区)与例如编码特定靶细胞上受体的配体的另一个基因一起插入病毒载体,载体现在具有靶特异性。逆转录病毒载体可以通过插入例如糖脂或蛋白而成为靶特异性的。通常通过使用抗体或重组抗体型分子(例如单链抗体)的抗原结合部分靶向逆转录病毒载体来实现靶向。本领域技术人员将了解或可以容易地确定实现逆转录病毒载体向特定靶的递送的特定方法,而无需过度实验。实施例5,具有蛋白v、六邻体、iva2、l1
‑
52/55k和l4
‑
22k中的缺失的腺病毒
[0229]
三种病毒核心蛋白(v、vii和mu)与病毒dna相互作用并使病毒dna凝缩,并介导核心与衣壳之间的相互作用。一系列次要衣壳组分iiia、vi、viii和ix有助于衣壳结构和稳定性。在体内和体外,l4
‑
22k蛋白与包装a重复序列的tttg基序结合,iva2蛋白与cg基序结合。仅在体内发现l1
‑
52/55k蛋白与包装结构域缔合,而在体外l1
‑
52/55k蛋白与iva2缔合。将ad dna包装到衣壳中需要iva2和l1
‑
52/55k蛋白。
[0230]
利用遗传霉素选择后,分离出稳定表达ad5 l1
‑
52/55k蛋白的新293细胞系,如针对293
‑
l1所述(j virol.[病毒学杂志]2011年8月;85(15):7849
‑
7855.doi:10.1128/jvi.00467
‑
11)。
[0231]
生成用于v、iva2、六邻体和l4
‑
22k表达的相似293细胞,并将其命名为293
‑
v、293
‑
iva2、294
‑
l4、293
‑
六邻体。通过以下方法来制备在这些区中具有缺失的腺病毒:首先从pad
‑
d3和pad
‑
d13中缺失这些编码区,然后从相应的细胞系中拯救感染性病毒。
[0232]
在293细胞中测试时,ad
‑
dv产生了报告基因产物,但从未受到困扰(plagued)。在相容的生产细胞系中作为aav的辅助物感染后,缺失v的病毒基因组能够正常复制。但是,后代病毒粒子缺乏蛋白v,并且在初次感染后无法主动感染第二组细胞。
[0233]
这些腺病毒支持aav产生,与实施例i中所述类似。
[0234]
实施例6.纤维缺失的腺病毒支持raav产生
[0235]
纤维蛋白与细胞受体的结合是腺病毒转导的主要方式。因此,无纤维的ad颗粒具有严重降低的感染性。
[0236]
为了开发表达ad5纤维的细胞系,对ad5纤维序列进行密码子优化(co)并合成。密码子优化将改善蛋白表达水平,并显著降低体外同源重组的可能性。使用polyfect(凯杰公司(qiagen),巴伦西亚(valencia),加利福尼亚州,美国),将具有ad5
‑
fiber
‑
co的表达片段转染到293细胞中。转染后二十四小时。添加遗传霉素(0.5mg/ml)。然后通过蛋白质印迹确认细胞系293
‑
fibr。
[0237]
为了从pad
‑
d3和pad
‑
d13中缺失纤维,使用经过特殊设计的crisp核酸酶来释放纤维基因片段,然后通过dna连接酶将所得的大片段重新环化以获得pdfibr
‑
d3和pdfibr
‑
d13。然后在293
‑
fibr细胞系中使用pdfibr
‑
d3和pdfibr
‑
d13来拯救病毒ad
‑
dfibr
‑
d3和ad
‑
dfibr
‑
d13。293
‑
fibr细胞系中ad
‑
dfibr
‑
d3和ad
‑
dfibr
‑
d13的产量正常。
[0238]
具有aav
‑
gfp的ad
‑
dfibr
‑
d3和ad
‑
dfibr
‑
d13是通过以下方式获得的:将aav
‑
gfp克隆到pdfibr
‑
d3和pdfibr
‑
d13中,然后将其用于293
‑
fibr细胞系中的拯救。
[0239]
测试结果为:
[0240]
[0241][0242]
该结果表明纤维需要与另一种因子例如iiia组合以获得不含腺病毒颗粒的aav载体。
[0243]
因此,本发明的组合物和方法的广度和范围不应受到任何上述示例性实施方式的限制,而应仅根据所附权利要求书及其等同物来限定。
[0244]
上面的描述是为了教导本领域的普通技术人员如何实践本申请,并且不旨在详细描述本领域技术人员在阅读本说明书后将变得显然的所有那些明显的修改和变化。尽管上面已经描述了各种实施方式,但是应该理解,这样的公开仅以示例的方式给出,并且不是限制性的。此外,旨在所有明显的修改和变化都应包括在由所附权利要求书限定的本申请的范围之内。权利要求书旨在覆盖能够有效地实现所预期目标的任何顺序的步骤和组分,除非上下文特别指出相反。本发明的组合物和方法的广度和范围不应受到任何上述示例性实施方式的限制,而应仅根据所附权利要求书及其等同物来限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1