一种具有酰基转移功能的酶及其应用的制作方法
本发明属于基因工程和生物制药技术领域,具体涉及一种具有酰基转移功能的酶及其应用。
背景技术:
药物经酰基化修饰通常能够改变理化性质,提高生物疗效。在药物合成中,常采用酰化反应保护羟基,胺基;并且酰基可以通过氧化,还原,加成,重排等反应转化为其它基团。因此,酰基转移酶作为一种工具酶成为研究的热点。
macrolactins是一系列24元大环内酯类化合物,具有抗菌、抗病毒、抗肿瘤、抗感染和抗衰老等生物学和药理学活性。最早,fenical研究组于1989年从一株深海细菌中分离得到了macrolactinsa-f,研究表明,macrolactina能够抑制b1-f10鼠科动物的黑色素肿瘤细胞和哺乳动物单纯疱疹病毒,并且能够通过抑制hiv病毒的复制起到保护淋巴细胞的作用。这些年来,macrolactins家族不断壮大,科学家们相继分离得到7-o-succinylmacrolactinf及7-o-succinylmacrolactina,macrolactinsg-m(其中h为22元大环内酯,l为双环内酯),macrolactinn,7-o-malonylmacrolactina,macrolactino-r,macrolactins和macrolactint。这些macrolactins都具有良好的抗菌活性,其中macrolactinn-r能够抑制金黄色葡萄球菌的肽脱甲酰酶,7-o-malonylmacrolactina对许多革兰氏阳性病原菌,如耐甲氧西林的金黄色葡萄球菌和耐万古霉素的肠道球菌和洋葱伯克霍尔德菌的变种都表现出较好的抑制作用,macrolactinb和t不仅能够抑制金黄色葡萄球菌,而且对植物病原真菌稻瘟霉和交链孢也有明显效果。
作为一类极具应用潜力的药物先导化合物,macrolactins已经引起人们的极大关注,macrolactins属于聚酮类化合物,其骨架结构macrolactina是由聚酮合酶(polyketidesynthases,pkss)催化组装而成,然而其后修饰步骤的研究一直未见报导。发明人在研究macrolactins的后修饰分子机制过程中,发现了对macrolactins进行酰基化修饰的酶基因。通过对macrolactins酰基化反应能够提高大环内酯类化合物的药理活性,进而可能改善其生物利用率,增强药效,降低毒副作用,为大环内酯类化合物的药物研制提供一个新的策略。
技术实现要素:
本发明的目的是提供一种具有酰基转移功能的酶及其应用,能够对macrolactins大环内酯类化合物进行酰基化修饰,从而弥补了现有技术的不足。
本发明一个方面提供一种酰基转移酶,包括有:
a)序列为seqidno:1的蛋白酶;
b)通过对a)中的蛋白酶缺失、取代、插入或添加一个或几个氨基酸,并具有a)酰基转移酶活性的蛋白酶。
用于编码上述酰基转移酶的基因,其一种核苷酸序列为seqidno:2。
本发明另一个方面提供一种重组载体,该重组载体携带有用于表达本发明的酰基转移酶的基因。
本发明还提供一种转化子,是将用于表达本发明的酰基转移酶的重组载体转化宿主细胞获的。
本发明的酰基转移酶的应用,是将酰基供体的酰基结合到大环内酯类化合物上;
所述的酰基供体试剂为(d)x-coa,其中x代表酰基;x选自乙酰、丙二酰、琥珀酰、丁酰;
所述的大环内酯类化合物为macrolactins。
本发明的具有酰基转移功能的酶通过对macrolactins酰基化反应能够提高大环内酯类化合物的水溶性,进而可能改善其生物利用率,增强药效,降低毒副作用,为大环内酯类化合物的药物研制提供一个新的策略。
附图说明
图1:本发明扩增的编码酰基转移酶基因bmmi电泳图;
图2:本发明实施例3构建的表达载体构建验证电泳图;
图3:纯化的酰基转移酶bmmi的sds-page分析电泳图;
图4.:酰基化产物的高效液相色谱(hplc)谱图;
图5:macrolactina和chloramphenicol及酰基化产物的紫外吸收光谱图;
图6:酰基化产物的质谱(hrms)谱图。
具体实施方式
首先对本发明所涉及的术语解释如下:
此处,术语“多个氨基酸”是指2至5个且优选2至3个氨基酸,关于相关序列号的氨基酸序列的一个或多个氨基酸的缺失、添加、插入或取代可通过用常规技术例如定点突变修饰编码包含每个序列号的氨基酸序列的蛋白质的dna序列进行。此处,优选氨基酸残基的取代是保守取代。已知保守取代可发生在以下氨基酸残基之间:甘氨酸(gly)和脯氨酸(pro)、甘氨酸和丙氨酸(ala)或缬氨酸(val)、亮氨酸(leu)和异亮氨酸(i1e)、谷氨酸(glu)和谷氨酰胺(gln)、天冬氨酸(asp)和天冬酰胺(asn)、半胱氨酸(cys)和苏氨酸(thr)、苏氨酸和丝氨酸(ser)或丙氨酸和赖氨酸(lys)和精氨酸(arg)。
优选被本发明的酰基转移酶用作酰基供体的化合物优选使用x选自乙酰、丙二酰、琥珀酰或丁酰作为酰基供体化合物。
本发明的酰基转移酶适合于酰基化大环内酯类化合物,本发明的酰基转移酶适合于酰基化大环内酯类化合物,优选macrolactins化合物。
酰基转移酶基因:本发明的酰基转移酶基因是编码具有导致酰基从上述酰基转移酶(即,酰基供体)转移到任意化合物(即,任意化合物的酰基化)的活性的蛋白质的基因。特别地,本发明的酰基转移酶基因是包含编码上述酰基转移酶的dna的酰基转移酶基因。
本发明的酰基转移酶基因包括与包含具有seqidno:2的核苷酸序列的dna的基因功能上相当的基因。此处,表述“功能上相当的基因”是指其中由目的基因编码的蛋白质具有与由本发明的酰基转移酶基因编码的蛋白质的那些生物和生化功能相当的生物和生化功能的情形。本领域技术人员已知的用于制备与特定基因功能上相当的基因的方法的实例是使用杂交技术的方法。因此,本发明的酰基转移酶基因包括包含在严格条件下与包含与seqidno:2的核苷酸序列互补的核苷酸序列的dna杂交并编码具有酰基转移酶活性的蛋白质的dna的基因。
此处,术语“严格条件”是指形成特异性杂合子,但不形成非特异性杂合子的条件。这些条件包括低严格条件和高严格条件。但是,优选高严格条件。低严格条件包括例如杂交后在42℃下,5×ssc和0.1%sds洗涤且优选在50℃下,5×ssc和0.1%sds洗涤。高严格条件包括例如杂交后在65℃下,0.1×ssc和0.1%sds洗涤。包括与seqidno:2的核苷酸序列高度同源(即具有80%或更大、优选90%或更大、更优选95%或更大、且进一步优选98%或更大的同源性或具有80%或更大、优选90%或更大、更优选95%或更大、且进一步优选98%或更大的同一性)的核苷酸序列的dna可在上述严格条件下与包括与该dna的核苷酸序列互补的核苷酸序列的dna杂交。
另外,本发明的酰基转移酶基因包括包含具有seqidno:2的核苷酸序列的dna的基因的简并异构体。此处,术语“简并异构体”是指能够编码与由上述基因编码的蛋白质相同的蛋白质但是具有简并密码子的dna。例如,包含seqidno:2的核苷酸序列的dna的简并异构体具有与该序列的氨基酸对应的简并密码子。
进一步地,本发明涉及包含上述酰基转移酶基因的重组载体。可通过将上述酰基转移酶基因引入到合适的载体上来构建本发明的重组载体。载体的类型无特别限制。可使用的载体的实例包括pbi,ppzp,psma,puc,pbr,pbluescript,pet,pgem,pksl和ptriextm载体(takara);和ptrchis2-topo载体(invitrogen)。另外,可使用病毒载体例如花椰菜花叶病毒(camv)、菜豆金色花叶病毒(bgmv)和烟草花叶病毒(tmv)。可选地,可使用pbi双元载体。
为了将基因插入载体,可使用包括使用合适的限制性内切酶酶切待插入的dna,然后在合适载体dna的限制性内切酶位点或多克隆位点插入dna片段以连接到载体dna上的方法。
以允许基因在其中发挥作用的方式将上述基因整合到载体上是必要的。为了这一目的,允许载体在基因内部、上游或下游包含例如启动子、内含子、增强子、翻译终止密码子、终止子、多聚腺昔酸添加信号和5‘一非翻译区序列的元件。另外,载体可包含选择标记基因。常规已知的载体元件可以以合适的方式组合使用。
能够在细菌细胞中发挥作用的启动子的实例包括:嗜热脂肪芽孢杆菌(bacillusstearothermophilus)的生麦芽酰淀粉酶基因启动子、地衣芽孢杆菌(bacilluslicheniformis)的α淀粉酶基因启动子、解淀粉芽孢杆菌(bacillusamyloliquefaciens)的ban淀粉酶基因启动子、枯草芽孢杆菌(bacillussubtilis)的碱性蛋白酶基因启动子和短小芽孢杆菌(bacilluspumilus)的木酰苷酶基因启动子;噬菌体入的pr或pl启动子,和大肠杆菌的lac,trp或tac启动子。
能够在酵母宿主细胞中发挥作用的启动子的实例包括来源于酵母酰酵解系统的基因的启动子、乙醇脱氢酶基因启动子、tpi1启动子和adh2-4c启动子。能够在真菌中发挥作用的启动子的实例包括adh3启动子和tpia启动子。
终止子的实例包括胭脂碱合酶(nos)基因终止子、章鱼碱合酶(ocs)基因终止子、camv35s终止子、大肠杆菌脂蛋白lpp3‘终止子、trp操纵子终止子、amyb终止子和adhl基因终止子。翻译终止密码子的实例包括例如taa,tag或tga的序列。
本发明还涉及可通过将包含上述酰基转移酶基因的重组载体引入合适宿主而产生的转化子。只要引入的基因可在其中表达,这些宿主不受限制。宿主的实例包括细菌例如大肠杆菌和枯草芽孢杆菌,酵母例如酿酒酵母(saccharomycescerevisiae)、裂殖酵母(schizosaccharomycespombe)和巴斯德毕赤酵母(pichiapastoris),和丝状真菌例如曲霉菌(aspergillus)、脉抱菌(neurospora)、镰刀霉(fusarium)和木霉菌(trichoderma)。
下面结合具体实施例对本发明进行详细的描述。
实施例1酰基转移酶基因的克隆
1、基因组dna的提取
将海洋芽孢杆菌b-9987接种于10mllb液体培养基中,37℃过夜培养,离心收集菌体,弃尽上清;用1ml的stebuffer洗涤2次;加入500μl用stebuffer配制的3~5mg/ml溶菌酶溶液,小心充分悬浮菌体,于37℃水浴30min,至细胞成为半透明状;加入250μl3%的sds,上下轻轻混匀,继续37℃水浴至澄清;加入1/10体积的3mnaac(ph=4.8)后,再加入200μl的酚:氯仿:异戊醇(25:24:1),反复颠倒离心管数次后,12,000rpm离心10min;小心移取上层清液,反复用酚:氯仿:异戊醇抽提,至中间层无蛋白杂质,转移上清,加入等体积的异丙醇(或2倍体积的无水乙醇),上下颠倒混合直至有白色絮状dna沉淀析出;挑出絮状沉淀,用70%的乙醇洗涤1~2次;室温晾干后,用100μl的te溶解基因组dna(t-dna);向100μlt-dna加入400μl的te,加入10μl的5mg/ml的rnase,在37℃温浴30min,除去其中rna;补加100μl的6%的sds,6μl的0.5medta和4μl的10mg/ml的蛋白酶k,混合后再于37℃~55℃温浴反应1小时以上;加入200μl的tris平衡酚:氯仿:异戊醇(25:24:1)抽提至中间无蛋白层;加入2倍无水乙醇重新沉淀t-dna,挑取絮状dna到70%乙醇中,洗涤1~2次,离心沉淀dna;室温干燥后溶于100μl的te中,备用。
2、bmmi酰基转移酶基因的克隆
设计引物对:
p1:5’-atgaaacaaacaataagc-3’;
p2:5’-ttcaatacccgcccacacg-3’,
将上述制备的海洋芽孢杆菌b-9987的t-dna稀释5倍作为模板进行pcr,反应体系(100μl)如下:引物p1和p2各5μl(50pmol),模板5μl,10×reactionbuffer10μl,2.5mmdntp10μl,25mmmgcl26μl,taqdnapolymerase1μl(5u/μl)(takara),加ddh2o至100μl。
pcr条件为:94℃变性4min;94℃40s,51℃40s,72℃1min,30循环;72℃8min。电泳结果如图1所示,将其克隆到pum-t载体上,转化大肠杆菌dh5α感受态细胞,挑选阳性克隆,送去上海桑尼生物技术公司进行序列测定,结果如seqidno:1所示,其翻译的蛋白酶序列为seqidno:2。多个测序的结果证明序列的正确性。
3、bmmi基因在大肠杆菌细胞中的表达
为了表达bmmi蛋白,利用克隆得到的全长bmmi基因作为模板,用含有ndei和xhoi酶切位点的引物(p3:5’-gggaattccatatgaaacaaacaataagc-3’/p4:5’–ccgctcgagttcaatacccgcccacacg-3’,下划线处分别为ndei和xhoi酶切位点),进行bmmi基因开放阅读框的pcr扩增。分别利用ndei和xhoi两种限制性内切酶消化上述扩增得到的dna片段,并将其克隆到质粒pet-28a之上,构建成重组质粒pet-28a-bmmi,构建后利用酶切及pcr鉴定,结果如图2所示。然后导入大肠杆菌rosetta(de3)细胞中,用异丙基硫代半乳酰苷(iptg)诱导表达目的蛋白,超声破碎菌体,经ni柱亲和纯化、超滤浓缩后,获得纯度较高的酶提取液。以十二烷基硫酸钠聚丙烯酞胺凝胶电泳(sds-page)检验获得目的蛋白的分子量及纯度,结果如图3所示,以bradford方法测定酶提取液的浓度,获得的酶提取液,加入酶提取液总体积50%的甘油和摩尔终浓度为0.01mmol/l的dtt,-20℃保存备用,避免反复冻融,以免酶的活性下降。
实施例2:bmmi蛋白的体外酶活检测
体外酶活反应体系:(100μl)
1mtris-hcl缓冲液(ph8.5):1.5μl
0.5mmgcl2:0.12μl
500μmmacrolactina:3μl
10mmsuccinyl-coa:1.5μl
37.54mmbmmi蛋白:0.8μl
ddh2o:23.08μl
反应条件:30℃,2h,反应结束后,加入30μl乙腈终止反应,13,000rpm离心20min,弃沉淀,除去反应液中的蛋白质。所得上清液,进行hplc检测。
hplc检测:使用反相c18column(规格:150×4.6mm,5μm);柱温为30℃;洗脱条件:0-5min平衡:55%a相(ddh2o+0.1%甲酸)和45%b相(乙腈+0.1%甲酸);5-15min线性洗脱:55-30%a相和45-70%b相;15-25min等度洗脱:0%a相和100%b相;检测波长为260nm;流速为1ml/min。从hplc获得的谱图上看(图4a),反应后出现了与底物紫外吸收光谱一致的新的吸收峰(图5,macrolactins和chloramphenicol紫外吸收光谱),说明了酶促反应的发生。
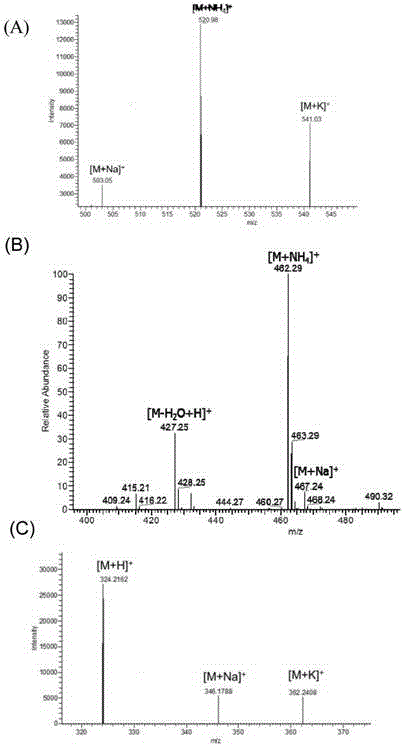
将获得的含有酰基化产物溶液进行高分辨质谱(hrms)分析(图6a)。从ms谱图上看,获得产物[m+nh4]+为520.98,[m+na]+为503.05,分子量与预期目的产物的分子量一致。以上结果证实反应液中生成了琥珀酰化的macrolactina。
申请人研究发现,对本发明实施例1的酶进行缺失、取代、插入或添加一个或几个氨基酸,所获得新的序列的酶还具有酰基转移的功能,例如,在seqidno:1的蛋白序列的第3和5位的q、i被其它氨基酸残基如h和l所替换;第67和70位的t、e氨基酸残基被其它氨基酸残基如s和k所替换;第126和128位的s和e氨基酸残基被其它氨基酸残基如a和d所替换;第215-217位的vis氨基酸残基被其它氨基酸残基如ivn所替换;第327和329位的ms氨基酸残基被其它氨基酸残基如所替换如lv所替换;第347和349位的h被其它氨基酸残基如n和e所替换。按照实施例2的酶活检测方法,上述衍生的酶都具有与序列为seqidno:2的酰基转移酶相同的功能。
实施例3:bmmi酰基转移酶对大环内酯类化合物的转酰基作用
以acetyl-coa做为酰基供体时,将实施例2中酶反应体系中的succinyl-coa替换为acetyl-coa时,30℃温育2h,终止反应后进行hplc检测和hrms分析(图4b,图5,6b),从ms谱图上看,获得产物[m+nh4]+为462.29,[m+na]+为467.24,分子量与预期目的产物的分子量一致。证实结果同样获得乙酰化的macrolactina。从而证明本发明的酰基转移酶具有很好的应用前景。
实施例4:bmmi酰基转移酶对氯霉素的转酰基作用
以succinyl-coa做为酰基供体时,将实施例2中酶反应体系中的macrolactina替换为chloramphenicol时,30℃温育2h,终止反应后进行hplc检测和hrms分析(图4c,图5,6c)。从ms谱图上看,获得产物[m+k]+为362.2408,[m+na]+为346.1788,分子量与预期目的产物的分子量一致。证实结果同样获得酰化的chloramphenicol。从而证明本发明的酰基转移酶具有很好的应用前景。
序列表
<110>中国海洋大学
<120>一种具有酰基转移功能的酶及其应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>363
<212>prt
<213>人工序列(artificialsequence)
<400>1
metlysglnthrileserasnproalapheaspmetlysglnileasn
151015
alaleuasnglyhistyrglnthrmetileaspasnglyaspleugln
202530
cysalasertyrmetmetserargglyglygluvalphealaalaglu
354045
serleuglygluphethrglyglyglnlysglulysglnthrphegln
505560
leuaspthrilearggluileglyserleuthrlysvalphethrala
65707580
valalavalmetglnleuvalglulysglyleuleuaspleulysmet
859095
provallysleuileleuproalapheasplysproglypheglyglu
100105110
ilelysileleuhisleuleuthrhisthralaglyleuserpheglu
115120125
leuaspileglnlysalagluglyileaspleuthrasnglugluglu
130135140
trpileasntyrleuvalserthrproleuglutyrglyvalaspglu
145150155160
alatrpasntyrserargthrglyphevalileleuglyileileile
165170175
serlysvalthrglyvalsertyrgluglntyrvalthrlyshisile
180185190
ileglualaleuglyleugluargthrtyrphetyrvalproaspthr
195200205
leulysglugluvalcysvalilesergluhisglucysvalglnleu
210215220
glulysserhishisprotyrpheproasnlysalathrserglyleu
225230235240
tyrserserleuargaspiletrplysleualaglumetpheargasn
245250255
lysglyargleulysasplyslysleuleuglyarglysthrvalglu
260265270
alametleuargasnglnilelysproglyleuprophetyrphephe
275280285
glyalaproargglugluglyglypheglyleuglyileasnleutrp
290295300
proalaglyasphistyrphemetthrgluglythrpheserhisleu
305310315320
glymetglytrpcysglymetpheseraspproalagluaspphethr
325330335
tyrvalphephethrproilesergluphehisprohisalavalleu
340345350
thrproleuasnilevaltrpalaglyileglu
355360
<210>2
<211>1092
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgaaacaaacaataagcaatccggcatttgatatgaaacaaattaacgctcttaacggc60
cattatcagacgatgatagacaatggagatctgcaatgtgcgagttatatgatgtcaaga120
ggaggtgaggtttttgcagctgagtcgttaggggaatttaccggcggacaaaaagaaaag180
caaacatttcagcttgatacaatcagagaaatcggttctttgacaaaagtgtttaccgct240
gtagccgtcatgcagctcgtcgaaaaaggtttgctcgatctgaaaatgccggtcaagctc300
attttgccagcgtttgataaaccgggtttcggagaaattaaaattttgcaccttttgact360
catacggcgggattaagttttgagctggatattcaaaaggctgaaggcattgacttaacg420
aatgaggaagaatggataaactatctggtcagtacgcctttggagtacggagtggatgaa480
gcatggaactattccagaaccggctttgttatacttggcatcattatttcaaaagtaaca540
ggcgtatcctacgaacagtatgtaacaaagcatattattgaagcgctcggattagaaaga600
acgtatttttatgtgcctgatactttaaaagaagaagtttgtgtgatcagtgagcacgag660
tgcgtacagctggaaaaaagtcatcacccgtattttccgaataaagcgacaagcggtctg720
tactcttcgttgcgagatatttggaagttagctgaaatgtttagaaataaaggcagattg780
aaagataagaagctgcttggaagaaaaacagtcgaagcgatgctgagaaatcaaataaag840
cccggtcttcctttttacttcttcggagcgcccagagaggaaggcggctttggtttaggc900
attaatttgtggccggccggtgaccattatttcatgacagaaggcaccttctcacatctt960
ggaatgggttggtgcggcatgttttctgatccagccgaagattttacgtatgtatttttc1020
actccgatttccgagtttcatcctcatgccgtgctgacgccgctgaatatcgtgtgggcg1080
ggtattgaataa1092
- 还没有人留言评论。精彩留言会获得点赞!