一种具有抗肿瘤活性的ChrysamideB衍生物及其制备和应用的制作方法
本发明属于药物化学技术领域,具体涉及一种具有抗肿瘤活性的chrysamideb衍生物及其制备和应用。
背景技术:
我国癌症发病率和死亡率的逐年增加,其已成为我国居民死亡的首要原因和主要公共健康问题。随着医疗技术的发展,癌症的药物治疗手段从以前的传统化疗方法发展到今天的免疫疗法、单克隆抗体疗法和基因疗法等,但是传统化疗方法在药物治疗中依然占据主导地位。传统的化学治疗药物都属于细胞毒类药物(顺铂、氮芥类等)。此类药物对正常细胞和肿瘤细胞选择性差,杀伤肿瘤细胞的同时对人体正常代谢细胞也造成了损伤,对人体造成的毒副作用较大,以至于细胞毒类药物在临床上的应用受到了限制。因此,寻找高效、低副作用的新型抗肿瘤药势在必行。
海洋天然产物的研究、开发方兴未艾,其中,抗肿瘤海洋天然产物占很大的比例。海洋独特的地理环境,造就了诸多富卤、富硫、富硝基等典型特殊骨架天然产物。2016年,刘永宏课题组从海洋真菌中分离提取得3个化合物-chrysamidea、chrysamideb、chrysamidec(非专利文献1),结构新颖,含多个手性中心,属于硝基苯反式环氧酰胺二聚体化合物。
非专利文献1:chenj,lij,zhul,etal.totalsynthesisandstructurerevisionofchrysamideborganicchemistryfrontiers,2018,5(23):3402-3405.
技术实现要素:
本发明所要解决的技术问题是针对现有技术中的缺点而提供一种具有抗肿瘤活性的chrysamideb衍生物。
本发明的另一目的是提供上述具有抗肿瘤活性的chrysamideb衍生物的制备方法。
本发明的另一目的是提供上述具有抗肿瘤活性的chrysamideb衍生物的的应用。
为解决本发明的技术问题采用如下技术方案:
一种具有抗肿瘤活性的chrysamideb衍生物,其化学结构式为通式(一)或通式(二)或通式(三),及其立体异构体或药学上可接受的盐、溶剂化物或前药:
其中,波浪线表示手性碳原子的不同手性;
r1或r6为苯环取代基,r1或r6在苯环上的取代位置为苯环上任意位置,取代基数量为单取代或多取代或单取代、多取代的任意组合;
r2为氢原子或是烷基的一种;
r3为烷基链、链烯基、环烃基、杂环基中的一种;
r4为杂原子;
r5为烷基链。
所述r1或r6为-no2、-h、-ch3、-nh2、-cf3、卤素、-so2nh2、-so2nhch3、-so2n(ch3)2、-nhso2ch3、烷氧基、烷基、氢键受体或供体基团中的一种或几种的组合。
所述r3为1-3个碳原子低级烷基链;或2个碳原子的
所述r5为低级烷基链。
所述r5为羟基取代的烷基链。
上述具有抗肿瘤活性的chrysamideb衍生物其结构式为下列的任意一种:
上述具有抗肿瘤活性的chrysamideb衍生物的制备工艺,其特征在于具体如下:
(1)羧酸类化合物ⅵ的合成路线为:
具体操作过程为:
苯甲醛类化合物ⅰ与wittig试剂反应生成化合物ⅱ;
化合物ⅱ经koh水解的羧酸化合物ⅲ;
化合物ⅱ被dibal-h还原得化合物ⅳ;
化合物ⅳ经环氧化或环丙烷化得化合物ⅴ;
化合物ⅴ通过两步连续氧化生成羧酸类化合物ⅵ;
(2)哌嗪类化合物x的合成路线为:
具体操作过程为:
化合物1在缩合剂hatu作用下缩合得二肽2;二肽2脱保护后发生分子内反应生成羰基哌嗪类化合物ⅸ;羰基哌嗪类化合物ⅸ经lialh4还原得哌嗪类化合物ⅹ;
(3)式(二)二聚体类化合物的合成路线如下:
羧酸类化合物ⅲ或羧酸类化合物ⅵ或羧酸类化合物vii与哌嗪类化合物x发生双边酸胺缩合得到式(二)二聚体类化合物;
(4)式(三)二聚体类化合物的合成路线如下:
羧酸类化合物viii与哌嗪类化合物x发生双边酸胺缩合得到式(三)二聚体类化合物;
(5)式(一)单体类化合物的合成路线如下:
羧酸类化合物ⅵ与哌嗪类化合物x发生单边酸胺缩合得式(一)单体类化合物。
所述的具有抗肿瘤活性的chrysamideb衍生物具有抗癌作用,可应用于抗肿瘤药物领域。
所述的具有抗肿瘤活性的chrysamideb衍生物可抑制肿瘤细胞株如hepg2、mgc-803、bgc-823、sgc-7901、ags、a549、mcf-7、hgc-27、hct-116、hl-60等增殖,诱导上述肿瘤细胞株凋亡,阻滞上述肿瘤细胞株的细胞周期。
所述的具有抗肿瘤活性的chrysamideb衍生物用于肾癌、食道癌、膀胱癌、神经母细胞瘤、前列腺癌、胃癌、结肠癌、肺癌、宫颈癌、乳腺癌、肝癌、黑色素瘤、淋巴癌、鼻咽癌、喉癌、胰腺癌、腺样囊性癌、甲状腺癌、白血病等肿瘤的治疗。
本发明以chrysamideb为模版分子,以药物分子优势骨架为核心,一方面,重点围绕关键官能团的替换和整体结构对称性的调整开展修饰工作,以探明该天然产物官能团的必要性和手性中心的专一性,来识别关键药效团,去除非必须的官能团,以此简化结构;另一方面,在上述工作完成后,根据生物电子等排体原理对其中必要官能团进行替换,以期提升药效。总之,为结构简化和提升药效的目的进行修饰改造。为达到上述修饰改造的目的,需要一条简洁高效的路线,而本发明报道的汇聚式的合成路线,可高效简洁批量合成多个chrysamideb衍生物。对chrysamideb衍生物进行抗肿瘤生物活性研究,结果表明,所述化合物具有很好的抗肿瘤活性,具有抗肿瘤药物开发潜力,可以用来制备抗肿瘤药物。此类药物对正常细胞和肿瘤细胞选择性好,选择性优于市场上传统抗肿瘤药物如5-氟脲嘧啶等,对人体造成的毒副作用较小,属于高效、低副作用的新型抗肿瘤药势。
附图说明
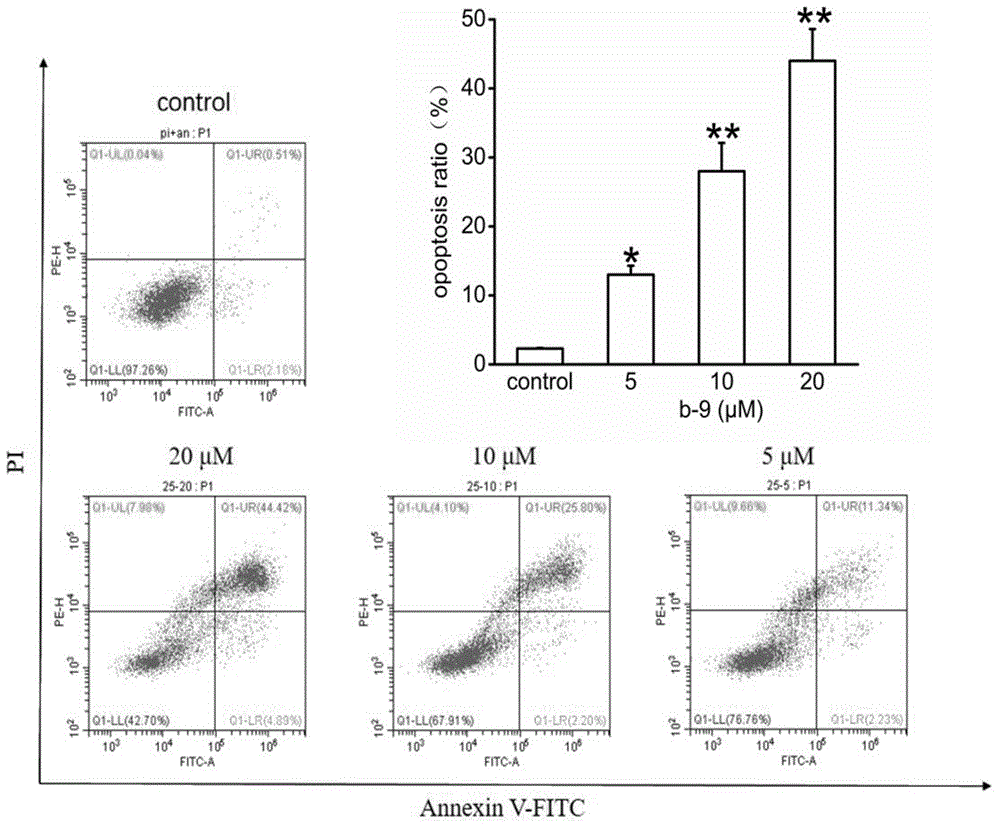
图1为本发明化合物b-9显著升高mgc-803细胞凋亡率,与control组相比较,*p<0.05,**p<0.01;
图2为本发明化合物b-9显著增加mgc-803细胞s期细胞比例,与control组相比较,*p<0.05,***p<0.001;
图3化合物b-9显著抑制低分化胃癌mgc-803细胞中pi3k蛋白的表达,与control组相比较,*p<0.05,**p<0.01。
具体实施方式:
实施例1
羧酸类化合物(ⅲ或ⅵ)的制备路线:
化合物ⅱ的制备:氩气条件下,在250ml反应瓶中,将3g(19.87mmol)苯甲醛(ⅰ)溶于40ml超干二氯甲烷中,冰浴条件下,缓慢加入8.3g(23.84mmol)wittg试剂(methyl2-(triphenylphosphoranylidene)propanoate),室温搅拌12h。经tlc检测反应完全后,用二氯甲烷稀释,加水萃取,收集有机相,用无水硫酸钠干燥后,将其旋干,经硅胶柱层析纯化(v/vpe:ea=15:1)得到淡黄色固体4g,收率92%。同样的合成过程,适用于苯甲醛,3-硝基苯甲醛,2-硝基苯甲醛为起始原料(i),可制备不同硝基位置取代或无取代基的中间体(ii);wittig试剂也可选用methyl2-(triphenyl-l5-phosphaneylidene)acetate,操作过程相同,用于制备中间体(ii)。
化合物ⅲ的制备:在50ml反应瓶中,将500mg(2.26mmol)化合物ⅱ溶于甲醇中,随后加入2ml(2m)koh溶液,室温搅拌30min。经tlc检测反应完全后,加乙酸乙酯稀释,用水萃取,收集水相,再用3mhcl酸化至ph=1-2,加乙酸乙酯萃取,收集有机相,用无水硫酸钠干燥后,过滤,旋干得淡黄色固体444mg,收率95%。
化合物ⅳ的制备:氩气条件下,在100ml反应瓶中,3.5g(15.83mmol)化合物ⅲ溶于30ml超干二氯甲烷中,将反应冷至-78℃,缓慢滴加23.22mldibal-h,搅拌3h。tlc监测反应完全后,滴加10ml饱和酒石酸钠溶液,移至室温,搅拌1h后,加二氯甲烷稀释,加水萃取,收集有机相,将其旋干,并用无水硫酸钠干燥,经硅胶柱层析纯化(v/vpe:ea=3:1)得到淡黄色固体2.75g,收率90%。
化合物ⅴ的制备:(1)、在反应瓶里,将1g(5.18mmol)化合物ⅳ、5g4a分子筛溶于17ml超干二氯甲烷中,将反应冷至-36℃,缓慢加入194mg(0.83mmol)d-(-)-酒石酸二异丙酯、236mg(0.83mmol)钛酸四异丙酯,搅拌30min后,加入2ml(11.40mmol)过氧叔丁醇(5.5mindecane),搅拌1h。经tlc检测反应完全,将反应移至室温,加水淬灭,抽滤并收集有机相,旋干,经硅胶柱层析纯化(v/vpe:ea=3:1)得到环氧化合物((2r,3r)-2-methyl-3-phenyloxiran-2-yl)methanol(白色固体)920mg,收率85%,ee值95%。(2)、在100ml反应瓶里,将1g(5.18mmol)化合物ⅳ、5g4a分子筛溶于25ml超干二氯甲烷中,将反应冷至-36℃,缓慢加入194mg(0.83mmol)l-(-)-酒石酸二异丙酯、236mg(0.83mmol)钛酸四异丙酯,搅拌30min后,加入2ml(11.40mmol)过氧叔丁醇(5.5mindecane),搅拌1h。经tlc检测反应完全,将反应移至室温,加水淬灭,抽滤并收集有机相,旋干,经硅胶柱层析纯化(v/vpe:ea=3:1)得到手性与上述b过程描述完全相反的环氧化合物((2s,3s)-2-methyl-3-phenyloxiran-2-yl)methanol(白色固体)866mg,收率80%,ee值92%。(3)、氩气条件下,在100ml反应瓶里,将3.2g(25.9mmol)二乙基锌、6.7g(25.9mmol)二碘甲烷溶于25ml超干二氯甲烷中,冷至-20℃,缓慢滴入5.18mmol化合物ⅳ的二氯甲烷溶液,搅拌10h。tlc监测反应完全后,用3ml饱和氯化铵淬灭后,加6ml1mhcl,加水稀释,萃取,收集有机相,旋干,干燥,经硅胶柱层析纯化(v/vpe:ea=3:1)得(2-methyl-3-phenyloxiran-2-yl)methanol(无色液体)750mg,收率70%。
化合物ⅵ的制备:在100ml反应瓶中,将1g化合物ⅴ溶于30ml二氯甲烷后,缓慢加入2.1gdmp,搅拌1h。tlc监测反应完全后,加5ml饱和碳酸氢钠和5ml饱和酒石酸钠溶液淬灭反应后,加水稀释,萃取,收集有机相,干燥,旋干,经硅胶层析柱纯化(v/vpe:ea=5:1)得白色固体或液体。将上述产物溶于30ml二氯乙烷中,依次加入1.9g(4.58mmol)硝酸铁(九水)、716mg(4.58mmol)四甲基哌啶氮氧化物、341mg(4.58mmol)氯化钾,搅拌12h。tlc监测反应完全后,加水萃取,收集水相后,加3mhcl调ph至1~2,加乙酸乙酯萃取,收集有机相,无水硫酸钠干燥,过滤,旋干,得白色固体或无色液体,收率为80-90%。
实施例2
2,5-二甲基哌嗪化合物(ⅹ)的制备路线:
化合物2的制备:(1)、在500ml反应瓶中,将5g(35.97mmol)d-丙氨酸甲酯盐酸盐(1)与6.8g(35.97mmol)boc保护d-丙氨酸溶于90mldmf中,将反应瓶移至冰浴,依次加入20.52g(53.96mmol)2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐、15ml(107.91mmol)三乙胺,室温搅拌16h。经tlc检测反应完全,水洗,然后,乙酸乙酯萃取,收集有机相,无水硫酸钠干燥,经硅胶柱层析纯化(v/vpe:ea=3:1)得白色固体8.9g,收率90%。(2)、在500ml反应瓶中,将5g(35.97mmol)l-丙氨酸甲酯盐酸盐(ⅶ)与6.8g(35.97mmol)boc保护l-丙氨酸溶于90mldmf中,将反应瓶移至冰浴,依次加入20.52g(53.96mmol)2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐、15ml(107.91mmol)三乙胺,室温搅拌16h。经tlc检测反应完全,水洗,然后,乙酸乙酯萃取,收集有机相,无水硫酸钠干燥,经硅胶柱层析纯化(v/vpe:ea=3:1)得白色固体9.2g,收率93%。
化合物ⅸ的制备:在250ml反应瓶中,将2g(7.3mmol)化合物ⅷ溶于18ml二氯甲烷中,在冰浴条件下,缓慢加入5.9ml(80.3mmol)三氟乙酸,室温搅拌3h。经tlc检测反应完全,旋干溶剂,得棕色液体,将其重新溶于36ml叔丁醇中,在冰浴条件下,缓慢加入13.35ml(153.3mmol)吗啉,室温搅拌26h。经tlc检测反应完全,旋干,乙酸乙酯稀释后,抽滤,旋干,得白色固体932mg,收率90%。
化合物ⅹ的制备:在250ml反应瓶中,将1g(7.04mmol)化合物ⅸ溶于28ml无水四氢呋喃中,在冰浴条件下,缓慢加入5.61g(147.84mmol)氢化锂铝后,70℃回流12h。经tlc检测反应完全,加水淬灭后,抽滤,旋干得化合物ⅹ710mg,收率90%。
实施例3
式(二)二聚体类化合物的制备:在50ml反应瓶中,将100mg(0.45mmol)(2s,3r)-2-methyl-3-phenyloxirane-2-carboxylicacid(ⅵ)与20mg(0.18mmol)(2s,5s)-2,5-dimethylpiperazine(ⅸ)溶于2mldmf中,随后,依次加入104mg(0.54mmol)1-(3-二甲胺基丙基)-3-乙基碳二亚胺盐酸盐、73mg(0.54mmol)1-羟基苯并三唑、0.19ml(1.08mmol)三乙胺,室温搅拌16h。经tlc检测反应完全,水洗,收集有机相,无水硫酸钠干燥,旋干,经硅胶柱层析纯化(v/vpe:ea=1:1)得白色固体chrysamidesb75mg,收率80%。在50ml反应瓶中,将100mg(0.48mmol)(z)-2-methyl-3-(4-nitrophenyl)acrylicacid(ⅲ)与20mg(0.18mmol)(2s,5s)-2,5-dimethylpiperazine(ⅸ)溶于2mldmf中,随后,依次加入104mg(0.54mmol)1-(3-二甲胺基丙基)-3-乙基碳二亚胺盐酸盐、73mg(0.54mmol)1-羟基苯并三唑、0.19ml(1.08mmol)三乙胺,室温搅拌16h。经tlc检测反应完全,水洗,收集有机相,无水硫酸钠干燥,旋干,经硅胶柱层析纯化(v/vpe:ea=1:1)得白色固体chrysamidesb85mg,收率90%。
当r1=-nh2、-cf3、-och3、-oh、-x、m-no2和o-no2;r2=-h、-ch3;r3=-o-、-ch2-;化合物ⅵ与化合物ⅹ变换时的二聚体化合物的制备同例3。
在50ml反应瓶中,将100mg(0.45mmol)(2s,3r)-2-methyl-3-phenyloxirane-2-carboxylicacid(ⅵ)与20mg(0.18mmol)(2s,5s)-2,5-dimethylpiperazine(ⅸ)溶于2mldmf中,随后,依次加入104mg(0.54mmol)1-(3-二甲胺基丙基)-3-乙基碳二亚胺盐酸盐、73mg(0.54mmol)1-羟基苯并三唑、0.19ml(1.08mmol)三乙胺,室温搅拌16h。经tlc检测反应完全,水洗,收集有机相,无水硫酸钠干燥,旋干,经硅胶柱层析纯化(v/vpe:ea=1:1)得白色固体chrysamidesb75mg,收率80%。在50ml反应瓶中,将100mg(0.48mmol)(z)-2-methyl-3-(4-nitrophenyl)acrylicacid(ⅲ)与20mg(0.18mmol)(2s,5s)-2,5-dimethylpiperazine(ⅸ)溶于2mldmf中,随后,依次加入104mg(0.54mmol)1-(3-二甲胺基丙基)-3-乙基碳二亚胺盐酸盐、73mg(0.54mmol)1-羟基苯并三唑、0.19ml(1.08mmol)三乙胺,室温搅拌16h。经tlc检测反应完全,水洗,收集有机相,无水硫酸钠干燥,旋干,经硅胶柱层析纯化(v/vpe:ea=1:1)得白色固体chrysamidesb85mg,收率90%。
该实施例方法也适用于vii与x的缩合,得到式(二)化合物xii。r1或r6为-no2、-h、-ch3、-nh2、-cf3、卤素、-so2nh2、-so2nhch3、-so2n(ch3)2、-nhso2ch3、烷氧基、烷基、氢键受体或供体基团中的一种或几种的组合,r1或r6在苯环上的取代位置为苯环上任意位置,取代基数量为单取代或多取代或单取代、多取代的任意组合;r3为烷基链、链烯基、环烃基、杂环基中的一种;r4为杂原子,如氧原子;
该实施例方法也适用于viii与x的缩合,得到式(三)化合物xii。
实施例4
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-2-methyl-3-(4-nitrophenyl)-oxiran-2-yl)methanone)(ab-1):(2s,3r)-2-methyl-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到ab-1为目标产物。[α]d24.7=+120.690(c:0.290,chloroform)1hnmr(400mhz,cdcl3)δ8.26(d,j=8.6hz,4h),7.53(d,j=8.5hz,4h),4.45(s,2h),4.28(s,4h),3.32–3.12(m,2h),1.31(s,6h),1.25(s,6h).13cnmr(101mhz,cdcl3)δ168.98,148.16,141.43,127.75,123.90,63.90,62.13,50.07,44.08,16.13,15.16.lc-ms(esi+)m/z547.2(mna+).
实施例5
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-2-methyl-3-(4-nitrophenyl)-oxiran-2-yl)methanone)(ab-2):
(2s,3r)-2-methyl-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到ab-2为目标产物。[α]d24.7=-157.45(c:0.470,chloroform).1hnmr(400mhz,cdcl3)δ8.24(d,j=8.5hz,4h),7.52(d,j=8.6hz,4h),4.45(s,2h),4.22(s,4h),3.06(s,1h),1.40–1.12(m,13h).13cnmr(101mhz,cdcl3)δ168.66,147.90,141.60,127.66,123.63,63.85,61.68,50.33,43.78,15.38,15.07.lc-ms(esi+)m/z547.2(mna+).
实施例6
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-2-methyl-3-(4-nitro-phenyl)oxiran-2-yl)methanone)(ab-3):(2r,3s)-2-methyl-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到ab-3为目标产物。[α]d25.2=-121.43(c:0.280,chloroform).1hnmr(400mhz,cdcl3)δ8.26(d,j=8.6hz,4h),7.52(d,j=8.5hz,4h),4.44(brs,2h),4.27(s,4h),3.32–3.10(m,2h),1.31(s,6h),1.28–1.15(m,6h).13cnmr(101mhz,cdcl3)δ168.97,148.18,141.44,127.76,123.92,63.93,62.15,50.06,44.09,16.16,15.18.lc-ms(esi+)m/z547.2(mna+).
实施例7
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-2-methyl-3-(4-nitro-phenyl)oxiran-2-yl)methanone)(ab-4):(2r,3s)-2-methyl-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到ab-4为目标产物。[α]d24.6=+147.170(c:0.530,chloroform).1hnmr(400mhz,cdcl3)δ8.24(d,j=8.6hz,4h),7.52(d,j=8.6hz,4h),4.45(brs,2h),4.22(overlap,4h),3.06(brs,1h),2.58(brs,1h),1.36–1.13(m,12h).13cnmr(101mhz,cdcl3)δ168.74,148.00,141.61,127.72,123.72,63.93,61.79,50.38,43.83,15.46,15.17.lc-ms(esi+)m/z547.2(mna+).
实施例8
piperazine-1,4-diylbis(((2s,3r)-2-methyl-3-(4-nitrophenyl)oxiran-2-yl)-methanone)(a-1)
(2s,3r)-2-methyl-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,piperazine做为中间体x,实施过程同xi。此实施例得到a-1为目标产物。[α]d25.3=-26.667(c:0.150,chloroform).1hnmr(400mhz,cdcl3)δ8.27(d,j=8.7hz,4h),7.54(d,j=8.6hz,4h),4.31(d,j=8.6hz,2h),4.11–3.96(m,2h),3.84–3.67(m,4h),3.61(d,j=10.6hz,1h),3.33(d,j=9.7hz,1h),1.32(s,6h).13cnmr(101mhz,cdcl3)δ167.63,147.58,141.76,128.16,123.81,62.99,60.82,45.13,41.52,14.43.lc-ms(esi+)m/z519.1(mna+).
实施例9
piperazine-1,4-diylbis(((2r,3s)-2-methyl-3-(4-nitrophenyl)oxiran-2-yl)-methanone)(a-2)
(2r,3s)-2-methyl-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,piperazine做为中间体x,实施过程同xi。[α]d24.5=+56.000(c:0.250,chloroform).此实施例得到a-2为目标产物。1hnmr(400mhz,cdcl3)δ8.26(d,j=8.7hz,4h),7.54(d,j=8.6hz,4h),4.31(d,j=8.9hz,2h),4.03(dd,j=21.0,9.8hz,2h),3.85–3.67(m,4h),3.61(d,j=10.0hz,1h),3.32(d,j=9.8hz,1h),1.31(s,6h).13cnmr(101mhz,cdcl3)δ168.39,148.20,141.44,127.78,123.91,64.02,62.08,45.91,42.53,15.27.lc-ms(esi+)m/z519.1(mna+).
实施例10
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis((1-methyl-2-(4-nitrophenyl)cyclo-propyl)methanone)(b-1):
1-methyl-2-(4-nitrophenyl)cyclopropane-1-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到b-1为目标产物。[α]d24.3=+190.698(c:0.430,chloroform).1hnmr(400mhz,cdcl3)δ8.26–8.13(m,4h),7.44–7.30(m,4h),4.52–4.29(m,2h),4.16(dd,j=14.4,6.6hz,1h),4.00(dd,j=14.1,6.4hz,1h),3.19–2.97(m,2h),2.70–2.50(m,2h),1.59–1.54(m,1h),1.29–1.16(m,9h),1.06(d,j=5.8hz,4h),1.02(s,2h).13cnmr(101mhz,cdcl3)δ173.11,147.02,146.99,145.61,145.33,145.27,129.83,129.44,129.39,123.93,123.91,123.79,49.92,49.85,49.63,44.62,29.22,28.68,27.77,27.73,27.15,17.77,17.70,17.68,17.12,16.54,16.46,16.19.lc-ms(esi+)m/z543.2(mna+)。
实施例11
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis((1-methyl-2-(4-nitrophenyl)-cyclopropyl)methanone)(b-2)
1-methyl-2-(4-nitrophenyl)cyclopropane-1-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到b-2为目标产物。[α]d24.4=-81.308(c:1.070,chloroform)1hnmr(400mhz,cdcl3)δ8.26–8.13(m,4h),7.44–7.29(m,4h),4.52–4.29(m,2h),4.23–4.09(m,1h),4.09–3.94(m,1h),3.19–2.97(m,2h),2.70–2.50(m,2h),1.59–1.55(m,1h),1.29–1.16(m,9h),1.06(d,j=5.8hz,4h),1.02(s,2h).13cnmr(101mhz,cdcl3)δ173.11,147.03,147.00,145.61,145.33,145.28,129.83,129.44,129.39,123.92,123.90,123.79,49.92,49.85,49.63,44.76,29.22,29.16,28.68,27.78,27.74,17.78,17.71,17.68,17.11,16.54,16.46.lc-ms(esi+)m/z543.2(mna+).
实施例12
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-2-methyl-3-phenyl-oxiran-2-yl)methanone)(c-1)
(2s,3r)-2-methyl-3-phenyloxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-1为目标产物。[α]d25.1=+39.216(c:2.550,chloroform).1hnmr(400mhz,cdcl3)δ7.41–7.27(m,10h),4.46(brs,2h),4.35–4.09(m,4h),3.28–3.08(m,2h),1.30(s,6h),1.22(d,j=4.8hz,6h).13cnmr(101mhz,cdcl3)δ169.73,133.99,128.55,128.44,126.66,63.25,62.71,49.78,44.09,16.11,14.97.lc-ms(esi+)m/z457.2(mna+)。
实施例13
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-2-methyl-3-phenyl-oxiran-2-yl)methanone)(c-2)
(2s,3r)-2-methyl-3-phenyloxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-2为目标产物。[α]d25.3=-163.49(c:0.630,chloroform).1hnmr(400mhz,cdcl3)δ7.42–7.27(m,10h),4.46(brs,2h),4.36–3.95(m,4h),3.03(brs,1h),2.53(brs,1h),1.44–1.05(m,12h).13cnmr(101mhz,cdcl3)δ169.40,133.93,128.26,128.13,128.01,126.46,63.13,62.25,49.91,43.67,15.33,14.84.lc-ms(esi+)m/z457.2(mna+)。
实施例14
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-2-methyl-3-phenyl-oxiran-2-yl)methanone)(c-3)
(2r,3s)-2-methyl-3-phenyloxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-di-methy-piperazine做为中间体x,实施过程同xi。此实施例得到c-3为目标产物。[α]d25.2=-109.52(c:0.630,chloroform).1hnmr(400mhz,cdcl3))δ7.42–7.27(m,10h),4.46(brs,2h),4.37–4.11(m,4h),3.31–3.07(m,2h),1.31(s,6h),1.22(d,j=4.7hz,6h).13cnmr(101mhz,cdcl3)δ169.67,133.92,128.49,128.39,126.60,63.16,62.62,49.72,44.03,16.04,14.90.lc-ms(esi+)m/z457.2(mna+)。
实施例15
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-2-methyl-3-phenyl-oxiran-2-yl)methanone)(c-4)
(2r,3s)-2-methyl-3-phenyloxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-4为目标产物。[α]d25.0=+61.053(c:2.850,chloroform).1hnmr(400mhz,cdcl3)δ7.40–7.27(m,10h),4.45(brs,2h),4.16(overlap,4h),3.05(brs,1h),2.53(brs,1h),1.48–1.06(m,12h).13cnmr(101mhz,cdcl3)δ169.61,134.21,128.55,128.42,128.30,126.74,126.66,63.40,62.50,50.28,43.90,15.55,15.12.lc-ms(esi+)m/z457.2(mna+)。
实施例16
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-2-methyl-3-(2-nitro-phenyl)oxiran-2-yl)methanone)(c-5)
(2s,3r)-2-methyl-3-(2-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-5为目标产物。[α]d24.8=+132.961(c:0.895,chloroform).1hnmr(300mhz,cdcl3)δ8.23–8.13(m,2h),7.74–7.65(m,2h),7.64–7.57(m,2h),7.57–7.48(m,2h),4.67(d,j=13.0hz,2h),4.60(s,1h),4.55–4.42(m,2h),4.40–4.26(m,1h),4.24–4.09(m,1h),3.26–2.97(m,2h),1.32–1.14(m,12h).13cnmr(101mhz,cdcl3)δ13cnmr(101mhz,cdcl3)δ168.51,147.98,133.99,131.12,129.74,129.46,125.17,63.89,63.64,61.56,61.25,44.25,15.69.lc-ms(esi+)m/z547.2(mna+)。
实施例17
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-2-methyl-3-(2-nitro-phenyl)oxiran-2-yl)methanone)(c-6)
(2s,3r)-2-methyl-3-(2-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-6为目标产物。[α]d24.9=-100.00(c:0.910,chloroform).1hnmr(400mhz,cdcl3)δ8.25–8.15(m,2h),7.74–7.66(m,2h),7.65–7.58(m,2h),7.57–7.49(m,2h),4.76–4.59(m,2h),4.58–4.41(m,2h),4.34(s,1h),4.26–4.11(m,1h),3.29–2.93(m,2h),1.31–1.17(m,12h).13cnmr(101mhz,cdcl3)δ168.60,148.00,134.00,131.14,129.76,129.47,129.41,125.19,63.66,61.58,50.57,44.10,15.68.lc-ms(esi+)m/z547.2(mna+)。
实施例18
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-2-methyl-3-(3-nitro-phenyl)oxiran-2-yl)methanone)(c-7)
(2s,3r)-2-methyl-3-(3-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-7为目标产物。[α]d25.1=+115.951(c:1.630,chloroform).1hnmr(400mhz,cdcl3)δ8.24–8.11(m,4h),7.69(d,j=7.6hz,2h),7.62–7.51(m,2h),4.46(brs,2h),4.28(overlap,4h),3.30–3.01(m,2h),1.41–1.10(m,12h).13cnmr(101mhz,cdcl3)δ168.71,148.28,148.24,136.37,136.21,132.68,132.58,129.49,129.42,123.27,123.20,121.50,63.56,61.62,49.81,43.81,15.05,14.85.lc-ms(esi+)m/z547.2(mna+)。
实施例19
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-2-methyl-3-(3-nitro-phenyl)oxiran-2-yl)methanone)(c-8)
(2r,3s)-2-methyl-3-(3-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-8为目标产物。[α]d24.9=+121.481(c:1.350,chloroform).1hnmr(400mhz,cdcl3)δ8.24–8.14(m,4h),7.70(d,j=7.7hz,2h),7.56(t,j=7.9hz,2h),4.46(brs,2h),4.22(overlap,4h),3.07(s,1h),2.55(s,1h),1.44–1.10(m,12h).13cnmr(101mhz,cdcl3)δ168.66,147.90,141.60,127.66,123.63,63.85,61.68,50.33,43.78,15.38,15.07.lc-ms(esi+)m/z547.2(mna+)。
实施例20
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-2-methyl-3-(3-nitro-phenyl)oxiran-2-yl)methanone)(c-9)
(2r,3s)-2-methyl-3-(3-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到c-9为目标产物。[α]d24.7=-101.82(c:1.100,chloroform).1hnmr(400mhz,cdcl3)δ8.26(d,j=8.7hz,4h),7.54(d,j=8.6hz,4h),4.31(d,j=8.9hz,2h),4.03(dd,j=21.0,9.8hz,2h),3.85–3.67(m,4h),3.61(d,j=10.0hz,1h),3.32(d,j=9.8hz,1h),1.31(s,6h).13cnmr(101mhz,cdcl3)δ168.77,148.34,136.26,132.64,129.55,123.33,121.55,63.56,61.69,49.88,43.89,15.90,14.92.lc-ms(esi+)m/z547.2(mna+).
实施例21
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-3-(4-nitrophenyl)-oxiran-2-yl)methanone)(r-1)
(2s,3r)-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到r-1为目标产物。[α]d24.1=+200.000(c:0.410,chloroform).1hnmr(400mhz,cdcl3)δ8.21(d,j=6.9hz,4h),7.57–7.42(m,4h),4.71–4.43(m,2h),4.38–4.14(m,3h),4.05(dd,j=14.3,6.1hz,1h),3.72–3.46(m,2h),3.30–2.95(m,1h),2.86–2.58(m,1h),1.25–1.09(m,6h).13cnmr(101mhz,cdcl3)13cnmr(101mhz,cdcl3)δ165.93,148.50,142.83,126.79,124.30,57.32,50.07,44.05,41.15,18.93.lc-ms(esi+)m/z519.2(mna+).
实施例22
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2s,3r)-3-(4-nitrophenyl)-oxiran-2-yl)methanone)(r-2)
(2s,3r)-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到r-2为目标产物。[α]d24.2=-3.125(c:0.320,chloroform).1hnmr(400mhz,cdcl3)δ8.21(d,j=8.0hz,4h),7.50(s,4h),4.48(brs,2h),4.36–3.98(m,4h),3.67–3.43(m,2h),3.13(s,1h),2.67(s,1h),1.50–1.08(m,6h).13cnmr(101mhz,cdcl3)13cnmr(101mhz,cdcl3)δ164.87,148.23,142.94,126.81,124.05,56.94,50.56,49.62,43.85,41.27,15.64.lc-ms(esi+)m/z519.2(mna+).
实施例23
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-3-(4-nitrophenyl)-oxi-ran-2-yl)methanone)(r-3)
(2r,3s)-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到r-3为目标产物。[α]d24.3=-196.67(c:0.300,chloroform).1hnmr(400mhz,cdcl3)δ8.28–8.12(m,4h),7.55–7.43(m,4h),4.65(dd,j=13.7,6.3hz,1h),4.51(s,1h),4.40–4.15(m,3h),4.05(dd,j=14.4,6.2hz,1h),3.70–3.53(m,2h),3.28–3.08(m,1h),2.86–2.67(m,1h),1.26–1.07(m,6h).13cnmr(101mhz,cdcl3)δ165.92,148.44,142.85,126.79,124.26,56.87,50.31,44.03,41.12,18.91.lc-ms(esi+)m/z519.2(mna+)。
实施例24
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(((2r,3s)-3-(4-nitrophenyl)-oxi-ran-2-yl)methanone)(r-4)
(2r,3s)-3-(4-nitrophenyl)oxirane-2-carboxylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到r-4为目标产物。[α]d24.3=-6.061(c:0.330,chloroform).1hnmr(400mhz,cdcl3)δ8.19(d,j=7.7hz,4h),7.50(s,4h),4.53(brs,j=55.4hz,2h),4.36–3.94(m,4h),3.67–3.41(m,2h),3.12(s,1h),2.67(s,1h),1.26(d,j=42.6hz,6h).13cnmr(101mhz,cdcl3)δ164.90,148.41,142.98,126.85,124.20,56.95,49.66,43.86,41.38,15.73.lc-ms(esi+)m/z519.2(mna+)。
实施例25
(2e,2'e)-1,1'-((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(2-methyl-3-(4-nitrophenyl)prop-2-en-1-one)(s-1)
(e)-2-methyl-3-(4-nitrophenyl)acrylicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到s-1为目标产物。[α]d24.4=+170.000(c:0.200,chloroform)1hnmr(300mhz,cdcl3)δ8.27–8.18(m,4h),7.51–7.42(m,4h),6.57(s,2h),4.50–4.29(m,2h),4.18–4.00(m,2h),3.10–2.88(m,2h),2.14(d,j=1.6hz,6h),1.24(d,j=6.2hz,6h).13cnmr(75mhz,cdcl3)δ172.85,147.14,142.38,137.10,129.99,127.82,124.01,50.02,16.72,16.64.lc-ms(esi+)m/z515.2(mna+)。
实施例26
(2e,2'e)-1,1'-((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(2-methyl-3-(4-nitrophenyl)prop-2-en-1-one)(s-2)
(e)-2-methyl-3-(4-nitrophenyl)acrylicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到s-2为目标产物。[α]d24.5=-200.00(c:0.330,chloroform).1hnmr(400mhz,cdcl3)δ8.23(d,j=8.6hz,4h),7.47(d,j=8.7hz,4h),6.57(s,2h),4.49–4.32(m,2h),4.17–3.99(m,2h),3.12–2.88(m,2h),2.14(d,j=1.5hz,6h),1.24(d,j=6.2hz,6h).13cnmr(101mhz,cdcl3)13cnmr(101mhz,cdcl3)δ172.83,147.15,142.39,137.11,129.99,127.82,124.01,50.01,16.72,16.64.lc-ms(esi+)m/z515.2(mna+)。
实施例27
1,1'-((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis(3-(4-nitrophenyl)propan-1-one)(s-3)
3-(4-nitrophenyl)propanoicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到s-3为目标产物。[α]d24.8=+117.647(c:0.340,chloroform).1hnmr(400mhz,cdcl3)δ8.12(d,j=8.6hz,4h),7.36(d,j=8.4hz,4h),4.57(s,1h),4.35(s,1h),3.91(s,1h),3.75–3.55(m,1h),3.16–2.86(m,5h),2.72–2.43(m,5h),1.10(s,6h).13cnmr(101mhz,cdcl3)δ170.23,149.27,146.77,129.57,123.97,49.34,44.65,34.76,31.01,15.95.lc-ms(esi+)m/z491.2(mna+)。
实施例28
1,1'-((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis(3-(4-nitrophenyl)propan-1-one)(s-4)
3-(4-nitrophenyl)propanoicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到s-4为目标产物。[α]d24.6=-152.94(c:0.340,chloroform).1hnmr(400mhz,cdcl3)δ8.12(d,j=8.4hz,4h),7.35(d,j=8.3hz,4h),4.55(s,1h),4.35(s,1h),3.85(s,1h),3.74–3.55(m,1h),3.16–2.89(m,5h),2.73–2.43(m,5h),1.10(s,6h).13cnmr(101mhz,cdcl3)δ170.20,149.26,146.79,129.57,123.98,53.70,49.34,34.76,31.03,15.99.lc-ms(esi+)m/z491.2(mna+)。
实施例29
((2s,5s)-2,5-dimethylpiperazine-1,4-diyl)bis((4-nitrophenyl)methanone)(s-5)
4-nitrobenzoicacid做为中间体vi,(2s,5s)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到s-5为目标产物。[α]d25.2=+248.485(c:0.660,chloroform).1hnmr(400mhz,cdcl3)δ8.36–8.28(m,4h),7.63–7.55(m,4h),4.43(s,2h),3.74(s,2h),3.21–2.96(m,2h),1.20(d,j=6.2hz,6h).13cnmr(75mhz,cdcl3)δ169.33,148.92,141.92,128.01,124.45,50.22,16.38.lc-ms(esi+)m/z435.1(mna+)。
实施例30
((2r,5r)-2,5-dimethylpiperazine-1,4-diyl)bis((4-nitrophenyl)methanone)(s-6)
4-nitrobenzoicacid做为中间体vi,(2r,5r)-2,5-dimethylpiperazine做为中间体x,实施过程同xi。此实施例得到s-6为目标产物。[α]d25.3=-263.08(c:0.650,chloroform).1hnmr(400mhz,cdcl3)δ8.32(d,j=8.7hz,4h),7.59(d,j=8.6hz,4h),4.43(s,2h),3.76(s,2h),3.22–2.97(m,2h),1.20(d,j=6.2hz,6h).13cnmr(75mhz,cdcl3)δ169.33,148.92,141.92,128.01,124.45,50.19,16.37.lc-ms(esi+)m/z435.1(mna+)。
实施例31
单体类化合物(ⅻ)的制备:
在50ml反应瓶中,将100mg(0.45mmol)(2s,3r)-2-methyl-3-phenyloxirane-2-carboxylicacid(ⅵ)与40mg(0.36mmol)(2s,5s)-2,5-dimethylpiperazine(ⅹ)溶于2mldmf中,随后,依次加入52mg(0.27mmol)1-(3-二甲胺基丙基)-3-乙基碳二亚胺盐酸盐、73mg(0.27mmol)1-羟基苯并三唑、0.1ml(0.54mmol)三乙胺,室温搅拌16h。经tlc检测反应完全,水洗,收集有机相,无水硫酸钠干燥,旋干,经硅胶柱层析纯化(v/vdcm:meoh=30:1)得淡黄色色固体((2s,5s)-2,5-dimethylpiperazin-1-yl)((2s,3r)-2-methyl-3-(4-nitrophenyl)oxiran-2-yl)methanone75mg,收率80%。
当r5=-ch3、-ch2ch20tbs时;化合物ⅵ与化合物ⅹ变换时的单体化合物的制备同例4。
实施例32
(4-(2-hydroxyethyl)piperazin-1-yl)((2s,3r)-2-methyl-3-(4-nitrophenyl)-oxiran-2-yl)methanone(d-1):[α]d24.9=-22.120(c:1.085,chloroform)1hnmr(400mhz,cdcl3)δ8.24(d,j=8.7hz,2h),7.52(d,j=8.5hz,2h),4.27(s,1h),3.85–3.74(m,1h),3.72–3.55(m,5h),2.65–2.54(m,5h),2.41(s,1h),1.28(s,3h).13cnmr(101mhz,cdcl3)δ168.03,148.09,141.78,127.75,123.84,63.95,61.93,59.62,58.12,53.43,52.74,45.63,42.22,15.23.lc-ms(esi+)m/z358.1(mna+)。
实施例33
肿瘤细胞增殖抑制试验
精密称定目标化合物,分别稀释至浓度为100mmol/l作为母液,过滤除菌,4℃密封保存备用。
预先培养各种肿瘤细胞(hepg2、mgc-803、bgc-823、sgc-7901、ags、a549、mcf-7、hgc-27、hct116、hl-60)或正常细胞(ges-1)生长至对数生长期,再把对数生长期的贴壁细胞用胰蛋白酶消化液消化后(悬浮细胞不需要消化),每孔100μl细胞悬浮液,每孔1000-10000个细胞,接种于96孔板中,周围一圈孔加入100μl的pbs缓冲液;
37℃细胞培养箱(5%co2,90%h2o)中培养至细胞贴壁;之后加入含待测目标化合物的培养液,实验组加入按浓度梯度稀释(终浓度为100、50、25、12.5、6.25μmol/l)的待测化合物,每孔加入100μl的待测样品,每个浓度均设置三个平行对照孔;阳性对照组加入同体积同浓度梯度的5-fu溶液,空白对照组加入100μl培养液,继续培养72h;
每孔加入10μl的mtt溶液,继续培养4h;之后终止培养,吸去孔内培养液;
每孔加入150μl的dmso,震荡使结晶甲瓒充分溶解(悬浮细胞用三联液溶解,放置12h左右);
置于酶标仪中570nm下测定吸光度值,根据公式计算出目标化合物的抑制率,再用软件计算出ic50的值。结果见表1和表2。
表1chrysamideb及其衍生物对5株胃癌细胞(hgc-27、mgc-803、bgc-823、sgc-7901、ags)的抑制活性(ic50)
表2chrysamideb及其衍生物对肝癌细胞(hepg2)、乳腺癌细胞(mcf-7)、结肠癌细胞(hct-116)、血癌细胞(hl-60)及肺癌细胞(a549)的抑制活性(ic50)
实施例34
annexinv/pi检测细胞凋亡率
基于上述结果,优选化合物b-9,以胃癌细胞mgc-803作为细胞模型,进行诱导所选化合物诱导凋亡实验测试。细胞培养至对数生长期,胰酶消化,接种在6孔板中,每孔约有细胞5×105个,继续培养至贴壁,将化合物配置成三个浓度梯度(5、10、20μmol·l-1)的溶液加入六孔板中,继续培养48h。之后,离心(1000r/min,5min)小心吸去上清液,用pbs重悬洗涤两次后,各样本加入bindingbuffer100μl,空白细胞设置阴性对照、annexinv-fitc/pi单染对照,其余加annexinv-fitc(5μl)和pi(10μl)。避光培养15min后,用流式细胞仪进行检测。结果见图1,由图可见所选化合物均有不同程度诱导肿瘤细胞凋亡。
实施例35
先将mgc-803细胞培养至对数生长期,再接种在6孔板中,每孔约有细胞5×105个,继续培养至细胞贴壁,将化合物b-9配置成三个浓度梯度(5、10、20μmol·l-1)的溶液加入六孔板中,继续培养48h。之后,离心(1000r/min,5min)小心吸弃上清液,用pbs重悬洗涤两次后,再加入-20℃预冷的70%乙醇1ml,置于4℃固定过夜;离心弃除乙醇,用pbs洗涤2次。加入200μlpbs,10μlpi避光培养30分钟,用流式细胞仪检测。结果见图2。所选化合物均有不同程度阻滞肿瘤细胞周期的作用。
实施例36
westernblot法测定pi3k蛋白表达
(1)制样:mgc-803细胞接种于6孔板中,37℃、5%co2培养箱中培养过夜后,用化合物b-9(5、10、20μmol·l-1)作用24h,之后用pbs洗细胞2次,使用索莱宝高效ripa裂解液300μl于冰上裂解10min,收集样品,样品液加sds-page蛋白上样缓冲液(5×),涡旋混匀后于95℃水浴中变性10min,冷却后置于-20℃待测。
(2)制胶:用保鲜膜密封凝胶玻璃板,根据待测蛋白分子量大小配制相应浓度的sds-page分离胶和浓缩胶,之后插入梳子,向上垂直放置并静置数分钟,充分凝固后拆去保鲜膜和梳子。
(3)上样:将制好的胶板插入电泳槽,每个上样孔加入等体积的样品和marker。在梯度电泳条件下跑电泳。
(4)转印:电泳结束后,剥离凝胶,将0.45μmpvdf膜于甲醇中活化5min,使用湿转转印法电泳槽将分离后的蛋白样品转印至活化后的pvdf膜上。
(5)封闭:待转印结束,将pvdf膜置于5%脱脂奶粉的tbst封闭液中室温封闭1.5h。用tbst缓冲液洗膜3次,各10min。
(6)一抗孵育:将pvdf膜置于适当比例稀释的相应一抗中,于4℃孵育过夜。
(7)二抗孵育:用tbst缓冲液洗膜3次,各10min。加入适当比例稀释的hrp标记的igg二抗,室温摇床孵育1.5h。
(8)化学发光:抗体孵育结束后,再次用tbst缓冲液洗膜3次,各10min。加入ecl化学发光液,采用天能多功能成像仪化学发光模块成像,结果见图3,所选化合物呈浓度依赖性地抑制pi3k蛋白的表达。
- 还没有人留言评论。精彩留言会获得点赞!