一种全悬浮MDCK细胞和利用全悬浮MDCK细胞培养猪流感病毒的方法与流程
本发明属于医学或兽医学
技术领域:
,尤其涉及一种全悬浮mdck细胞和利用全悬浮mdck细胞培养猪流感病毒的方法。
背景技术:
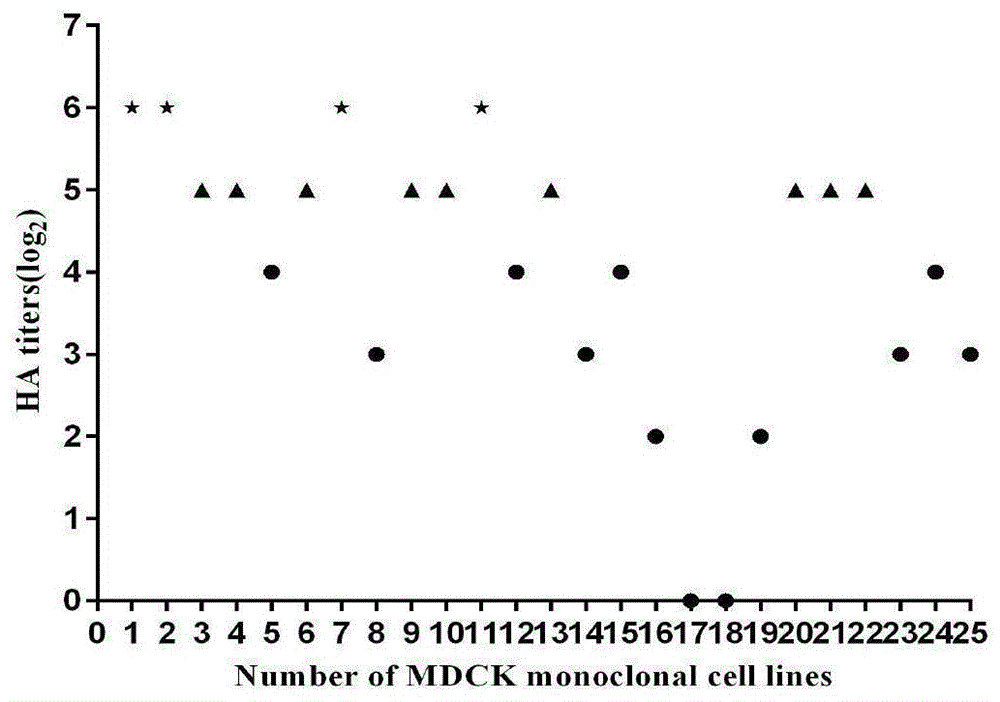
:猪流感(si)是由猪流感病毒(siv)引起的一种猪的急性、热性和高度接触性的呼吸道传染性疾病,临床症状常以轻度呼吸道疾病为主,发病率高,恢复快,死亡病例少见,但由于siv感染而继发其他病原的混合感染往往使病情复杂且加重,严重危害猪群健康,给养殖场造成巨大的经济损失。作为重要的人畜共患病病原体,siv可在人与猪之间传播,对公众健康造成影响。甲型流感病毒对人类威胁极大,上世纪爆发的“西班牙流感”、“亚洲流感”、“香港流感”等大流感流行,造成了数千万人死亡,给人类健康和经济造成了巨大危害和损失。近年来,新发高致病性h5n1禽流感、2009年的甲型h1n1流感和2013年暴发的h7n9禽流感再一次给人们敲响了警钟,流感的防控极其重要。目前,针对流感的治疗还没有有效的药物,疫苗是防控流感爆发经济、有效的手段。由于猪的呼吸道上皮细胞同时存在禽的流感病毒受体和哺乳动物的流感病毒受体,因此,猪被认为是流感病毒的“混合器”,使来自不同宿主物种的流感病毒发生重配进而产生新的流感病毒。si的另一大危害是其与人流感密切相关,上个世纪几次人流感的大暴发都与si有着密不可分的联系。2009年4月引起全球范围爆发的甲型h1n1流感,又一次地突出了“猪”作为中间宿主及其在流感病毒跨种间传播中的重要作用。si除了具有兽医学意义,还具有一定的人类公共卫生学意义。疫苗免疫是防控si的有效措施,其中应用最广泛的是全病毒灭活疫苗,在欧美等发达国家,si灭活疫苗已经应用了数十年。然而当前流感疫苗的生产介质主要是鸡胚,此方法存在诸多缺陷,如生产周期过长、疫情发生时鸡胚供应不足、易引起机体过敏和易致病毒变异等,且鸡胚生产操作繁琐,无法及时有效地应对流感大流行。鉴于siv可能对人类及猪群健康造成的威胁及当前所用疫苗生产存在的局限性,有必要进一步探索疫苗生产的新工艺和新方法,有效保障si的防控和公共卫生安全。技术实现要素:有鉴于此,本发明的目的在于提供一种全悬浮mdck细胞和利用全悬浮mdck细胞培养猪流感病毒的方法,全悬浮mdck细胞能有效地高滴度增殖猪流感病毒,为si疫苗的研发和生产提供良好的培养介质以及为开发si疫苗生产的细胞培养工艺奠定基础。为了实现上述发明目的,本发明提供了以下技术方案:本发明提供了一种全悬浮mdck细胞,所述全悬浮mdck细胞为全悬浮mdck细胞d11-f11-d11;所述全悬浮mdck细胞d11-f11-d11的保藏编号为cctccno:c2019211。本发明还提供了一种利用上述技术方案所述的全悬浮mdck细胞培养猪流感病毒的方法,包括:将上述技术方案所述的全悬浮mdck细胞与猪流感病毒、tpck-胰酶混合,得到混合液,将所述混合液置于33~37℃、5%co2下培养。优选的,所述混合液在细胞摇瓶中培养。优选的,所述全悬浮mdck细胞的接种密度为1.0×106~1.2×107个细胞/ml。优选的,按照公式pfu=moi×全悬浮mdck细胞数量,得出猪流感病毒的数量,所述moi为0.001~0.01。优选的,所述混合液中tpck-胰酶的浓度为1~10μg/ml。优选的,所述混合液中tpck-胰酶的浓度为2~8μg/ml。优选的,所述培养的时间为30~72h。优选的,所述培养的时间为48h。优选的,所述培养的温度为35℃。本发明提供了一种全悬浮mdck细胞,所述全悬浮mdck细胞为全悬浮mdck细胞d11-f11-d11;所述全悬浮mdck细胞d11-f11-d11的保藏编号为cctccno:c2019211。附图说明图1高滴度增殖疫苗株的mdck单克隆细胞株;图2mdck单克隆细胞株表面的α-2,6唾液酸受体丰度;图3细胞悬浮的最佳转速;图4a细胞悬浮进程;图4bmdck单克隆细胞株驯化至不同阶段的密度对比图4cmdck单克隆细胞株驯化至不同阶段的形态对比;图5a每48h更换培养基对细胞生长的影响;图5b不同密度传代对细胞生长的影响;图5cmdck单克隆细胞的传代稳定性;图6mdck单克隆细胞株驯化前后细胞表面的α-2,6唾液酸受体丰度对比;图7病毒感染的最佳细胞密度;图8病毒感染的最佳培养温度;图9病毒的最佳感染剂量;图10病毒感染的最佳tpck-胰酶浓度;图11病毒的最佳收获时间。生物保藏说明全悬浮mdck细胞d11-f11-d11,于2019年9月27日保藏于中国典型培养物保藏中心,地址为中国武汉武汉大学,保藏编号为cctccno:c2019211。猪流感病毒a/swine/liaoning/bx266/2015(h1n1),于2019年9月27日保藏于中国典型培养物保藏中心,地址为中国武汉武汉大学,保藏编号为cctccno:v201961。具体实施方式本发明提供了一种全悬浮mdck细胞,所述全悬浮mdck细胞为全悬浮mdck细胞d11-f11-d11;所述全悬浮mdck细胞d11-f11-d11的保藏编号为cctccno:c2019211。本发明还提供了一种利用上述技术方案所述的全悬浮mdck细胞培养猪流感病毒的方法,包括:将上述技术方案所述的全悬浮mdck细胞与猪流感病毒、tpck-胰酶混合,得到混合液,将所述混合液置于33℃~37℃、5%co2下培养。本发明对所述猪流感病毒的来源没有特殊限定,采用常规即可,在本发明中,所述猪流感病毒优选为a/swine/liaoning/bx266/2015(h1n1)。本发明优选将全悬浮mdck细胞接种于细胞摇瓶中培养,本发明对所述细胞摇瓶的规格没有特殊限定,采用常规培养细胞使用的摇瓶即可。在本发明中,所述全悬浮mdck细胞的接种密度优选为1.0×106个细胞/ml~1.2×107个细胞/ml,具体为1.0×106个细胞/ml、3.0×106个细胞/ml、6.0×106个细胞/ml、9.0×106个细胞/ml和1.2×107个细胞/ml。本发明优选按照公式pfu=moi×全悬浮mdck细胞数量,得出猪流感病毒的数量,所述moi优选为0.001~0.01,具体为0.01、0.005和0.001。在本发明中,所述混合液中tpck-胰酶的浓度优选为1~10μg/ml,具体为1μg/ml、2μg/ml、4μg/ml、5μg/ml、6μg/ml、8μg/ml和10μg/ml。在本发明中,所述tpck-胰酶的作用是专一性地切割精氨酸和赖氨酸位点,流感病毒的ha蛋白在其水解的作用下裂解精氨酸而裂解为ha1和ha2,使流感病毒具有感染性。本发明对所述tpck-胰酶的来源没有特殊限定,采用常规市售产品即可。在本发明中,所述培养的温度优选为35℃。在本发明中,所述培养的时间优选为30~72h。在本发明中,当所述培养的温度为33℃时,在72h时收获病毒;当所述培养的温度为35℃时,在48h时收获病毒。下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。实施例1mdck单克隆细胞株和猪流感疫苗株的筛选1.1mdck单克隆细胞库的建立将贴壁mdck细胞,运用有限稀释法,共经3次亚克隆,获得25个mdck单克隆细胞株,结果见表1。表1mdck单克隆细胞库细胞株编号细胞株名称细胞株编号细胞株名称1d11-c3-e814e8-d12-d32d11-e3-c615h7-f7-d93d11-e3-d416e8-d12-c34e8-d12-a217f7-g3-e105d11-e6-a318f7-g8-e26d11-c3-c819h7-f7-f97d11-f11-d1120e8-d12-d58d11-c3-e921d11-e6-a49h7-f7-g822e8-d12-d210d11-e6-d623g10-b11-d511d11-e6-e324f7-g3-e812d11-e6-c525e11-d2-b1113h7-f7-e111.2si疫苗株的筛选第一步:高免血清的制备。利用spf鸡胚增殖不同基因型的siv,收获尿囊液并用甲醛灭活,制备疫苗后,以2ml/只的剂量免疫spf鸡,2周后心脏采血,分离血清;第二步:抗原交互试验。96孔微量反应板上,从左至右每孔加入50μlpbs,于左侧第一列加入50μl病毒液,按照2倍倍比从左至右稀释至第11孔,第12孔加入红细胞作为阴性对照。每孔加入50μl1%的鸡红细胞,并混匀。室温下静置25-30min观察结果,以能够凝集红细胞的病毒的最高稀释倍数作为病毒的血凝效价。根据ha效价配置4单位抗原,验证4单位抗原,确定4单位抗原配制正确之后,将各毒株的高免血清进行2倍倍比稀释,每孔25μl,加入25μl的4单位抗原,室温作用25-30min。每孔加入25μl的1%鸡红细胞,作用25min后观察结果,以能完全抑制4单位抗原的血清最高稀释倍数作为hi效价。以测得的hi效价进行抗原性比较,筛选出一株具有抗原代表性的毒株a/swine/liaoning/bx266/2015(h1n1bx266),为si疫苗株,结果见表2。表2siv抗原性分析1.3筛选高滴度增殖si疫苗候选毒株的mdck单克隆细胞株将步骤1.2筛选的si疫苗株按照10倍倍比稀释至10-5,以50μl/孔的接种量依次接至每株单克隆细胞株,补加250μl的维持液,置于37℃、5%co2培养箱中感染1h,期间每隔10-15min摇晃一次。弃掉病毒液补加2ml维持液,置于37℃、5%co2培养箱培养。48-72h观察细胞病变并收集细胞上清、测定ha效价,结果见图1。从图1中可以得出,所制备的25株单克隆细胞株中,其中有4株细胞培养病毒的ha效价达26,9株细胞培养病毒ha效价达25,其余细胞株培养病毒的ha效价相对较低。mdck单克隆细胞株表面neuacα2,6gal丰度检测。具体操作方法参考roche地高辛糖苷键分析试剂盒的操作步骤。将生长状态良好的单克隆细胞株消化、计数后,按照3.0×105个细胞/孔铺至12孔板,置于37℃、5%co2培养箱培养。待细胞贴壁后,弃掉细胞上清,用tbs洗3遍,每孔加入500μl的1μg/ml的dig-sna,室温孵育1h。用预冷的tbs洗3遍,每孔加入300μl的20μg/ml的dig-fitc,室温孵育30-45min。预冷的pbs洗3遍,避光放置,于荧光显微镜下检测,结果见图2。从图2中可以得出,在筛选出的能够较高效价增殖病毒的13株细胞表面,都不同程度地分布有α2,6唾液酸受体。实施例2mdck单克隆细胞株的无血清悬浮驯化和病毒培养条件的优化2.1确立mdck单克隆细胞株悬浮驯化的转速。将正常培养于25cm2细胞培养瓶中的贴壁mdck细胞扩大培养至75cm2的细胞培养瓶。将贴壁细胞消化,计数后,按9.0×105个细胞/ml接至125ml的细胞摇瓶中,培养体积为25ml。设置80rpm、100rpm、120rpm、130rpm、135rpm、140rpm、145rpm、150rpm,监测在不同转速下的细胞活力。将最高细胞活力对应的转速确定为细胞悬浮驯化的最佳转速,结果见图3。从图3中可以得出,相比较于其他转速,当转速为140rpm时,细胞活力最高,为98.9%。2.2mdck单克隆细胞株的无血清悬浮驯化将正常培养于25cm2细胞培养瓶中的贴壁细胞扩大培养至75cm2的细胞培养瓶。消化计数后,将每株细胞按照9.0×105个/ml的细胞密度接至125ml的细胞摇瓶中,培养体积为25ml。将摇床转速设置为最佳转速140rpm,置于37℃、5%co2培养箱中培养。每24h取少量细胞悬液经台盼蓝染色后进行计数并监测细胞活力。每48h将培养的细胞转移至50ml离心管中,800rpm离心3-5min,弃掉培养基,用25ml新鲜培养基将细胞重悬。当细胞密度达到4.0×106-5.0×106个细胞/ml时,及时将细胞进行传代,继续按9.0×105个/ml的细胞密度接至125ml的细胞摇瓶中,重复上述步骤。当细胞密度于接种后至72h能达到9.0×106-1.0×107个细胞/ml时,且细胞活力到达96%以上时,细胞驯化基本结束,结果见图4a、图4b和图4c。从图4a、图4b和图4c中可以得出,经过45-48d的连续驯化,其中有4株细胞的细胞密度达到1.0×107个细胞/ml,细胞活力达95%-99.6%。驯化20d的细胞密度比驯化初期(0d)增长了3-4倍;驯化至后期时,5株细胞的细胞密度分别为驯化初期的15.5倍、16倍、17.5倍、8.3倍和10.5倍。由细胞形态来看,随着驯化时间的增长,5株细胞形态逐渐规则,已完全适应无血清单细胞悬浮生长。2.3不同培养条件下悬浮细胞的生长性能的比较为进一步了解悬浮细胞在培养过程中,更换培养基是否对细胞的生长速度和细胞活力产生较大的影响,将每株悬浮细胞分为两组,分别按照9.0×105个/ml的细胞密度培养至两个125ml的细胞摇瓶中,其中一组细胞每隔48h将细胞离心,更换一次新鲜培养基(常规培养mdck的培养基即可),细胞重悬后继续置于37℃、5%co2培养箱中培养;另外一瓶细胞在培养过程中,不更换新鲜培养基。每天吸取少量细胞进行细胞计数和活力监测,从接种细胞开始,持续监测144h,细胞密度采用多重t检验,p<0.05表示统计学差异显著,p<0.01表示差异极显著,结果见图5a。从图5a中可以得出,e8-d12-a2细胞株更换培养基的细胞96h时细胞密度与未更换培养基的细胞密度差异极显著(p<0.001),更换培养基的细胞密度可至少维持144h,细胞活力在96h以后缓慢下降;d11-f11-d11细胞株更换培养基的细胞在72h、96h和120h细胞密度与未更换培养基的细胞密度差异极显著(p<0.01);d11-c3-e8细胞株更换培养基的细胞在96h和120h细胞密度与未更换培养基的细胞密度差异极显著(p<0.001);d11-e6-d6细胞株更换培养基的细胞在120h细胞密度与未更换培养基的细胞密度差异极显著(p<0.001);d11-e6-a4细胞株更换培养基的细胞在72h、96h、和120h细胞密度与未更换培养基的细胞密度差异极显著(p<0.001);不更换培养基的细胞中,e8-d12-a2在96h细胞活力降为0;四株细胞在144h细胞活力均降为0。将每株细胞分别按照起始密度5.0×105个/ml、1.0×106个/ml、1.5×106个/ml和2.0×106个/ml进行培养,置于37℃、5%co2培养箱中培养,每天吸取少量细胞进行细胞计数,连续培养3d,并计算细胞的比生长速率。细胞比生长速率的计算公式为:μ=1/t×ln(ct/c0)结果见图5b。从图5b中可以得出,d11-f11-d11、d11-c3-e8两株细胞以1.0×106个细胞/ml的密度传代时细胞的生长速率最大,分别为0.764和0.641,72h时其最大密度可突破1.0×107个细胞/ml;e8-d12-a2、d11-e6-a4、d11-e6-d6以5.0×105个细胞/ml的密度传代时细胞的生长速率最大,分别为0.808、0.804、0.581。但其最大密度分别只有5.64×106个细胞/ml、5.58×106个细胞/ml和2.86×106个细胞/ml。将刚复苏的细胞定为f0代,待细胞状态稳定后将细胞传代,按照9.0×105个/ml的细胞密度接至125ml的细胞摇瓶中,为f1代。每48h将细胞离心,更换一次新鲜培养基,将细胞悬液转移至新的125ml的细胞摇瓶中,继续培养。每隔24h取少量细胞悬液进行计数并监测细胞活力,细胞密度采用多重t检验,p<0.05表示统计学差异显著,p<0.01表示差异极显著。每72h传代一次。重复上述步骤,一直培养至f15代。分别对f1和f15代细胞进行接毒,比较不同代次细胞的增殖病毒的能力,结果见图5c。从图5c中可以得出,e8-d12-a2和d11-f11-d11从f1代开始,表现出较好的生长性能,且能够持续到f15代;d11-c3-e8的f1代与f5代细胞密度在接种后72h差异极显著(p<0.001);d11-e6-a4和d11-e6-d6从f5代生长性能才有所提高,与f1代相比,72h的细胞密度差异极显著(p<0.01),可以稳定持续到f15代。通过比较每株细胞f1和f15增殖病毒的ha效价,e8-d12-a2和d11-c3-e8的增殖病毒能力不变,增殖病毒的最高ha效价为28,f1代d11-f11-d11和d11-e6-d6增殖病毒的最高ha效价分别为29和28,到f15代,分别为25和24,f1代d11-e6-a4增殖病毒的最高ha效价为29,f15代d11-e6-a4增殖病毒的最高ha效价为28。2.4mdck单克隆细胞株悬浮驯化前后neuacα2,6gal丰度的变化具体操作方法参考roche地高辛糖苷键分析试剂盒的操作步骤,对悬浮前后的细胞表面的neuacα2,6gal丰度进行检测,结果见图6。从图6中可以得出,e8-d12-a2、d11-f11-d11、d11-e6-d6和d11-e6-a4这4株细胞悬浮驯化后,相较于贴壁培养的细胞,悬浮细胞表面的neuacα2,6gal丰度比贴壁mdck细胞有了显著的提高;d11-c3-e8的受体丰度在悬浮驯化前后细胞表面的neuacα2,6gal丰度未出现明显的提高。2.5优化悬浮mdck细胞培养疫苗株的最佳条件从5株已完成驯化的细胞中,选取其中的一株细胞(d11-f11-d11)继续探索能够高效价培养病毒的各种条件:第一步:优化病毒感染的细胞密度。按照mdck细胞无血清悬浮驯化的条件,以9.0×105个mdck细胞/ml的密度接种细胞,将细胞培养至2-3代。待细胞状态稳定后,将细胞同时以9.0×105个细胞/ml的密度传至5个125ml细胞摇瓶中。对细胞进行计数,当细胞密度分别达到1.0×106个细胞/ml、3.0×106个细胞/ml、6.0×106个细胞/ml、9.0×106个细胞/ml和1.2×107个细胞/ml时,将细胞离心,更换新的培养基,并将细胞重悬。根据计数所得的细胞密度,计算摇瓶中的细胞总数,以moi为0.001的感染剂量,按照公式pfu=moi×细胞数量,得出所需猪流感病毒的pfu。将病毒稀释后接至细胞悬液中,并补加工作浓度为2μg/ml的tpck-胰酶。置于35℃、5%co2培养箱中培养。每12h测定一次病毒的ha效价,平行做3次,结果见图7。从图7中可以得出,当细胞密度为6.0×106个细胞/ml时,接毒后48h病毒的ha效价最高,为29。第二步:优化病毒感染的培养温度。以9.0×105个细胞/ml的密度接种细胞,同时传3瓶,置于37℃、5%co2培养箱中培养。细胞计数,待细胞密度长至6.0×106个细胞/ml时,按照moi为0.001的剂量感染病毒,分别将3瓶细胞置于33℃、35℃和37℃、5%co2培养箱中培养。每12h测定一次病毒的ha效价,平行做3次,结果见图8。从图8中可以得出,33℃条件下,ha效价在72h后达到最高,为29;35℃条件下,ha效价在48h后达到最高,为29;37℃条件下,病毒不复制。第三步:优化病毒的感染剂量。以9.0×105个细胞/ml的密度接种细胞,同时传12瓶,置于37℃、5%co2培养箱中培养。细胞计数,待细胞密度长至6.0×106个细胞/ml时,将12瓶细胞分为2组,每组中的6瓶细胞分别以moi为0.05、0.01、0.005、0.001、0.0005和0.0001感染细胞,感染后将其中一组置于33℃、5%co2培养箱中培养,将另外一组置于35℃、5%co2培养箱中培养。每12h测定一次病毒的ha效价,平行做3次,结果见图9。从图9中可以得出,33℃条件下的最佳moi为0.001,35℃条件下的最佳moi为0.001和0.0001。第四步:优化病毒感染的tpck-胰酶的浓度。以9.0×105个细胞/ml的密度接种细胞,同时传16瓶,置于37℃、5%co2培养箱中培养。细胞计数,待细胞密度长至6.0×106个细胞/ml时,将16瓶细胞分为2组,每组中的8瓶细胞分别以tpck-胰酶的浓度0、1μg/ml、2μg/ml、4μg/ml、5μg/ml、6μg/ml、8μg/ml、10μg/ml感染细胞,将其中一组置于33℃、5%co2培养箱中培养,以moi为0.001的剂量接毒,将另外一组置于35℃、5%co2培养箱中培养,以moi为0.0001的剂量接毒。每12h测定一次病毒的ha效价,平行做3次,结果见图10。从图10中可以得出,在33℃和35℃条件下,tpck-胰酶的浓度为2μg/ml时,病毒的ha效价最高,为29。第五步:病毒收获时间。将正常培养的细胞置于37℃、5%co2培养箱中培养,当细胞密度达到6.0×106个细胞/ml时,其中一组细胞以moi为0.0001,tpck-胰酶的浓度为2μg/ml,之后置于35℃、5%co2培养箱中培养;另外一组细胞以moi为0.001,tpck-胰酶的浓度为2μg/ml,之后置于33℃、5%co2培养箱中培养。每12h测定一次病毒的ha效价,平行做3次,结果见图11。从图11中可以得出,33℃和35℃条件下,病毒的最佳收获的时间分别为72h和48h,病毒的效价最高,均为29。本发明提供的mdck全悬浮细胞株易于保存、复苏和培养,培养过程简单,传代操作中不需要胰酶消化,大大提高了生产效率,节约了试验成本;全悬浮细胞株具有生长速度快、密度高和生长性能稳定等优势,能够完全满足培养猪流感病毒的要求;全悬浮细胞株已经完全适应无血清培养,避免了潜在外源性污染的机会,也大大减少了收获病毒后下游的纯化工作;悬浮培养的方式极大地增加了细胞的生长空间,打破了传统贴壁培养中的生长限制,最大限度地增加了细胞密度。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1