大豆粕抗菌肽及其制备方法和用途与流程
本发明属于大豆粕深加工领域,具体涉及一种大豆粕抗菌肽及其制备方法和用途。
背景技术:
抗生素是指对细菌、病毒或者寄生虫等具有一定抑制或者杀灭作用的药物,是由细菌和真菌等微生物或其他高等动物在繁殖过程中产生的具有抗病原体作用的次级代谢产物。自被发现以来,由于能有效治愈各种感染病例,受到广泛应用,在医用治疗领域做出了重大贡献。抗生素除用作人类医用治疗外,在医治动物感染疾病,提高动物免疫力,增进产量,提高经济价值等方面也具有重要贡献。
随着抗生素使用量的日益增长及人类对抗生素的认识不足,出现了抗生素滥用的问题,致使某些致病细菌产生耐药性,使得抗生素失去了其原本杀菌治病功能。此外,由于抗生素的消化吸收率极低,摄入后大部分未被吸收的抗生素会附着在人或动物的尿液或者粪便中排出体外,不仅对环境造成极大的污染,甚至通过大自然循环,最终回到人体内积累,从而危害人类及其它生物的身体健康。
抗菌肽是指某些生物体内自身所带有的或者可以通过自身合成的具有抗菌活性的小分子肽类物质,是生物体内非特异性免疫抵御系统的组成成分,可抵御部分外来病原体的入侵。抗菌肽能够替代抗生素的医用作用,且十分有效,其可通过生物体自身合成,用于抵御外来病原菌,属于自身防御系统内部组分的一种小分子蛋白。抗菌肽来源广泛,目前已从动植物和细菌中发现多种具有抵抗病原菌(细菌、真菌等)功能特性的抗菌肽。
大豆是我国重要农作物之一,其中含有丰富的蛋白质及必需氨基酸。大豆粕是生产大豆油的副产品,研究表明大豆粕经过发酵后可用于制备提取大豆生物活性肽,能够显著增加大豆粕的附加值,可应用于食品和保健等行业,拥有很好的发展前景。
技术实现要素:
本发明的首要目的在于提供一种利用大豆粕制备抗菌活性多肽的方法。该方法主要是利用微生物液态发酵大豆粕,促其释放抗菌活性肽,再通过乙醇分级分离,调控大豆粕发酵产物中抗菌多肽的分布情况,富集抗菌特性较强的蛋白多肽,此方法简单高效,安全,适合工业化大规模生产。
本发明的另一目的在于提供由上述方法制备得到的抗菌多肽。
本发明的再一目的在于提供上述的抗菌多肽的用途。
本发明的目的通过下述技术方案实现:
一种大豆粕抗菌肽的制备方法,包括以下步骤:
(1)大豆粕发酵液的制备:取大豆粕,加水混匀,调整ph值为4.5-5.5,加入还原糖,再接种曲精,在32-37℃下保温振荡发酵36-48h;发酵完成后,灭酶,离心分离,得到的上清液为具有抗菌活性的大豆粕发酵液;以大豆粕质量为计算基准,还原糖加入量占1.5-2.5%,曲精的接种量占0.3-0.7‰。
(2)乙醇分离富集大豆粕抗菌肽:将大豆粕发酵液做适当浓缩,以每10-20%(按质量计)为一个浓度梯度加入无水乙醇,每加入一个浓度梯度乙醇后恒温匀速搅拌1-2h,离心,取上清液,再往上清液中继续加入一个浓度梯度无水乙醇,使得上清液中乙醇浓度达到40-80%(按质量计),恒温匀速搅拌1-2h后,离心取上清液,去除上清液中残余乙醇,冷冻干燥,得到大豆粕抗菌肽;
步骤(1)所选用的大豆粕为高温或低温大豆粕;
步骤(1)所述的还原糖为葡萄糖、果糖或麦芽糖中的一种以上,优选葡萄糖;
步骤(1)所述的曲精为酱油发酵专用曲精,优选沪酿3.042米曲霉菌种发酵所得的曲精;
步骤(1)所述的灭酶优选在90℃下保温30min;
步骤(2)中,优选地,使得上清液中乙醇浓度达到80%(按质量计);
步骤(2)中,优选地,将大豆粕发酵液真空浓缩至固形物含量为30-45%;
步骤(2)所述的恒温匀速搅拌是加入无水乙醇后在常温下200-400r/min转速下匀速搅拌;
步骤(2)所述去除上清液残余乙醇是用去离子水复溶后真空条件下浓缩,温度为50-60℃。
步骤(1)和(2)所述的离心采用低温离心,一般为4℃下,5000-8000r/min保持15-30min。
本发明大豆粕抗菌肽的制备方法是微生物液态发酵法,微生物在发酵过程中可分泌出与原料特性吻合、专一性较高的酶,且本发明中使用的酱油曲精,是优选沪酿3.042米曲霉菌种发酵所得,蛋白发酵产物的氨基酸转化率高,米曲霉菌丝由多细胞组成,可产丰富酶系,包括蛋白酶、淀粉酶、糖化酶和纤维素酶,相比单一的商业酶,能够更高效的分解大豆粕。
本发明方法通过乙醇可以起到一定的富集和分离抗菌肽的效果,其原理主要为:
(1)改变了介电常数;水是高介电常数,乙醇是低介电常数,因此有机溶剂加入使水溶液的介电常数降低,从电学库伦定律可知,介电常数降低增加两个相反电荷之间的吸引力。这样,蛋白质分子表面可解离基团的离子化程度减弱,水化程度降低,因此促进了大分子蛋白的聚集和沉淀,而小分子蛋白肽与氨基酸则残留在上清液中。
(2)可能与盐析相似,有机试剂与蛋白类物质直接争夺水化水,致使大分子蛋白的聚集而沉淀。同时乙醇安全性较其他有机物高,沸点为78℃,易挥发,在工业生产中可以广泛运用。
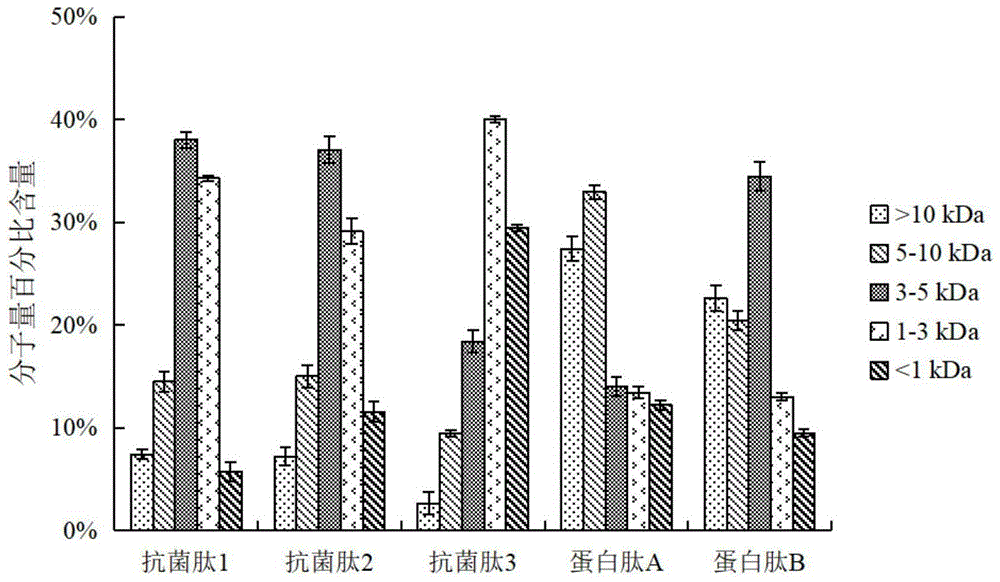
本发明方法所得多肽分子量分布多为小分子肽段,用无水乙醇分离和富集之后偏向于集中在5000da以下,而采用非本发明方法得到的产物(如对比例的大豆粕蛋白肽a和大豆粕蛋白肽b)以大于5000da的肽为主,因此抗菌率较低。
由上述方法制得的大豆粕抗菌肽可应用于健康食品、保健品和动物饲料中。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明以大豆粕为发酵底物,利用曲精在发酵过程中分泌产生的多种酶类,水解培养原料中大分子蛋白。既可以利用生物发酵法获得与原料特性吻合、专一性较高的酶,也能降低大豆粕中原有抗营养因子成分,同时也可产生更多的小分子多肽与氨基酸。
(2)本发明添加还原糖进行发酵,除了能为米曲霉生长提供充足的碳源,剩余的还原糖还可以在发酵和灭菌过程中与发酵液中肽和氨基酸发生美拉德反应,进一步提升发酵液的抗菌活性。
(3)本发明采用等浓度梯度依次醇沉法,通过最终浓度不同的乙醇处理去除弱抗菌特性组分、富集强抗菌特性组分,一方面可以高效分离目标肽,富集分子量在1000-5000da之间的肽,同时达到高效浓缩目标肽的目的,简化了工艺流程。
(4)本发明所用乙醇可以通过回收循环利用,经济安全无污染。
(5)本发明工艺操作简单、生产成本低、没有任何污染、安全性高,所得抗菌肽的抗菌活性强,可广泛应用于食品领域中。
附图说明
图1是实施例和对比例所得多肽的分子量分布图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
以下实施例中,抗菌效果的测定方法如下:
管碟法测定抗菌率:
(1)培养基的配制
牛肉膏蛋白胨培养基/肉汁培养基的制备:称取牛肉膏5.0g,蛋白胨10.0g,氯化钠5.0g,琼脂20g(肉汁培养基不含),用蒸馏水加热融化,定容至1000ml,调节ph至7.0-7.2后于121℃灭菌15min,灭菌完成后待用。
斜面培养基的制备:准备试管(15mm×150mm)若干,将上述牛肉膏蛋白胨培养基加热融化后用分液漏斗分装入试管,每支试管约5ml,塞好棉塞,用报纸将棉塞部分包好,于高压蒸汽灭菌锅在121℃下灭菌15min,完成后斜面放置,冷却至室温待用。
(2)菌种活化
①准备两个牛肉膏蛋白胨培养基平板;②在超净工作台中打开装有细菌冻干粉的安剖管,用酒精灯灼烧顶部,后立即滴加无菌水使管口破裂,随后轻轻用镊子将其敲碎;③吸取0.5ml肉汁培养基打入冻干管,充分溶解混匀后,每个平板吸取200μl菌悬液均匀涂布平板,37℃恒温培养24h。
(3)菌悬液的制备
使用灭菌后冷却至室温的85%生理盐水将传代琼脂斜面培养基上传代2-3代的菌体洗出,洗出液在8000r/min,4℃下离心15min,取沉淀菌体用生理盐水冲洗1-2次,将菌体稀释至650nm下透光率为20%的菌悬液,待用。
(4)抗菌实验
制备双层平板:取适当数量的培养皿(直径90mm,高20mm,要求大小一致,皿底平坦),加入20ml热融化的牛肉膏蛋白胨培养基,均匀摊布凝固作为底层,待凝固。然后将融化并冷却至50-60℃牛肉膏蛋白胨培养基,每100ml加入1ml,50%葡萄糖液和5ml制备好的菌悬液,充分混匀后取5ml均匀平铺在已经凝固的底层培养基上作为上层培养基。
加样:将消毒后的牛津杯(不锈钢管,内径6±0.1mm,外径8±0.1mm,高10±0.1mm)置于培养基表面,每只牛津杯间距相等,放置后轻压,保证牛津杯底部与培养基接触,每只牛津杯中加入150μl的样液(以生理盐水代替样液作为对照),每个样品做三次平行。
培养:加样完成后,每个平板盖内附一层无菌滤纸,盖上培养皿盖,放置恒温培养箱中37℃培养24h。
测量:培养完成后,取出牛津杯,用游标卡尺测量培养皿中各个抗菌圈的直径。
(5)抗菌率计算公式如下:
实施例1
一种大豆粕抗菌肽的制备方法,包括以下步骤:
(1)大豆粕发酵液的制备:按大豆粕质量加入7倍去离子水混合均匀,调整ph值为4.5,加入大豆粕质量1.5%的麦芽糖混合均匀,置于锥形瓶中,接入大豆粕质量0.3‰的曲精作为发酵菌种,置于水浴恒温振荡器中,在32℃下以200r/min水浴震荡发酵36h。发酵完成后,90℃下保温30min灭酶,在8000r/min,4℃下离心20min,得到的上清液为具有抗菌活性的大豆粕发酵液;
(2)乙醇分离富集大豆粕抗菌肽:真空浓缩大豆粕发酵液至固形物含量30%,加入无水乙醇,至最终体系中乙醇含量为20%(按质量计)时,在室温下以200r/min匀速搅拌1h,离心(8000r/min,20min),取上清液,得上清液1;再往上清液1中继续加入无水乙醇至体系中乙醇含量达到40%(按质量计),在室温下以200r/min匀速搅拌2h后,离心(8000r/min,20min),取上清液,去除上清液部分残余乙醇,冷冻干燥,得到大豆粕抗菌肽1。
实施例2
一种大豆粕抗菌肽的制备方法,包括以下步骤:
(1)大豆粕发酵液的制备:按大豆粕质量加入11倍去离子水混合均匀,调整ph为5.0,加入大豆粕质量2.0%的果糖混合均匀,置于锥形瓶中,接入大豆粕质量0.5‰的曲精作为发酵菌种,置于水浴恒温振荡器中,在35℃下以200r/min水浴震荡发酵42h。发酵完成后,90℃下保温30min灭酶,在8000r/min,4℃下离心20min,得到的上清液为具有抗菌活性的大豆粕发酵液;
(2)乙醇分离富集大豆粕抗菌肽:真空浓缩大豆粕发酵液至固形物含量40%,加入无水乙醇,至最终体系中乙醇含量为20%(按质量计)时,在室温下以200r/min匀速搅拌1h,离心(8000r/min,20min),取上清液,得上清液1;再往上清液1中继续加入无水乙醇至体系中乙醇含量达到40%(按质量计),在室温下以200r/min匀速搅拌2h后,离心(8000r/min,20min),取上清液,得上清液2;再往上清液2中继续加入无水乙醇至体系中乙醇含量达到60%(按质量计),在室温下以200r/min匀速搅拌1h后,离心(8000r/min,20min),取上清液,去除上清液部分残余乙醇,冷冻干燥,得到大豆粕抗菌肽2。
实施例3
一种大豆粕抗菌肽的制备方法,包括以下步骤:
(1)大豆粕发酵液的制备:按大豆粕质量加入9倍去离子水混合均匀,调整ph为5.5,加入大豆粕质量2.5%的葡萄糖混合均匀,置于锥形瓶中,接入大豆粕质量0.7‰的曲精作为发酵菌种,置于水浴恒温振荡器中,在37℃下以200r/min水浴震荡发酵48h。发酵完成后,90℃下保温30min灭酶,在8000r/min,4℃下离心20min,得到的上清液为具有抗菌活性的大豆粕发酵液;
(2)乙醇分离富集大豆粕抗菌肽:真空浓缩大豆粕发酵液至固形物含量45%,加入无水乙醇,至最终体系中乙醇含量为20%(按质量计)时,在室温下以200r/min匀速搅拌1.5h,离心(8000r/min,20min),取上清液,得上清液1;再往上清液1中继续加入无水乙醇至体系中乙醇含量达到40%(按质量计),在室温下以200r/min匀速搅拌1h后,离心(8000r/min,20min),取上清液,得上清液2;再往上清液2中继续加入无水乙醇至体系中乙醇含量达到60%(按质量计),在室温下以200r/min匀速搅拌1.5h后,离心(8000r/min,20min),取上清液,得上清液3;再往上清液3中继续加入无水乙醇至体系中乙醇含量达到80%(按质量计),在室温下以200r/min匀速搅拌1h后,离心(8000r/min,20min),取上清液,去除上清液部分残余乙醇,冷冻干燥,得到大豆粕抗菌肽3。
对比例1
一种大豆粕蛋白肽的制备方法,包括以下步骤:
(1)按重量称取大豆粕1份与去离子水9份混合均匀后,利用均质分散机在5000r/min下均质10min,加入大豆粕质量0.15%的复合植物水解酶和0.35%的碱性蛋白酶,随后在55℃下,以200r/min恒温酶解12h。酶解完成后,90℃下保温30min灭酶,然后将于8000r/min,4℃下离心20min,取上清液,得到大豆粕酶解液;
(2)真空浓缩大豆粕酶解液至固形物含量45%,加入无水乙醇,至最终体系中乙醇含量为20%(按质量计)时,在室温下以200r/min匀速搅拌1h,离心(8000r/min,20min),取上清液,得上清液1;再往上清液1中继续加入无水乙醇至体系中乙醇含量达到40%(按质量计),在室温下以200r/min匀速搅拌1h后,离心(8000r/min,20min),取上清液,得上清液2;再往上清液2中继续加入无水乙醇至体系中乙醇含量达到60%(按质量计),在室温下以200r/min匀速搅拌1h后,离心(8000r/min,20min),取上清液,得上清液3;再往上清液3中继续加入无水乙醇至体系中乙醇含量达到80%(按质量计),在室温下以200r/min匀速搅拌1h后,离心(8000r/min,20min),取上清液,去除上清液部分残余乙醇,冷冻干燥,得到大豆粕蛋白肽a。
对比例2
一种大豆粕蛋白肽的制备方法,包括以下步骤:
按大豆粕质量加入9倍去离子水进行混合,利用均质分散机在5000r/min下均质15min,混合均匀后,调整ph为5.5,加入大豆粕质量2.5%的葡萄糖混合均匀,置于锥形瓶中,接入大豆粕质量0.7‰的曲精作为发酵菌种,置于水浴恒温振荡器中,在37℃下以200r/min水浴震荡发酵48h。发酵完成后,90℃下保温30min灭酶,在8000r/min,4℃下离心20min,取上清液,冷冻干燥,得到大豆粕蛋白肽b。
各实施例和对比例所得多肽的抗菌率如表1所示:
表1多肽的抗菌率*
*:在样品浓度为60mg/ml时进行测量。
由表1可以发现,在实施例1、2、3使用本发明的微生物液态发酵与乙醇等级分离后,得到的抗菌肽1、2、3对大肠杆菌与金黄色葡萄球菌均有较高的抑制作用,当最终乙醇浓度达到80%(按质量计)时,即抗菌肽3对大肠杆菌与金黄色葡萄球菌的抑制率分别达到了69.98%和54.11%。
在对比例1与对比例2中,对比例1中采用的是常用商业酶制剂对大豆粕进行酶解,然后采用本专利技术的乙醇分离工艺制备大豆粕蛋白肽,所得的大豆粕蛋白肽a对两种细菌的抑制效果远不如采用微生物液态发酵法结合乙醇分离富集发制备大豆粕抗菌肽的抑菌效果,对大肠杆菌与金黄色葡萄球菌的抑制率仅为25.02%和14.80%。
对比例2中使用了本发明中的液态发酵法,但未进行乙醇等级分离,得到的大豆粕蛋白肽b对大肠杆菌与金黄色葡萄球菌的抑制率分别为31.58%和30.89%,与实施例中的抑制率有一定的差异,说明乙醇等级分离能够有效富集大豆粕抗菌肽。
图1为各实施例对比例中大豆粕抗菌肽的肽分子量分布,由图中可知,采用本发明方法获得的大豆粕抗菌肽(实施例1、2、3)具有更高比例的分子量<5000da肽段,而采用普通商业酶酶解技术得到的大豆粕蛋白肽a具有更多的大分子肽段(>5000da的肽段占比达到60.4%),仅采用液态发酵未采用乙醇分离的大豆粕蛋白肽b包含43.1%的分子量>5000da的肽段。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!