食蚊鱼Nrf2基因及其提取方法及特异性一抗抗体制备方法与流程
本发明涉及基因提取及特异性抗体制备技术领域,具体涉及一种食蚊鱼nrf2基因及其提取方法及特异性一抗抗体制备方法。
背景技术:
食蚊鱼(gambusiaaffinis)是一种小型淡水鱼,原产于南美洲,归属于胎鳉科食蚊鱼属。雌鱼和雄鱼体型明显区别:雌鱼体型普遍大于雄鱼,雌鱼臀鳍呈扇形,雄鱼臀鳍呈剑型。食蚊鱼又名大肚鱼、柳条鱼,其繁殖方式为卵胎生。食蚊鱼因其极强的环境适应性和广谱的食性,而在全球各地被广泛引进用以控制蚊虫相关的疫情。近些年来,食蚊鱼作为入侵种,已广泛存在于中国的河流水域中。由于其性别差异明显、在自然水域广泛分布、容易捕获以及易于实验室驯养,食蚊鱼适合作为生态环境研究方面的实验动物。目前已有一些以食蚊鱼作为实验动物的研究和报道。但由于食蚊鱼非模式实验动物,也不是珍稀保护物种,对于我国来说甚至属于入侵物种,其强大的环境适应力和繁殖力,甚至侵占了很多中国本地生态位相近的物种(如青鳉)的生存空间,大多数科研人员对其研究还停留在浅表层面。此外,食蚊鱼遗传背景不清晰,ncbi数据库中没有收录其全基因组的序列。相关研究多集中于食蚊鱼的表观性状变化和种群结构等方面,深入探讨其基因的分子生物学层面相关研究和方法还很少。
nrf2核转录因子(nf-e2-relatedfactor2),又称nfe2l2,是一种含有碱性亮氨酸拉链结构的核转录因子。nrf2是生物体内一种非常重要,进化上非常保守的调控生物体氧化应激响应转录因子,一般通过nrf2/are(antioxidantresponseelement)信号通路,调控下游抗氧化相关基因和ⅱ相解毒代谢酶基因的表达,维持和保护机体内氧化还原状态的平衡。
有鉴于此,急需对现有的基因提取方法进行改进,以方便操作,并获得食蚊鱼的nrf2基因及特异性一抗抗体。
技术实现要素:
本发明所要解决的技术问题是食蚊鱼遗传背景不清晰,ncbi数据库中没有收录其全基因组的序列的问题。
为了解决上述技术问题,本发明所采用的技术方案是提供一种食蚊鱼nrf2基因,其特征在于,该基因片段序列如nrf2idno.1所示。
本发明所采用的另一技术方案是一种食蚊鱼nrf2基因提取方法,包括以下步骤:
1)提取食蚊鱼肝脏总rna;
2)根据食蚊鱼肝脏总rna,反转录获得食蚊鱼第一链cdna;
3)以食蚊鱼第一链cdna为模板,进行普通pcr扩增以获得食蚊鱼nrf2核心片段;
4)将已完成pcr扩增的产物与5×loadingbuffer按混匀后,注入凝胶上的点样孔中,并加点合适的marker,电泳仪电压90v运行40min;
5)将电泳结束后的凝胶用chemidocxrs+凝胶成像系统紫外光检测电泳结果,将符合设计长度的条带位置的凝胶切下,并进行测序。
在上述技术方案中,所述提取食蚊鱼肝脏总rna包括:
1)ran提取:将食蚊鱼的肝脏放入无菌处理过的圆底离心管内,并加入trizolreagent溶液,用0一次性无菌注射器抽吸吹打,至溶液为均匀粉红色匀浆,用针头吸取溶液无堵塞情况,无明显块状物;将均匀粉红色匀浆在圆底离心管室温静置5min;加入200μl氯仿,盖好离心管盖后,摇离心管混匀,室温静置5min;再将圆底离心管在4℃,12000g下离心15min;
2)rna沉淀:吸取上清液到无菌尖底离心管,加入异丙醇,盖好管盖轻轻上下颠倒几次,于室温静置10min,尖底离心管在4℃,12000g下离心10min,离心后管底会形成白色凝胶样沉淀;
3)rna净化:尖底离心管弃去上清,加入75%无菌处理乙醇,用手指轻弹管底,使沉淀悬浮;尖底离心管在4℃,7500g下离心5min,用移液枪小心吸走上清;在室温状态下干燥5~10min,使乙醇挥发;加入rnasefreeh2o,溶解rna。
在上述技术方案中,在进行普通pcr扩增以获得食蚊鱼nrf2核心片段时,普通pcr的反应体系为ddh2o17.25μl,10×pcrbuffer2.5μl,dntpmixture2μl,cdna模板0.75μl,上下游引物(10μm浓度)各1μl,rtaq酶0.5μl,反应总体系为25μl。普通pcr反应在abiveriti96孔梯度pcr仪进行,反应条件为95℃,预变性4min;94℃,变性30s,55℃,退火40s,72℃,延伸1min,循环35次;72℃,延伸10min;4℃保存。
在上述技术方案中,所述引物需根据ncbi数据库和ensemblasia数据库现有数据,选择与食蚊鱼亲缘关系近的鱼类的基因序列为参考,并寻找与食蚊鱼亲缘关系近的几个物种之间的保守区域,并在保守区域中根据普通pcr引物设计要求设计引物。
在上述技术方案中,在进行电泳时需要加入缓冲液及2%琼脂糖凝胶。
本发明提供的另一种个技术方案是一种食蚊鱼nrf2基因特异性一抗抗体制备方法,根据上述食蚊鱼nrf2序列,分析出敏感性多肽链,合成食蚊鱼nrf2蛋白特异性多克隆一抗抗体。
在上述技术方案中,食蚊鱼nrf2基因特异性一抗抗体制备方法具体包括以下步骤:
1)分别合成第606至617个碱基对应的nrf2多肽和第41至52个碱基对应的nrf2多肽;
2)将合成的第606至617个碱基对应的nrf2多肽和第41至52个碱基对应的nrf2多肽分别进行klh偶联后,混合免疫2只新西兰白兔,皮下免疫400μg/次,2-3周免疫一次,免疫4次;
3)进行抗血清效价检测;
4)进行抗体的纯化和鉴定。
在上述技术方案中,所述抗血清间接效价检测的步骤具体为:
1)根据实验需要设计好包被板,并在板条上做上标记;
2)包被:用pbs包被液将第606至617个碱基对应的nrf2多肽和第41至52个碱基对应的nrf2多肽抗原稀释成需要的浓度,混匀后加入板条中,每孔100ul,4℃冰箱过夜;
包被抗原:第606至617个碱基对应的nrf2多肽、第41至52个碱基对应的nrf2多肽;
包被浓度:5μg/ml,100ul/孔;
包被缓冲液:磷酸盐缓冲液;
3)封闭:包被好后,弃去包被液,洗板3次,每孔加入200μl封闭液,37℃恒温箱1h,取出酶标板,弃去内液,洗板1次;
4)一抗反应:抗血清按1/500,3倍稀释,每孔100μl,37℃恒温箱1h;
5)二抗反应:取出酶标板,弃去内液,洗板3次,向每孔中加入100μl稀释好的酶标二抗,酶标二抗:羊抗兔-hrp,1/5000,37℃恒温箱1小时;
6)显色:取出酶标板,弃去内液,洗板4次,每孔先加入100μltmb显色液,根据颜色的深浅决定显色时间,一般37℃,15min;
7)终止反应:每孔加入100μl1mhcl溶液,终止反应,即刻在酶标仪上450nm读数,将od值大于设定的阴性对照od值的2.1倍的孔对应的稀释度,定为该样品的效价。
在上述技术方案中,所述进行抗体的纯化包括以下步骤:
将巯基胶与第606至617个碱基对应的nrf2多肽、第41至52个碱基对应的nrf2多肽混合多肽制备成抗原亲和纯化层析柱,将兔子抗血清与pbs等量混合后,先缓慢上样,待抗体结合后用甘氨酸洗脱缓冲液分别洗脱,即得到所需纯化抗体,立即在pbs中进行4℃透析过夜,隔日进行纯度,浓度和效价测定;
所述进行抗体的鉴定包括以下步骤:
通过elisa检测纯化抗体的效价,利用bca蛋白浓度测定试剂盒对所得抗体进行浓度测定;通过sds-page电泳,考马斯亮蓝染色观察纯化抗体的纯度。
与现有技术相比,本发明的一种食蚊鱼nrf2基因提取方法及特异性一抗抗体制备方法,首次成功克隆了食蚊鱼体内的nrf2基因的核心碱基序列,并合成了食蚊鱼nrf2特异性多克隆一抗抗体,可推广用于快速获得其他非模式物种未知碱基序列及制备相关特异性抗体,并在后续研究中使用这些基因构建分子层面检测方法和使用抗体从事相关蛋白变化的检测。食蚊鱼环境适应力超强,对于我国是一种强势的入侵生物,甚至在生物需氧量和化学需氧量较高的污水和下水道中都能正常生活,推测其超强生命力也和其体内的nrf2抗氧化信号通路有关,本方法克隆出的基因和制备出的一抗抗体可为研究nrf2相关通路如何在环境压力下发挥抗氧化作用、生物如何抵御氧化应激压力和相关环境风险提供新的技术手段和检测方法。
附图说明
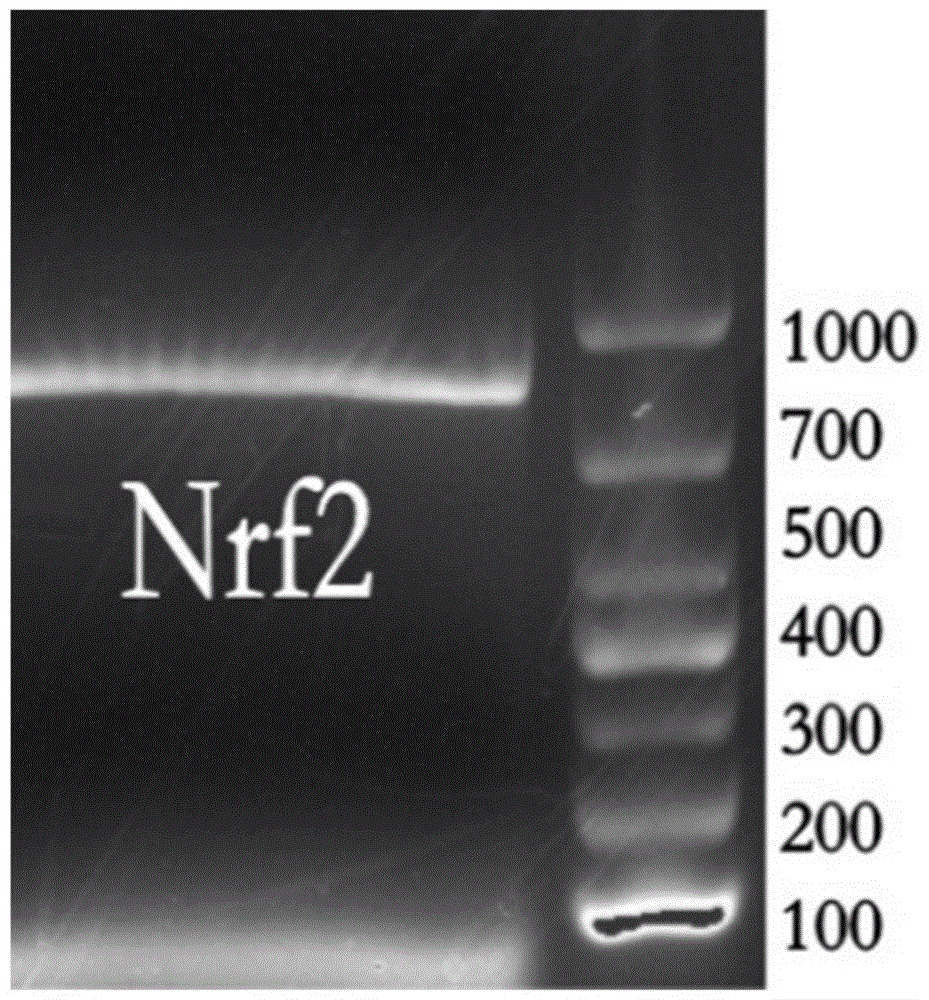
图1为本发明中食蚊鱼nrf2基因凝胶电泳结果;
图2为本发明中食蚊鱼的nrf2基因进化树;
图3为本发明中多肽nrf2(606-617)hplc实验结果;
图4为本发明中多肽nrf2(606-617)ms实验结果;
图5为本发明中多肽nrf2(41-52)hplc实验结果;
图6为本发明中多肽nrf2(41-52)ms实验结果;
图7为本发明中食蚊鱼nrf2多克隆抗体sds-page电泳结果;
图8为本发明中食蚊鱼nrf2多克隆一抗抗体wb实验结果。
具体实施方式
本发明提供了一种食蚊鱼nrf2基因提取方法及特异性一抗抗体制备方法,方便操作,并获得食蚊鱼的nrf2基因及特异性一抗抗体。下面结合说明书附图和具体实施方式对本发明做出详细说明。
本发明提供的一种食蚊鱼nrf2基因,其特征在于,该基因片段序列如nrf2idno.1所示。
本发明提供的一种食蚊鱼nrf2基因提取方法,其特征在于,包括以下步骤:
1)提取食蚊鱼肝脏总rna;
2)根据食蚊鱼肝脏总rna,反转录获得食蚊鱼第一链cdna;
3)以食蚊鱼第一链cdna为模板,进行普通pcr扩增以获得食蚊鱼nrf2核心片段;
4)将已完成pcr扩增的产物与5×loadingbuffer按混匀后,注入凝胶上的点样孔中,并加点合适的marker,电泳仪电压90v运行40min;
5)将电泳结束后的凝胶用chemidocxrs+凝胶成像系统紫外光检测电泳结果,将符合设计长度的条带位置的凝胶切下,并进行测序。
在该实施例中,通过食蚊鱼的rna反转录获得食蚊鱼第一链cdna,经过pcr扩增等技术手段,成功克隆了食蚊鱼体内的nrf2基因的核心碱基序列,能够根据食蚊鱼体内的nrf2基因的中心序列,分析其遗传特征,制作nrf2进化树以比较其进化位置,无需对食蚊鱼进行全基因测序,获得了食蚊鱼体内nrf2基因的核心片段,方法简单,容易操作,且可推广至其他鱼类的基因片段的获取。
在本发明的一个实施例中,优选地,提取食蚊鱼肝脏总rna包括:
1)ran提取:于冰盘上解剖出的食蚊鱼肝脏,迅速放入无菌处理过的2ml圆底离心管内,并加入1mltrizolreagent溶液,用0.45μm口径针头1ml容量一次性无菌注射器抽吸吹打,至溶液为均匀粉红色匀浆,用针头吸取溶液无堵塞情况,无明显块状物;2ml圆底离心管室温静置5min;加入200μl氯仿,仔细盖好离心管盖后,大力摇离心管混匀,室温静置5min;2ml圆底离心管在4℃,12000g下离心15min;离心后混合物分为三层,其中rna存在于上层无色水相中;
2)rna沉淀:小心吸取上清液到1.5ml无菌尖底离心管,加入500μl异丙醇,盖好管盖轻轻上下颠倒几次,于室温静置10min;1.5ml尖底离心管在4℃,12000g下离心10min,离心后管底会形成白色凝胶样沉淀;;
3)rna净化:1.5ml尖底离心管弃去上清,加入1ml75%无菌处理乙醇,用手指轻弹管底,使沉淀悬浮;1.5ml尖底离心管在4℃,7500g下离心5min,用移液枪小心吸走上清;室温干燥5~10min,使乙醇挥发(但注意不要让其完全干燥,rna若完全干燥则很难溶解);加入20-30μlrnasefreeh2o,溶解rna。
4)rna检验:提取出的食蚊鱼肝脏总rna使用nanodrop2000超微量分光光度计检测其提取质量,其吸光度od260/280在1.8-2.0之间的方符合要求,而成功提取出的rna暂存于-80℃超低温冰箱。
其中,以上实验应全程在超净工作台或无菌环境下进行,使用的所有离心管和枪头均经过无酶化处理。
食蚊鱼第一链cdna由其肝脏总rna反转录获得,其操作遵循takara公司的primescripttmiirtreagentkit试剂盒说明书,实验全程在超净工作台下戴无菌乳胶手套进行,并保持冰上操作,所有离心管和枪头均经过无酶化处理,反转录反应体系如表1。
表1第一链cdna合成的反转录反应体系
在本发明的一个实施例中,优选地,在进行普通pcr扩增以获得食蚊鱼nrf2核心片段时,普通pcr的反应体系为ddh2o17.25μl,10×pcrbuffer2.5μl,dntpmixture2μl,cdna模板0.75μl,上下游引物(10μm浓度)各1μl,rtaq酶0.5μl,反应总体系为25μl。普通pcr反应在abiveriti96孔梯度pcr仪进行,反应条件为95℃,预变性4min;94℃,变性30s,55℃,退火40s,72℃,延伸1min,循环35次;72℃,延伸10min;4℃保存。
在本发明的一个实施例中,优选地,引物需根据ncbi数据库和ensemblasia数据库现有数据,选择与食蚊鱼亲缘关系近的鱼类的基因序列为参考,并寻找与食蚊鱼亲缘关系近的几个物种之间的保守区域,并在保守区域中根据普通pcr引物设计要求设计引物。
在该实施例中,根据ncbi数据库和ensemblasia数据库现有数据,可选择和食蚊鱼亲缘关系比较近的鳉形目鱼类(如剑尾鱼,秀美花鳉等)以及其他硬骨鱼(如典型模式物种斑马鱼和虹鳟)的基因序列为参考,在vectornti11.5.1软件上寻找上述几个物种之间的保守区域,并在保守区域中根据普通pcr引物设计要求设计引物,如表2。食蚊鱼nrf2的普通pcr引物设计分别参照以下基因序列:nrf2引物由编号为hq916348.1(虹鳟,oncorhynchusmykiss),xm_005172511.1(斑马鱼,daniorerio)和ensxmat00000000447(剑尾鱼,xiphophorusmaculatus,从ensemblasia数据库获得)的nrf2序列设计出。
设计好的普通pcr引物用rnasefreedh2o稀释至10μm浓度,并分装保存于-20℃低温冰箱,尽量避免反复冻融。
表2食蚊鱼nrf2的引物设计
注:f:上游;r:下游。
在本发明的一个实施例中,优选地,在进行电泳时需要加入缓冲液及2%琼脂糖凝胶。
在该实施例中,缓冲液的配置方法为:称量三羟甲基氨基甲烷(tris)242g,edta18.612g于1l烧杯中;向烧杯中加入约800ml去离子水,充分搅拌均匀;加入57.1ml冰乙酸,充分溶解;用naoh调ph至8.3,再用去离子水定容至1l后室温保存。使用时用去离子水稀释50倍,即得1×taebuffer。普通pcr产物2%琼脂糖凝胶电泳跑出清晰条带并检测结果。2%琼脂糖凝胶的配制方法为:0.36g琼脂糖凝胶粉加入到18ml1×taebuffer中,微波加热融化至无色透明,稍凉后加入200μlgelgreen染料(按1:10000稀释)并倒入模板灌制,室温冷却40min后即为2%琼脂糖凝胶。
本发明成功克隆出食蚊鱼长度为803bp的nrf2序列,其电泳图片如图1所示,并在vectornti软件和ncbi数据库中分析了其最长的开放式阅读框(openreadingframe,orf)为758bp,可转录为252个氨基酸,而这段多肽链预测的蛋白分子量为28,757kda,理论pi值为4.54,如序列表所示。为了检测食蚊鱼和其他物种的解毒代谢相关基因的进化关系,我们使用mega5.05软件根据不同物种的nrf2的碱基序列构建了进化树,如图2所示。
一种食蚊鱼nrf2基因特异性一抗抗体制备方法,根据如上述实施例中的食蚊鱼nrf2序列,分析出敏感性多肽链,合成食蚊鱼nrf2蛋白特异性多克隆一抗抗体。
在该实施例中,根据食蚊鱼体的nrf2基因的核心碱基序列,合成了食蚊鱼nrf2特异性多克隆一抗抗体,,可推广用于快速获得其他非模式物种未知碱基序列及制备相关特异性抗体,并在后续研究中使用这些基因构建分子层面检测方法和使用抗体从事相关蛋白变化的检测。
在本发明的一个实施例中,优选地,具体包括:
1)分别合成合成nrf2(606-617)多肽和nrf2(41-52)多肽;
2)将合成的多肽nrf2(606-617)和nrf2(41-52)分别进行klh偶联后,混合免疫2只新西兰白兔(2-2.5kg),皮下免疫400μg/次,2-3周免疫一次,免疫4次
3)进行抗血清效价检测;
4)进行抗体的纯化和鉴定。
在该实施例中,合成nrf2(606-617)多肽,具体hplc和ms报告如图3,图4所示,成nrf2(41-52)多肽,具体hplc和ms报告如图5,图6所示。
在本发明的一个实施例中,优选地,抗血清间接效价检测的步骤具体为:
1)根据实验需要设计好包被板,并在板条上做上标记
2)包被:用pbs包被液将多肽nrf2(606-617)和nrf2(41-52)抗原稀释成需要的浓度,混匀后加入板条中,每孔100ul,4℃冰箱过夜。
包被抗原:多肽nrf2(606-617)、多肽nrf2(41-52);
包被浓度:5μg/ml,100ul/孔;
包被缓冲液:磷酸盐缓冲液(pbs,ph7.4)。
3)封闭:包被好后,弃去包被液,洗板3次,每孔加入200μl封闭液,37℃恒温箱1h。取出酶标板,弃去内液,洗板1次。
4)一抗反应:抗血清按1/500,3倍稀释,每孔100μl,37℃恒温箱1h。
5)二抗反应:取出酶标板,弃去内液,洗板3次,向每孔中加入100μl稀释好的酶标二抗,酶标二抗:羊抗兔-hrp,1/5000。37℃恒温箱1小时。
6)显色:取出酶标板,弃去内液,洗板4次,每孔先加入100μltmb显色液,根据颜色的深浅决定显色时间,一般37℃,15min。
7)终止反应:每孔加入100μl1mhcl溶液,终止反应。即刻在酶标仪上450nm读数,将od值大于设定的阴性对照od值的2.1倍的孔对应的稀释度,定为该样品的效价。
在该实施例中,抗血清效价大于121k,具体结果如表3所示,包被抗原:多肽nrf2(606-617)、多肽nrf2(41-52),包被浓度:5μg/ml,100μl/孔,包被缓冲液:磷酸盐缓冲液(pbs,ph7.4),二抗:羊抗兔-hrp,1/5000。
表3抗血清elisa结果
起始稀释度:1:500
在本发明的一个实施例中,优选地,进行抗体的纯化包括:将巯基胶与nrf2(606-617)、nrf2(41-52)混合多肽制备成抗原亲和纯化层析柱,将兔子抗血清与pbs等量混合后,先缓慢上样,待抗体结合后用甘氨酸洗脱缓冲液分别洗脱,即得到所需纯化抗体,立即在pbs中进行4℃透析过夜,隔日进行纯度,浓度和效价测定。
在本发明的一个实施例中,优选地,进行抗体的鉴定包括:通过elisa检测纯化抗体的效价,利用bca蛋白浓度测定试剂盒对所得抗体进行浓度测定;通过sds-page电泳,考马斯亮蓝染色观察纯化抗体的纯度。
纯化抗体间接elisa效价检测,具体操作如下:
(1)根据实验需要设计好包被板,并在板条上做上标记
(2)包被:用pbs包被液将多肽nrf2(606-617)、nrf2(41-52)抗原稀释成需要的浓度,混匀后加入板条中,每孔100μl,4℃冰箱过夜。
包被抗原:多肽nrf2(606-617)、多肽nrf2(41-52)
包被浓度:5μg/ml,100μl/孔
包被缓冲液:磷酸盐缓冲液(pbs,ph7.4)
(3)封闭:包被好后,弃去包被液,洗板3次,每孔加入200μl封闭液,37℃恒温箱1h。取出酶标板,弃去内液,洗板1次
(4)一抗反应:纯化抗体按1/500,2倍稀释,每孔100μl,37℃恒温箱1h。
(5)二抗反应:取出酶标板,弃去内液,洗板3次,向每孔中加入100ul稀释好的酶标二抗,酶标二抗:羊抗兔-hrp,1/5000。37℃恒温箱1小时。
(6)显色:取出酶标板,弃去内液,洗板4次,每孔先加入100μltmb显色液,根据颜色的深浅决定显色时间,一般37℃,15min。
(7)终止反应:每孔加入100μl1mhcl溶液,终止反应。即刻在酶标仪上450nm读数,将od值大于设定的阴性对照od值的2.1倍的孔对应的稀释度,定为该样品的效价。
纯化抗体效价大于512k,具体结果如下表2.4所示,包被抗原:多肽nrf2(606-617)、多肽nrf2(41-52),包被浓度:5μg/ml,100μl/孔,包被缓冲液:磷酸盐缓冲液(pbs,ph7.4),二抗:羊抗兔-hrp,1/5000。
表4纯化抗体elisa结果
起始稀释度:1:500
效价即样品od/空白od>=2.1的最高稀释度
在进行抗体纯度鉴定时,纯化后抗体进行sds-page电泳,考马斯亮蓝染色。可见抗体纯化后纯度在90%以上(图7)。
一抗抗体合成成功后,在冰上解剖健康的食蚊鱼并取出其肝脏,用所合成的食蚊鱼nrf2蛋白特异性一抗抗体进行westernblotting预实验,其具体操作如下:
步骤一、食蚊鱼肝脏组织总蛋白提取:使用碧云天ripa(radioimmunoprecipitationassay)细胞裂解液,含pmsf(苯甲基磺酰氟,phenylmethanesulfonylfluoride,蛋白酶抑制剂),细胞裂解液要避免反复冻融,pmsf用时加到ripa里,按99份ripa:1份pmsf比例加(pmsf终浓度为1mm);称量肝脏组织的质量,按每10mg样品加10μl裂解液来裂解,使用玻璃匀浆器充分裂解,14000g4℃离心5min,取上清液加5×loadingbuffer分装于-20℃短期保存,或不加buffer于-80℃长期保存。
步骤二、检测组织蛋白总浓度:使用碧云天bca蛋白浓度测定试剂盒,并按说明书操作检测食蚊鱼组织蛋白浓度。蛋白样品在加上样缓冲液的时候加生理盐水稀释到10μg/μl使其蛋白浓度均一,方便上样,之后煮沸5min使蛋白变性。
步骤三、制备蛋白电泳胶体:制备电泳胶体使用sds-page凝胶配制试剂盒,一块胶分包括分离胶5ml和浓缩/堆积胶1.5-2ml,分离胶具体浓度参照说明书。先制分离胶(分离胶浓度与目标蛋白分子量kda大小有关,本实验选择12%浓度),再制浓缩胶(分离胶浓度为5%),胶试剂盒里的aps(过硫酸铵)和temed(四甲基乙二胺)是催化剂,最后加,temed越多,胶凝固的越快(1-2μl)。分离胶溶液(注:使用1mtris缓冲液,ph=8.8)配好后,用枪头抵住玻璃片加入,分离胶制胶时间约为1h。分离胶凝固后,胶体和水分离,把上层水倒掉。制备浓缩胶,temed同样最后加,浓缩胶液体(注:使用1mtris缓冲液,ph=6.8),快速加入浓酸胶1-2ml并插梳子,浓缩胶凝固用时40min,制备好的胶体用塑料膜加双蒸水封存,4℃过夜。点样孔下千万不要存在气泡,若有气泡,则此孔弃用。
步骤四、蛋白电泳:胶体在冰箱过夜后,跑蛋白电泳,倾斜拔掉梳子,小心操作,勿破坏胶,往电泳槽中装胶的时候把短玻璃板往上退一些,防止侧面漏液。若有10个泳道,则最左最右两个跑1×蛋白上样缓冲液做空白封闭,并留蛋白质分子量标准marker孔,做好样品孔标记,知道哪个是哪个,样品加样要体积准确,保证总蛋白一致。加样时电泳buffer只加到槽内,加样完毕再加电泳buffer(碧云天p0014bsds-page电泳液)没过电势线,加电极盖,不能弄反。跑浓缩/堆积胶,电流20ma,跑到胶的中间白色横梁部分,把蛋白压成一条带。跑分离胶电压尽量大,把marker跑开即可停止。
步骤五、转膜:本实验采用湿法转膜,采用冰浴环境,提前开好制冰机,全程用干净镊子夹取膜。转膜前先裁好并活化pvdf(聚偏氟乙烯,poly(vinylidenefluoride))膜,在塑料盒中用甲醇浸没即可,1min左右,膜活化后放到1×转膜buffer(碧云天p0021bwestern转膜液)。滤纸先裁好,要比胶略大,也用1×转膜buffer浸泡。给pvdf膜剪角,分清正反,转模时胶保持湿润不时洒水,保证胶和膜之间没有气泡。做转膜三明治:滤纸(三张)-胶-pvdf膜-滤纸(三张),用力合上三明治,膜和胶保证未移动。三明治夹板装入转膜槽颜色要黑色对着转膜槽黑色,不要弄反。转膜条件:120ma,30-40min,(目的蛋白分子量越大,转膜时间越长,具体需先行摸索条件)槽内放冰袋,整个槽埋于冰中,槽内加满western转膜液。
步骤六、封闭:转膜结束后,用镊子取出膜,放在孵育盒内,开摇床,用tbst溶液(tris-hcl缓冲液+1%体积的吐温20)洗膜3次,每次30s,用5%脱脂奶粉封闭液(碧云天p0023bwestern封闭液)封闭2h。封闭结束,用tbst再洗膜3次。
步骤七、孵育一抗:不同抗体用不同孵育盒,剪膜的时候垫上湿润滤纸,分清正反面,全程膜要保持湿润,和需要的marker片段一起剪下,不同抗体严格分开。一抗抗体平时保存在-20℃,用5%脱脂奶粉封闭液稀释1000倍。先把一抗点到孵育盒上,一次用400μl左右,膜有蛋白面与抗体接触,之间不能有气泡。孵育盒冰箱4℃过夜。
步骤八、孵育二抗:孵育完一抗后,用tbst洗膜,再孵育二抗抗体,本实验所用二抗为辣根过氧化物酶结合抗体(一抗和二抗要严格匹配)。二抗也用5%奶粉tbst稀释。孵育二抗的手法与一抗一致,所不同的是二抗在室温下孵育2h即可。
步骤九、显影:使用碧云天p0018beyoeclplus(超敏ecl化学发光试剂盒),参照其说明书进行化学发光检测,并用chemidocxrs+凝胶成像系统检测其结果。
实验结果如下图8所示,wb实验结果符合预期,说明制备合成的食蚊鱼nrf2蛋白特异性一抗抗体可用于其他相关的蛋白含量检测正式实验。
本方法首次成功克隆了食蚊鱼体内的nrf2基因的核心碱基序列,并合成了食蚊鱼nrf2特异性多克隆一抗抗体,可推广用于快速获得其他非模式物种未知碱基序列及制备相关特异性抗体,并在后续研究中使用这些基因构建分子层面检测方法和使用抗体从事相关蛋白变化的检测。食蚊鱼环境适应力超强,对于我国是一种强势的入侵生物,甚至在生物需氧量和化学需氧量较高的污水和下水道中都能正常生活,推测其超强生命力也和其体内的nrf2抗氧化信号通路有关,本方法克隆出的基因和制备出的一抗抗体可为研究nrf2相关通路如何在环境压力下发挥抗氧化作用、生物如何抵御氧化应激压力和相关环境风险提供新的技术手段和检测方法。
在本发明中,术语“第一”、“第二”、“第三”仅用于描述的目的,而不能理解为指示或暗示相对重要性;术语“多个”则指两个或两个以上,除非另有明确的限定。术语“安装”、“相连”、“连接”、“固定”等术语均应做广义理解,例如,“连接”可以是固定连接,也可以是可拆卸连接,或一体地连接;“相连”可以是直接相连,也可以通过中间媒介间接相连。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
本发明并不局限于上述最佳实施方式,任何人应该得知在本发明的启示下做出的结构变化,凡是与本发明具有相同或相近的技术方案,均落入本发明的保护范围之内。
序列表
<110>暨南大学
<120>食蚊鱼nrf2基因及其提取方法及特异性一抗抗体制备方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>803
<212>dna
<213>食蚊鱼(2ambystomalateralexambystomajeffersonianum)
<400>1
ccgcgtacgggcggagcttgaggaggagaagagctgcacttgatgcaggagcaggagaag60
gccctgctggcgcagctgcagctggatgaggaaacgggagagtacataccccgcccgcct120
cccagcgcccctctgcagccgaccatcacacccctggaggttactcagaatgccggcttc180
acacaggagacaggtgacagcatgtcatttgatgagtgtttgcagctcctggcagagacg240
tttcccatagagcaaactccgactcccccggtttgcctggatgcacctgctgtttcagta300
cccatgatgatgtccccaaagcagccagctctgtcgccagccaccctgtcctcaggtcag360
ccgactccgccacagagaatgtctcccgatctggaggaggcttggatggagctcttgtca420
ctccctgagctacagcaatgtctgaacatgcaaatggaagacacgttgcagaccacaaca480
taccctctcccagccaatgctgaagcacagactccaagctaccctaactatccccctgtc540
caagctcctatttttaaccccctaaacagcatcaacaatgtcaaaacaaacagtctgaat600
gttggccccgcagagtttatgaatacattggatggctccattcccagcttggctccgtca660
aatgctattcagacagatcgaagtggacgcccccaacctagatacaagcttcagtggaga720
aggttttggtggggtgtttttatccaacaactgagctggatgagtgcagcagtcagcaca780
accaagaagaaaatgaaagaatg803
<210>2
<211>239
<212>prt
<213>食蚊鱼(2ambystomalateralexambystomatexanum)
<400>2
leuleualaglnleuglnleuaspglugluthrglyglutyrilepro
151015
argproproproseralaproleuglnprothrilethrproleuglu
202530
valthrglnasnalaglyphethrglngluthrglyaspsermetser
354045
pheaspglucysleuglnleuleualagluthrpheproileglugln
505560
thrprothrproprovalcysleuaspalaproalavalservalpro
65707580
metmetmetserprolysglnproalaleuserproalathrleuser
859095
serglyglnprothrproproglnargmetserproaspleugluglu
100105110
alatrpmetgluleuleuserleuprogluleuglnglncysleuasn
115120125
metglnmetgluaspthrleuglnthrthrthrtyrproleuproala
130135140
asnalaglualaglnthrprosertyrproasntyrproprovalgln
145150155160
alaproilepheasnproleuasnserileasnasnvallysthrasn
165170175
serleuasnvalglyproalagluphemetasnthrleuaspglyser
180185190
ileproserleualaproserasnalaileglnthraspargsergly
195200205
argproglnproargtyrlysleuglntrpargargphetrptrpgly
210215220
valpheileglnglnleusertrpmetseralaalavalserthr
225230235
- 还没有人留言评论。精彩留言会获得点赞!