一种应用生物炭促进生物还原亚硒酸盐的方法
本发明属于污染物的生物处理技术领域,特别是涉及一种应用生物炭促进微生物还原亚硒酸盐的方法。
背景技术:
硒是一种多变价的元素,在自然界中主要以硒化物(se(-ii))、单质硒(se(0))、亚硒酸盐(se(iv))及硒酸盐(se(vi))等四种形态存在。其中,se(iv)和se(vi)具有较强的生物毒性、高溶解度和生物可利用性,通过采矿、农业和石化生产及工业废料处置等途径进入环境后可造成严重污染和危害。。在受污染的地表水中存在的se(iv)和se(vi)可以进入水生食物链,并以硒蛋白的形式进行生物累积,达到毒性水平,影响鱼类、鸟类和陆生动物的正常发育,破坏生态平衡,近些年国内外都曾发生硒污染导致的人和动物中毒,以及鱼类和禽类发育畸变的事件。通过化学或生物还原,将se(iv)/se(vi)转化成水溶性较差、生物可利用性低的单质硒,可有效解决硒污染和毒性问题。
环境中的部分微生物可通过自身代谢过程实现对se(iv)的还原转化。shewanellaoneidensismr-1广泛分布于天然环境中,具有多样化的产能代谢和电子传递途径,能够利用外膜上的细胞色素c、纳米导线以及自身分泌或外加的氧化还原介体等三种方式,向胞外电子受体传递电子,还原转化多种污染物。ze-chaoxia等在2016年biochemistry第3卷第408-413页和carolyn等在2009年environmentaltechnology第30卷第12期第1313-1326页报道了s.oneidensismr-1通过厌氧呼吸合成硒纳米颗粒,展示了mr-1还原亚硒酸盐合成硒纳米颗粒的潜力。
醌类化合物及腐殖质等氧化还原介体,可以加速电子由细胞转移到胞外电子受体的过程,从而促进生物还原转化氧化态污染物。xiujuanwang等在2011年bioresourcetechnology第102卷第3期第3268-3271页和ze-chaoxia等在2016年biochemistry第3卷第408-413页报道了利用醌类物质强化微生物还原亚硒酸盐。但以水溶性醌类化合物作为氧化还原介体成本高昂,具有一定生物毒性的醌类化合物随水流失易造成二次污染,限制了介导还原技术的有效应用。
生物炭是在限氧条件下通过生物质的高温热分解(通常<700℃)产生的一种细粒度多孔隙碳材料,常作为土壤改良剂用于增加土壤肥力和污染土壤修复。t.j.purakayastha等人在2019年chemosphere第227卷第345-365页综述了生物炭在增加土壤肥力提高作物产量方面的应用。相比醌类化合物,生物炭生物毒性较低,原材料来自天然环境中废弃生物质,制备工艺相对简单,应用成本低廉。与其他可以作为氧化还原介体的碳材料类似,生物炭具有良好的导电性、较高的比表面积和丰富的表面官能团。近年来,已有研究发现生物炭能够促进生物还原。shengnanxu等在2016年environmentalscience&technology第50卷第2389-2395页报道了生物炭介导赤铁矿还原的研究。基于上述认识,申请人提出利用生物炭促进s.oneidensismr-1还原转化亚硒酸盐,提高硒污染治理效率。目前尚未见有关利用生物炭促进微生物还原含氧阴离子为相应单质颗粒的报道。
技术实现要素:
本发明的目的是提供一种应用生物炭快速有效地促进生物还原亚硒酸盐的方法,该方法成本低廉、还原效率高,可产生单质硒纳米颗粒。
本发明的技术方案:
一种应用生物炭促进生物还原亚硒酸盐的方法,包括以下步骤:
(1)微生物的培养:采用胰酪大豆胨液体(tsb)培养基培养s.oneidensismr-1,作为还原se(iv)的菌种。调节培养基ph至7.2,并在121℃,30min的条件下高压蒸汽灭菌。s.oneidensismr-1在无菌操作台接种至培养基,接种比例为1:100;接种后的培养基在30℃,150rpm恒温摇床中培养13h,得到对数生长期末期的s.oneidensismr-1菌液备用。
(2)配制25mm哌嗪-1,4-二乙磺酸(pipes)缓冲溶液,加入乳酸钠,乳酸钠的终浓度为25mm,并转移至50ml的玻璃厌氧瓶中,以0.15mm的naoh调节ph至7.0。通氮气曝气30min,将厌氧瓶顶空及水溶液中的氧气排尽后,放入高压蒸汽灭菌锅灭菌,冷却至室温后转移至厌氧箱中以确保体系始终处于厌氧状态。
(3)配制40mm的亚硒酸钠溶液。
(4)在厌氧箱中,用移液枪吸取0.1-2ml上述亚硒酸钠溶液转移至厌氧瓶中,得到亚硒酸钠终浓度为0.1-2mm的反应体系。
(5)称取生物炭,并在厌氧箱中转移到厌氧瓶中,终浓度为0.2-5g/l,超声1h使其均匀分散在溶液中。
(6)收集培养至对数期末期的微生物细胞,并转移至厌氧瓶中,使体系光密度od600=0.3-1.5。然后将厌氧瓶放入150rpm,30℃恒温摇床中,避光反应1-6d。
本实验以收集自山东省某农田的小麦秸秆为生物质,采用慢速限氧热解法制备生物炭材料。将小麦秸秆用超纯水洗涤数次,在65℃下烘干24h后利用粉碎机将其粉碎。将粉碎的小麦秸秆粉末置于石英舟内,放入管式电阻炉中,持续通入氮气(30ml/min),既保证炉内厌氧环境又可将热解过程中产生的气态有机产物吹扫出热解炉。以15℃/min的速率升温至目标热解温度(300℃、500℃或700℃),恒温2.5h,自然冷却降至室温后取出炭化产物,将所得的生物炭样品用球磨机研磨1h,即得到本研究所使用的不同热解温度的生物炭:bc300、bc500和bc700。
本发明的效果和益处是能够快速有效地提高亚硒酸盐的生物还原效率和速率,且所采用的生物炭材料制备工艺简单,原材料来源广泛,成本低廉,可操作性强,便于在实际中推广应用。
附图说明
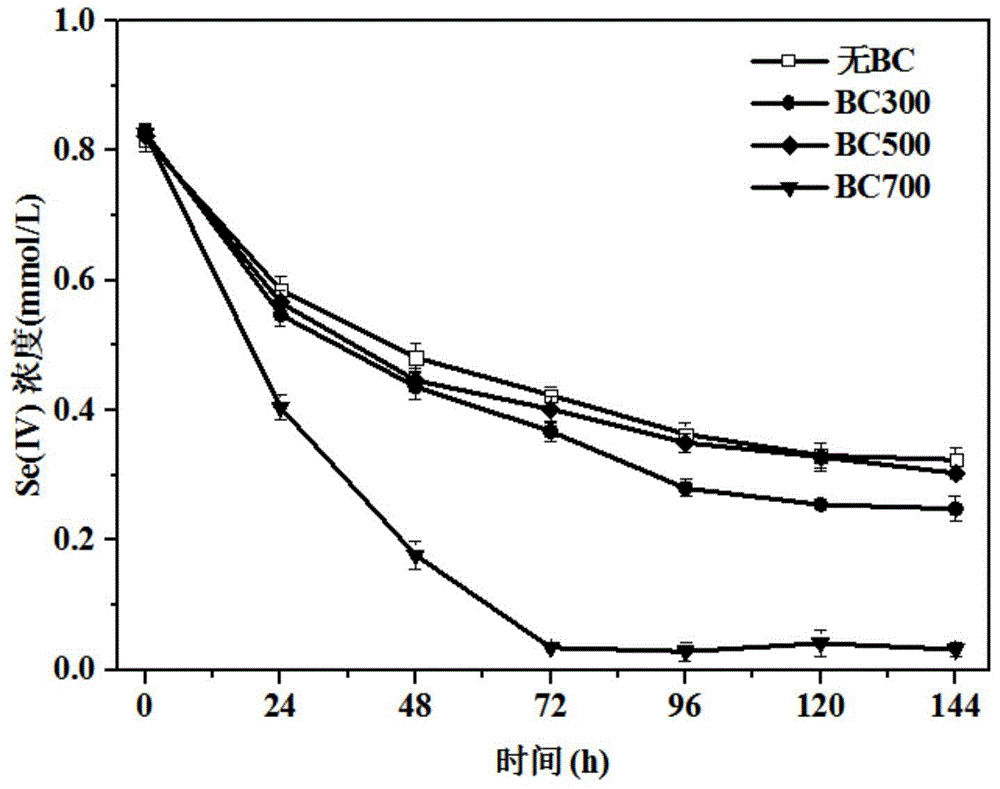
图1是不同热解温度条件下制备的生物炭促进生物还原se(iv)。
图2是生物炭浓度对生物还原se(iv)的影响。
图3是生物量对生物还原se(iv)的影响。
图4是生物炭促进生物还原不同浓度的se(iv)。
图5是生物炭促进生物重复还原se(iv)。
具体实施方式
以下结合附图和技术方案,进一步说明本发明的具体实施方式。
实施例1
不同热解温度条件下制备的生物炭促进生物还原se(iv)。
(1)生物炭的制备:将小麦秸秆粉末置于管式热解炉中,以15℃/min的升温速率分别加热至300℃、500℃和700℃,恒温热解2.5h,热解过程中持续向管式炉中通入氮气,既保证炉内厌氧环境又可将产生的气态有机产物吹扫出热解炉。自然冷却后取出剩余炭化产物,球磨1h,分别得到不同热解温度制备的限氧热解生物炭:bc300、bc500和bc700。
(2)微生物的培养:采用tsb培养基培养s.oneidensismr-1,作为还原se(iv)的菌种。调节培养基ph至7.2,并在121℃,30min的条件下高压蒸汽灭菌。s.oneidensismr-1在无菌操作台接种至培养基,接种比例为1:100;接种后的培养基在30℃,150rpm恒温摇床中培养13h,得到对数生长期末期的s.oneidensismr-1菌液备用。
(3)配制25mm的pipes缓冲溶液,加入乳酸钠,乳酸钠的终浓度为25mm,并转移至50ml的玻璃厌氧瓶中,以0.15mm的naoh调节ph至7.0。然后通氮气曝气30min,将厌氧瓶顶空及溶液中的氧气排尽后转移至厌氧箱中以确保厌氧瓶内体系处于厌氧状态。
(4)配制40mm的亚硒酸钠溶液。
(5)在厌氧箱中,用移液枪吸取0.8ml上述亚硒酸钠溶液转移至厌氧瓶中,得到亚硒酸钠终浓度为0.8mm的反应体系。
(6)分别称取bc300、bc500和bc700,在厌氧箱中转移到厌氧瓶中,使各反应体系内生物炭终浓度均为1g/l,超声1h使其均匀分散。
(7)收集培养至对数期末期的mr-1细胞,并转移至厌氧瓶中,使体系光密度od600=0.5。然后将厌氧瓶放入150rpm,30℃恒温摇床中,避光反应6d,期间每24h取样一次,采用紫外分光光度法检测溶液中剩余se(iv)的浓度。所有实验均平行进行3次,同时设置不加入生物炭仅有微生物还原se(iv)的对照实验。
经以上实验测得:加入bc300、bc500和bc700生物炭后,反应24h后,se(iv)还原率分别为26.8%,28.7%和48.1%;反应144h后,各体系中se(iv)浓度基本不再下降,最终se(iv)还原率分别达到66.8%,63.1%和96.0%,而不添加生物炭的对照体系中se(iv)最终还原率仅为59.8%。实验结果说明,在700℃下热解制备的生物炭对mr-1还原se(iv)的促进效果最好。
实施例2
生物炭浓度对生物还原se(iv)的影响。
(1)选择bc700作为本实施例中的生物炭材料。
(2)微生物的培养:同实施例1。
(3)配制25mm的pipes缓冲溶液,加入乳酸钠,乳酸钠的终浓度为25mm,并转移至50ml的玻璃厌氧瓶中,以0.15mm的naoh调节ph至7.0。然后通氮气曝气30min,将厌氧瓶顶空及溶液中的氧气排尽后转移至厌氧箱中以确保厌氧瓶内体系处于厌氧状态。
(4)配制40mm的亚硒酸钠溶液。
(5)在厌氧箱中,用移液枪吸取0.8ml上述亚硒酸钠溶液转移至厌氧瓶中,得到亚硒酸钠终浓度为0.8mm的反应体系。
(6)称取bc700,在厌氧箱中转移到不同厌氧瓶中,使生物炭终浓度分别为0.2、0.5、1、2、3和5g/l,超声1h使其均匀分散在溶液中。
(7)收集培养至对数期末期的mr-1细胞,并转移至厌氧瓶中,使体系光密度od600=0.5。然后将厌氧瓶放入150rpm,30℃恒温摇床中,避光反应6d,期间每24h取样一次,采用紫外分光光度法检测溶液中剩余se(iv)的浓度。所有实验均平行进行3次,同时设置不加入生物炭仅有微生物还原se(iv)的对照实验。
经以上实验测得:在无生物炭的对照组中,反应24h后se(iv)还原率为28.2%,反应144h后se(iv)还原率为60.4%。而在分别加入0.2、0.5、1、2、3和5g/l生物炭材料的实验组中,反应24h后se(iv)还原率分别为28.9%、29.2%、51.2%、91.6%、72.4%和27.9%,反应144h后se(iv)还原率分别可达65.0%、69.3%、95.6%、96.2%、95.4%和79.3%。此外,当bc700浓度为2g/l时,体系初始se(iv)还原速率最高(0.044mm/(gcell·h)),为不添加生物炭对照体系的3.2倍。因此,当添加生物炭浓度为2g/l时,对微生物还原se(iv)的促进效果最为显著。
实施例3
生物量对生物还原se(iv)的影响。
(1)选择bc700作为本实施例中的生物炭材料。
(2)微生物的培养:同实施例1。
(3)配制25mm的pipes缓冲溶液,加入乳酸钠,乳酸钠的终浓度为25mm,并转移至50ml的玻璃厌氧瓶中,以0.15mm的naoh调节ph至7.0。然后通氮气曝气30min,将厌氧瓶顶空及溶液中的氧气排尽后转移至厌氧箱中以确保厌氧瓶内体系处于厌氧状态。
(4)配制40mm的亚硒酸钠溶液。
(5)在厌氧箱中,用移液枪吸取0.8ml上述亚硒酸钠溶液转移至厌氧瓶中,得到亚硒酸钠终浓度为0.8mm的反应体系。
(6)称取bc700,在厌氧箱中转移到厌氧瓶中,使生物炭终浓度分别为1g/l,超声1h使其均匀分散在溶液中。
(7)收集培养至对数期末期的微生物细胞,并转移至不同厌氧瓶中,使体系光密度od600分别为0.3、0.7、1.0和1.5。然后,将厌氧瓶放入150rpm,30℃恒温摇床中,避光反应6d,期间每24h取样一次,采用紫外分光光度法检测溶液中剩余se(iv)的浓度。所有实验均平行进行3次,同时在不同生物量条件下均对应设置不添加生物炭的对照组。
经以上实验测得:反应144h后,,对于初始od600=0.3的反应体系,添加生物炭后se(iv)的还原率由42.5%提高至94.6%;体系光密度od600=0.7时,se(iv)的还原率分别为78.6%和95.5%,加入bc700后还原率提高了16.9%;当体系光密度继续提高到od600=1.0以及od600=1.5时,还原率分别为96.3%和96.4%以及94.9%和94.2%,即当生物量增加时,加入bc700后并不能显著改善se(iv)的生物还原率。以上结果表明,在生物量较低时(od600=0.3),生物炭介导mr-1还原se(iv)的促进效果最为显著。
实施例4
生物炭促进生物还原不同浓度的se(iv)。
(1)选择bc700作为本实施例中的生物炭材料。
(2)微生物的培养:同实施例1。
(3)配制25mm的pipes缓冲溶液,加入乳酸钠,乳酸钠的终浓度为25mm,并转移至50ml的玻璃厌氧瓶中,以0.15mm的naoh调节ph至7.0。然后通氮气曝气30min,将厌氧瓶顶空及溶液中的氧气排尽后转移至厌氧箱中以确保厌氧瓶内体系处于厌氧状态。
(4)配制40mm的亚硒酸钠溶液。
(5)在厌氧箱中,用移液枪吸取0.1-2ml上述亚硒酸钠溶液转移至不同的厌氧瓶中,分别得到亚硒酸钠终浓度为0.1-2mm的反应体系。
(6)称取bc700,在厌氧箱中转移到厌氧瓶中,使生物炭终浓度分别为1g/l,超声1h使其均匀分散。
(7)收集培养至对数期末期的mr-1细胞,并转移至厌氧瓶中,使体系光密度od600=0.5。然后将厌氧瓶放入150rpm,30℃恒温摇床中,避光反应6d,期间每24h取样一次,采用紫外分光光度法检测溶液中剩余se(iv)的浓度。所有实验均平行进行3次,同时设置不加入生物炭仅有微生物还原se(iv)的对照实验。
经以上实验测得:当se(iv)初始浓度为0.6mm、1.0mm、1.25mm、1.5mm和2.0mm时,在未添加bc700的对照体系中,se(iv)在96h内的还原率分别为73.5%、71.8%、60.4%、58.5%和50.5%;而在添加bc700的体系中se(iv)的还原率分别为95.2%、95.5%、96.6%、78.3%和55.1%。说明在生物炭浓度为1g/l,菌的光密度od600=0.5的条件下,本发明方法对浓度为1.25mm以下的se(iv)几乎实现完全还原,而对浓度高于1.25mm的se(iv)仍表现出较仅含mr-1的对照组更强的还原能力。
实施例5
生物炭促进生物重复还原se(iv)。
(1)选择bc700作为本实施例中的生物炭材料。
(2)微生物的培养:同实施例1。
(3)配制25mm的pipes缓冲溶液,加入乳酸钠,乳酸钠的终浓度为25mm,并转移至50ml的玻璃厌氧瓶中,以0.15mm的naoh调节ph至7.0。然后通氮气曝气30min,将厌氧瓶顶空及溶液中的氧气排尽后转移至厌氧箱中以确保厌氧瓶内体系处于厌氧状态。
(4)配制40mm的亚硒酸钠溶液。
(5)在厌氧箱中,用移液枪吸取0.8ml上述亚硒酸钠溶液转移至厌氧瓶中,得到亚硒酸钠终浓度为0.8mm的反应体系。
(6)称取bc700,在厌氧箱中转移到不同厌氧瓶中,使生物炭浓度为1g/l,超声1h使其均匀分散在溶液中。
(7)收集培养至对数期末期的mr-1细胞,并转移至厌氧瓶中,使体系光密度od600=1.5。然后将厌氧瓶放入150rpm,30℃恒温摇床中,避光反应。期间每24h取样一次,采用紫外分光光度法检测溶液中剩余se(iv)的浓度。同时设置不加入生物炭仅有微生物还原se(iv)的对照实验。
(8)当体系中se(iv)的还原率达到90%以上时,补充加入上述亚硒酸钠溶液,使得se(iv)浓度恢复至初始设定值(0.8mm),继续进行下一轮还原,共重复进行3次循环。
经以上实验测得:在第一轮还原实验中,添加bc700的体系中se(iv)的还原率在48h达98.8%,由于使用生物量较高,促进效果并不显著,仅比未添加bc700的体系中se(iv)的还原率(95.5%)略高。然而,在第二轮还原实验中,添加生物炭的体系促进还原效果显著:反应120h时,未添加bc700的体系中se(iv)的还原率为54%,而添加bc700后,还原率高达93.2%。此外,添加bc700的体系仍可继续进行第三轮还原,到216h时,还原率仍可高达85%,而未添加bc700的对照体系在相同反应时间内仅对第二轮添加se(iv)达到相近的还原率。以上结果表明,投加生物炭可显著提高mr-1细胞的重复使用性及生物对se(iv)的循环处理能力。
- 还没有人留言评论。精彩留言会获得点赞!