一种人源细胞制剂静脉输入动物体内脏器组织分布的检测方法与流程
1.本发明属于生物医药技术领域,具体涉及一种人源细胞制剂静脉输入动物体内脏器组织分布的检测方法。
背景技术:
2.近年来,多种干细胞(如人脐带间充质干细胞,uc-mscs)因其组织细胞再生修复能力,在诸多疾病,如心肌损伤、肺损伤、肝脏疾病、骨关节炎、糖尿病及其并发症等治疗中的应用引起了人们的广泛关注。在药物研发过程中,研究药物在体内的代谢和运动是必须包括的项目,为了研究细胞药物在体内的代谢和运动,必须通过动物试验,将人源细胞移植到实验动物体内并进行示踪。人源细胞在移植后,可能随血流或通过其他途径从移植位点迁移致其他器官或组织,所以检测方法必须可以检测实验动物包括血液在内的不同器官和组织内的人源细胞。然而,评价细胞植入、分布、存活、迁移、分化和功能的干细胞标记示踪研究明显滞后于整体功能改善的观察,成为干细胞治疗机制探讨的瓶颈因素和新的研究热点。
3.目前的检测手段包括非侵入式和侵入式两大类。非侵入式检测主要靠活体成像技术(in vivo imaging system,ivis)(如利用荧光体外标记细胞)或其他标记(如同位素标记、转基因及磁性离子等),然后在体内追踪细胞制剂,来判断细胞制剂的存活以及命运,从而在整体水平上定性地反映细胞制剂在体内的分布。利用该方法,首先需要对进入体内的细胞制剂进行标记或修饰,操作复杂,过程繁琐,并且一些标记手段会对细胞制剂的活性以及体内清除率有所影响。侵入式检测主要靠收集体液或组织样本,提取组织或体液样本总dna,通过定量pcr(q-pcr)或半定量pcr法检测dna样本中人体细胞染色体dna上看家基因(如β-actin、globin、gapdh等基因)含量,从而推算组织或体液样本中人体细胞药物含量(周进明,邹仲敏.培养小鼠骨髓间充质干细胞及其移植后在体内的定位分布[j].中华放射医学与防护杂志,2002,22(3):167-169;邓为民,李长虹,廖联明等.成体骨髓源多能间充质干细胞体内分化皮肤干细胞和皮肤组织[j].细胞生物学杂志,2003,25(2):98-104;deng w,han q,liao l,et al.engrafted bone marrow-derived flk-(1+)mesenchymal stem cells regenerate skin tissue.tissue eng,2005,11(1-2):110-119)。该方法可以用于人体细胞药物在小鼠、大鼠等与人同源性低的动物体内分布的研究,但由于人与猴基因序列同源性高,看家基因序列基本一致,用该方法就无法区分人和猴的染色体dna,也就无法检测猴子体内人体细胞的含量。因此该方法目前仅用于人体细胞药物在啮齿类动物体内分布情况的研究,应用范围较窄。
[0004]
因此,迫切需要一种能够有效研究人体细胞药物在各种动物体内分布特点的方法,来研究人体细胞药物作为治疗药物的安全性,以解决现有技术中存在的问题。
技术实现要素:
[0005]
本发明目的在于提供一种人源细胞制剂静脉输入动物体内脏器组织分布的检测方法。线粒体dna(mtdna)是独立于细胞核染色体外的又一基因组,线粒体dna结构简单,分子量小,易于在真核生物(尤其是哺乳动物)种属间进行比较,因此可以通过比对种属间线粒体基因组序列找到人特异性基因片段。看家基因在生物体各组织和细胞中的表达相对恒定,高度保守,表达水平受环境因素影响较小,在检测基因的表达水平变化时常用看家基因作为内参基因来做参照物。常用的内参基因如β-actin,gapdh,18s-rrna等。本发明设计出相对于动物的人源细胞内线粒体dna具有特异性的引物和相对于人的动物内参基因引物。采用qpcr检测目的基因片段,发现目的基因片段的产物特异性好,ct值与模板含量的相关系数高。为了比较不同样本之间目的基因含量,弥补制备过程中样本纯度和浓度的差别,本发明使用内参基因以校正dna用量,由此,建立了一套简单、通用、高灵敏度的qpcr分析方法。以改善目前的限制条件,能够快速有效研究人类细胞制剂静脉输注到各种动物体内后的器官组织分布特点,确定待检细胞药物的治疗安全性与有效性。
[0006]
为达成上述目的,本发明采用如下技术方案:
[0007]
第一方面,本发明提供一种检测人源细胞的方法,其特征在于以seq id no.1所示片段为模板,设计特异性引物,采用rt-qpcr法检测。
[0008]
根据本发明,所述方法检测的是动物体、动物组织或动物细胞培养物中的人源细胞的分布。优选地,检测的是人源细胞制剂静脉输入实验性动物体内脏器组织或血液分布。
[0009]
根据本发明,所述检测方法包括如下步骤:
[0010]
(1)根据ncbi-genome中所提供的人类和大鼠线粒体基因组,经过比对获得差异最大的片段,所述片段的核苷酸序列如seq id no.1所示,以获得的片段为模板,设计人源细胞线粒体dna特异性引物a和大鼠dna内参基因特异性引物;
[0011]
(2)提取人源细胞制剂细胞和大鼠脏器组织或血液dna,分别进行梯度稀释,并指定梯度稀释的dna起始浓度的相对百分比浓度为100%,利用实时定量rt-qpcr,分别建立人源细胞线粒体dna特异性引物a和大鼠内参基因特异性引物的rt-qpcr扩增的标准曲线,所述标准曲线的x轴为各类dna的相对百分比浓度,y轴为各相对百分比浓度的dna经引物a或大鼠内参基因特异性引物扩增获得的ct值;
[0012]
(3)人源细胞制剂给予大鼠之后,按照需要观察的时间点采集大鼠脏器组织、血液,提取样本总dna进行rt-qpcr反应,得到引物a和大鼠内参基因引物扩增的ct值;
[0013]
(4)步骤(3)获得的ct值通过步骤(2)的标准曲线计算,分别获得各脏器组织或血液总dna样本中引物a或大鼠内参基因引物扩增的dna模板的相对百分比浓度,将人源细胞线粒体dna特异性引物a扩增的dna模板的相对百分比浓度除以大鼠内参基因特异性引物扩增的dna模板的相对百分比浓度,获得的比值对大鼠脏器组织或血液中人源dna含量进行表征。
[0014]
优选地,所述步骤(2)包括:将一定量的人源细胞dna和大鼠dna分别按2-20倍梯度稀释后,分别进行rt-qpcr;优选5-15倍梯度稀释;更优选10倍梯度稀释;根据反应体系所产生的循环数ct值,绘制dna的相对百分比浓度-ct值的标准曲线,即分别建立引物a和大鼠内参基因引物的rt-qpcr扩增的标准曲线。
[0015]
优选地,所述人源细胞线粒体dna特异性引物a为homo1,homo1序列如下:
[0016]
forward:5
′‑
ccatcctccgtgaaatcaat-3
′
(seq id no.2)
[0017]
reverse:5
′‑
gggaacgtgtgggctattta-3
′
(seq id no.3);
[0018]
优选地,所述大鼠内参基因为gapdh,gapdh引物序列如下:
[0019]
forward:5
′‑
gcaagttcaacggcacag-3
′
(seq id no.4)
[0020]
reverse:5
′‑
gccagtagactccacgaca-3
′
(seq id no.5)。
[0021]
进一步优选地,所述步骤(2)中,配制浓度为25ng/μl的人源细胞dna或大鼠dna,以25ng/μl作为梯度稀释的dna起始浓度,其dna的相对百分比浓度为100%,依次稀释2倍、20倍、200倍、2000倍、20000倍和200000倍,即得到相对百分比浓度分别为50%、5%、0.5%、0.05%、0.005%、0.0005%的dna梯度稀释样品,各取1μl进行rt-qpcr,每个浓度设3个复孔,以ct均值为y轴,以人源细胞dna的相对百分比浓度为x轴,建立人源细胞线粒体dna特异性引物homo1的标准曲线;按照同样的方法建立大鼠内参基因gapdh的标准曲线。
[0022]
进一步优选地,所述步骤(2)中,按下列rt-qpcr反应条件扩增目的基因片段:
[0023][0024]
更优选为:
[0025][0026]
优选地,所述步骤(2)中rt-qpcr反应体系:dna模板1μl,引物homo1/大鼠gapdh上下游引物各0.5μm,2
×
gold sybr green 5μl,用ddh2o补齐10μl总反应体积。
[0027]
优选地,所述步骤(3)中,人源细胞制剂给予大鼠后,利用dna提取试剂盒提取各脏器组织及全血总dna,提取的样本总dna进行rt-qpcr反应;所述各脏器组织包括心、肝、脾、肺、肾;所述的人源细胞制剂包括体细胞(如上皮细胞)、体外诱导形成的多能干细胞、造血干细胞、间充质干细胞、神经干细胞、肝干细胞、表皮干细胞、视网膜干细胞等,优选为人间充质干细胞,更优选为人脐带间充质干细胞;rt-qpcr反应条件与标准曲线建立反应条件相同。
[0028]
优选地,所述步骤(4)中,利用步骤(2)的标准曲线,根据各脏器组织样本或血液总
dna经过引物homo1和大鼠gapdh引物进行rt-qpcr反应产生的ct值,分别计算样品总dna中引物homo1和大鼠gapdh引物扩增的dna模板的相对百分比浓度,采用二者比值对大鼠脏器组织或血液中人源dna含量进行表征。
[0029]
第二方面,本发明提供一种检测人源细胞的试剂盒,所述试剂盒包含以核苷酸序列如seq id no.1所示的这段序列为模板,设计的人源细胞线粒体dna特异性引物a和大鼠内参基因特异性引物。
[0030]
根据本发明,所述试剂盒是测定动物体、动物组织或动物细胞培养物中的人源细胞的分布。优选地,所述试剂盒用于测定人源细胞制剂静脉输入实验性动物体内脏器组织或血液分布。优选地,所述人源细胞线粒体dna特异性引物a为homo1,homo1序列如下:
[0031]
forward:5
′‑
ccatcctccgtgaaatcaat-3
′
(seq id no.2)
[0032]
reverse:5
′‑
gggaacgtgtgggctattta-3
′
(seq id no.3)。
[0033]
优选地,所述大鼠内参基因为gapdh,gapdh引物序列如下:
[0034]
forward:5
′‑
gcaagttcaacggcacag-3
′
(seq id no.4)
[0035]
reverse:5
′‑
gccagtagactccacgaca-3
′
(seq id no.5)。
[0036]
第三方面,本发明提供一种引物,其特征在于,所述引物序列为:
[0037]
forward:5
′‑
ccatcctccgtgaaatcaat-3
′
(seq id no.2)
[0038]
reverse:5
′‑
gggaacgtgtgggctattta-3
′
(seq id no.3)。
[0039]
第四方面,本发明提供上述引物和/或试剂盒的应用,
[0040]
根据本发明,所述引物和/或试剂盒用于测定动物体、动物组织或动物细胞培养物中的人源细胞的分布。优选地,所述引物和/或试剂盒用于测定人源细胞制剂静脉输入实验性动物体内脏器组织或血液分布。
[0041]
根据本发明,所述引物和/或试剂盒还可以用于药物代谢动力学研究。
[0042]
有益效果:
[0043]
采用现有技术方法,只能定性检测到人类细胞在动物某一部位富集,而无法检测在其他组织的分布,也无法准确定量在富集部位的含量。相比于现有技术,采用本发明的检测方法用于研究人源细胞制剂在动物体内的分布,具体优点如下:
[0044]
(1)直接研究体细胞制剂本身,不需要对细胞制剂进行修饰,试验方法简单,结果可靠;(2)实验过程简单,只需要常规的dna提取和rt-qpcr技术,不需要大型的、复杂的试验设备,一般实验室都可以进行;(3)使用人源线粒体dna相对于其它种属的特异性片段进行扩增,专属性高且易扩增,检测的灵敏度大大提高,检测限可低至0.125pg/μl,满足药代动力学研究对于动物体内细胞药物残留检测限的要求;(4)使用rt-qpcr方法相对于传统的pcr法、流式细胞检测(facs)法,实验内和实验间的可重复性大大提高,保证实验结果的可靠性,满足药代动力学研究对于动物体内细胞药物代谢曲线测定的精准性要求。
附图说明
[0045]
图1.人类线粒体基因组和大鼠线粒体基因组差异最大、最多的一段dna序列比对结果图;
[0046]
图2.实施例1中将uc-mscs和大鼠肾小管上皮细胞nrk52e dna按照一定比例混合后用引物homo1进行rt-qpcr扩增所得到的扩增曲线;
[0047]
其中,“1”到“7”表示uc-mscs dna在上述混合dna中的百分比浓度分别为100%、50%、5%、0.5%、0.05%、0.005%、0.0005%,将浓度为25ng/μl的uc-mscs dna设为100%;
[0048]
图3.实施例1中uc-mscs dna的百分比浓度分别为100%、50%、5%、0.5%、0.05%、0.005%、0.0005%及0%(即nrk52e dna)时用引物homo1进行rt-qpcr扩增所得到的熔解曲线;
[0049]
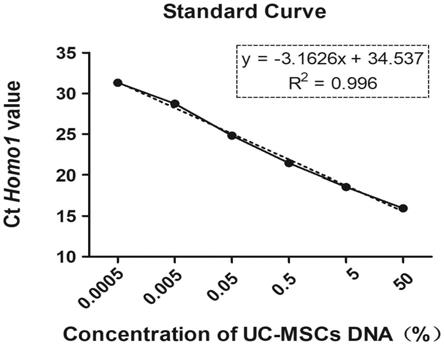
图4.实施例1中uc-mscs dna相对百分比浓度为0.0005%-50%时,用引物homo1对其分别进行rt-qpcr扩增获得的ct值之间建立的标准曲线(以平均值
±
sem表示);
[0050]
图5.nrk52e dna相对百分比浓度为0.0001%-100%时,用大鼠gapdh引物对其分别进行rt-qpcr扩增获得的ct值之间建立的标准曲线(以平均值
±
sem表示);
[0051]
图6.实施例2的人特异性引物homo1的rt-qpcr反应体系的重复性检测图;
[0052]
a-f为独立的rt-qpcr运行后的标准曲线;
[0053]
图7.实施例3尾静脉注射uc-mscs后的不同时间点大鼠血液dna中uc-mscs引物homo1 rt-qpcr扩增模板dna的相对百分比浓度与大鼠gapdh引物rt-qpcr扩增模板dna的相对百分比浓度比值随时间变化曲线(以平均值
±
sem表示);
[0054]
图8.实施例3中尾静脉注射uc-mscs后的不同时间点大鼠各脏器组织dna中uc-mscs引物homo1 rt-qpcr扩增模板dna的相对百分比浓度与大鼠gapdh引物rt-qpcr扩增模板dna的相对百分比浓度比值(以平均值
±
sem表示)比较图;
[0055]
图9.实施例4中尾静脉注射uc-mscs后,分别于24和48小时uc-mscs引物homo1 rt-qpcr扩增模板(即人源dna)在正常和aki大鼠肾脏中的分布图(以平均值
±
sem表示),*p《0.05表示显著差异;
[0056]
图10.实施例5中尾静脉注射uc-mscs 2周后的uc-mscs引物homo1 rt-qpcr扩增模板(即人源dna)在正常和dn大鼠的脏器组织中的分布图(以平均值
±
sem表示),**p《0.01表示极显著差异。
具体实施方式
[0057]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0058]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0059]
除非另外定义或由背景清楚指示,否则在本公开中的全部技术与科学术语具有如本公开所属领域的普通技术人员通常理解的相同含义。
[0060]
实施例1:人特异性基因片段和引物验证以及标准曲线的建立
[0061]
在ncbi-genome中搜索homo sapiens mitochondrion和rat sapiens mitochondrion,找到所述的人类线粒体基因组(refseq:nc_012920.1),大鼠线粒体基因组(refseq:nc_001665.2);在https://www.justbio.com/hosted-tools.html上将找到的两对序列进行比对,找到差异最大、最多的一段dna序列,两者比对结果如图1所示,该段dna的核苷酸序列如seq id no.1所示。以获得的这段dna为模板,使用primer 3软件进行引物设计,同时以动物内参基因(如大鼠gapdh)为模板,设计动物内参基因引物;引物长度在15-50
碱基,优选17-30碱基,更优选20-27碱基;设计好的引物在ncbi-blast中,与homo sapiens和rat sapiens进行比对,找到比对结果最好(即得到非特异性扩增产物最少)的一对序列作为最终引物,所述的人特异性引物homo1和大鼠内参基因gapdh引物序列如下:
[0062]
human homo1:
[0063]5′‑
ccatcctccgtgaaatcaat-3
′
(forward)
[0064]5′‑
gggaacgtgtgggctattta-3
′
(reverse)
[0065]
rat gapdh:
[0066]5′‑
gcaagttcaacggcacag-3
′
(forward)
[0067]5′‑
gccagtagactccacgaca-3
′
(reverse)
[0068]
将设计好的引物序列交给天一辉远生物科技有限公司进行引物合成。
[0069]
1)依赖于上述人源细胞线粒体dna特异性引物homo1设计rt-qpcr反应体系:
[0070]
利用dna提取试剂盒提取细胞dna,按下列反应条件rt-qpcr扩增目的基因片段:
[0071][0072]
反应体系:dna模板1μl,human homo1/rat gapdh上下游引物各0.5μm,2
×
gold sybr green 5μl,用ddh2o补齐10μl总反应体积。
[0073]
2)验证该qpcr反应体系在提取人间充质干细胞(uc-mscs)和大鼠肾小管上皮细胞nrk52e dna的适用性:
[0074]
配制浓度为25ng/μl的uc-mscs dna样品,以25ng/μl nrk52e dna对uc-mscs dna进行梯度稀释,图2中“1”到“7”表示uc-mscs dna浓度分别为100%、50%、5%、0.5%、0.05%、0.005%、0.0005%,将浓度为25ng/μl的uc-mscs dna设为100%。
[0075]
人homo1引物在上述样品中能扩增出单一特异性峰(图2、3),在nrk52e dna中扩增不出产物。因此,本发明设计的人homo1引物具有较好的特异性。同理,大鼠gapdh引物在nrk52e dna中能扩增出单一特异峰,在uc-mscs dna中扩增不出产物(结果未显示)。
[0076]
3)制作人源细胞线粒体dna特异性引物homo1和大鼠内参基因gapdh引物的rt-qpcr扩增的标准曲线
[0077]
将25ng/μl uc-mscs dna的相对百分比浓度指定为100%,用ddh2o分别稀释2倍、20倍、200倍、2000倍、20000倍和200000倍,即得到dna相对百分比浓度分别为50%、5%、0.5%、0.05%、0.005%、0.0005%,各取1μl进行rt-qpcr,每个浓度设3个复孔,以ct均值为y轴,以uc-mscs dna相对百分比浓度值为x轴,建立人源细胞线粒体dna特异性引物homo1的标准曲线;提取对照组大鼠脏器组织或血液dna,按照同样的方法建立大鼠内参基因gapdh的标准曲线,所述对照组为同等饲养条件下未经造模和msc治疗的大鼠。由图4可知,人源细
胞线粒体dna特异性引物homo1的标准曲线r2为0.996,扩增效率为107.11%,检测限:浓度为0.125pg/μl,定量限:浓度为0.125pg/μl。大鼠内参基因gapdh的标准曲线r2为0.994,扩增效率为102.54%,如图5所示。
[0078]
每次检测给药后大鼠脏器组织或血液dna样本中的人homo1引物的rt-qpcr扩增模板的量时,都需要同时按照上述方法分别建立人uc-mscs dna的homo1引物和对照组大鼠脏器组织或血液dna的gapdh引物的rt-qpcr扩增的标准曲线。
[0079]
实施例2.人特异性引物homo1的rt-qpcr反应体系的重复性检测
[0080]
样品准备:用ddh2o配制5份浓度为25ng/μl的人源uc-mscs细胞dna样本,作为重复性验证供试品,置于冰盒上备用。按照实施例1中3)的方法稀释样品dna,通过5次独立的rt-qpcr运行导出数据,制备人源细胞线粒体dna特异性引物homo1的rt-qpcr扩增的标准曲线。如图6所示,5次标准曲线的斜率在-3.0303~-3.198,截距在34.043~35.121,r2均大于0.99,扩增效率均介于90%-110%。因此,人源细胞线粒体dna特异性引物homo1重复性试验,符合规定,具有较好的重复性。
[0081]
表1.人特异性引物homo1的qpcr反应体系的重复性检测
[0082][0083]
实施例3.uc-mscs对大鼠尾静脉注射后在脏器组织和血液中的分布
[0084]
1)雄性sd大鼠(6-8周;180-200克)购自湖北省食品药品安全评价中心(中国武汉)。大鼠在标准无菌条件下按光/暗循环喂养12小时,并以标准实验室饲料维持。本研究的所有动物实验均按照中国动物福利委员会《实验动物护理与使用指南》进行,并经湖北省食品药品安全评价中心动物研究中心(以下简称安全评价中心)批准。
[0085]
2)大鼠尾静脉注射2.0
×
106uc-mscs(悬浮于500μl pbs中),分别于注射后0、5、10、15、30、45分钟内眼角静脉丛采血,并于注射后1、2、4、24、48小时和1、2周用2%戊巴比妥钠麻醉大鼠,心脏采血,然后行安乐死,采集大鼠心、肝、脾、肺、肾,-80℃快速冷冻,提取脏器组织和血液样本的dna并做进一步分析。
[0086]
3)通过检测人homo1和大鼠gapdh来评价uc-mscs在脏器组织和血液中的生物学分布。uc-mscs(homo1)在大鼠尾静脉注射后30分钟达到最高点,随后迅速下降,2小时消失(图7)。在肺中,uc-mscs注射后4小时内达到峰值。24~48小时后,肺内uc-mscs比例快速减少,并逐步减少至最低。在注射1周后,组织中uc-mscs比例没有显著差异(图8)。以往的追踪研究表明,绝大多数经荧光或同位素标记的mscs在静脉注射后聚集于肺内,这与本发明的研究结果一致,mscs在肺内受阻的主要原因可能是细胞困于肺毛细血管和血管内皮黏附作
用。
[0087]
实施例4.uc-mscs在正常和急性肾损伤大鼠肾脏中的分布
[0088]
1)雄性sd大鼠(6-8周;180-200克)购自湖北省食品药品安全评价中心(中国武汉)。大鼠在标准无菌条件下按光/暗循环喂养12小时,并以标准实验室饲料维持。经过1周的适应性喂养后,将动物随机分为对照组和急性肾损伤(aki)模型组,每组n=4。本研究的所有动物实验均按照中国动物福利委员会《实验动物护理与使用指南》进行,并经湖北省食品药品安全评价中心动物研究中心(以下简称安全评价中心)批准。
[0089]
2)缺血再灌注损伤(ischemia-reperfusion injury,iri)是aki(急性肾损伤)最常见的病因,因此可以通过iri手术建立大鼠aki模型。大鼠腹腔注射戊巴比妥钠麻醉,然后通过中线输尿管切除术和右肾切除术进行腹部切口,将微锯齿钳夹在肾动静脉上闭合45分钟诱导左肾缺血,然后取出左肾开始再灌注。当肾脏由苍白变为红色时,判断肾iri手术成功。对照组大鼠麻醉,腹部切口并缝合,全部大鼠手术后进行康复和护理。aki模型建立后,对照组和aki组大鼠分别尾静脉注射2.0
×
106uc-mscs(悬浮在500μlpbs中),分别于注射后24和48小时取肾,-80℃快速冷冻,提取dna并做进一步分析。
[0090]
在尾静脉注射后24和48小时,aki大鼠肾脏中uc-mscs(homo1)的比例显著高于正常大鼠,此外,与注射后24小时相比,48小时aki大鼠肾脏中uc-mscs(homo1)的比例显著增加(图9),显示uc-mscs在模型组动物的损伤部位进行富集。
[0091]
实施例5.uc-mscs在正常和慢性肾损伤(糖尿病肾病)大鼠肾脏中的分布
[0092]
(1)雄性sd大鼠(6-8周;180-200克)购自湖北省食品药品安全评价中心(中国武汉)。大鼠在标准无菌条件下按光/暗循环喂养12小时,并以标准实验室饲料维持。经过1周的适应性喂养后,将动物随机分为对照组和糖尿病肾病(dn)组,每组n=4。本研究的所有动物实验均按照中国动物福利委员会《实验动物护理与使用指南》进行,并经湖北省食品药品安全评价中心动物研究中心(以下简称安全评价中心)批准。
[0093]
(2)用60mg/kg链脲佐菌素(sigma,美国)单次腹腔注射诱导大鼠dn模型,对照组给予等体积生理盐水处理。24小时后,检测大鼠血糖,连续三天血糖浓度超过16.7mm的大鼠确认为糖尿病大鼠。6周后用代谢笼收集糖尿病大鼠尿液,测量大鼠尿液体积和尿蛋白浓度,并将蛋白尿≥30mg/24h确认为糖尿病肾病。对照组和dn组的大鼠分别尾静脉注射2.0
×
106uc-mscs(悬浮在500μl pbs中),2周后分别采集对照组和dn组大鼠的心、肝、脾、肺、肾组织,并-80℃快速冷冻,后提取dna做进一步分析。
[0094]
(3)除了心脏,dn大鼠的其余脏器组织中uc-mscs(homo1)的比例均高于对照组的大鼠,尤其是在脾脏和肾脏(p《0.01)(图10)。在本发明的实施例中,uc-mscs向dn模型大鼠损伤的肾脏的迁移比对照组的大鼠多,与大量证据一致,注入的uc-mscs更容易向炎症或损伤部位迁移。
[0095]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1