miR-30a-5p作为血管损伤修复分子靶点的应用
mir-30a-5p作为血管损伤修复分子靶点的应用
技术领域
1.本发明涉及生物制药技术领域,尤其涉及一种mir-30a-5p作为血管损伤修复分子靶点的应用。
背景技术:
2.血管损伤往往伴发于各类组织器官损伤,给临床治疗与损伤恢复带来极大负担。尽管血管受损后可以自发的再生,但由于再生速度有限,血液供应不足限制了氧气在受损组织内的扩散,造成受损组织的延迟恢复甚至产生继发性损伤,因此血管再生与组织再生之间的关系近年来越来越受到关注。充分探索血管损伤再生的细胞与分子机制,有助于促进血管损伤修复,为临床治疗提供理论基础。
技术实现要素:
3.本发明的目的是为了解决现有技术中的血管受损后再生速度有限的技术问题。
4.为了实现上述目的,本发明采用了如下技术方案:mir-30a-5p及 mir-30a-5p mimics作为血管损伤修复分子靶点的应用。
5.mir-30a-5p及 mir-30a-5p mimics用于制备促进血管再生和修复神经血管损伤的药物的应用。
6.优选的,所述神经血管损伤为周围神经系统坐骨神经血管损伤。
7.一种血管损伤修复药物,包括mir-30a-5p及 mir-30a-5p mimics。
8.一种mir-30a-5p及 mir-30a-5p mimics作为血管损伤修复分子靶点的验证方法,包括以下步骤:培养huvecs细胞系,观察体外过表达mir-30a-5p提高huvecs活力的情况、促进huvecs迁移的情况及促进huvecs成管的情况。
9.优选的,培养huvecs细胞系包含以下步骤:准备huvecs;在添加5%胎牛血清、1%内皮细胞生长补充剂 100 u/ml青霉素/链霉素的内皮细胞培养基中培养,在5%co2、37℃的增湿培养箱中培养。
10.优选的,培养huvecs细胞系完成后转染huvecs mimics ,包含以下步骤:待细胞贴壁后,用转染试剂混匀mir-30a-5p mimics及阴性对照后加入到培养的huvecs细胞系中,培养8h后更换为内皮细胞完全培养基。
11.优选的,huvecs活力的情况的观察方法包括以下步骤:s1.3.1、huvecs转染48h后加0.25%的胰酶消化;s1.3.2、用含有10%胎牛血清的 dmem 终止消化,离心后弃上清,加入新的内皮细胞完全培养基重悬后,以每孔4千的密度将细胞接种于96孔板;s1.3.3、待细胞贴壁后加入cck8再培养4h。
12.s1.3.4、使用酶标仪在450nm处测量吸光度,细胞活力以相对于对照组的百分比值
表示;优选的,huvecs迁移的情况的观察步骤如下:s2.3.1、huvecs转染48h后加0.25%的胰酶消化;s2.3.2、用含有10%胎牛血清的 dmem 终止消化,离心后弃上清,加入fbs浓度降至0.25%的内皮细胞完全培养基重悬后,以每孔1万的密度将huvecs接种到培养插件中培养24h;s2.3.3、取下培养插件,光学显微镜下拍摄图像,12小时后再次拍摄。
13.s2.3.4、使用imagej软件测量图片中无细胞覆盖的区域面积,最后计算迁移率来评估huvec的迁移能力。
14.优选的,huvecs成管的观察步骤如下:s3.3.1、huvecs转染48h后加适量 0.25%的胰酶消化;s3.3.2、用含有10%胎牛血清的 dmem 终止消化,离心后弃上清,加入新的内皮细胞完全培养基重悬后,以每孔1万的密度将huvecs接种到预先以等体积基质胶和内皮细胞完全培养基混合液包被的96孔板中培养4h;s3.3.3、光学显微镜下拍摄图像;s3.3.4、使用imagej软件中的angiogenesis插件自动分析测量图片中的管状结构。
15.与现有技术相比,本发明的上述技术方案的有益效果如下:1、本发明以mir-30a-5p及 mir-30a-5p mimics作为分子干预靶点,过表达mir-30a-5p,提高huvecs的活力、迁移与成管能力。
16.2、本发明在体外培养huvecs,转染mir-30a-5p mimic,可以显著提高huvecs的活力、迁移与成管能力。
17.3、本发明提供的mir-30a-5p可以通过调节血管内皮细胞的活力、迁移与成管参与血管损伤修复,有助于更好地理解mirna在血管损伤修复过程中的重要作用,并为血管损伤后的治疗提供新的靶点。
附图说明
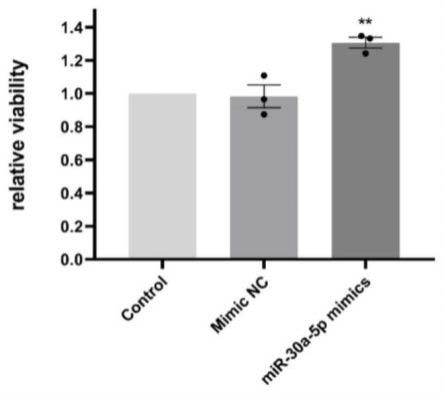
18.图1为本发明实施例一中体外过表达mir-30a-5p可以显著提高huvecs活力的示意图;图2为本发明实施例一中体外过表达mir-30a-5p可以显著促进huvecs迁移的示意图;图3为本发明实施例一中体外过表达mir-30a-5p可以显著促进huvecs成管的示意图。
具体实施方式
19.为使本发明的目的、技术方案和优点更加清楚,以下结合具体实施例,对本发明作进一步地详细说明。
20.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是,本发明还可以采用不同于在此描述的其他方式来实施,因此,本发明并不限于下面公开说明书的具体
实施例的限制。
21.microrna (mirna )是内源性、非编码的,长度约为20-24个核苷酸的小rna,其通过与靶基因3`端的非翻译区结合,抑制靶基因翻译或直接降解靶基因。mirna能够调控包括血管内皮细胞和血管平滑肌细胞在内的多种细胞的增殖、迁移和成血管能力,影响受损组织器官修复。
22.本技术提供了mir-30a-5p及 mir-30a-5p mimics作为血管损伤修复分子靶点的应用,在血管损伤修复过程中对血管内皮细胞进行调控,显著提高血管内皮细胞的活力、迁移与成管能力,本技术还提供了mir-30a-5及 mir-30a-5p mimicsp用于制备促进血管再生和修复神经血管损伤的药物的应用,其中所述神经血管损伤为周围神经系统坐骨神经血管损伤。
23.本技术还提供了一种血管损伤修复药物,其包括mir-30a-5p及 mir-30a-5p mimics。
24.本技术还提供了一种mir-30a-5p及 mir-30a-5p mimics作为血管损伤修复分子靶点的验证方法,用于验证mir-30a-5p在提高huvecs活力、迁移与成管能力和血管损伤修复方面的效果,其包括以下步骤:s1:培养huvecs细胞系,观察体外过表达mir-30a-5p提高huvecs活力的情况;具体的,在一实施方式中,步骤s1的具体步骤为:s1.1、培养huvecs细胞系s1.1.1、人脐静脉内皮细胞(huvecs)细胞系购自美国模式培养物集存库(atcc);s1.1.2、在添加5%胎牛血清、1%内皮细胞生长补充剂 100 u/ml青霉素/链霉素的内皮细胞培养基,即内皮细胞完全培养基中培养。在5%co2、37℃的增湿培养箱中培养;s1.2、huvecs mimics转染待细胞贴壁后,用转染试剂混匀mir-30a-5p mimics及阴性对照后加入到步骤s1.1培养的huvecs中,培养8h后更换为内皮细胞完全培养基;s1.3、细胞活力测定s1.3.1、huvecs转染48h后加适量 0.25%的胰酶消化;s1.3.2、用含有10%胎牛血清的 dmem 终止消化,离心后弃上清,加入新的内皮细胞完全培养基重悬后,以每孔4千的密度将细胞接种于96孔板;s1.3.3、待细胞贴壁后加入cck8再培养4h。
25.s1.3.4、使用酶标仪在450nm处测量吸光度,细胞活力以相对于对照组的百分比值表示。
26.请参阅图1,结果显示,过表达mir-30a-5p(mir-30a-5p mimics)可以显著提高huvecs的活力,图1为mimic nc(mimic negative control,阴性对照)或mir-30a-5p mimics分别转染体外培养的huvecs,48h后消化并接种于96孔板。待细胞贴壁加入cck8,孵育4h后以酶标仪测量450nm处的吸光度值。 **p 《 0.01。
27.s2、培养huvecs细胞系,观察体外过表达mir-30a-5p促进huvecs迁移的情况;具体的,在一实施方式中,步骤s2的具体步骤为:s2.1、培养huvecs细胞系
s2.1.1、人脐静脉内皮细胞(huvecs)细胞系购自美国模式培养物集存库(atcc);s2.1.2、在添加5%胎牛血清、1%内皮细胞生长补充剂 100 u/ml青霉素/链霉素的内皮细胞培养基,即内皮细胞完全培养基中培养。在5%co2、37℃的增湿培养箱中培养;s2.2、huvecs mimics转染待细胞贴壁后,用转染试剂混匀mir-30a-5p mimics及阴性对照后加入到步骤s2.1培养的huvecs中,培养8h后更换为内皮细胞完全培养基;s2.3、细胞迁移能力测定s2.3.1、huvecs转染48h后加适量 0.25%的胰酶消化;s2.3.2、用含有10%胎牛血清的 dmem 终止消化,离心后弃上清,加入fbs浓度降至0.25%的内皮细胞完全培养基重悬后,以每孔1万的密度将huvecs接种到培养插件中培养24h;s2.3.3、取下培养插件,光学显微镜下拍摄图像,12小时后再次拍摄。
28.s2.3.4、使用imagej软件测量图片中无细胞覆盖的区域面积,最后计算迁移率来评估huvec的迁移能力。
29.请参阅图2,过表达mir-30a-5p(mir-30a-5p mimics)可以显著促进huvecs的迁移,其中,图2a为mimic nc(mimic negative control,阴性对照)或mir-30a-5p mimics分别转染体外培养的huvecs,48h后消化并接种于培养插件。24h后取下插件并拍摄的图片及细胞迁移12h后再次拍摄的图像,bar=200μm。imagej测量面积,计算迁移率的平均值如图2b所示。 **p 《 0.01。
30.s3、培养huvecs细胞系,观察体外过表达mir-30a-5p促进huvecs成管的情况。
31.具体的,在一实施方式中,步骤s3的具体步骤为:s3.1、培养huvecs细胞系s3.1.1、人脐静脉内皮细胞(huvecs)细胞系购自美国模式培养物集存库(atcc);s3.1.2、在添加5%胎牛血清、1%内皮细胞生长补充剂 100 u/ml青霉素/链霉素的内皮细胞培养基,即内皮细胞完全培养基中培养。在5%co2、37℃的增湿培养箱中培养;s3.2、huvecs mimics转染待细胞贴壁后,用转染试剂混匀mir-30a-5p mimics及阴性对照后加入到步骤s3.1培养的huvecs中,培养8h后更换为内皮细胞完全培养基;s3.3、细胞成管能力测定s3.3.1、huvecs转染48h后加适量 0.25%的胰酶消化;s3.3.2、用含有10%胎牛血清的 dmem 终止消化,离心后弃上清,加入新的内皮细胞完全培养基重悬后,以每孔1万的密度将huvecs接种到预先以等体积基质胶和内皮细胞完全培养基混合液包被的96孔板中培养4h;s3.3.3、光学显微镜下拍摄图像;s3.3.4、使用imagej软件中的angiogenesis插件自动分析测量图片中的管状结构。
32.请参阅图3,结果显示,过表达mir-30a-5p(mir-30a-5p mimics)可以显著促进huvecs的成管,其中,图3a为mimic nc(mimic negative control,阴性对照)或mir-30a-5p mimics分别转染体外培养的huvecs,48h后消化并接种于等体积基质胶和内皮细胞完全培
养基混合液包被的96孔板中,孵育4h后拍摄的图像。图3b为使用imagej软件中的angiogenesis插件自动分析测量所拍摄图片中管状结构的分支点数、管数和管长平均值的统计。*p 《 0.05。
33.本发明提供的mir-30a-5p可以通过调节血管内皮细胞的活力、迁移与成管参与血管损伤修复,有助于更好地理解mirna在血管损伤修复过程中的重要作用,并为血管损伤后的治疗提供新的靶点。
34.以上所述仅为本发明的实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的权利要求范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1