一种同时制备新科斯糖和1F-低聚果糖的方法及其专用工程菌株
一种同时制备新科斯糖和1f-低聚果糖的方法及其专用工程菌株
技术领域
1.本发明属于基因工程技术领域,具体涉及一种同时制备新科斯糖和1f-低聚果糖的方法及其专用工程菌株。
背景技术:
2.低聚果糖(fructooligosaccharides,简写为fos)是在水果、蔬菜、大麦、蜂蜜等中少量存在的天然成分。它作为益生元,可选择性地刺激消化道中乳酸杆菌和双歧杆菌等有益菌群的生长及活性,并能抑制病原微生物的生长,促进肠道微生物群良好平衡。低聚果糖多为含蔗果三糖(gf2)、蔗果四糖(gf3)和蔗果五糖(gf4)的混合物,由葡萄糖通过β-(2,1)糖苷键与果糖单元的短链聚合物连接组成。低聚果糖根据单糖残基之间的连接形式,可分为三种主要类型:1f-低聚果糖(普通型)、6g-低聚果糖(新科斯糖为代表)和6f-低聚果糖(稀有型)。
3.工业上生产低聚果糖主要采用微生物酶法,大体可分为蔗糖酶的转糖基作用和菊粉酶的水解作用。由于菊粉受到原料生产的限制,目前国内低聚果糖规模化生产主要来自蔗糖的转糖基合成。在转糖基过程中,将高浓度蔗糖作为原料,利用具有果糖基转移活性的β-呋喃果糖苷酶(fopa)催化合成。
4.β-呋喃果糖苷酶(fopa)主要来自真菌,如aspergillus niger、a.japonicus、aureobasidium pullulans和penicillium expansum等。在这些真菌中,曲霉菌物种被认为是优秀的β-果糖苷酶生产者。其中,黑曲霉atcc 20611是商业低聚果糖生产中的主要菌株之一。该菌的fopa表现出较高的转果糖基活性,且其编码基因启动子pfopa为天然强启动子。尽管有报道改善培养条件(如碳氮源优化)等可以提高菌体生物量和fopa酶产量,然而,该酶转化合成的低聚果糖含量一般在55%左右(即55型低聚果糖),因此优化低聚果糖成分和提升低聚果糖含量一直是行业发展的重要方向。
5.经检索,有关构建表达高活性异源6g-β-呋喃果糖苷酶(xd-inv)和原有β-呋喃果糖苷酶(fopa)的黑曲霉工程菌株以及将其用于同时制备新科斯糖和1f-低聚果糖的方法还未见报道。
技术实现要素:
6.针对现有技术的不足,本发明要解决的问题是提供一种同时制备新科斯糖和1f-低聚果糖的方法及其专用工程菌株。
7.本发明所述同时制备新科斯糖和1f-低聚果糖的方法,步骤是:
8.(1)制备红发夫酵母来源6g-β-呋喃果糖苷酶xd-inv基因表达盒:以黑曲霉atcc 20611的基因组dna为模板,以fopa-1uf/fopa-1r为引物扩增β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp;然后将β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp、xd-inv编码基因、终止子基因ttrpc、抗性基因prta按顺序连接,制得能随机整合
进入黑曲霉atcc 20611基因组中表达xd-inv蛋白的xd-inv表达盒,其中所述xd-inv表达盒的核苷酸序列如seq id no.1所示,所述β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp的核苷酸序列如seq id no.2所示,所述xd-inv编码基因的核苷酸序列如seq id no.3所示;所述的终止子ttrpc基因来源于质粒pan7-1;所述的抗性基因prta扩增于质粒t-prta;所述引物核苷酸序列如下:
9.fopa-1uf:attgtgtcattatagctctttct;
10.fopa-1r:tgaggcttctgctgctgc;
11.(2)构建共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株:制备黑曲霉atcc 20611的原生质体,将红发夫酵母来源6g-β-呋喃果糖苷酶xd-inv基因表达盒转化进入黑曲霉atcc 20611的原生质体,经筛选、验证,验证正确的菌株命名为共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1;
12.(3)发酵生产6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa:将活化后的工程菌株incf-1以106个/ml的数量接种到发酵培养基中,在温度30
±
3℃、转速180-220r/min条件下发酵1-7天,即得到含异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的菌丝体;其中,所述发酵培养基配方是:蔗糖38
±
2g/l,酵母膏3
±
1g/l,nano
3 4
±
1g/l,k2hpo
4 0.4
±
0.2g/l,mgso
4 7h2o 0.5
±
0.1g/l,feso
4 0.01
±
0.05g/l,cuso
4 0.01
±
0.05g/l,ph 4.5
±
1.0,115℃,灭菌30min;
13.(4)利用含β-呋喃果糖苷酶菌丝体同时制备新科斯糖和1f-低聚果糖:测定得到的含酶菌丝体的总酶活,获得每克含酶的菌丝体量与β-呋喃果糖苷酶(xd-inv和fopa)活力单位的关系值;确定制备低聚果糖的反应体系为:400-446u/g酶的菌丝体量为7-35g/l,蔗糖浓度为200-600g/l,温度为20-60℃,转速为150-200r/min;反应5-30h即获得含新科斯糖和1f-低聚果糖的反应液。
14.上述同时制备新科斯糖和1f-低聚果糖的方法中:步骤(3)所述发酵培养基配方优选是:蔗糖40g/l,酵母膏3g/l,nano
3 5g/l,k2hpo
4 0.5g/l,mgso
4 7h2o 0.5g/l,feso
4 0.01g/l,cuso
4 0.01g/l,ph 5.0。
15.上述同时制备新科斯糖和1f-低聚果糖的方法中:步骤(3)所述工程菌株incf-1的发酵条件优选是:温度为30℃,转速为200r/min,发酵时间为2天。
16.上述同时制备新科斯糖和1f-低聚果糖的方法中:步骤(4)所述制备低聚果糖的反应体系优选为:400-446u/g酶的菌丝体量为14g/l,蔗糖浓度为500g/l,温度为50℃,转速为180r/min;反应5h即获得含新科斯糖和1f-低聚果糖的反应液。
17.得到含新科斯糖和1f-低聚果糖的反应液,将反应液稀释2倍,反应产物利用hplc进行分析,纯化。条件为:液相仪是lc-6a(shimadzu,japan),色谱柱是安捷伦agilent zorbax nh2 column(5μm,4.6mm
×
250 208mm),示差检测器(2414,waters,usa),70%的乙腈为流动相,进样量10μl,以1.0ml/min的流速进行流加,最后根据保留时间和峰面积确定产物中各糖组分的含量,并于出峰时间纯化各糖分。
18.本发明提供了一种用于同时制备新科斯糖和1f-低聚果糖的工程菌株,其特征在于:所述菌株能表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa,其是以黑曲霉atcc 20611为出发菌株,在其基因组中整合加入如seq id no.1所示的能表达xd-inv蛋白的xd-inv表达盒制得,命名为共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶
fopa的工程菌株incf-1;其中所述xd-inv表达盒是将β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp、xd-inv编码基因、终止子基因ttrpc、抗性基因prta按顺序连接构建获得。
19.本发明提供了一种用于构建上述工程菌株incf-1的表达xd-inv蛋白的表达盒,其特征在于:所述表达盒命名为xd-inv表达盒,其是将β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp、xd-inv编码基因、终止子基因ttrpc、抗性基因prta按顺序连接构建获得,该表达盒的核苷酸序列如seq id no.1所示。
20.本发明提供了一种用于构建上述工程菌株incf-1的启动子及信号肽基因,其特征在于:所述启动子及信号肽基因是β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp,该启动子为蔗糖诱导型启动子,其核苷酸序列如seq id no.2所示。
21.本发明公开了一种同时制备新科斯糖和1f-低聚果糖的方法及其专用工程菌株incf-1,其显著的有益效果体现在:利用本发明所述方法制得的共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1生产的含β-呋喃果糖苷酶(xd-inv和fopa)菌丝体中酶活力可达到446.72u/g,并且确定β-呋喃果糖苷酶活力主要存在于工程菌株incf-1细胞壁。应用含酶的菌丝体直接用于同时制备新科斯糖和1f-低聚果糖,产量达349.80g/l,转化率为69.96%。本发明提供的方法与已有方法相比,低聚果糖合成效果及效率显著提升,低聚果糖益生性能更优,生产成本低廉,具有较高的应用和推广价值,有助于扩大低聚果糖的产业化进程。
附图说明
22.图1.共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1构建的示意图。
23.其中:a11为出发菌株黑曲霉atcc 20611;incf-1为以黑曲霉atcc 20611为出发菌株构建的xd-inv表达工程菌株。
24.图2.共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1葡萄糖平板检测和xd-inv基因片段的扩增电泳图示意图。
25.其中:a是葡萄糖平板检测结果;b是异源6g-β-呋喃果糖苷酶(xd-inv)表达工程菌株incf-1的xd-inv基因片段的扩增电泳图示意图。
26.其中:a11为出发菌株黑曲霉atcc 20611;incf-1为以黑曲霉atcc 20611为出发菌株构建的xd-inv表达工程菌株;δfopa为出发菌株黑曲霉atcc 20611敲除fopa基因后获得的菌株;m为1kb dna marker,1、2、3、4验证xd-inv基因片段大小约为1.9kb。
27.图3.共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1的β-呋喃果糖苷酶(xd-inv和fopa)活力测定结果。
28.其中:a是不同时间(24h、48h、72h)β-呋喃果糖苷酶(xd-inv和fopa)活力测定结果;b是发酵液、菌丝体不同组分(完整菌丝体、破壁上清、原生质体)中β-呋喃果糖苷酶(xd-inv和fopa)活力测定结果。
29.其中:fermentation broth为发酵48h后工程菌株incf-1发酵液中β-呋喃果糖苷酶(xd-inv和fopa)酶活;cell为发酵48h后工程菌株incf-1完整菌丝体中β-呋喃果糖苷酶(xd-inv和fopa)酶活;cell wall为发酵48h后工程菌株incf-1菌丝体细胞破壁上清中β-呋
喃果糖苷酶(xd-inv和fopa)酶活;protoplast为发酵48h后工程菌株incf-1菌丝体原生质体中β-呋喃果糖苷酶(xd-inv和fopa)酶活。
30.图4.共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1不同温度下制备的混合型低聚果糖含量(合成的混合型低聚果糖hplc分析结果)。
31.其中:7g/l抽滤后工程菌株incf-1含酶的菌丝体于不同温度下(20℃、30℃、40℃、50℃、60℃)转化300g/l蔗糖5h时所制备的混合型低聚果糖含量。
32.图5.共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1不同底物浓度下制备的混合型低聚果糖含量。
33.其中:7g/l抽滤后工程菌株incf-1含酶的菌丝体于50℃转化不同浓度蔗糖底物时(200g/l、300g/l、400g/l、500g/l、600g/l)5h时所制备的混合型低聚果糖含量。
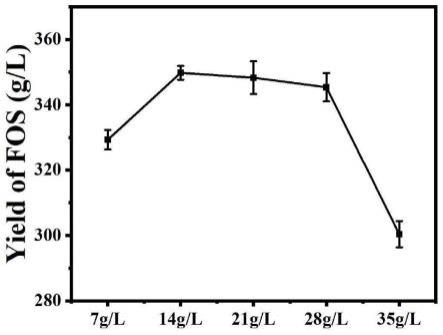
34.图6.共表达异源6g-β-呋喃果糖苷酶xd-inv和β-呋喃果糖苷酶fopa的工程菌株incf-1不同菌丝体添加量下制备的混合型低聚果糖含量。
35.其中:不同含酶的菌丝体添加量(7g/l、14g/l、21g/l、28g/l、35g/l)的抽滤后工程菌株incf-1含酶的菌丝体于50℃转化500g/l蔗糖5h时所制备的混合型低聚果糖含量。
具体实施方式
36.下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
37.本发明使用了基因工程和分子生物学领域常规的技术和方法。本领域的技术人员可以在本发明提供的实施方式的基础上采用本领域其它常规技术、方法和试剂,而不限于本发明具体实施例的限定。
38.下述实施例中,所用的菌株黑曲霉atcc 20611购自美国菌种保藏中心。质粒购自takara。其他所使用的材料、试剂等,如无特殊说明,均从商业途径得到。
39.实施例1.红发夫酵母来源xd-inv表达盒的构建:
40.首先以黑曲霉atcc 20611的基因组dna为模板,以黑曲霉atcc 20611的基因组dna为模板,以fopa-1uf/fopa-1r为引物扩增β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp;然后将β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp、xd-inv编码基因、终止子基因ttrpc、抗性基因prta按顺序连接,制得能随机整合进入黑曲霉atcc 20611基因组中表达xd-inv蛋白的xd-inv表达盒,其中所述xd-inv表达盒的核苷酸序列如seq id no.1所示,所述β-呋喃果糖苷酶fopa编码基因启动子及信号肽基因pfopa-sp的核苷酸序列如seq id no.2所示,所述xd-inv编码基因的核苷酸序列如seq id no.3所示;所述的终止子ttrpc基因来源于质粒pan7-1;所述的抗性基因prta扩增于质粒t-prta;见图1。
41.上述引物对具体核苷酸序列如下:
42.fopa-1uf:attgtgtcattatagctctttct;
43.fopa-1r:tgaggcttctgctgctgc;
44.实施例2.利用xd-inv表达盒转化黑曲霉atcc 20611构建表达异源6g-β-呋喃果糖苷酶(xd-inv)和β-呋喃果糖苷酶(fopa)的工程菌株:
45.黑曲霉atcc 20611的遗传转化是利用peg/cacl2介导的原生质体转化方法,吡啶硫胺素抗性基因ptra为选择标记。
46.将纯化的xd-inv表达盒转化黑曲霉atcc 20611原生质体构建应用于同时制备新科斯糖和1f-低聚果糖的表达异源6g-β-呋喃果糖苷酶(xd-inv)和β-呋喃果糖苷酶(fopa)的工程菌株。其中所述peg/cacl2介导的原生质体转化的具体方法如下:
47.(1)黑曲霉atcc 20611原生质体的制备:
48.将100μl浓度为106个/ml的新鲜的黑曲霉atcc 20611孢子(2周之内)涂布于8个铺有玻璃纸的pda平板上,30℃下培养13h。待菌丝生长到显微镜下2/3视野时,用镊子将菌丝从玻璃纸上转移至细胞壁裂解液中(0.2g裂解酶、0.1g蜗牛酶、0.05g溶菌酶溶解到20ml溶液i),轻轻摇晃使菌体均匀分散,30℃,200rpm酶解2h。将裂解液用漏斗(铺设四层擦镜纸)过滤,离心(2500rpm/min)收集原生质体。加入200-400μl溶液ii重悬浮沉淀,将其置于冰上以备后续实验。整个制备原生质体细胞的过程需在冰上进行。
49.其中pda培养基组成为:土豆200g/l去皮切碎,蒸馏水煮沸后8层纱布过滤后,将所得滤液添加葡萄糖20g/l,自然ph,2%琼脂粉,115℃灭菌30min;
50.溶液i:0.1m kh2po4,1.2m山梨醇,ph 5.6,115℃灭菌30min;
51.溶液ii:50mm cacl2,1m山梨醇,10mm tris-hcl,ph 7.5,115℃灭菌30min。
52.(2)xd-inv表达盒转化黑曲霉atcc 20611的原生质体获得应用于同时制备新科斯糖和1f-低聚果糖的表达异源6g-β-呋喃果糖苷酶(xd-inv)和β-呋喃果糖苷酶(fopa)的工程菌株:
53.将xd-inv表达盒各10μg与200μl的黑曲霉atcc 20611原生质体混合,加入50μlpeg溶液,冰浴20min,后加2ml peg溶液,37℃放置5min,最后加4ml溶液ii(ph 6.5),轻轻混匀;然后,将上述溶液加入到含有2μg/ml吡啶硫胺素氢溴酸盐(购自sigma公司)的10ml转化上层培养基中,混匀后倒入预先凝固的转化下层培养基平板,冷却凝固后30℃培养2-3天,挑选生长良好的转化株,提取染色体,进行pcr验证。
54.利用引物对inv-52f/inv-1992r从工程菌株基因组中扩增xd-inv表达盒中的xd-inv基因片段(1.9kb)来验证工程菌株。结果如图2b所示,其中转化子能够扩增出1.4kb大小的条带,证明xd-inv表达盒被成功转入黑曲霉atcc 20611。将验证正确的应用于同时制备新科斯糖和1f-低聚果糖的高活性异源6g-β-呋喃果糖苷酶(xd-inv)表达和β-呋喃果糖苷酶(fopa)表达工程菌株命名为共表达异源6g-β-呋喃果糖苷酶(xd-inv)和β-呋喃果糖苷酶(fopa)的工程菌株incf-1。
55.其中涉及引物序列是:
56.inv-52f:cagcagcagcagaagcctcagcggaactggacctgccc
57.inv-1992r:ctcctccgcggtcaccgaatagccggcgaacaggccgtacat。
58.其中上述peg培养基为:25%peg 6000,50mm cacl2,10mm tris-hcl,ph 7.48;
59.溶液i:1.2m山梨醇,0.1m kh2po4,用1m naoh调节ph至5.6;
60.溶液ii:1m山梨醇,50mm cacl2,10mm tris-hcl,调ph至7.5;
61.上层培养基(g/l):葡萄糖10g/l,mgso4·
7h2o 1g/l,kh2po
4 10g/l,(nh4)2so
4 6g/l,c6h5na3o
7 3g/l,山梨醇182.18g/l,琼脂糖6g/l;
62.下层培养基(g/l):葡萄糖10g/l,mgso4·
7h2o 1g/l,kh2po
4 10g/l,(nh4)2so
4 6g/
l,c6h5na3o
7 3g/l,琼脂粉20g/l;以上均经115℃灭菌30min后使用。
63.实施例3.新科斯糖和1f-低聚果糖合成工程菌的β-呋喃果糖苷酶(xd-inv和fopa)活力测定:
64.(1)将实施例2获得的表达异源6g-β-呋喃果糖苷酶(xd-inv)和β-呋喃果糖苷酶(fopa)的工程菌株incf-1、出发菌株黑曲霉atcc 20611、fopa敲除菌株δfopa各取1μl相同浓度的孢子悬液点种于察氏固体培养基平板中30℃培养12h,取出倒入葡萄糖检测试剂,并使其均匀覆盖平板上的所有培养基表面,40℃放置10min后,菌落周围产生明显红色晕圈的菌株表示β-呋喃果糖苷酶(xd-inv和fopa)的成功表达。如图2a所示,转化株incf-1菌落周围产生明显的红色晕圈,其晕圈明显大于出发菌株黑曲霉atcc 20611;敲除出发菌株黑曲霉atcc 20611的fopa基因的δfopa菌株无红色晕圈产生,说明xd-inv表达盒成功整合进入黑曲霉atcc 20611基因组中且6g-β-呋喃果糖苷酶(xd-inv)获得表达,因此,转化株incf-1可作为表达6g-β-呋喃果糖苷酶(xd-inv)和β-呋喃果糖苷酶(fopa)的新科斯糖和1f-低聚果糖合成工程菌株用于后继分析应用。
65.其中上述察氏培养基成分为:nano
3 3g/l,k2hpo
4 1g/l,mgso4·
7h2o 0.5g/l,kcl 0.5g/l,feso
4 0.01g/l,蔗糖20g/l,固体需加2%的琼脂粉,115℃灭菌30min。
66.葡萄糖检测试剂成分为:葡萄糖氧化酶(god)4-6u/ml,过氧化物酶(pod)0.2-0.4u/ml,4-氨基安替吡啉(4-aap)0.1mg/ml,苯酚1mg/ml,琼脂粉0.007g/ml。
67.(2)将实施例2获得的共表达异源6g-β-呋喃果糖苷酶(xd-inv)和β-呋喃果糖苷酶(fopa)的工程菌株incf-1按106个/ml分别接种到150ml(500ml的三角瓶)发酵培养基中,温度为30℃,转速为200r/min,每隔24h取样,抽滤收集菌丝体用于测定β-呋喃果糖苷酶(xd-inv和fopa)活力。
68.所述发酵培养基配方是:蔗糖40g/l,酵母膏3g/l,nano
3 5g/l,k2hpo
4 0.5g/l,mgso
4 7h2o 0.5g/l,feso
4 0.01g/l,cuso
4 0.01g/l,ph 5.0,115℃灭菌30min。
69.β-呋喃果糖苷酶(xd-inv和fopa)测定方法是:
70.2ml 25%的蔗糖溶液,3ml柠檬酸磷酸缓冲液,0.02g菌体细胞,50℃反应1h,反应结束后煮沸5分钟终止反应。dns(3,5-二硝基水杨酸)法测定反应后还原糖的浓度:上述反应体系上清稀释适当倍数,取1ml至25ml酶标管中,再加入2ml 10mg/ml 3,5-二硝基水杨酸(dns)溶液,沸水浴2min,冷水冷却,蒸馏水补足至25ml,540nm测定吸光值。
71.酶活定义:1u的β-呋喃果糖苷酶(xd-inv和fopa)为1min酶反应产生1μmol的还原糖所需的酶量。
72.β-呋喃果糖苷酶(xd-inv和fopa)测定结果显示,incf-1菌株的酶活在48h时最高,达到446.72u/g(图3a)。因此确定蔗糖发酵48h的incf-1含酶的菌丝体进行新科斯糖和1f-低聚果糖生产。
73.进一步测定incf-1工程菌发酵液和菌丝体不同组分(完整菌丝体、破壁上清和原生质体)中的β-呋喃果糖苷酶(xd-inv和fopa)活力,结果如图3b所示,incf-1转化株菌丝体总酶活为446.72u/g,其中破壁上清中酶活为420.47u/g、原生质体组分酶活仅40.41u/g。也就是,incf-1转化株表达的红发夫酵母xd-inv原有β-呋喃果糖苷酶(fopa)主要存在于破壁酶解上清中。
74.实施例4.工程菌incf-1菌株在同时制备新科斯糖和1f-低聚果糖中的应用:
9g含酶的菌丝体/l),温度为50℃,转速为180r/min,反应时间为5h。反应产物利用hplc进行分析。此条件下,工程菌incf-1反应产物中混合型低聚果糖含量在5h为226.41g/l。
86.或者,将发酵培养48h的酶活力达到400-446u/g的incf-1菌丝体,反应体系为500g/l的蔗糖溶液,菌体量为14g/l,温度为50℃,转速为180r/min,反应时间为5h。反应产物利用hplc进行分析。此条件下,工程菌incf-1反应产物中混合型低聚果糖含量在5h为349.8g/l。
87.或者,将发酵培养48h的酶活力达到400-446u/g的incf-1菌丝体,反应体系为500g/l的蔗糖溶液,菌体量为21g/l,温度为50℃,转速为180r/min,反应时间为5h。反应产物利用hplc进行分析。此条件下,工程菌incf-1反应产物中混合型低聚果糖含量在5h为348.3g/l。
88.或者,将发酵培养48h的酶活力达到400-446u/g的incf-1菌丝体,反应体系为500g/l的蔗糖溶液,菌体量为28g/l,温度为50℃,转速为180r/min,反应时间为5h。反应产物利用hplc进行分析。此条件下,工程菌incf-1反应产物中混合型低聚果糖含量在5h为345.4g/l。
89.或者,将发酵培养48h的酶活力达到400-446u/g的incf-1菌丝体,反应体系为500g/l的蔗糖溶液,菌体量为35g/l,温度为50℃,转速为180r/min,反应时间为5h。反应产物利用hplc进行分析。此条件下,工程菌incf-1反应产物中混合型低聚果糖含量在5h为300.35g/l。
90.优选的,所述工程菌株incf-1制备混合型低聚果糖的条件如下:温度为50℃(图4),蔗糖浓度为500g/l(图5),转速为180r/min,400-446u/g的incf-1菌丝体菌体量为14g/l(图6)。此时,混合型低聚果糖含量在5h为349.8g/l。
91.其中,反应产物利用hplc进行分析,纯化,条件为:液相仪是lc-6a(shimadzu,japan),色谱柱是安捷伦agilent zorbax nh
2 column(5μm,4.6mm
×
250 208mm),示差检测器(2414,waters,usa),70%的乙腈为流动相,进样量10μl,以1.0ml/min的流速进行流加,最后根据保留时间和峰面积确定产物中各糖组分的含量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1