一种逆转录酶、核酸分子及合成cDNA的方法与流程
本发明涉及逆转录酶突变体,具体而言,涉及一种逆转录酶、核酸分子及合成cdna的方法。
背景技术:
1、m-mlv(moloney murine leukemia virus)逆转录酶是一种分子量为75kd的单体酶,具有rna和dna依赖的聚合酶活性、rnase h活性、以及末端核苷酸转移酶(terminaldeoxynucleotidyl transferase,tdt)活性。其中,rna依赖的聚合酶活性用于合成与rna互补的第一链dna(cdna);dna依赖的聚合酶活性用于合成与第一链cdna互补的dna链,最终得到完整的cdna双链产物;rnase h活性会特异性降解rna和dna杂合体中的rna;tdt则会在第一链cdna的3’端加上非模板依赖的碱基。m-mlv逆转录酶已被广泛应用于cdna的合成,构建cdna文库,等温扩增技术等方面。
2、常见的逆转录酶还有来自amv(avian myeloblastosis virus)的逆转录酶,由α和β亚基组成的异二聚体,其中α亚基是由β亚基通过酶解得到的;类似的异源二聚体还有劳斯肉瘤病毒(rous sarcoma virus,rsv)逆转录酶,由p95和p63两个亚基组成;hiv-1(humanimmunodeficiency virus)逆转录酶,由p66和p52亚基组成的异源二聚体。
3、目前,野生型的m-mlv逆转录酶与amv逆转录酶相比,野生型的m-mlv逆转录酶的热稳定性较差,但保真度更好,且缺乏dna核酸内切酶活性,rnase h活性较低。有鉴于m-mlv逆转录酶的特性,特提出本发明。
技术实现思路
1、本发明的目的在于提供一种具有比野生型m-mlv逆转录酶更高的热稳定性的逆转录酶。热稳定性更高,逆转录酶更耐高温,有利于在高温条件下破坏rna模板的二级结构,使高gc模板变性,减少引物的非特异性结合,提高逆转录效率,进而获得更多的逆转录产物。
2、本发明是这样实现的:
3、本发明提供了一种逆转录酶,与seq id no:1所示的氨基酸序列相比,逆转录酶具有a322v突变。
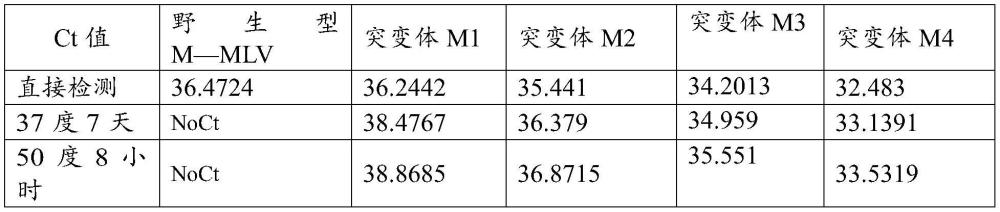
4、发明人首次发现,针对野生型m-mlv逆转录酶的第322位氨基酸突变为val,可以增加逆转录酶的热稳定性。经过热稳定性实验和热激稳定性实验证实,具有上述突变的逆转录酶具有更高的热稳定性和热激稳定性。且用于反转录扩增检测灵敏度更高,检出率高、重复率好、逆转录活性好。发明人发现,具有上述突变的逆转录酶可以满足不同rna样本的逆转录需求,且不受样本中抑制剂的影响。
5、seq id no:1所示的氨基酸序列如下:
6、ltlniedehrlhetskepdvslgstwlsdfpqawaetggmglavrqapliiplkatstpvsikqypmsqearlgikphiqrlldqgilvpcqspwntpllpvkkpgtndyrpvqdlrevnkrvedihptvpnpynllsglppshqwytvldlkdaffclrlhptsqplfafewrdpemgisgqltwtrlpqgfknsptlfdealhrdladfriqhpdlillqyvddlllaatseldcqqgtrallqtlgnlgyrasakkaqicqkqvkylgyllkegqrwltearketvmgqptpktprqlreflgtagfcrlwipgfaemaaplypltktgtlfnwgpdqqkayqeikqalltapalglpdltkpfelfvdekqgyakgvltqklgpwrrpvaylskkldpvaagwppclrmvaaiavltkdagkltmgqplvilaphavealvkqppdrwlsnarmthyqallldtdrvqfgpvvalnpatllplpeeglqhncldilaeahgtrpdltdqplpdadhtwytdgssllqegqrkagaavtteteviwakalpagtsaqraelialtqalkmaegkklnvytdsryafatahihgeiyrrrglltsegkeiknkdeilallkalflpkrlsiihcpghqkghsaeargnrmadqaarkaaitetpdtstllienssp。
7、本文使用的“对应于与seq id no:1所示的氨基酸序列的第322位的位置”是指与野生型m-mlv逆转录酶中的环结构的立体结构相关的位置,并且具体指m-mlv逆转录酶突变体的氨基酸序列中的第322位或氨基酸序列中对应于野生型m-mlv逆转录酶的氨基酸序列中的第322位的位置。“m-mlv逆转录酶突变体的氨基酸序列中对应于野生型m-mlv逆转录酶的氨基酸序列中的第322位的位置”可通过比较或比对突变体的氨基酸序列与野生型的氨基酸序列,例如使用已知的算法等易于确定。类似地,本文使用的氨基酸位置是指野生型的氨基酸序列中的氨基酸位置,并且包括突变体的氨基酸序列中对应于相应野生型的氨基酸序列中的氨基酸位置的位置。
8、在一种可选的实施方式中,上述逆转录酶对应于与seq id no:1所示的氨基酸序列,还具有2个以上的突变。
9、在一种可选的实施方式中,上述逆转录酶对应于与seq id no:1所示的氨基酸,除了a322v突变外,还具有选自h8、p51、h204、n249、m289、t306、f309、d524、e562、k571、d583和t664的一个或多个突变。
10、在一种可选的实施方式中,上述逆转录酶同时具有2-13个突变。
11、在一种可选的实施方式中,上述逆转录酶同时具有2、3、4、5、6、7、8、9、10、11、12或13个突变。
12、在一种可选的实施方式中,逆转录酶对应于与seq id no:1所示的氨基酸,除了a322v突变外,还具有选自h8y、p51l、h204r、n249d、m289l、t306k、t306r、f309n、d524g、e562q、k571r、d583n和t664n的一个或多个突变。
13、在一种可选的实施方式中,上述逆转录酶同时具有a322v、h204r、m289l、t306k和f309n突变(即m2)。
14、发明人发现,同时针对a322v、h204r、m289l、t306k和f309n突变,可以进一步提高逆转录酶的热稳定性增强。
15、在一种可选的实施方式中,上述逆转录酶同时具有a322v、h204r、m289l、t306k、f309n、d524g、e562q和d583n突变(即m3)。
16、rnase h的活性中心是asp-glu-asp三个氨基酸组成的基序,催化活性位点包括d524,e562,d583,d653。而同时针对a322v、h204r、m289l、t306k、f309n、d524g、e562q和d583n突变,使得逆转录酶同时兼具较高的热稳定性和低水平的rnase h的活性。而rnase h的活性过高可能会提前降解rna模板,降低逆转录的产物产量,通过提供一种降低或缺失rnase h活性的逆转录酶,有利于应用于长cdna的逆转录合成。
17、而长cdna的合成需要逆转录酶有较好的持续合成能力,发明人发现通过同时针对a322v、d524g、e562q和d583n突变,可以提高逆转录酶的长链持续合成能力,提高m-mlv的逆转录酶的逆转录长度,例如扩增至8k。
18、在一种可选的实施方式中,上述逆转录酶同时具有a322v、f309n、h204r和t306k突变。通过f309n、h204r和t306k突变,有利于降低tdt活性,提高逆转录酶的热稳定性,而抑制tdt活性能获得cdna末端不掺杂其他核苷酸的产物,减少非模板配对碱基的产生。而同时具有a322v、f309n、h204r和t306k突变,使得逆转录酶兼具高的热稳定性和低的tdt活性。
19、在一种可选的实施方式中,上述逆转录酶同时具有a322v、m289l、f309n、h204r、t306k、d524g、e562q、d583n、h8y、p51l、n249d、k571r和t664n突变(即m4)。逆转录酶兼具更高的热稳定性、低水平的rnase h的活性、极低的tdt活性和较高的逆转录效率。
20、突变后的氨基酸序列如下seq id no:2所示:
21、ltlniedeyrlhetskepdvslgstwlsdfpqawaetggmglavrqapliillkatstpvsikqypmsqearlgikphiqrlldqgilvpcqspwntpllpvkkpgtndyrpvqdlrevnkrvedihptvpnpynllsglppshqwytvldlkdaffclrlhptsqplfafewrdpemgisgqltwtrlpqgfknsptlfdealrrdladfriqhpdlillqyvddlllaatseldcqqgtrallqtlgdlgyrasakkaqicqkqvkylgyllkegqrwltearketvlgqptpktprqlreflgkagncrlwipgfaemavplypltktgtlfnwgpdqqkayqeikqalltapalglpdltkpfelfvdekqgyakgvltqklgpwrrpvaylskkldpvaagwppclrmvaaiavltkdagkltmgqplvilaphavealvkqppdrwlsnarmthyqallldtdrvqfgpvvalnpatllplpeeglqhncldilaeahgtrpdltdqplpdadhtwytggssllqegqrkagaavtteteviwakalpagtsaqraqlialtqalrmaegkklnvytnsryafatahihgeiyrrrglltsegkeiknkdeilallkalflpkrlsiihcpghqkghsaeargnrmadqaarkaaitenpdtstllienssp。
22、本发明提供了一种核酸分子,其编码上述的逆转录酶。
23、本发明还提供了一种表达盒、表达载体、重组细胞或重组菌,其包含上述的核酸分子。
24、在一种可选的实施方式中,上述表达盒连接有用于调控上述核酸分子表达的调控序列,包括不限于启动子、增强子、信号肽编码序列、筛选标记基因、终止子、组氨酸标签等。
25、本发明还提供了一种重组菌或重组细胞,其含有上述的表达盒或载体。重组细胞可以是感受态细胞,例如选自大肠杆菌或酵母感受态细胞。
26、重组菌包括不限于大肠杆菌,例如bl21、dh5α、top10等。
27、在本发明公开了逆转录酶的氨基酸序列的基础上,本领域技术人员容易想到采用基因工程技术或其他技术(化学合成)制备得到逆转录酶,例如从能够重组表达如上任一项的逆转录酶的重组细胞的培养产物中分离纯化得到逆转录酶,这对本领域技术人员来说是容易实现的,基于此,无论采用何种技术制备本发明的逆转录酶,其均属于本发明的保护范围。
28、本发明还提供了一种试剂或试剂盒,其包括上述的逆转录酶。
29、试剂包括不限于:包含逆转录酶的组合物。例如还包括保存剂、防腐剂等助剂。
30、试剂盒例如一种逆转录试剂盒,包括逆转录酶,oligo(dt)、rnasin等。
31、本发明还提供了一种用于合成cdna的方法,方法包括使用上述的逆转录酶合成与模板rna互补的dna的步骤。
32、本发明还提供了一种构建cdna文库的方法,包括:
33、提取待测生物样本中的rna,获得待测生物样本的mrna;基于待测生物样本的mrna,利用上述的合成cdna的方法进行处理,获得cdna分子;基于cdna分子,扩增,建库,以便获得cdna文库。
34、待测生物样本选自土壤、粪便、血液、血清中的至少一种。不同生物来源的样本中含有多种抑制m-mlv rt活性的抑制剂,如土壤和粪便中的腐植酸,血液中的血色素,血清中的各种血液抗凝剂如肝素和柠檬酸盐以及胍、硫氰酸酯、乙醇、甲酰胺、edta及植物酸性多糖等。因此提高该酶的抗抑制剂能力能够更加有效地扩大逆转录酶的应用范围。
35、本发明具有以下有益效果:
36、在一个具体的技术方案中,本发明针对野生型m-mlv逆转录酶具有第322位氨基酸突变为val的突变,可以增加逆转录酶的热稳定性。经过热稳定性实验和热激稳定性实验证实,具有上述突变的逆转录酶具有更高的热稳定性和热激稳定性。
37、在一个具体的技术方案中,相较于野生型逆转录酶,本发明提供的逆转录酶用于反转录扩增检测灵敏度更高,检出率高。
38、在一个具体的技术方案中,相较于野生型逆转录酶,本发明提供的逆转录酶具有更高的热稳定性和热激稳定性,并且用于反转录扩增检测灵敏度更高,检出率高。
- 还没有人留言评论。精彩留言会获得点赞!