一种新冠病毒特异性结合的复合体及载物体的制作方法
1.本发明属于生物化学技术领域,特别涉及一种新冠病毒特异性结合的复合体及载物体。
背景技术:
2.2019年以来,新冠病毒(2019-ncov)肆虐以来,人们对新冠病毒的研究就一直未停止过。新冠病毒(sars-cov-2)有四种主要的结构蛋白:刺突蛋白(spike protein,s蛋白),核衣壳蛋白(nucleocapsid,n蛋白),膜蛋白(membrane protein,m蛋白),包膜蛋白(envelope protein,e蛋白)。s蛋白是冠状病毒非常重要的表面蛋白,与病毒的传染能力密切相关,s蛋白包含s1、s2和受体结合域(rbd)。
3.n蛋白(nucleocapsid protein)是病毒的核衣壳蛋白,它具有两个rna结合结构域起到保护基因组的作用。同时,n蛋白相对保守,在病毒的结构蛋白中所占比例最大,感染早期机体就能产生抗n蛋白的高水平抗体。
4.基于现有对于新冠病毒上n蛋白的研究,如何通过基于对与n蛋白的识别来提供高现有诊断、排查或治疗的效果是十分重要的。
技术实现要素:
5.本发明针对现有技术的问题,提供一种新冠病毒特异性结合的复合体及载物体,具体技术方案如下:
6.本发明的新冠病毒特异性结合的复合体包括介孔二氧化硅包裹体和门控适配体。
7.其中,介孔二氧化硅包裹体具有分布于表面的孔;
8.所述门控适配体包括双链dna和金纳米颗粒,所述双链dna具有一条n蛋白适配体及一条互补链,所述金纳米颗粒连接在介孔二氧化硅包裹体与n蛋白适配体之间,金纳米颗粒封堵介孔二氧化硅包裹体的微孔。
9.n蛋白适配体一端标记有巯基,可以与金纳米颗粒结合,然后与羧基修饰的互补链杂交,形成双链dna(ds-dna)寡核苷酸,将ds-dna与rdv负载和氨基功能化的介孔二氧化硅反应,关闭中空通道(介孔),获得金纳米颗粒(msns-au)封装的介孔二氧化硅,当msns-au与n蛋白相互识别后,金纳米颗粒修饰的适配体与n蛋白结合离开介孔二氧化硅,打开介孔二氧化硅的中空通道。介孔二氧化硅的中空通道内可以特异性封闭一些物质,以实现这些物质的保护,避免特殊的环境对介孔二氧化硅的内容物产生不利影响或内容物对外部环境产生不利影响,例如破坏非新冠病毒所处环境的原生态环境,或者未接触到新冠病毒时,内容物部分或全部失效。
10.优选的,所述n蛋白适配体的dna序列为:
[0011]5’‑
gctggatgtc gctta cgacaatatt cctta ggggc
[0012]
accgc tacat tgaca catccagc-sh-3’。
[0013]
优选的,所述互补链的dna序列为:
[0014]5’‑
cooh-ttgtactggc tcatagctggatgtg tcaat gtagc
[0015]
ggtgc ccctaaggaa tattg tcgtaagcg-3’。
[0016]
优选的,介孔二氧化硅包裹体的表面具有氨基,氨基是对介孔二氧化硅包裹体进行的功能性修饰。
[0017]
优选的,所述复合体的介孔二氧化硅包裹体内包含有内容物,内容物以复合体为载体达到针对新冠病毒的靶向目的,例如内容物可以治疗的药物、检测的试剂等。
[0018]
本发明的有益效果为:本发明基于n蛋白适配体与n蛋白得到特异性结合特征,设计出特异性结合的复合体,可以达到对内容物的靶向输送的目的,同时还可以对内容物及外部环境进行保护,避免内容物在输送至目的区域前失效的问题,以及内容物暴露于无关环境后对无关环境本身所处状态产生负面影响。
附图说明
[0019]
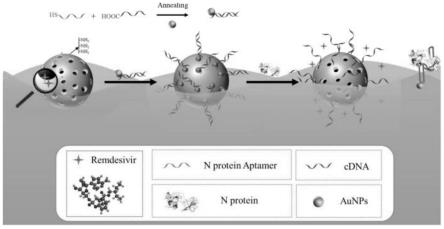
图1为msn-au与n蛋白特异性结合的模型示意图;
[0020]
图2为ds-dna的琼脂糖凝胶电泳图;
[0021]
图3为介孔二氧化硅的透射电镜图像(a和b),氮气吸附解吸等温线(c)和孔隙尺寸分布(d),msns-hn2的红外图像(e),氨基标准曲线的荧光定量检测(f);
[0022]
图4为介孔二氧化硅的扫描电镜图像;
[0023]
图5为rdv的三维原理图;
[0024]
图6为固体msn和msn-nh2的粉末x射线图;
[0025]
图7为不同浓度rdv的紫外-可见光谱(a)以及uv-vis强度与rdv浓度的相关性(b);
[0026]
图8为rdv浓度的紫外-可见吸收图(a),msn-au的tem图像(b),以及msn-au与n蛋白结合后的tem图像(c);
[0027]
图9为在没有n蛋白、存在2μm n蛋白及rdv负载金纳米颗粒修饰的介孔二氧化硅的情况下,从msn-au释放rdv的时间的优化;
[0028]
图10为n蛋白适配体对目标蛋白的选择性;
[0029]
图11为干扰物质和n蛋白分别与msn-au溶液反应后,rdv在溶液中的紫外-可见吸收峰;
[0030]
图12为志愿者的基本特征;
[0031]
图13为在相同浓度和相同体积的msn-au溶液中加入含有不同浓度的n蛋白的全血,得到了rdv的紫外吸收峰;
[0032]
图14为不同浓度n蛋白与msn-au结合的紫外-可见光谱(a)以及rdv的紫外-可见度与n蛋白浓度的相关性(b);
[0033]
图15为人血液样本中n蛋白诱导的rdv信号的恢复结果(n=3)。
具体实施方式
[0034]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合实施例对本发明技术方案进行清楚、完整地描述。
[0035]
瑞德西韦(remdesivir),是一种核苷类似物,具有抗病毒活性,在hae细胞中,对sars-cov和mers-cov的ec50值为74nm,在延迟脑肿瘤细胞中,对鼠肝炎病毒的ec50值为
30nm。
[0036]
目前,瑞德西韦(rdv)已被临床证明对治疗sars-cov-2有效。然而,不确定的副作用使得在减少药物的同时,确保治愈效果的使用很重要。2020年5月7日,日本批准了美国吉利德科技公司研发的瑞德西韦作为国内首款新冠肺炎治疗药物,将被用于重症患者治疗。2020年10月22日,美国食品药品管理局(fda)批准了吉利德科学的抗病毒药物瑞德西韦用于治疗新冠住院患者,成为美国首个正式获批的新冠治疗药物。
[0037]
本技术中以瑞德西韦作为介孔二氧化硅的内容物,如图1所示,为载有瑞德西韦的复合体与sars-cov-2的特异性结合过程,并通过如下实施例的记载,来辅助说明。
[0038]
1、试剂和材料
[0039]
瑞德西韦(rdv;99.74%)来自医疗化学快递(蒙茅斯枢纽,新泽西州,美国);
[0040]
n-羟基琥珀酰亚胺(nhs)、免疫球蛋白g(igg)、血红蛋白(hgb)、纤维蛋白原(fib)、细胞色素c、凝血酶、溶菌酶(lz)和50
×
tae均来自北京soleibo科技有限公司;
[0041]
核衣壳蛋白(n蛋白)购自北京义桥神舟科技有限公司;
[0042]
标记物、6
×
加样缓冲液、agrose和t4多核苷酸激酶(t4 pnk)购自生工生物技术公司(上海,中国);
[0043]
牛血清白蛋白(bsa)购自山东思捷生物有限公司;
[0044]
碱性磷酸酶(akp)由上海双云生物有限公司提供;
[0045]
sybrtm金核酸凝胶染色公司是赛默费世尔科学公司;
[0046]
生工生物技术公司合成纯化n蛋白适配体和互补dna链;
[0047]
所有溶液均由微孔隙水净化系统(》18.2mω
·
cm)获得的超纯水制备;
[0048]
所有其他化学品均为分析级化学品。
[0049]
2、仪器
[0050]
用tu-1901紫外-可见分光光度计(北京)记录了紫外-可见吸收光谱;
[0051]
使用日立s-4800(日本)获得扫描电子显微镜(sem)图像;
[0052]
x射线衍射(xrd)采用bruker d8推进技术获得x射线衍射(xrd)图像;
[0053]
n蛋白适配体和互补链的浓度由核酸定量仪(纳米滴2000美国)获得;
[0054]
dna双链的合成采用聚合酶链反应(pcr;hermal cycler s1000美国);
[0055]
由dna电泳仪(jy300cchina)形成条带;
[0056]
凝胶成像采用凝胶图像形成分析仪(chemidoc mp成像系统美国)。
[0057]
3、试验部分
[0058]
3.1适配体与金纳米颗粒的结合
[0059]
合成和定量分析的双链dna(ds-dna)寡核苷酸通过n蛋白适配体与n蛋白互补杂交形成。将n蛋白质适配体(20μm)和互补dna(20μm)加入到90μl的tri-mgcl2(5mm mgcl2、140mm nacl、20mm tri-base、ph7.4),然后加入10μl退火缓冲液(100mm tris、0.5mm edta、1mm nacl、ph 7.4)。然后将整个系统在pcr仪器中以95℃加热10分钟,然后以1℃/min的速度逐渐冷却到20℃。
[0060]
样品用3%琼脂糖凝胶电泳鉴定,在1
×
tae缓冲液中,100v,30min。然后通过凝胶形成分析仪获得凝胶图像,通过凝胶电泳进一步证实了dna双链的合成,图2为琼脂糖凝胶电泳图。图2中,从左到右:标记标准条带(m),n蛋白适配体(1),cdna(2),ds-dna(3)。
[0061]
取20μl(0.25mm)的平均直径为5nm的金纳米颗粒加入到ds-dna溶液中。将金纳米颗粒与巯基化的ds-dna链混合12h,通过au-s键获得含金纳米颗粒(au-dna)的dsdna。最后,在超滤管中以3000r/min离心10min,去除多余的ds-dna链。然后将得到的au-dna重悬在80μlpbs缓冲液(137mm氯化钠,2.7mm氯化钾,10mm磷酸氢二钠,1.75mm磷酸二钾,50mm氯化镁,ph 7.4)中。
[0062]
3.2用金纳米颗粒修饰的适配体与msn-nh2的结合
[0063]
将3mg的rdv固体粉末溶于5ml的pbs和乙腈中(比例为10:1),超声波均匀溶解。然后,在rdv溶液中加入10mg胺基介孔二氧化硅。将rdv通过在磁力搅拌器上缓慢搅拌24小时,扩散到胺化介孔二氧化硅的孔径。然后,将100μl的rdv与介孔二氧化硅和au-dna溶液混合。最后,将10μl edc(250mm)和10μlnhs(1.25m)放入混合溶液中,在10℃(24h)下缓慢振荡,得到msn-au。
[0064]
图7中,采用紫外-可见法测定pbs溶液中rdv的浓度。如图7a所示,基线表示无rdv的紫外-可见图,从下到上添加的rdv浓度分别为1mg
·
l-1
、3mg
·
l-1
、5mg
·
l-1
、7mg
·
l-1
、10mg
·
l-1
、12mg
·
l-1
、15mg
·
l-1
、17mg
·
l-1
和20mg
·
l-1
。在247nm处的吸光度随着rdv浓度的增加而增加。在1-20mg
·
l-1
范围内,吸光度与rdv浓度呈线性关系,线性回归方程为a=0.055+0.036c
rdv
,r2=0.995,如图7b所示。检测限对0.5mg
·
l-1
(s/n=3)敏感。
[0065]
3.3介孔二氧化硅的表征
[0066]
采用比表面积法和孔径分析仪计算其比表面积、孔径体积和孔径分布。将样品分散在无水乙醇中,并滴在铜网上进行吸附。在室温下干燥后,用透射电镜观察了孔隙的结构和形貌。采用溴化钾片法ftir分析msn-nh2表面修饰官能团。建立了荧光胺与aptes之间的标准曲线,并通过测定样品计算了介孔二氧化硅表面的氨基浓度。
[0067]
将1mg的样品分散在2ml的无水乙醇中,然后落在硅片上,用扫描电镜观察了样品的形貌,通过透射电镜和扫描电镜图像对介孔二氧化硅进行表征,如图3和图4所示。典型介孔二氧化硅的直径在50~100nm之间(图3a、b和图4a、b)。如图3b所示,介孔二氧化硅中有大量的均匀孔隙排列,为rdv的加载提供了足够的空间。采用氮吸附解吸等温线检测介孔二氧化硅的表面积,计算结果为760.6m2·
g-1
(图3c),平均孔径为2.7nm(图3d)。
[0068]
图5中,rdv的三维尺寸分别为1.8、1.2和1.1nm。rdv的大小是通过使用multiwfn3.7计算获得的。
[0069]
这些结果表明,介孔二氧化硅的孔径足以满足rdv的加载。ms-nh2的ft-ir光谱如图3e所示。典型的o-si-o弯曲振动峰在467cm-1
处,1091cm-1
处的峰是由si-o-si的拉伸振动引起的。氨基化介孔二氧化硅中硅氢的弯曲振动与961和1641cm-1
处的弯曲振动一致。-nh-的振动峰值为1503cm-1
。在3427cm-1
处的吸收峰是由水分子的o-h伸缩振动引起的。上述在3427、1641、1503、1091、961和467cm-1
处的吸收峰与特征吸收位置相匹配,证实了氨基化介孔二氧化硅的成功合成。荧光检测结果显示,介孔二氧化硅上的氨基浓度为0.63mm(图3f)。
[0070]
图6为氨基修饰的介孔二氧化硅前后x射线衍射xrd峰的变化,图中,上方曲线为msn,下方曲线为msn-nh2,在2θ处的衍射峰约为2.300
°
,说明材料在一定的尺度下排列有序。粉末x射线衍射(xrd)的胺改性介孔二氧化硅峰低于粉末x射线衍射(xrd)的介孔二氧化硅峰。这可能是由于氨基修饰的msn材料降低了msn的粉末x射线衍射(xrd)峰的强度。
[0071]
3.4介孔二氧化硅的rdv加载
[0072]
取100μlmsn-au溶液(2份),用超滤管离心,用pbs清洗,去除多余的rdv。一个含有2μm的n蛋白,另一个不含。100μl msn-au溶液,过滤和冲洗,在60℃的真空烘箱中干燥,然后在100μlpbs缓冲溶液中溶解。用紫外-可见吸光光度法测定溶液中rdv的浓度。
[0073]
如图8a所示,在uv-vis检测中,没有msn-au的空白pbs溶液在247nm处没有显示峰值信号(最下部线)。msn-au溶液在247nm处出现吸收峰(中部线),而吸收峰信号随着n蛋白的加入而明显增加(顶部线)。透射电镜进一步观察n蛋白加入前后msn-au的变化。在金纳米颗粒覆盖的介孔二氧化硅中,在透射电镜下观察到单分散二氧化硅外壳上的黑点(图8b)。与n蛋白结合后,介孔二氧化硅表面的黑点明显减少(图8c)。这些结果表明,加入n蛋白后,介孔二氧化硅上的金纳米颗粒可以打开,实现了加载的rdv释放过程。
[0074]
在rdv释放的实验条件之前,我们首先测试了msn-au的稳定性,参见图9,在没有n蛋白(最下部线)和存在2μm n蛋白(中部线)的情况下,从msn-au释放rdv的时间的优化。对照实验rdv负载金纳米颗粒修饰的介孔二氧化硅(顶部线)。
[0075]
3.4n蛋白适配体选择性
[0076]
为了验证适配体对n蛋白的独特选择性,我们选择了血液中常见的9种蛋白(akp、bsa、t4 pnk、igg、凝血酶、hgb、lz、细胞色素c、fib)作为干扰物质。参见图10,然后将单个干扰蛋白和所有干扰混合物分别与msn-au反应,以评估适配体对选择性传递过程的影响,图10中从左到右,添加的蛋白分别为akp(20u
·
ml-1
)、牛血清白蛋白(2μm)、t4 pnk(20u
·
ml-1
)、igg(2μm)、凝血酶(2μm)、hgb(2μm)、lz(2μm)、细胞色素c(2μm)、fib(2μm)和n蛋白(2μm)。
[0077]
参见图11,为干扰物质和n蛋白分别与msn-au溶液反应后,rdv在溶液中的紫外-可见吸收峰。从图11可以看出,蛋白混合物(从下往上第三道曲线)中rdv浓度的紫外-可见吸收峰与无n蛋白的msn-au溶液(从下往上第二道曲线)相似。当将n蛋白加入到含有msn-au的溶液中时,紫外-可见峰的吸收值显著增加(从下往上第四道曲线)。说明rdv从介孔二氧化硅通道中释放出来,溶液中rdv的浓度增加。这一结果证实了适配体与n蛋白的特异性结合。
[0078]
3.5实际样品中rdv介孔硅的分析
[0079]
随机选取5名志愿者,通过抽取5名志愿者的静脉血并将血液放入抗凝管edta-k2中获得血液样本。将2μl血样加入100μlmsn-au溶液中。然后,将不同浓度的n蛋白加入到血液和rdv的混合溶液中,用紫外-可见分光光度法检测msn-au的rdv释放量,msn-au溶液需要通过超滤管离心,用pbs清洗以去除多余的rdv。其特征见图12。在添加msn-au前未对血液进行预处理。分别在血液和msn-au的混合溶液中加入0μm、0.5μm、1μm和2μm的n蛋白。从图13可以看出,随着混合溶液中n蛋白浓度的增加,紫外-可见吸收峰逐渐增加。rdv释放浓度与n蛋白添加量的相关性如图14所示,不同浓度n蛋白与msn-au结合的紫外-可见光谱(参见图14a)以及rdv的紫外-可见度与n蛋白浓度的相关性(参见图14b)。采用统计学方法获得血样中n蛋白的平均回收率。分别在0.5μm、1μm、2μm下加入n蛋白进行恢复实验,参见图15,采用统计学方法计算血液样本中n蛋白诱导的rdv信号的平均回收率,在血样中分别加入0.5μm、1μm和2μm的n蛋白。如图15所示,所获得的血液样本回收率在90.4%~113.1%之间,rsd在3.6%~6.7%之间。
[0080]
rdv分子在摇床磁力搅拌器上振荡加载入孔中,当rdv负载的介孔二氧化硅与金纳米颗粒修饰的dna双链结合时,介孔二氧化硅的孔被金纳米颗粒包围。在与n蛋白结合后,连接金纳米颗粒的适配体与其互补的dna寡核苷酸分离并与靶标结合。随着介孔二氧化硅表
面微孔门的打开,rdv将从孔中释放出来。
[0081]
以上实施例仅用以说明本发明的技术方案,而非对其限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1