一种制备酰胺的方法
1.本发明涉及有机合成领域,具体涉及在二氟卡宾试剂和碱性物质作用下,羧酸和胺类化合物反应直接制备酰胺类化合物的方法。
背景技术:
2.无论在天然分子还是合成药物分子中,酰胺键都是十分重要的化学键,酰胺键的形成在药物合成中是最重要的反应之一。在2008年stephen等人统计来自于三大制药公司的139篇论文中发现,酰胺键的形成在所有反应类型占比达16%[stephen d.roughley and allan m.jordan,j.med.chem.,2011,54,3451-3479]。无独有偶,2016年dean等人对比1984年和2014年天然产物全合成使用的化学反应中酰胺键的合成由25%增加到了50%左右[dean g.brown and jonas j.med.chem.,2016,59,4443-44458]。羧酸与胺直接缩合是制备酰胺的最常见的方法。常见的由酸/胺合成酰胺的方法包括碳二亚胺类缩合剂法、混合酸酐法、脲鎓盐类的缩合剂法、有机磷鎓盐类缩合剂、酰卤法等。目前,应用在药物合成中较多的方法是偶联试剂法,较常用的缩合剂包括:1)碳二亚胺类,如二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)和1-(3-二甲胺基丙基)-3-乙基碳二亚胺(edci);2)脲鎓盐类,如o-(7-氮杂苯并三氮唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐(hatu)、o-(苯并三氮唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐(hbtu)和o-(6-氯苯并三氮唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐(hctu);3)有机磷鎓盐类,如(7-氮杂苯并三氮唑-1-基氧三吡咯烷基磷鎓六氟磷酸盐(pyaop)和苯并三氮唑-1-基氧三吡咯烷基磷鎓六氟磷酸盐(pybop)。虽然上述三类试剂具有反应条件温和、反应高效、投料简单等优点,但是此类缩合剂分子量大、原子经济性低,大部分试剂价格较高,而且反应产生当量的有机副产物(n-羟基苯并三氮唑、脲或磷酰胺)使酰胺产物难以分离纯化。此外,近年来有研究表明:碳二亚胺类、脲鎓盐类和有机磷鎓盐类这三种高活性的缩合剂是人体免疫系统的致敏剂,长期接触这些试剂会导致过敏反应,甚至有潜在的致癌毒性[kate j.mcknelly,william sokol,and james s.nowick et al,j.org.chem.2020,85,1764-1768]。因此,开发一种安全、绿色、高原子经济性的酰胺合成方法是有必要的。
技术实现要素:
[0003]
为满足药物化学中对酰胺缩合的需求,本发明提供了在二氟卡宾试剂的存在下,羧酸和胺类化合物直接缩合制备酰胺类化合物的方法。该方法使用的原料廉价易得,反应条件温和,操作简便实用。
[0004]
为实现上述目的,本发明的技术方案如下:
[0005]
一种式(ⅰ)所示的酰胺类化合物的制备方法,所述制备方法为:将式(ⅱ)所示化合物和式(ⅲ)所示化合物加入到有机溶剂中,加入二氟卡宾试剂构建反应体系,60-130℃反应6-15h,反应结束后,所得反应液经后处理即得所述的式(ⅰ)所示的酰胺类化合物;所述的二氟卡宾试剂为二氟溴乙酸乙酯、二氟氯乙酸钠、二氟一氯甲烷中的一种或两种以上的混
合物;所述的式(ⅱ)所示化合物、式(ⅲ)所示化合物与二氟卡宾试剂的物质的量之比为1:0.8-2:1-80;
[0006][0007]
其中,式(ⅰ)、式(ⅱ)、式(ⅲ)中,r1为c
1-20
烷基、苯基、被卤素或c
1-4
烷基取代的苯基、苯甲基、被卤素、c
1-4
烷基或c
1-4
烷氧基取代的苯甲基、1-叔丁氧羰基-4-哌啶基、如式(x)所示的取代基、如式(y)所示的取代基、如式(z)所示的取代基或苯乙烯基;r2为c
1-4
烷基、萘基、噻唑基、吡啶基、苯基或者被卤素、c
1-4
烷基、c
1-4
烷氧基、c
1-4
烷羰基、氰基、c
1-4
烷硫基、硝基或c
1-4
羟烷基取代的苯基,r3为氢或c
1-4
烷基,或者r2、r3与两者之间的n组合形成哌啶环或吗啉环。
[0008]
进一步,所述的有机溶剂为n,n-二甲基甲酰胺(dmf)、n,n-二甲基乙酰胺(dma)、n-甲基吡咯烷酮(nmp)、乙腈、甲苯、氯苯、二甲基亚砜、乙醇、1,4-二氧六环中的一种或两种以上的混合溶剂;所述有机溶剂的体积以式(ⅱ)所示的化合物的物质的量计为3.3~4ml/mmol。
[0009]
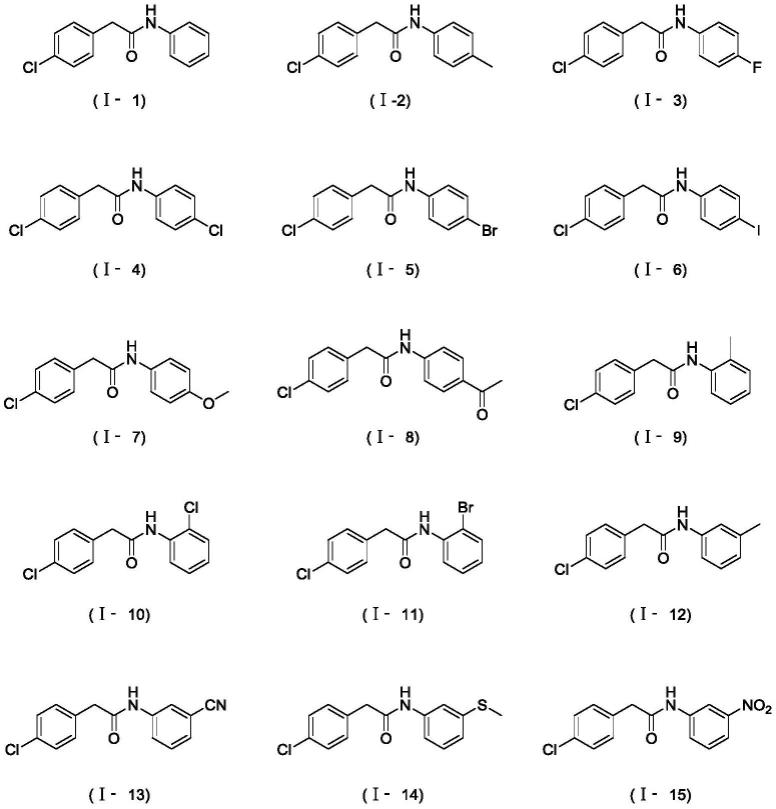
综合考虑原料的来源、反应的收率和产物的代表性,作为最优选,r1为对氯苯甲基、苯甲基、邻甲苯甲基、邻氯苯甲基、间氯苯甲基、对甲氧基苯甲基、十五烷基、2-苯基乙烯基、1-叔丁氧羰基-4-哌啶基、苯基、对甲基苯甲基、对氯苯甲基、如式(x)所示的取代基、如式(y)所示的取代基、如式(z)所示的取代基;r2为邻甲基苯基、邻氯苯基、邻溴苯基、间甲基苯基、间氰基苯基、间甲硫基苯基、间硝基苯基、间羟甲基苯基、对甲苯基、对氟苯基、对氯苯基、对溴苯基、对碘苯基、对甲氧基苯基、对乙酰基苯基、1-萘基、2-噻吩基、3-吡啶基,r3为氢,或者r2、r3和两者之间的n组合形成哌啶环或吗啉环。最后得化合物(ⅰ)结构如下:
[0010]
[0011][0012]
二氟溴乙酸乙酯、二氟氯乙酸钠、二氟一氯甲烷的结构式分别如下:
[0013][0014]
进一步,所述反应体系中还加入了碱性物质,所述的碱性物质为碳酸铯、碳酸钾、碳酸钠、碳酸锂、碳酸氢钠、氢氧化钠、氢氧化钾、氢氧化锂、磷酸钾、乙酸钾、乙酸钠、三乙胺、dbu(1,8-二氮杂双环[5.4.0]十一碳-7-烯)、dmap(4-二甲氨基吡啶)中的一种或两种以上的混合物;所述的式(ⅱ)所示化合物与碱性物质的物质的量之比为1:0-4,其中0为无限
接近于0但不为0。即所述制备方法为:将式(ⅱ)所示化合物和式(ⅲ)所示化合物加入到有机溶剂中,在碱性物质的作用下,加入二氟卡宾试剂构建反应体系,60-130℃反应6-15h,反应结束后,所得反应液经后处理即得所述的式(ⅰ)所示的酰胺类化合物;所述的碱性物质为碳酸铯、碳酸钾、碳酸钠、碳酸锂、碳酸氢钠、氢氧化钠、氢氧化钾、氢氧化锂、磷酸钾、乙酸钾、乙酸钠、三乙胺、dbu、dmap中的一种或两种以上的混合物;所述的二氟卡宾试剂为二氟溴乙酸乙酯、二氟氯乙酸钠、二氟一氯甲烷中的一种或两种以上的混合物;所述的式(ⅱ)所示化合物、式(ⅲ)所示化合物与、二氟卡宾试剂与碱性物质的物质的量之比为1:0.8-2:1-80:0-4;
[0015]
当二氟卡宾试剂为(ⅳ)二氟溴乙酸乙酯时,所述的碱性物质优选为碳酸铯、碳酸钾、碳酸钠、碳酸锂、氢氧化钠、氢氧化钾、氢氧化锂、磷酸钾、乙酸钾、乙酸钠、三乙胺、dbu、dmap中的一种或两种以上的混合物;作为最优选,所述碱性物质为三乙胺,所述反应溶剂为n,n-二甲基甲酰胺,反应温度为110℃,式(ⅱ)所示化合物、式(ⅲ)所示化合物、二氟卡宾试剂与碱性物质的物质的量之比为1:1.5:3:2;此时推荐所述反应在保护氛围下进行,收率会稍高于无气体保护的情况,优选所述保护氛围为氮气氛围。
[0016][0017]
当二氟卡宾试剂为(
ⅴ
)二氟氯乙酸钠时,所述的碱性物质优选为碳酸铯、碳酸钾、碳酸钠、碳酸锂、氢氧化钠、氢氧化锂、磷酸钾、乙酸钾、乙酸钠、三乙胺、dbu、dmap中的一种或两种以上的混合物;作为最优选,碱性物质为碳酸铯,反应溶剂为n,n-二甲基甲酰胺,反应温度为110℃,式(ⅱ)所示化合物、式(ⅲ)所示化合物、二氟卡宾试剂与碱性物质的物质的量之比为1:1.2:2:1.5;此时推荐所述反应在保护氛围下进行,收率会稍高于无气体保护的情况,优选所述保护氛围为氮气氛围。
[0018][0019]
当二氟卡宾试剂为(ⅵ)二氟一氯甲烷时,所述的碱性物质优选为碳酸铯、碳酸钾、碳酸钠、碳酸锂、氢氧化钠、氢氧化锂、碳酸氢钠、磷酸钾、乙酸钾、乙酸钠、三乙胺、dbu、dmap中的一种或两种以上的混合物;作为最优选,碱性物质为碳酸钾,反应溶剂为n,n-二甲基甲酰胺,反应温度为80℃,式(ⅱ)所示化合物、式(ⅲ)所示化合物、二氟一氯甲烷与碱性物质的物质的量之比为1:1:80:1.5。
[0020][0021]
作为优选,当二氟卡宾试剂为二氟溴乙酸乙酯或二氟氯乙酸钠时,所述反应在保护氛围(如氮气)下进行。收率会稍高于无气体保护的情况。
[0022]
进一步,所述的后处理为:反应结束后,加水稀释,用乙酸乙酯萃取(三次),合并有机层,用饱和食盐水洗涤,然后用无水硫酸钠干燥,过滤,浓缩,以体积比为0-9:1的石油醚
和乙酸乙酯为洗脱剂进行硅胶柱层析分离,收集含目标产物的洗脱液,减压蒸馏,干燥,得到所述如式(ⅰ)所示的酰胺类化合物。
[0023]
与现有技术相比,本发明的有益效果体现在:
[0024]
本发明方法以二氟卡宾试剂为缩合剂,n,n-二甲基甲酰胺为溶剂,加入合适的碱,直接一锅法反应实现了羧酸与胺的缩合,合成了药物化学中常见的酰胺键。该方法原料廉价易得,反应条件温和,制备分离方法简单,反应产率较高,纯度都在95%以上。
具体实施方式
[0025]
下面结合实施例来具体说明,但本发明并不仅限于此。
[0026]
当使用二氟卡宾试剂为溴二氟乙酸乙酯(ⅳ)时,最优条件优化过程如下。
[0027]
实施例1
[0028]
在装有磁搅拌的干燥反应管中,加入0.0853g(0.5mmol)的对氯苯乙酸、46μl(0.5mmol)的苯胺和0.3045g(1.5mmol)的二氟溴乙酸乙酯,最后加入2ml的n,n-二甲基甲酰胺(dmf)。将反应管装配上连接有氮气球的三通管,使反应在氮气氛围下90℃油浴中搅拌反应6小时;反应结束后,加30ml水稀释,用乙酸乙酯萃取三次,每次30ml,合并有机层,有机相用饱和食盐水洗涤,然后用无水硫酸钠干燥,过滤,浓缩,柱层析(石油醚:乙酸乙酯(v/v)=4:1),收集rf值0.2的洗脱液,减压蒸馏,干燥得到目标化合物(
ⅰ‑
1),白色固体57.2mg,收率为47%,熔点164-166℃,纯度96.24%(hplc检测)。
[0029]
实施例2-5
[0030]
改变反应的溶剂,将dmf改为dma、甲苯、乙腈、nmp,其他同实施例1,反应结果如表1-1所示:
[0031]
表1-1不同反应溶剂对反应产率的影响
[0032]
实施例反应溶剂产量[mg]产率[%]2dma(2ml)33.1273甲苯(2ml)20.5174乙腈(2ml)18.3155nmp(2ml)30.025
[0033]
结果表明当反应溶剂为dmf时反应产率最高。
[0034]
实施例6-9
[0035]
改变反应的温度,将反应温度由90℃改为50℃、70℃、110、130℃,其他操作同实施例1,反应结果如表1-2所示:
[0036]
表1-2不同反应溶剂对反应产率的影响
[0037]
实施例反应温度产量[mg]产率[%]650℃36.029770℃47.3388110℃65.4539130℃49.340
[0038]
结果表明当反应温度为110℃时反应产率最高。
[0039]
实施例10-12
[0040]
改变溴二氟乙酸乙酯(ⅳ)的用量,由原来的1.5mmol改为0、1mmol、2mmol,反应使用dmf为溶剂,反应温度为110℃,其他操作同实施例1,反应结果如表1-3所示:
[0041]
表1-3溴二氟乙酸乙酯(ⅳ)的用量对反应产率的影响
[0042][0043][0044]
结果表明溴二氟乙酸乙酯(ⅳ)的用量使用量为0时没有产物生成,溴二氟乙酸乙酯(ⅳ)的用量增加到2mmol时反应产率无明显的变化(对比实施例8),所以最优的用量仍为1.5mmol。
[0045]
实施例13-16
[0046]
探究碱性物质对反应的影响,向反应中加入0.5mmol碱性物质:nahco3、na2co3、dmap、三乙胺,反应使用dmf为溶剂,反应温度为110℃,其他操作同实施例1,反应结果如表1-4所示:
[0047]
表1-4不同的碱对反应产率的影响
[0048]
实施例碱的种类产量[mg]产率[%]13nahco3(0.5mmol,42.0mg)38.23114na2co3(0.5mmol,53.0mg)60.44915dmap(0.5mmol,61.1mg)61.35016三乙胺(0.5mmol,50.6mg)66.854
[0049]
结果表明当反应加入0.5mmol的三乙胺时反应产率更高。加入0.5mmol的碳酸氢钠会导致副产物二氟溴乙酰苯胺的增加,使产物的收率降低至31%。
[0050]
实施例17-18
[0051]
探究三乙胺的最佳用量,向反应中加入1mmol或1.5mmol的三乙胺,反应使用dmf为溶剂,反应温度为110℃,其他操作同实施例1,反应结果如表1-5所示:
[0052]
表1-5不同的三乙胺用量对反应产率的影响
[0053]
实施例三乙胺用量产量[mg]产率[%]17三乙胺(1mmol,101.2mg)71.95918三乙胺(1.5mmol,151.8mg)63.352
[0054]
结果表明三乙胺的量增加入至1mmol时反应产率最高。
[0055]
实施例19-21
[0056]
改变反应中羧酸和胺的物质的量之比,反应使用dmf为溶剂,反应温度为110℃,反应中加入1mmol的三乙胺,其他操作同实施例1,反应结果如表1-6所示:
[0057]
表1-6羧酸和胺的物质的量之比对反应产率的影响
[0058]
实施例对氯苯乙酸:苯胺产量[mg]产率[%]191.5:1(0.75mmol:0.5mmol;128.0mg:46.6mg)75.963201:1.5(0.5mmol:0.75mmol;85.3mg:69.8mg)81.166211:2(0.5mmol:1mmol;85.3mg:93.1mg)81.266
[0059]
结果表明对氯苯乙酸和苯胺的物质的量之比为1:1.5时反应产率更高,再增加苯胺的量,产率基本无变化。
[0060]
经过以上一系列的条件筛选,最优条件为实施例20时使用的条件,具体操作如下:
[0061]
在装有磁搅拌的干燥反应管中,加入0.0853g(0.5mmol)的对氯苯乙酸、68μl(0.75mmol)的苯胺、0.3045g(1.5mmol)的二氟溴乙酸乙酯和0.1012g(1mmol)的三乙胺,最后加入2ml的n,n-二甲基甲酰胺。将反应管装配上连接有氮气球的三通管,使反应在氮气氛围下110℃油浴中搅拌反应6小时;反应结束后,加30ml水稀释,用乙酸乙酯萃取三次,每次30ml,合并有机层,有机相用饱和食盐水洗涤,然后用无水硫酸钠干燥,过滤,浓缩,柱层析(石油醚:乙酸乙酯=4:1),收集rf值0.2的洗脱液,减压蒸馏,干燥得到目标化合物(
ⅰ‑
1),白色固体81.1mg,收率为66%,熔点164-166℃,纯度97.14%(hplc检测)。
[0062]
当使用二氟卡宾试剂为溴二氟乙酸乙酯(ⅳ)时,底物适用性探究
[0063]
实施例22-39
[0064]
改变反应胺的种类,将苯胺改为对甲基苯胺、对氟苯胺、对氯苯胺、对溴苯胺、对碘苯胺、对甲氧基苯胺、对乙酰苯胺、邻甲基苯胺、邻氯苯胺、邻溴苯胺、间甲基苯胺、间氨基苯甲腈、间氨基茴香硫醚、间硝基苯胺、α-萘胺、吗啉、哌啶、2-氨基噻吩,其他同实施例20,反应结果如表1-7所示:
[0065]
表1-7不同胺对反应产率的影响
[0066]
[0067]
结果表明,对于改变对位和间位取代基的苯胺类化合物,对反应产率的影响较小;对于邻位取代的苯胺,随着位阻的增大产率随之降低;将苯胺改变为α-萘胺、2-氨基噻吩或脂肪仲胺,反应依旧有较好的产率。
[0068]
实施例40-53
[0069]
改变反应羧酸的种类,将对氯苯乙酸改为苯乙酸、邻甲基苯乙酸、邻氯苯乙酸、对甲氧基苯乙酸、间氯苯乙酸、2-(6-甲氧基-2-萘基)丙酸、2-甲基-4-(2-甲基丙基)苯乙酸、苯甲酸、对氯苯甲酸、对甲苯甲酸、肉桂酸、十六烷基酸、1-叔丁氧羰基-4-哌啶甲酸或6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-乙酸,其他同实施例20,反应结果如表1-8所示:
[0070]
表1-8不同羧酸对反应产率的影响
[0071][0072][0073]
结果表明,使用不同取代基的苯乙酸类化合物和脂肪羧酸,反应产率都较高;而将对氯苯乙酸改变为苯甲酸类的芳香羧酸,反应产率有明显的下降。
[0074]
实施例53
[0075]
同时改变羧酸和胺的种类,其他操作同实施例20,区别在于对氯苯乙酸换成6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-乙酸(140.2mg,0.5mmol),使用33%的二甲胺水溶液(1366.2mg,10mmol)而不是苯胺,反应15小时而不是6小时,得到目标化合物(
ⅰ‑
28),白色固体77.4mg,收率为50%。
[0076]
当使用二氟卡宾试剂为二氟氯乙酸钠(
ⅴ
)时,最优条件优化过程如下。
[0077]
实施例54
[0078]
在装有磁搅拌的干燥反应管中,加入0.0853g(0.5mmol)的对氯苯乙酸、46μl(0.5mmol)的苯胺、0.2287g(1.5mmol)的二氟氯乙酸钠和0.1012g(1mmol)的三乙胺,最后加入2ml的n,n-二甲基甲酰胺。将反应管装配上连接有氮气球的三通管,使反应在氮气氛围下110℃油浴中搅拌反应6小时;反应结束后,加30ml水稀释,用乙酸乙酯萃取三次,每次30ml,合并有机层,有机相用饱和食盐水洗涤,然后用无水硫酸钠干燥,过滤,浓缩,柱层析(石油
醚:乙酸乙酯=4:1),收集rf值0.2的洗脱液,减压蒸馏,干燥得到目标化合物(
ⅰ‑
1),白色固体103.0mg,收率为84%,,熔点164-165℃,纯度97.73%(hplc检测)。
[0079]
实施例55-62
[0080]
探究碱性物质对反应的影响,向反应中加入1mmol碱性物质:cs2co3、dmap、na2co3、k2co3、li2co3、k3po4、nahco3、lioh而不是1mmol的三乙胺,其他操作同实施例54,反应结果如表2-1所示:
[0081]
表2-1不同的碱对反应产率的影响
[0082]
实施例碱的种类产量[mg]产率[%]55cs2co3(1mmol,325.8mg)106.38756dmap(1mmol,122.2mg)101.78357na2co3(1mmol,106.6mg)75.66258k2co3(1mmol,207.3mg)75.36159li2co3(1mmol,73.9mg)91.07460k3po4(1mmol,163.9mg)84.76961nahco3(1mmol,84.0mg)33.92862lioh(1mmol,24.0mg)91.074
[0083]
结果表明当反应加入1mmol的cs2co3时反应产率更高。
[0084]
实施例63-67
[0085]
探究cs2co3的最佳用量,向反应中加入0.25mmol、0.5mmol、0.75mmol、1.25mmol、1.5mmol的cs2co3而不是1mmol的三乙胺,其他操作同实施例54,反应结果如表2-2所示:
[0086]
表2-2不同的cs2co3用量对反应产率的影响
[0087]
实施例碱的用量产量[mg]产率[%]63cs2co3(0.25mmol,81.5mg)65.95464cs2co3(0.5mmol,162.9mg)100.28265cs2co3(0.75mmol,244.4mg)105.28666cs2co3(1.25mmol,407.3mg)107.28767cs2co3(1.5mmol,488.7mg)109.589
[0088]
结果表明cs2co3用量增加入至0.75mmol时再增加cs2co3的用量,反应产率变化不明显,所以选择使用0.75mmol的cs2co3。
[0089]
实施例68-73
[0090]
改变反应所使用的溶剂,反应使用dma、nmp、dmso、氯苯、甲苯、二氧六环为溶剂而不是dmf,使用0.75mmol的cs2co3而不是1mmol三乙胺,其他操作同实施例54,反应结果如表2-3所示:
[0091]
表2-3反应溶剂对反应产率的影响
[0092]
实施例溶剂产量[mg]产率[%]68dma(2ml)85.87069nmp(2ml)94.17770dmso(2ml)67.655
71氯苯(2ml)87.37172甲苯(2ml)97.17973二氧六环(2ml)89.173
[0093]
结果表明使用其他溶剂都没有dmf作溶剂时反应产率高(对比实施例65),最终使用dmf作为反应溶剂。
[0094]
实施例74-76
[0095]
探究最佳反应温度,反应在70℃、90℃、130℃下反应而不是110℃,使用0.75mmol的cs2co3而不是1mmol三乙胺,其他操作同实施例54,反应结果如表2-4所示:
[0096]
表2-4反应温度对反应产率的影响
[0097]
实施例溶剂产量[mg]产率[%]7470℃98.0807590℃95.17776130℃100.482
[0098]
结果表明无论是升高温度还是降低温度,反应产率都不如110℃时产率高(对比实施例65),最终反应温度使用110℃。
[0099]
实施例77-81
[0100]
改变二氟氯乙酸钠(
ⅴ
)的用量,由原来的1.5mmol改为0.5mmol、0.75mmol、1mmol、1.25mmol、1.75mmol,使用0.75mmol的cs2co3而不是1mmol三乙胺,其他操作同实施例54,反应结果如表2-5所示:
[0101]
表2-5二氟氯乙酸钠(
ⅴ
)的用量对反应产率的影响
[0102][0103][0104]
结果表明二氟氯乙酸钠(
ⅴ
)的用量增加到1mmol时反应产率无明显的变化,所以最优的用量为1mmol。
[0105]
实施例82-83
[0106]
改变反应中羧酸和胺的物质的量之比,使用0.75mmol的cs2co3而不是1mmol三乙胺,使用1mmol二氟氯乙酸钠(
ⅴ
)而不是1.5mmol二氟氯乙酸钠(
ⅴ
),其他操作同实施例54,反应结果如表2-6所示:
[0107]
表2-6羧酸和胺的物质的量之比对反应产率的影响
[0108]
实施例对氯苯乙酸:苯胺产量[mg]产率[%]821.2:1(0.6mmol:0.5mmol;102.4mg:46.6mg)103.284831:1.2(0.5mmol:0.6mmol;85.3mg:55.9mg)110.190
[0109]
结果表明对氯苯乙酸和苯胺的物质的量之比为1:1.2时反应产率最高
[0110]
经过以上一系列的条件筛选,最优条件为实施例83时使用的条件,具体操作如下:
[0111]
在装有磁搅拌的干燥反应管中,加入0.0853g(0.5mmol)的对氯苯乙酸、55μl(0.6mmol)的苯胺、0.1525g(1mmol)的二氟氯乙酸钠和0.2444g(0.75mmol)的碳酸铯,最后加入2ml的n,n-二甲基甲酰胺。将反应管装配上连接有氮气球的三通管,使反应在氮气氛围下110℃油浴中搅拌反应6小时;反应结束后,加30ml水稀释,用乙酸乙酯萃取三次,每次30ml,合并有机层,有机相用饱和食盐水洗涤,然后用无水硫酸钠干燥,过滤,浓缩,柱层析(石油醚:乙酸乙酯=4:1),收集rf值0.2的洗脱液,减压蒸馏,干燥得到目标化合物(
ⅰ‑
1),白色固体110.1mg,收率为90%。
[0112]
实施例84-103
[0113]
改变反应胺的种类,将苯胺改为对甲基苯胺、对氟苯胺、对氯苯胺、对溴苯胺、对碘苯胺、对甲氧基苯胺、对乙酰苯胺、邻甲基苯胺、邻氯苯胺、邻溴苯胺、间甲基苯胺、间氨基苯甲腈、间氨基茴香硫醚、间硝基苯胺、3-氨基苯甲醇、α-萘胺、吗啉、哌啶、2-氨基噻吩、3-氨基吡啶,其他同实施例83,反应结果如表2-7所示:
[0114]
表2-7不同胺对反应产率的影响
[0115][0116][0117]
结果表明,对于改变对位和间位取代基的苯胺类化合物,对反应产率的影响较小;对于邻位取代的苯胺,随着位阻的增大产率随之降低;将苯胺改变为α-萘胺或脂肪仲胺,反
应依旧有较好的产率,将苯胺改变为2-氨基噻吩、3-氨基吡啶,反应产率则有较大的降低。
[0118]
实施例104-118
[0119]
改变反应羧酸的种类,将对氯苯乙酸改为苯乙酸、邻甲基苯乙酸、邻氯苯乙酸、对甲氧基苯乙酸、间氯苯乙酸、2-(6-甲氧基-2-萘基)丙酸、2-甲基-4-(2-甲基丙基)苯乙酸、苯甲酸、对氯苯甲酸、对甲苯甲酸、肉桂酸、十六烷基酸、1-叔丁氧羰基-4-哌啶甲酸或6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-乙酸,其他同实施例83,反应结果如表2-8所示:
[0120]
表2-8不同羧酸对反应产率的影响
[0121][0122]
结果表明,使用不同取代基的苯乙酸类化合物和脂肪羧酸,反应产率都较高;而将对氯苯乙酸改变为苯甲酸类的芳香羧酸,反应产率相对较低。
[0123]
实施例118
[0124]
同时改变羧酸和胺的种类,其他操作同实施例83,区别在于对氯苯乙酸换成6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-乙酸(140.2mg,0.5mmol),使用33%的二甲胺水溶液(1366.2mg,10mmol)而不是苯胺,反应15小时而不是6小时,得到目标化合物(
ⅰ‑
28),白色固体69.4mg,收率为45%。
[0125]
当使用二氟卡宾试剂为二氟一氯甲烷(ⅵ)时,最优条件优化过程如下。
[0126]
实施例119
[0127]
在装有磁搅拌的干燥反应管中,加入0.0853g(0.5mmol)的对氯苯乙酸、46μl(0.5mmol)的苯胺和0.4887g(1.5mmol)的碳酸铯,最后加入2ml的n-甲基吡咯烷酮(nmp)。将反应管装配上连接有二氟一氯甲烷气球的三通管(二氟一氯甲烷约为40mmol),80℃油浴中搅拌反应6小时;反应结束后,加30ml水稀释,用乙酸乙酯萃取三次,每次30ml,合并有机层,
有机相用饱和食盐水洗涤,然后用无水硫酸钠干燥,过滤,浓缩,柱层析(石油醚:乙酸乙酯=4:1),收集rf值0.2的洗脱液,减压蒸馏,干燥得到目标化合物(
ⅰ‑
1),白色固体108.5mg,收率为88%。熔点165-166℃,纯度98.11%(hplc检测)
[0128]
实施例120-126
[0129]
探究碱性物质对反应的影响,向反应中加入1.5mmol碱性物质:koh、ko
t
bu、k2co3、na2co3、nahco3、k3po4、dbu而不是1.5mmol的cs2co3,其他操作同实施例119,反应结果如表3-1所示:
[0130]
表3-1不同的碱对反应产率的影响
[0131]
实施例碱的种类产量[mg]产率[%]120koh(1.5mmol,84.2mg)54.144121ko
t
bu(1.5mmol,168.3mg)62.144122k2co3(1.5mmol,207.3mg)111.891123na2co3(1.5mmol,159.0mg)109.989124nahco3(1mmol,126.0mg)77.263125k3po4(1mmol,318.4mg)77.763126dbu(1mmol,24.0mg)228.474
[0132]
结果表明当反应加入1.5mmol的k2co3时反应产率更高。
[0133]
实施例127-130
[0134]
探究k2co3的最佳用量,向反应中加入0.5mmol、0.75mmol、1mmol、2mmol的k2co3而不是1.5mmol的cs2co3,其他操作同实施例119,反应结果如表3-2所示:
[0135]
表3-2不同的k2co3用量对反应产率的影响
[0136]
实施例碱的用量产量[mg]产率[%]127k2co3(0.5mmol,69.1mg)91.975128k2co3(0.75mmol,103.7mg)111.891129k2co3(1mmol,138.2mg)112.892130k2co3(2mmol,276.4mg)111.391
[0137]
结果表明k2co3用量增加入至0.75mmol时再增加k2co3的用量,反应产率变化不明显,所以选择使用0.75mmol的k2co3。
[0138]
实施例131-133
[0139]
改变反应所使用的溶剂,反应使用dmf、dma、dmso为溶剂而不是nmp,使用0.75mmol的k2co3而不是1.5mmolcs2co3,其他操作同实施例119,反应结果如表3-3所示:
[0140]
表3-3反应溶剂对反应产率的影响
[0141]
实施例溶剂产量[mg]产率[%]131dmf(2ml)116.495132dma(2ml)81.867133dmso(2ml)100.982
[0142]
结果表明使用dmf作溶剂时反应产率最高,最终使用dmf作为反应溶剂。
[0143]
实施例134-136
[0144]
探究最佳反应温度,反应在25℃、60℃、100℃下反应而不是80℃,使用0.75mmol的k2co3而不是1.5mmolcs2co3,使用dmf为溶剂而不是nmp,其他操作同实施例119,反应结果如表3-4所示:
[0145]
表3-4反应温度对反应产率的影响
[0146]
实施例溶剂产量[mg]产率[%]13425℃26.52213560℃46.037136100℃108.088
[0147]
结果表明无论是升高温度还是降低温度,反应产率都不如80℃时产率高(对比实施例131),最终反应温度使用80℃。
[0148]
实施例137-138
[0149]
改变反应中羧酸和胺的物质的量之比,使用0.75mmol的k2co3而不是1.5mmolcs2co3,使用dmf为溶剂而不是nmp,其他操作同实施例119,反应结果如表3-5所示:
[0150]
表3-5羧酸和胺的物质的量之比对反应产率的影响
[0151]
实施例对氯苯乙酸:苯胺产量[mg]产率[%]1371.2:1(0.6mmol:0.5mmol;102.4mg:46.6mg)116.8951381:1.2(0.5mmol:0.6mmol;85.3mg:55.9mg)114.693
[0152]
结果表明改变对氯苯乙酸和苯胺的物质的量之比对反应产率基本无影响(对比实施例131),所以羧酸和胺的物质的量之比依旧使用1:1。
[0153]
经过以上一系列的条件筛选,最优条件为实施例131时使用的条件,具体操作如下:
[0154]
在装有磁搅拌的干燥反应管中,加入0.0853g(0.5mmol)的对氯苯乙酸、46μl(0.5mmol)的苯胺和0.1037g(0.75mmol)的碳酸钾,最后加入2ml的n,n-二甲基甲酰胺。将反应管装配上连接有二氟一氯甲烷气球的三通管(二氟一氯甲烷约为40mmol),80℃油浴中搅拌反应6小时;反应结束后,加30ml水稀释,用乙酸乙酯萃取三次,每次30ml,合并有机层,有机相用饱和食盐水洗涤,然后用无水硫酸钠干燥,过滤,浓缩,柱层析(石油醚:乙酸乙酯=4:1),收集rf值0.2的洗脱液,减压蒸馏,干燥得到目标化合物(
ⅰ‑
1),白色固体116.4mg,收率为95%。
[0155]
实施例139-157
[0156]
改变反应胺的种类,将苯胺改为对甲基苯胺、对氟苯胺、对氯苯胺、对溴苯胺、对碘苯胺、对甲氧基苯胺、对乙酰苯胺、邻甲基苯胺、邻氯苯胺、邻溴苯胺、间甲基苯胺、间氨基苯甲腈、间氨基茴香硫醚、间硝基苯胺、3-氨基苯甲醇、α-萘胺、吗啉、哌啶、3-氨基吡啶,其他同实施例119,反应结果如表3-6所示:
[0157]
表3-6不同胺对反应产率的影响
[0158]
[0159][0160]
结果表明,对于改变对位和间位取代基的苯胺类化合物,对反应产率的影响较小;对于邻位有较大位阻的苯胺,产率较低;将苯胺改变为α-萘胺或脂肪仲胺,反应依旧有较好的产率,将苯胺改变为3-氨基吡啶,反应产率则有较大的降低。
[0161]
实施例158-172
[0162]
改变反应羧酸的种类,将对氯苯乙酸改为苯乙酸、邻甲基苯乙酸、邻氯苯乙酸、对甲氧基苯乙酸、间氯苯乙酸、2-(6-甲氧基-2-萘基)丙酸、2-甲基-4-(2-甲基丙基)苯乙酸、苯甲酸、对氯苯甲酸、对甲苯甲酸、肉桂酸、十六烷基酸、1-叔丁氧羰基-4-哌啶甲酸或6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-乙酸,其他同实施例119,反应结果如表3-7所示:
[0163]
表3-7不同羧酸对反应产率的影响
[0164][0165][0166]
结果表明,使用不同取代基的苯乙酸类化合物和脂肪羧酸,反应产率都较高;而将对氯苯乙酸改变为苯甲酸类的芳香羧酸,反应产率相对较低。
[0167]
实施例172
[0168]
同时改变羧酸和胺的种类,其他操作同实施例119,区别在于对氯苯乙酸换成6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-乙酸(140.2mg,0.5mmol),使用33%的二甲胺水溶液(1366.2mg,10mmol)而不是苯胺,反应15小时而不是6小时,得到目标化合物(
ⅰ‑
28),白色固体85.5mg,收率为56%。
[0169]
所有产物的熔点和核磁数据如下:
[0170][0171]
mp:165-166℃.1h nmr(400mhz,cdcl3)δ7.43(d,j=7.8hz,2h),7.36(d,j=8.3hz,2h),7.31-7.27(m,4h),7.12-7.08(m,2h),3.69(s,2h).
[0172][0173]
mp:191-192℃.1h nmr(400mhz,cdcl3)δ7.36(d,j=8.4hz,2h),7.31-7.28(m,4h),7.09(d,j=8.3hz,2h),7.04(br,1h),3.68(s,2h),2.29(s,3h).
[0174][0175]
mp:157-158℃.1h nmr(400mhz,cdcl3)δ7.40-7.35(m,4h),7.26(d,j=7.9hz,2h),7.16(br,1h),6.98(t,j=8.5hz,2h),3.68(s,2h);
13
c nmr(101mhz,cdcl3)δ168.55,159.53(j=244.96hz),133.71,133.41(j=2.5hz),132.70,130.82,129.34,121.81(j=8.0hz),115.66(j=22.6hz),43.84.
[0176][0177]
mp:187-188℃.1h nmr(400mhz,cdcl3)δ7.39-7.36(m,4h),7.28-7.23(m,4h),7.04(br,1h),3.70(s,2h).
[0178][0179]
mp:202-203℃.1h nmr(400 mhz,d
6-dmso)δ10.31(s,1h),7.58-7.55(m,2h),7.50-7.46(m,2h),7.40-7.33(m,4h),3.65(s,2h);
13
c nmr(101 mhz,d
6-dmso)δ169.74,139.33,135.59,132.39,132.21,131.90,129.09,121.94,115.71,43.27.
[0180][0181]
mp:212-213℃.1h nmr(400 mhz,d
6-dmso)δ10.30(s,1h),7.63(d,j=8.0 hz,2h),7.44-7.33(m,6h),3.64(s,2h);
13
c nmr(101 mhz,d
6-dmso)δ169.86,139.88,138.33,135.68,132.27,132.02,129.18,122.24,87.70,43.36.
[0182][0183]
mp:185-186℃.1h nmr(400 mhz,cdcl3)δ7.38-7.29(m,6h),6.97(s,1h),6.83(d,j=8.5hz,2h),3.78(s,3h),3.69(s,2h).
[0184][0185]
mp:145-146℃.1h nmr(400 mhz,cdcl3)δ7.90(d,j=8.2 hz,2h),7.66(s,1h),7.57(d,j=8.3 hz,2h),7.35(d,j=7.8 hz,2h),7.26(d,j=6.4 hz,2h),3.72(s,2h),2.57(s,3h);
13
cnmr(101 mhz,cdcl3)δ197.13,168.91,141.96,133.75,133.04,132.40,130.78,129.70,129.32,118.99,44.01,26.49.
[0186][0187]
mp:184-185℃.1h nmr(400 mhz,d
6-dmso)δ9.52(s,1h),7.41-7.35(m,5h),7.19(d,j=7.3 hz,1h),7.14(t,j=6.6 hz,1h),7.07(t,j=7.4 hz,1h),3.68(s,2h),2.16(s,3h);
13
c nmr(101 mhz,d
6-dmso)δ169.57,137.06,136.17,132.67,132.10,131.83,131.15,129.10,126.79,126.15,125.98,42.79,18.66.
[0188][0189]
mp:170-171℃.1h nmr(400 mhz,cdcl3)δ8.34(d,j=8.1 hz,1h),7.62(br,1h),7.38(d,j=8.1 hz,2h),7.31-7.29(m,3h),7.25(td,j=7.4,1.2 hz,1h),7.02(td,j=7.9,1.3 hz,1h),3.76(s,2h);
13
c nmr(101 mhz,cdcl3)δ168.43,134.29,133.86,132.45,130.96,129.40,128.97,127.74,124.87,122.82,121.39,44.35.
[0190][0191]
mp:173-174℃.1h nmr(400 mhz,cdcl3)δ8.33(d,j=7.6 hz,1h),7.60(br,1h),7.47(dd,j=8.0,1.4 hz,1h),7.41-7.38(m,2h),7.32-7.27(m,3h),6.95(td,j=7.9,1.5,1h),3.76(s,2h);
13
c nmr(101 mhz,cdcl3)δ168.49,135.38,133.89,132.39,132.21,131.09,129.44,128.39,125.38,121.59,113.33,44.40.
[0192][0193]
mp:128-129℃.1h nmr(400 mhz,cdcl3)δ7.33(d,j=8.1 hz,2h),7.27-7.13(m,6h),6.91(d,j=7.3 hz,1h),3.64(s,2h),2.29(s,3h).
13
c nmr(101 mhz,cdcl3)δ168.57,138.93,137.45,133.53,132.99,130.77,129.21,128.79,125.43,120.61,117.04,43.97,21.40.
[0194][0195]
mp:146-147℃.1h nmr(400 mhz,cdcl3)δ7.88(s,1h),7.65-7.64(m,1h),7.43-7.36(m,5h),7.27(d,j=5.3 hz,2h),3.72(s,2h);
13
c nmr(101 mhz,cdcl3)δ168.90,138.37,133.89,132.22,130.78,129.90,129.42,127.98,123.93,122.91,118.39,112.93,43.86.
[0196][0197]
mp:136-137℃.1h nmr(400 mhz,cdcl3)δ7.48-7.41(m,1h),7.36(d,j=8.3 hz,2h),7.26(d,j=8.3 hz,2h),7.21-7.12(m,3h),6.98(d,j=7.6 hz,1h),3.68(s,2h),2.45(s,3h);
13
c nmr(101 mhz,cdcl3)δ168.51,139.73,138.03,133.70,132.72,130.80,129.32,129.23,122.61,117.58,116.39,44.05,15.68.
[0198][0199]
mp:187-188℃.1h nmr(400 mhz,d
6-dmso)δ10.68(s,1h),8.62(t,j=2.1 hz,1h),7.91(dd,j=8.2,2.2 hz,2h),7.61(t,j=8.2 hz,1h),7.41-7.35(m,4h),3.71(s,2h);
13
c nmr(101 mhz,d
6-dmso)δ170.39,148.84,141.07,135.28,132.33,131.99,131.09,129.14,125.94,118.68,114.11,43.27.
[0200][0201]
mp:168-169℃.1h nmr(400 mhz,d
6-dmso)δ10.15(s,1h),7.56(s,1h),7.47(d,j=8.1hz,1h),7.40-7.34(m,4h),7.23(t,j=7.8 hz,1h),6.98(d,j=7.5 hz,1h),5.09(br,1h),4.46(s,2h),3.64(s,2h);
13
c nmr(101 mhz,d
6-dmso)δ168.68,143.26,139.02,135.08,131.29,131.02,128.41,128.25,121.30,117.45,117.17,62.81,42.51.
[0202][0203]
mp:189-190℃.1h nmr(400 mhz,d
6-dmso)δ10.17(s,1h),8.12-8.06(m,1h),7.94(d,j=8.0 hz,1h),7.76(d,j=8.1 hz,1h),7.69-7.67(m,1h),7.58-7.41(m,7h),3.85(s,2h);
13
cnmr(101 mhz,d
6-dmso)δ169.40,135.20,133.65,133.35,131.24,131.00,128.21,128.10,127.66,125.96,125.79,125.47,125.27,122.50,121.61,41.97.
[0204][0205]
mp:107-108℃.1h nmr(400 mhz,cdcl3)δ7.30(d,j=8.4 hz,2h),7.18(d,j=8.4 hz,2h),3.69(s,2h),3.65(s,4h),3.54-3.42(m,4h).
[0206][0207]
mp:89-90℃.1h nmr(400 mhz,cdcl3)δ7.29-7.17(m,4h),3.68(s,2h),3.64-3.28(m,4h),1.59-1.39(m,6h);
13
c nmr(101 mhz,cdcl3)δ168.73,133.95,132.52,130.08,128.73,47.20,42.95,40.25,26.28,25.47,24.40.
[0208][0209]
mp:174-175℃.1h nmr(400 mhz,d
6-dmso)δ12.36(s,1h),7.47(d,j=3.6 hz,1h),7.41-7.34(m,4h),7.21(d,j=3.5 hz,1h),3.78(s,2h).
[0210][0211]
mp:117-118℃.1h nmr(400 mhz,cdcl3)δ8.50(d,j=2.5 hz,1h),8.31(d,j=4.7 hz,1h),8.11(d,j=8.4 hz,2h),7.33(d,j=8.4 hz,2h),7.25-7.23(m,2h),3.69(s,2h);
13
c nmr(101 mhz,cdcl3)δ169.26,145.31,141.09,134.77,133.71,132.51,130.72,129.27,127.47,123.78,43.69.
[0212][0213]
mp:118-119℃.1h nmr(400 mhz,cdcl3)δ7.41(d,j=8.1 hz,2h),7.38-7.24(m,8h),7.07(t,j=7.4 hz,1h),3.71(s,2h).
[0214][0215]
mp:131-132℃.1h nmr(400 mhz,cdcl3)δ7.38(d,j=7.6 hz,2h),7.29-7.25(m,6h),7.07(t,j=7.4 hz,1h),7.04(br,1h),3.74(s,2h),2.34(s,3h).
[0216][0217]
mp:141-142℃.1h nmr(400 mhz,d
6-dmso)δ10.20(s,1h),7.60-7.58(m,2h),7.46-7.41(m,2h),7.33-7.28(m,4h),7.04(t,j=7.4 hz,1h),3.83(s,2h).
[0218][0219]
mp:118-119℃.1h nmr(400 mhz,cdcl3)δ7.41(d,j=8.0 hz,2h),7.29-7.23(m,5h),7.07(t,j=7.4 hz,1h),6.92(d,j=8.5 hz,2h),3.82(s,3h),3.66(s,2h).
[0220][0221]
mp:129-130℃.1h nmr(400 mhz,cdcl3)δ7.51-7.40(m,3h),7.32-7.25(m,5h),7.20(br,1h),7.09(t,j=7.4 hz,1h),3.65(s,2h).
13
c nmr(101 mhz,cdcl3)δ168.38,137.52,136.41,134.85,130.28,129.56,128.99,127.77,127.57,124.67,120.06,44.21.
[0222][0223]
mp:171-172℃.1h nmr(400mhz,cdcl3)δ8.19(s,旋转异构,0.5h),8.06(s,旋转异构,0.5h),7.78(s,1h),7.60-7.58(m,2h),7.47
ꢀ‑
7.42(m,3h),7.28-7.19(m,4h),7.08(t,j=7.4hz,1h),7.04-7.01(m,1h),8.19(s,旋转异构,1.2h),8.19(s,旋转异构,0.8h),2.36(s,3h),2.31(s,3h);
13
c nmr(101mhz,cdcl3)δ166.96,144.71,144.31,137.98,137.51,130.83,129.57,128.96,128.21,128.05,124.72,122.78,121.05,120.26,116.63,112.66,33.53,21.25,18.38.
[0224][0225]
mp:188-189℃.1h nmr(400mhz,cdcl3)δ7.99(s,1h),7.55-7.52(m,3h),7.26(d,j=7.9hz,2h),7.04(d,j=9.2hz,1h),4.07(s,2h),2.94(s,3h),2.88(s,3h),2.39(s,3h),2.34(s,3h).
[0226][0227]
mp:144-145℃.1h nmr(400mhz,cdcl3)δ7.74(t,j=9.3hz,3h),7.43(dd,j=8.4,1.7hz,1h),7.39(d,j=7.9hz,2h),7.27-7.23(m,2h),7.18(dd,j=8.9,2.5hz,1h),7.14(d,j=2.4hz,1h),7.05(t,j=7.4hz,2h),3.93(s,3h),3.85(q,j=7.1hz,1h),1.67(d,j=
7.1hz,3h).
[0228][0229]
mp:143-145℃.1h nmr(400mhz,cdcl3)δ7.41(d,j=8.0hz,2h),7.27-7.23(m,4h),7.14(d,j=8.0hz,2h),7.05(t,j=7.4hz,1h),3.69(q,j=7.1hz,1h),2.47(d,j=7.2hz,2h),1.93-1.79(m,1h),1.58(d,j=7.2hz,3h),0.91(d,j=6.6hz,6h).
[0230][0231]
mp:164-165℃.1h nmr(400mhz,cdcl3)δ7.87(d,j=7.2hz,2h),7.84(br,1h),7.64(d,j=7.7hz,2h),7.55(t,j=7.3hz,1h),7.48(t,j=7.3hz,2h),7.37(t,j=7.9hz,2h),7.15(t,j=7.4hz,1h).
[0232][0233]
mp:200-201℃.1h nmr(400mhz,cdcl3)δ7.82(d,j=8.6hz,2h),7.75(br,1h),7.62(d,j=7.6hz,2h),7.47(d,j=8.6hz,2h),7.41-7.36(m,2h),7.17(t,j=7.4hz,1h).
[0234][0235]
mp:145-146℃.1h nmr(400mhz,cdcl3)δ7.84-7.76(m,3h),7.64(d,j=7.7hz,2h),7.37(t,j=7.9hz,2h),7.29(d,j=8.0hz,2h),7.14(t,j=7.4hz,1h),2.43(s,3h).
[0236][0237]
mp:150-151℃.1h nmr(400mhz,cdcl3)δ7.76(d,j=15.5hz,1h),7.71-7.46(m,4h),7.37-7.33(m,5h),7.13(t,j=7.3hz,1h),6.57(d,j=15.5hz,1h).
[0238][0239]
mp:87-88℃.1h nmr(400mhz,cdcl3)δ7.51(d,j=7.9hz,2h),7.31(t,j=7.9hz,2h),7.18(br,1h),7.09(t,j=7.4hz,1h),2.35(t,j=7.6hz,2h),1.76-1.69(m,2h),1.45-1.25(m,24h),0.88(t,j=6.8hz,3h).
[0240][0241]
mp:158-159℃.1h nmr(400mhz,cdcl3)δ7.51(d,j=7.9hz,2h),7.31(t,j=7.5hz,2h),7.10(t,j=7.2hz,1h),4.25-4.11(m,2h),2.80-2.75(m,2h),2.42-2.34(m,1h),1.90-1.69(m,4h),1.47(s,9h)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1