一种钩虫Kunitz多肽及其抗凝血应用
一种钩虫kunitz多肽及其抗凝血应用
技术领域
1.本发明属于医药生物技术领域,具体的,涉及一种钩虫kunitz多肽及其抗凝血应用。
背景技术:
2.血栓栓塞性疾病是指在血液循环系统中,产生过度的血液凝块,超出了生理上健康的止血反应的需要,导致产生血栓堵塞,扰乱流向下游组织的血液流动,而导致机体产生病理性症状[1]。根据形成血栓的血管类型,可以把血栓栓塞性疾病划分为动脉血栓栓塞性疾病(arterial thromboembolic disease,atd),静脉血栓栓塞性疾病(venous thromboembolism,vte)以及血栓性微血管病(thrombotic microangiopath,tma)[2]。对于血栓栓塞性的治疗有手术治疗和药物治疗这两大手段,由于药物治疗具有途径便利和采血检测药物活性需求低的优势,因此药物治疗血栓栓塞性疾病是最基础最广泛的治疗手段[3]。
[0003]
抗凝药物是通过抑制凝血因子来预防和减少血栓的形成,由于使用便利和效果明显,自问世以来在预防和治疗vte过程中得到广泛的使用。随着对抗凝药物研究的不断深入,抗凝药物的种类也越来越多。传统抗凝药物,为多靶点抗凝药物,对凝血途径的多个因子都有影响,代表性药物是肝素和华法林。肝素是最早应用于临床的传统抗凝药物,开启了药物抗凝治疗的历史新篇章,也大大改变了人们对于血栓性疾病的治疗理念。华法林是首个可以口服的传统的抗凝药物,而新型口服抗凝药物(new oral anticoagulants,noacs)研发,主要包括凝血酶抑制剂和凝血因子xa抑制剂。与传统抗凝药物相比,noacs具有起效快、代谢相对快、药物相互作用少、无需密切临床实验室监测的优点[4-8]。目前可用的noacs包括直接凝血酶(fiia)抑制剂达比加群酯(dabigatran),以及xa因子直接抑制剂阿哌沙班(apixaban)、埃多沙班(edoxaban)和利伐沙班(rivaroxaban)。达比加群酯(dabigatran)是第一个应用于临床的noacs,通过竞争性结合凝血酶活性位点发挥作用。因此,达比加群酯(dabigatran)可防止凝血酶将纤维蛋白原转化为其活性形式纤维蛋白,从而抑制血栓的发展。由于凝血稳态系统的复杂性和生理病理情况的多样性,这些抗凝药物依然存在不同程度的出血风险,因此,新型抗凝先导分子的发现,依然具有重要的意义。
[0004]
钩虫是一种常见的吸血性的人体寄生虫,主要寄生于宿主小肠及十二指肠等部位,以其口囊咬附于肠黏膜上吸血为生[9],寄生人体中的钩虫主要有美洲钩虫和十二指肠钩虫。钩虫在长期进化过程中,为了适应摄食和自身生存,而进化出有效的抗血液凝固机制,钩虫的分泌物中有抗血液凝固的物质,使宿主被咬伤的肠黏膜不易凝血,有利于钩虫吸取宿主的血液[10],这一特性暗示钩虫分泌的抗凝多肽为很有前景的抗凝多肽药物。
[0005]
迄今为止已发现的钩虫抗凝多肽有20种,来源于犬钩虫、十二指肠钩虫、锡兰钩虫。其中犬钩虫来源的抗凝多肽有14种:acap、acapc2、napc2、acapc3、acapc4、acap5
[11]
、nap5、acap6、nap6、acanap7、acanap8、acanap10、acanap11、ac-ap-12
[12]
;十二指肠来源的抗凝多肽有3种:adunap1
[13]
、adunap4、adunap7
[14]
;锡兰钩虫来源的抗凝多肽有4种:aceap、
e:comparative effectiveness of warfarin,dabigatran,rivaroxaban and apixaban in non-valvular atrial fibrillation:a nationwide pharmacoepidemiological study.plos one 2019,14(8):e0221500.
[0016]
9.shalash ao,hussein wm,skwarczynski m,toth i:hookworm infection:toward development of safe and effective peptide vaccines.j allergy clin immunol 2021,148(6):1394-1419e1396.
[0017]
10.abuzeid ami,zhou x,huang y,li g:twenty-five-year research progress in hookworm excretory/secretory products.parasit vectors 2020,13(1):136.
[0018]
11.zhu y,lin y,liu x,hu w,wang y:identification of acap5 as a novel factor xa inhibitor with both direct and allosteric inhibition.biochem biophys res commun 2017,483(1):495-501.
[0019]
12.jiang d,zhan b,mayor rs,gillespie p,keegan b,bottazzi me,hotez p:ac-ap-12,a novel factor xa anticoagulant peptide from the esophageal glands of adult ancylostoma caninum.mol biochem parasitol 2011,177(1):42-48.
[0020]
13.陈耀哲,邓莉,邵正,何庆丰,司徒永立,周叶,彭礼飞:十二指肠钩虫抗凝肽adunap1的原核表达及其抗凝活性研究.中国病原生物学杂志2016,11(07):611-614+619.
[0021]
14.彭礼飞,邓莉,杨陈,胡晶晶,甘伟琼,吴亚敏,付汉维:十二指肠钩虫抗凝蛋白adunap7的原核表达、纯化及抗凝活性鉴定.中国人兽共患病学报2007(10):1021-1025.
[0022]
15.huang y,abuzeid ami,liu y,he l,zhao q,yan x,hang j,ran r,sun y,li x et al:identification and localization of hookworm platelet inhibitor in ancylostoma ceylanicum.infect genet evol 2020,77:104102.
[0023]
16.zhu w,gao h,luo x,ye x,ding l,hao j,shu z,li s,li j,chen z:cloning and identification of a new multifunctional ascaris-type peptide from the hemolymph of buthus martensii karsch.toxicon 2020,184:167-174.
技术实现要素:
[0024]
本发明首先涉及一组kunitz型抗凝多肽namp48,其特征在于,所述的namp48多肽的氨基酸序列如seq id no.1所示。
[0025]
本发明还涉及编码所述抗凝多肽namp48的核苷酸片段,优选的,所述的核苷酸片段的序列如seq idno.2所示。
[0026]
本发明还涉及包含所述抗凝多肽namp48或编码所述抗凝多肽namp48的核苷酸片段的药物或药物组合物,所述的药物或药物组合物含有治疗有效量的所述多肽或编码所述多肽的核苷酸片段,以及必要的药用辅料。
[0027]
本发明还涉及所述抗凝多肽namp48或编码所述抗凝多肽namp48的核苷酸片段的如下应用:
[0028]
(1)制备抗fxia的制剂;
[0029]
(2)制备抗凝血药物。
[0030]
本发明的有益效果在于:
[0031]
(1)从美洲钩虫中发现了一个新的高活性抗凝多肽namp48,其对aptt、pt和tt三种
凝血激活途径都具有抑制活性;
[0032]
(2)机理学研究结果显示,抗凝多肽namp48抑制fxia的活性非常特异;
[0033]
(3)安全性实验显示,所述的抗凝多肽namp48具有很好的安全性。
[0034]
上述结果表明,所述的抗凝多肽namp48有成为专一性更高的抗凝血制剂的开发潜力。
附图说明
[0035]
图1、七个寄生钩虫kunitz多肽序列。其中,
[0036]
namp2来源于ncbi:xp_013308967.1;
[0037]
namp3来源于ncbi:xp_013308916.1;
[0038]
namp15来源于xp_013305030.1;
[0039]
namp21来源于ncbi:xp_013302552.1;
[0040]
namp31来源于ncbi:xp_013302471.1;
[0041]
namp34来源于ncbi:xp_013298401.1;
[0042]
namp48来源于ncbi:xp_013295982.1。
[0043]
图2、四个寄生钩虫kunitz多肽的rp-hplc出峰图,波长为230nm。2a:namp2、2b:namp31、2c:namp34、2d:namp48。
[0044]
图3、四个寄生钩虫kunitz多肽的aptt功能筛选,3a图表示在终浓度为20μg/ml时,野生型多肽namp2与namp31对aptt延长时间倍数的差异;3b图表示在终浓度为5μg/ml时,野生型多肽namp34与namp48对aptt延长时间倍数的差异。
[0045]
图4、多肽namp34和namp48对三个凝血途径的影响,4a、4b、4c为多肽namp34延长aptt、pt和tt的时间倍数图;4d、4e和4f为多肽namp48延长aptt、pt和tt的时间倍数图。
[0046]
图5、抗凝多肽namp48的红细胞毒性。
[0047]
图6、抗凝多肽namp48的血栓弹力图,图中,a、b、c曲线分别是多肽namp48浓度为0μg/ml、5μg/ml(519.11nm)、10μg/ml(1.04μm)的血栓弹力图。
[0048]
图7、抗凝多肽namp48的血栓弹力图参数,图中为3个不同浓度namp48的血栓弹力图的四个参数比较,x轴为血栓弹力图的四个参数r、k、angle deg、ma,y轴为加肽组参数与生理盐水组参数比值。
[0049]
图8、抗凝多肽namp48的6个凝血因子抑制活性评价,8a、8b、8c、8d、8e、8f分别表示设置的浓度梯度的多肽namp48与kallikrein、fxiia、fxia、fxa、fiia和kallikrein这6个不同凝血因子孵育后,这6个凝血因子残留酶活性的变化曲线。图中,x轴为多肽namp48的浓度梯度(0、78.125nm、156.25nm、312.5nm、625nm、1250nm、2500nm),凝血因子fxia多肽设置的浓度梯度为0、10nm、20nm、40nm、80nm、160nm、320nm;y轴为不同凝血因子的残留酶活。
[0050]
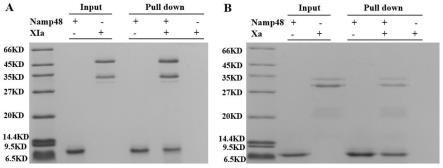
图9、抗凝多肽namp48与fxia和fxa的his pull down凝胶电泳,9a为namp48与fxia的相互作用,将namp48和fxia先后与ni beads孵育,混合物经加热变性后离心,将上清加载到15%的sds-page凝胶电泳;9b为namp48与fxa的相互作用,将namp48和fxa先后与ni beads孵育,将上清加载到15%的sds-page凝胶中电泳。
具体实施方式
[0051]
namp48,序列如seq id no.1:
[0052]
dqnlfclmppdpgfcrailrrwawnpveercerfeyggcggnrnnfktqkeclyecwnkfv
[0053]
优化后的编码核酸,序列如seq id no.2:
[0054]
gatcagaacctgttttgcctgatgccgccggatccgggcttttgccgcgcgattctgcgccgctgggcgtggaacccggtggaagaacgctgcgaacgctttgaatatggcggctgcggcggcaaccgcaacaactttaaaacccagaaagaatgcctgtatgaatgctggaacaaatttgtgtga
[0055]
namp2,序列如seq id no.3:
[0056]
qgydrsgdicnmkedegpckslqtrwrwdfnegncvkfnyggcggnknnfeteekclerctf
[0057]
优化后的编码核酸,序列如seq id no.4:
[0058]
cagggctatgatcgcagcggcgatatttgcaacatgaaagaagatgaaggcccgtgcaaaagcctgcagacccgctggcgctgggattttaacgaaggcaactgcgtgaaatttaactatggcggctgcggcggcaacaaaaacaactttgaaaccgaagaaaaatgcctggaacgctgcaccttttga
[0059]
namp31,序列如seq id no.5:
[0060]
wpkrvreecpetewydfcfngceptcynpepkcsklcgwggctcrggyvredegecildsecr
[0061]
优化后的编码核酸,序列如seq id no.6:
[0062]
tggccgaaacgcgtgcgcgaagaatgcccggaaaccgaatggtatgatttttgctttaacggctgcgaaccgacctgctataacccggaaccgaaatgcagcaaactgtgcggctggggcggctgcacctgccgcggcggctatgtgcgcgaagatgaaggcgaatgcattctggatagcgaatgccgctga
[0063]
namp34,序列如seq id no.7:
[0064]
nidsrclqpvngpvcralvkrwsydpttnkcktfmyggcggtennflseeeciktcvrrsh
[0065]
优化后的编码核酸,序列如seq id no.8:
[0066]
aacattgatagccgctgcctgcagccggtgaacggcccggtgtgccgcgcgctggtgaaacgctggagctatgatccgaccaccaacaaatgcaaaacctttatgtatggcggctgcggcggcaccgaaaacaactttctgagcgaagaagaatgcattaaaacctgcgtgcgccgcagccattga
[0067]
实施例1、生物信息学分析获得寄生钩虫kunitz家族序列
[0068]
从ncbi网站搜索美洲钩虫kunitz序列,去掉重复的氨基酸序列,获得美洲钩虫kunitz序列信息资源库。分析蛋白的信号肽,得到成熟肽的氨基酸序列,并对氨基酸序列进行分析比对。将美洲钩虫kunitz序列,与文献已报道的同时具有抗凝功能和kunitz结构模体的多肽,进行本地blast比对,根据同源性,获得候选美洲钩虫kunitz序列,并编号命名。
[0069]
找出7个后续kunitz多肽序列,分别命名为namp2、namp3、namp15、namp21、namp31、namp34和namp48。这些kunitz多肽都含有6个保守的cys,其巯基脱氢形成三对二硫键(-s-s-),配对方式为cysⅰ-cysⅵ、cysⅱ-cysⅳ和cysⅲ-cys
ⅴ
,为kunitz型蛋白的经典结构特征(图1)。
[0070]
实施例2、钩虫kunitz家族多肽及其类似物的表达、纯化
[0071]
以pet-28a为载体,构建重组人体寄生钩虫kunitz家族多肽及其类似物的质粒,将质粒转化入感bl21受态细胞于-20℃冰箱保存。
[0072]
将100μl namp系列的蛋白表达菌液,接入0.003% kana的luria-bertani液体培养基中,置于气浴恒温振荡器中,于37℃、150rpm条件下培养11-12小时。
[0073]
用量筒取50ml过夜活化的表达菌液,接入1000ml含0.003%kana的luria-bertani液体培养基中,于37℃、210rpm条件下培养2小时左右,当菌液的od值为0.4左右时,加入iptg进行诱导,再37℃、210rpm条件下继续培养4小时。
[0074]
诱导结束后,于4℃、6000rpm条件下进行收菌,收菌时间大概为6~8min。向收集的菌体中加入25ml的冰pbs,使菌体重悬。再使用超声破壁机进行超声破壁,破壁的条件为:80w,工作3秒,间歇8秒,共22min。经过超声破壁后的菌体于4℃、12000rpm的条件下离心20min,弃上清收集底下的沉淀,此沉淀即为包涵体。
[0075]
在收集的包涵体中加入10ml的冰pbst,并充分混匀,再冰浴10~30min,于4℃、5000g条件下离心15min,弃去上清。再重复此步骤一次,得到纯度较高的包涵体蛋白。
[0076]
包涵体蛋白复性:在5ml变性液中加入0.15g的gsh,并搅拌均匀,放于25℃变性2小时。包涵体蛋白的复性:将变性完成的包涵体于20℃、12000rpm条件下离心20min,弃沉淀取上清。在500ml冰复性液中加入0.06gssg,将离心后的上清逐滴加入500ml的复性液中,边滴加边搅拌。滴加完成后将复性液于16℃复性16小时。
[0077]
将复性后的蛋白液于4℃、12000rpm条件下离心20分钟,弃沉淀。
[0078]
使用3kd的超滤管将复性液上清于4℃、4000rpm条件下离心40分钟,直至蛋白浓缩液的体积<5ml。将蛋白浓缩液按1ml/管进行分装,每1ml蛋白浓缩液中加入10μl 10% tfa,于4℃、12000rpm条件下离心20min,将离心后的上清液移至新ep管中,做好标记后再次离心5min,用rp-hplc仪进行蛋白浓缩液的纯化。
[0079]
hplc仪器(安捷伦液相色谱仪1260)的流速为4ml/分钟,上样体积<5ml。hplc仪器使用的是c18反向柱(10
×
250mm,5μm,elite-hplc),其流动相为溶液b-0.1% tfa,溶液d-90%乙腈+0.1% tfa。洗脱梯度为60分钟的线性洗脱梯度,初始时b液为95%,d液为5%;结束时b液为5%,d液为95%;检测波长为230nm。纯化的蛋白液收集后,先标记清楚,再放于-80℃冰箱保存。
[0080]
将hplc纯化后的蛋白液放于-80℃冰箱预冻8小时以上,再使用真空冷冻冻干机把预冻好的蛋白液冻干成粉末,再往蛋白干粉中加灭菌好的冰ddh2o。加灭菌冰ddh2o原则是5万峰面积加1ml灭菌冰ddh2o,其中蛋白的峰面积由hplc收样程序自动计算得出。
[0081]
把重新溶解的蛋白液再分装至1.8ml的冻存管中,每管装500μl。把分装好的蛋白液用冷冻干燥机再次冻干为蛋白干粉,标注好蛋白的名称、分装时间等信息。对于分装剩余的蛋白液,进行sds-page凝胶电泳和bca定量的实验。
[0082]
七个寄生钩虫的kunitz多肽,namp2、namp31、namp34和namp48这四个成功制备,用rp-hplc对蛋白浓缩液纯化时,收集时间为10-30min明显的蛋白峰,收集的蛋白集份的hplc谱图如图2所示,其中namp31收集图2b所示谱图的两个集份(peak1、peak2)。namp3、namp15和namp21这三个未能获得。
[0083]
实施例3、多肽的抗凝血功能检测
[0084]
活化部分凝血活酶时间(aptt)是反映内源凝血途径特别是第一阶段的凝血因子综合活性的一项凝血功能检查指标,广泛用于测定内源途径凝血因子的缺陷,如因子
ⅺ
、
ⅷ
、
ⅸ
,同时也可用于出血疾病的初筛诊断以及肝素抗凝治疗的实验室监测。
[0085]
凝血酶原时间(prothrombin time,pt)是指在缺乏血小板的血浆中加入过量的组织凝血活酶和钙离子,凝血酶原转化为凝血酶,导致血浆凝固所需的时间,pt是反映血浆中
凝血因子活性的指标。凝血酶原时间测定是检查机体外源性凝血系统功能有无障碍的过筛试验,也是临床抗凝治疗的重要监测指标。
[0086]
凝血酶时间(thrombin time,tt),是指在血浆中加入标准化的凝血酶后血液凝固的时间。在共同凝血途径中,所生成的凝血酶使纤维蛋白原转变为纤维蛋白,可用凝血酶时时间(tt)来反映。
[0087]
1、多肽的aptt功能检测
[0088]
打开md pacific tsa 9000c全自动凝血仪,根据标本数量计算所需的清洗液、aptt试剂、cacl2溶液,其中aptt试剂50μl/次、cacl2溶液50μl/次,并把这些试剂放入规定区间。把配制好浓度的多肽取25μl和50μl健康人血浆进行混匀,再冰上孵育15min。在全自动血凝仪上输入样品信息,并设置进行aptt检测。15min冰浴后,把样品按照设置的位置一一对应放置。将仪器检测的数据导入graph pad prism,绘制多肽的浓度依赖曲线图。
[0089]
结果如图3所示,pbs为阴性对照,设定pbs的aptt时间倍数为1。
[0090]
(1)当多肽namp2和namp31终浓度为20μg/ml时,namp2延长的aptt时间倍数为1.73
±
0.03,namp31 peak1延长的aptt时间倍数为1.01
±
0.009,namp31 peak2延长的aptt时间倍数为1.85
±
0.03(图3a)。
[0091]
(2)由于在20μg/ml条件下,namp34和namp48的aptt时间20min不停止,因此将多肽浓度降为5μg/ml,进行namp34和namp48的aptt检测。当多肽终namp34和namp48终浓度为5μg/ml时,namp34延长的aptt时间倍数为12.12
±
0.57,namp48延长的aptt时间倍数为35.12
±
1.21(图3b)。
[0092]
经过aptt活性筛选后,从这四个kunitz多肽中选择两个具有较好aptt活性的多肽namp34和namp48进行aptt、pt和tt的浓度依赖试验。
[0093]
2、多肽的pt功能检测方法:
[0094]
打开md pacific tsa 9000c全自动凝血仪,根据标本数量计算所需的清洗液、pt试剂,其中pt试剂100μl/次,pt试剂并把这些试剂放入规定区间。配制好浓度的多肽取25μl和50μl健康人血浆进行混匀,再冰上孵育15min。在全自动血凝仪上输入样品信息,并设置进行pt检测。15min冰浴后,把样品按照设置的位置一一对应放置。将仪器检测的数据导入graph pad prism,绘制多肽的浓度依赖曲线图。
[0095]
3、多肽的tt功能检测方法:
[0096]
打开md pacific tsa 9000c全自动凝血仪,根据标本数量计算所需的清洗液、pt试剂,其中tt试剂100μl/次,并把这些试剂放入规定区间。配制好浓度的多肽取25μl和100μl健康人血浆进行混匀,再冰上孵育15min。在全自动血凝仪上输入样品信息,并设置进行tt检测。15min冰浴后,把样品按照设置的位置一一对应放置。将仪器检测的数据导入graph pad prism,绘制多肽的浓度依赖曲线图。
[0097]
多肽namp34设置为0、31.25nm、62.5nm、125nm、250nm、500nm、1000nm这七个浓度梯度,结果显示namp34呈浓度依赖性的显著延长aptt、pt和tt时间,在最高浓度1000nm时延长aptt、pt和tt时间倍数分别为20.2、8和2.7。
[0098]
多肽namp48设置0、15.625nm、31.25nm、62.5nm、125nm、250nm、500nm这七个浓度梯度,结果显示namp48呈浓度依赖性的显著延长aptt、pt和tt时间,在最高浓度500nm时延长aptt、pt和tt时间倍数分别为35.1、9.1和3.3(图4)。
[0099]
namp34和namp48这两个多肽相对比,它们对aptt、pt和tt这三个凝血途径都有抑制作用,但是namp48的抗凝效果更强,所以我们后续的研究集中于多肽namp48。
[0100]
实施例4、多肽namp48对人全血的作用
[0101]
为了研究多肽namp48对人的全血是否也具有抗凝效果,我们用血栓弹力图仪器对其全血抗凝效果进行评价。
[0102]
1、先进行红细胞溶血实验,来评价多肽namp48的毒性,实验步骤如下:
[0103]
用枸橼酸钠抗凝管抽取健康人新鲜全血,再吸出部分置于1.5ml ep管内,再往ep管中加入灭菌的0.9%生理盐水1ml,于1000g条件下离心10min,后弃上清。重复以上步骤,用灭菌生理盐水重复洗涤2~3次,直至上清呈无色透明。
[0104]
将洗涤后的红细胞用生理盐水配制成4%(v/v)的溶液,混匀后备用。将100μl的4%红细胞悬液和100μl不同浓度的多肽共同加入1.5mlep管中,于37℃条件下进行水浴1小时。
[0105]
将水浴后ep管于3000g条件下离心10min,并吸取100μl的上清加入96孔板孔内,加样完成后将96孔板置于酶标仪中,设置波长为540nm来进行检测,得到样本吸光值数据。阴性对照为100μl的生理盐水,阳性对照为100μl的2%triton x-100。
[0106]
溶血率(%)=100
×
(a样品-a阴性)/(a阳性-a阴性)。
[0107]
生理盐水设为阴性对照组且溶血率为0%,0.5%tritonx-100设为阳性对照组且溶血率为100%(图5)。
[0108]
多肽namp48设置了50μg/ml(5.19μm)和100μg/ml(10.38μm)这两个浓度,
[0109]
实验结果显示,多肽namp48再两个设定浓度下,溶血率均为0%,初步说明多肽namp48溶血的毒副作用较低。
[0110]
2、血栓弹力图检测
[0111]
研究抗凝多肽namp48对人全血血液凝固机制的作用。血栓弹力图仪实验参数包括凝血时间(r)、血凝块形成速率(k)、弧线切线与水平线夹角α(angel deg)和血凝强度(ma)。实验方法如下:
[0112]
打开西芬斯血栓弹力图仪(cfms lepu-8800),先进行水平测试,后选择进行检测的测试通道,在对应位置输入样品编号,测试类型设置为“ck-citrated kaolin”。
[0113]
按照要求加载普通杯于要检测的两个通道上,后向高岭土管中加入1ml的枸橼酸钠抗凝全血并混匀,多肽用生理盐水配置为检测浓度,后取50μl检测浓度的多肽溶液加入高岭土管并轻轻混匀,后置于冰上冰浴活化4分钟。
[0114]
在测试杯中先加入20μl的标准cacl2溶液,再加入340μl的活化后的全血。
[0115]
迅速将测试杯上托,测试杆划至测试位,点击电脑程序中的开始,进行测试。
[0116]
根据血栓弹力图的走向判断是否结束,结束后点击程序中的停止键,将测试杆打开,卸去测试杯。
[0117]
导出血栓弹力图和数据,按照程序关闭仪器。
[0118]
多肽终浓度占整个体积计算:(340/360)*(50/1050)
[0119]
将抗凝多肽namp48设为三个浓度:0、5μg/ml(519.11nm)、10μg/ml(1.04μm),每个浓度重复进行两次实验,检测不同浓度的namp48对人全血凝血时间的影响。
[0120]
血栓弹力图结果显示:
[0121]
与0μg/ml namp48组(生理盐水组)相比较,5μg/ml(519.11nm)namp48组和10μg/ml namp48(1.04μm)组显示出明显的抑制全血凝固的作用。
[0122]
凝血时间(r)和血凝块形成速率(k)呈浓度依赖性的增加,α角(angel deg)和血块强度(ma)呈浓度依赖的降低(图6)。
[0123]
5μg/ml(519.11nm)namp48组中:r值增加至3.8倍,k值增加至3.4倍,angel值降低至0.4倍,ma值降低至0.8倍;
[0124]
10μg/ml(1.04μm)namp48组中:r值增加至6.3倍,k值增加至5.9倍,angel值降低至0.2倍,ma值降低至0.8倍(图7)。
[0125]
上述结果可见,多肽namp48组的r值和k值呈明显的浓度依赖性增加,而α角度和ma值呈明显的浓度依赖性降低。r值增加表示开始凝血的时间增加,反映出凝血因子的功能减弱;k值增加和α角度降低表示血凝块形成的速率降低,反映出纤维蛋白的形成减少;ma值降低表示形成的血凝块强度降低,反映出参与凝血的血小板减少。这四个参数的变化,都一致的反映出,加入namp48组的样品,凝血功能被抑制了,且抑制的程度与namp48的浓度呈正相关。
[0126]
实施例5、抗凝多肽namp48的抗凝机制
[0127]
1、多肽对凝血因子的抑制活性检测
[0128]
kallikrein、fxiia、fxia、fxa、fiia和plasmin抑制活性检测
[0129]
取25μl工作浓度的酶和25μl不同浓度的多肽依次加入96孔板孔内,阴性对照为凝血因子buffer。
[0130]
另一排孔中加入80μl工作浓度的发光底物溶液。
[0131]
加样完成后将96孔板于37℃、90rpm条件下孵育15min,孵育完成后置于酶标仪上。
[0132]
用排枪向每个[e]-[i]混合物孔中加入50μl工作浓度的发光底物溶液,把酶标仪检测波长设置为405nm,检测时间设置为6min,每隔1分钟检测1次,共检测7次。
[0133]
将测得数据导入graph pad prism,绘制浓度依赖曲线,计算抑制率。
[0134]
结果显示,
[0135]
抗凝多肽namp48对fiia无明显的抑制作用,而对kallikrein、fxiia、fxia、fxa和plasmin具有显著的抑制作用,ic50分别为139.8
±
2.15nm、1661
±
3.22nm、9.95
±
0.99nm、151.1
±
2.18nm和17.21
±
1.24nm(图8)。namp48对plasmin、fxa、fxia、fxiia和kallikrein均有抑制作用,并且对凝血因子fxia的抑制效果最强,在多肽namp48浓度仅为160nm时,几乎可以完全抑制住fxia的活性。
[0136]
2、采用his pull down检测kunitz多肽namp48与fxia、fxa的结合
[0137]
pull down是一种类似于免疫共沉淀的技术,我们可以用这一技术检测多肽和酶是否存在特异性结合。检测原理是标记蛋白可以被ni beeds捕获,在规定的孵育和洗涤步骤之后,相互作用的多肽和酶被洗脱,并用sds-page凝胶电泳进行鉴定。而通过大肠杆菌异源表达技术制备的kunitz型抗凝多肽namp48含有his(组氨酸)融合标签,可以特异性的结合镍离子(ni
2+
)。于是用带his标签的namp48作为诱饵,捕捉可能与其结合的伙伴,经过孵育和洗脱后,再经过sds-page凝胶电泳进行鉴定。sds-page凝胶电泳结果显示:实验组中加namp48和凝血因子共孵育后,namp48和凝血因子共同被ni beeds拉住;而单独加凝血因子的,凝血因子没有被ni beeds拉住(图9)。这说明namp48与凝血因子fxia、fxa之间都存在特
异性结合。
[0138]
最后需要说明的是,以上实施例仅用于帮助本领域技术人员理解本发明的实质,不用于限定本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1