作为HPK1抑制剂的杂环类化合物及其应用的制作方法
本发明涉及一种新型的杂环类化合物或其药学可接受的盐,含有它们的药物组合物以及作为hpk1抑制剂在预防或治疗相关疾病中的用途。
背景技术:
1、癌症的一个主要特征是具有免疫逃避能力。肿瘤细胞通过多种复杂机制抑制机体免疫系统对其识别和攻击。为解除这种免疫抑制设计了多项肿瘤免疫治疗的策略,包括干扰负调控效应t细胞功能的机制,例如pd1/pdl1免疫检查点抑制剂,通过阻断pd1和pdl1相互作用,在高表达pdl1的癌症细胞中解除对t淋巴细胞的免疫抑制,针对pd1或pdl1抑制剂抗体开发,在多种癌症类型中临床获益亦已得到证实。另外,阻断cd80/cd86同t细胞共抑制受体(ctla-4)间相互作用的治疗性抗体,能够促进各级淋巴组织内t细胞扩增。除了这些细胞表面相关蛋白,研究发现细胞内信号也参与免疫负调控,其中造血细胞内特异表达的hpk1(造血祖细胞激酶1,又称map4k1)是一种丝氨酸/苏氨酸激酶,主要参与细胞内免疫负调控。
2、研究发现人和小鼠细胞内hpk1失活常常伴随自身免疫疾病的发生,表明hpk1调控机体免疫耐受。比如,银屑病关节炎患者的外周单个核细胞(pbmc)以及系统性红斑狼疮患者的t细胞均发现hpk1表达下调(j autoimmun 2011,37(3),180-9);小鼠模型实验发现hpk1缺失的小鼠更易发生自体免疫性脑膜炎(nat immunol 2007,8(1),84-91)。体外研究证实,以抗原刺激来源于hpk1缺失的t和b淋巴细胞,有更强的激活效果(cancerimmunol.immunother.2010,59(3),419-429),表明hpk1负调控t和b淋巴细胞功能。此外,hpk1缺失的树突状细胞(dc细胞)表现出更有效的抗原递呈和t细胞激活特性,表明hpk1同样参与dc细胞的免疫调控。
3、t细胞受体(tcr)和b细胞受体(bcr)活化后,胞质hpk1被募集到细胞膜附近被激活,活化的hpk1磷酸化衔接蛋白slp76或lat,以此激活slp76作为负调节蛋白14-3-3π的停靠位点,介导slp76泛素化降解,最终导致tcr信号复合物的不稳定,从而下调tcr信号(j.cell biol.2011,195(5),839-853)。研究还发现,hpk1可以被pge2(前列腺素e2)以pka依赖的方式激活,甚至也可能由肿瘤细胞表达的免疫抑制因子激活(blood 2003,101(9),3687-3689)。
4、同野生型相比,hpk1-/-小鼠对接种的同基因型肺癌肿瘤生长表现出较强的抑制生长作用。通过对t细胞移植小鼠模型的抗肿瘤免疫反应研究证实hpk-/-敲除的强抗肿瘤效应至少部分是t细胞依赖性的。而树突细胞在抗肿瘤活性上的贡献也通过来源于hpk1-/-缺陷的小鼠骨髓的dc细胞移植实验得以证实(j.immunol.2009,182(10),6187-61)。近来,研究发现同野生型hpk转基因小鼠相比,催化酶失活的hpk1转基因小鼠同样能有效抑制胶质母细胞瘤gl261生长,以及能够增强抗pd1治疗mc38肿瘤的药效。因此,hpk1是一个潜在的抗肿瘤治疗靶点,开发针对hpk1激酶的小分子抑制剂无论作为单药还是联合其它免疫调控治疗策略在抗肿瘤治疗上的效果值得期待。
技术实现思路
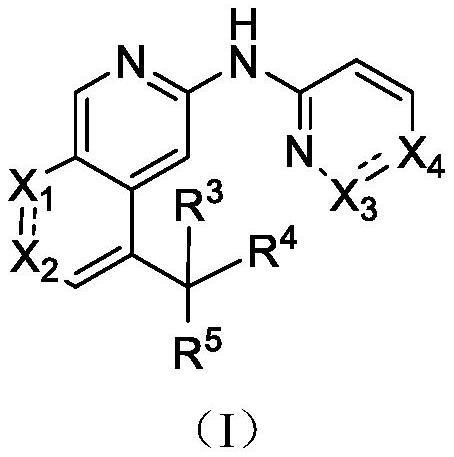
1、本发明提供一种式(i)所示化合物或其药学上可接受的盐:
2、
3、其中,
4、x1选自n或cr1,r1选自h、卤素、cn、sh、nh2、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、c3-c10环烷基氧基、4-7元杂环基、4-7元杂环基氧基或每一个r1a相同或不同,所述r1a独立地选自c1-c10烷基、c3-c10环烷基或4-7元杂环基,所述sh、nh2、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、c3-c10环烷基氧基、4-7元杂环基或4-7元杂环基氧基任选被r1b取代;
5、x2选自n或cr2,r2选自h、卤素、cn、sh、nh2、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、c3-c10环烷基氧基、4-7元杂环基或4-7元杂环基氧基,所述sh、nh2、c1-c10烷基、c1-c10烷氧基、c3-c10环烷基、c3-c10环烷基氧基、4-7元杂环基或4-7元杂环基氧基任选被r2b取代;
6、或者,x1、x2相连共同形成4-14元杂环基或5-6元杂芳基,所述4-14元杂环基或5-6元杂芳基任选被r2b取代;当x1、x2不成环时,x1、x2仅以双键相连,当x1、x2成环时,x1、x2以单键或双键相连;
7、r3、r4各自独立地选自h、卤素、cn、oh、nh2、c1-c6烷基、c3-c6环烷基或4-7元杂环基,所述oh、nh2、c1-c6烷基、c3-c6环烷基或4-7元杂环基任选被r3b取代;
8、r5选自oh或nh2,所述oh或nh2任选被r5b取代;且当r5选自任选被r5b取代的nh2时,x1、x2相连共同形成4-14元杂环基或5-6元杂芳基,所述4-14元杂环基或5-6元杂芳基任选被r2b取代,或者,x1选自cr1,r1选自sh或每一个r1a相同或不同,所述r1a独立地选自c1-c10烷基、c3-c10环烷基或4-7元杂环基,所述sh任选被r1b取代,x2选自n;
9、x3、x4选自以下情况中的任一种:
10、1)x3选自n或cr6,x4选自n或cr7,x3、x4以双键相连,r6、r7各自独立地选自h、卤素、cn、oh、nh2、c1-c6烷基、c3-c6环烷基或4-7元杂环基,所述oh、nh2、c1-c6烷基、c3-c6环烷基或4-7元杂环基任选被r6b取代;或者,
11、2)x3、x4二者之一选自c(=o),另一者选自nr8,x3、x4以单键相连,所述r8选自h、c1-c6烷基、c3-c6环烷基或4-7元杂环基,所述c1-c6烷基、c3-c6环烷基或4-7元杂环基任选被r8b取代;或者,
12、3)x3、x4相连共同形成4-14元杂环基或5-6元杂芳基,x3、x4以双键相连,所述4-14元杂环基或5-6元杂芳基任选被r9b取代;
13、每一个r1b或r3b独立地选自氘、f、cl、br、i、cn、=o、oh、nh2、c1-c6烷基、c3-c6环烷基、c2-c3烯基、c2-c3炔基或4-7元杂环基,所述oh、nh2、c1-c6烷基、c3-c6环烷基、c2-c3烯基、c2-c3炔基或4-7元杂环基任选被rc取代;
14、每一个r2b、r5b、r6b、r8b或r9b独立地选自f、cl、br、i、cn、=o、oh、nh2、c1-c6烷基、c3-c6环烷基或4-7元杂环基,所述oh、nh2、c1-c6烷基、c3-c6环烷基或4-7元杂环基任选被rc取代;
15、每一个rc独立地选自f、cl、br、i、cn、=o、oh、nh2、c1-c6烷基、c3-c6环烷基或4-7元杂环基;
16、条件是,式(i)所示化合物不包含
17、在一些实施方案中,r1选自sh、nh2、c1-c6烷基、c1-c6烷氧基、c3-c6环烷基、c3-c6环烷基氧基、4-7元杂环基、4-7元杂环基氧基或所述r1a独立地选自c1-c6烷基、c3-c6环烷基或4-7元杂环基,所述sh、nh2、c1-c6烷基、c1-c6烷氧基、c3-c6环烷基、c3-c6环烷基氧基、4-7元杂环基或4-7元杂环基氧基任选被r1b取代。
18、在一些实施方案中,x1选自n或cr1,r1选自sh、c1-c6烷基、c1-c6烷氧基、c3-c6环烷基或c3-c6环烷基氧基,所述sh、c1-c6烷基、c1-c6烷氧基、c3-c6环烷基或c3-c6环烷基氧基任选被r1b取代。
19、在一些实施方案中,x1选自n或cr1,r1选自sh、c1-c6烷氧基、c3-c6环烷基氧基或所述sh、c1-c6烷氧基或c3-c6环烷基氧基任选被r1b取代。
20、在一些实施方案中,x1选自n或cr1,r1选自sh、c1-c6烷氧基或c3-c6环烷基氧基,所述sh、c1-c6烷氧基或c3-c6环烷基氧基任选被r1b取代。
21、在一些实施方案中,x1选自n或cr1,r1选自sh、甲氧基、环丙基氧基或所述sh、甲氧基或环丙基氧基任选被r1b取代。
22、在一些实施方案中,x1选自n或cr1,r1选自sh、甲氧基或环丙基氧基,所述sh、甲氧基或环丙基氧基任选被r1b取代。
23、在一些实施方案中,r1a选自c1-c3烷基。在一些实施方案中,r1b选自氘、f、cl、br、i、cn、=o、c1-c6烷基、c2-c3烯基或c2-c3炔基。
24、在一些实施方案中,r1b选自氘或c1-c3烷基。
25、在一些实施方案中,x1选自cr1,r1选自sch3、och3、ocd3、环丙基氧基或在一些实施方案中,x1选自n或cr1,r1选自sch3、och3、ocd3或环丙基氧基。
26、在一些实施方案中,x2选自n。
27、在一些实施方案中,x1、x2相连共同形成5-10元杂环基或5-6元杂芳基,所述5-10元杂环基或5-6元杂芳基任选被r2b取代。
28、在一些实施方案中,x1、x2相连共同形成其中y选自ch2、nh、o或s,所述任选被r2b取代。
29、在一些实施方案中,x1、x2相连共同形成所述任选被r2b取代。
30、在一些实施方案中,x1、x2相连共同形成所述任选被r2b取代。
31、在一些实施方案中,x1、x2相连共同形成
32、在一些实施方案中,r3、r4各自独立地选自h、卤素、cn或c1-c3烷基,所述c1-c3烷基任选被r3b取代。
33、在一些实施方案中,r3、r4各自独立地选自h或任选被r3b取代c1-c3烷基。
34、在一些实施方案中,r3、r4各自独立地选自任选被r3b取代c1-c3烷基。
35、在一些实施方案中,r3、r4其中一个选自h或甲基,另一个选自甲基。在一些实施方案中,r3、r4均选自甲基。在一些实施方案中,r5选自任选被r5b取代的oh。
36、在一些实施方案中,r5选自oh或nh2,所述oh或nh2任选被r5b取代;且当r5选自任选被r5b取代的nh2时,x1、x2相连共同形成4-14元杂环基或5-6元杂芳基,所述4-14元杂环基或5-6元杂芳基任选被r2b取代。
37、在一些实施方案中,r5选自oh或nh2,所述oh或nh2任选被r5b取代;且当r5选自任选被r5b取代的nh2时,x1、x2相连共同形成所述任选被r2b取代,或者,x1选自cr1,r1选自sh或每一个r1a相同或不同,所述r1a独立地选自c1-c3烷基,所述sh被c1-c3烷基取代,x2选自n。
38、在一些实施方案中,当r5选自任选被r5b取代的nh2时,x1、x2相连共同形成5-10元杂环基或5-6元杂芳基,所述5-10元杂环基或5-6元杂芳基任选被r2b取代。
39、在一些实施方案中,r5选自oh或nh2,所述oh或nh2任选被r5b取代,x1、x2相连共同形成其中y选自ch2、nh、o或s,所述任选被r2b取代。
40、在一些实施方案中,r5选自oh或nh2,所述oh或nh2任选被r5b取代,x1、x2相连共同形成所述任选被r2b取代。
41、在一些实施方案中,每一个r2b、r5b各自独立地选自f、cl、br、i、cn、c1-c6烷基、c3-c6环烷基或4-7元杂环基。
42、在一些实施方案中,r5选自oh或nh2,x1、x2相连共同形成其中y选自ch2、nh、o或s。
43、在一些实施方案中,r5选自oh或nh2,x1、x2相连共同形成
44、在一些实施方案中,r5选自oh或nh2。在一些实施方案中,x3选自n或cr6,x4选自n,x3、x4以双键相连,r6选自c1-c6烷基或c3-c6环烷基,所述c1-c6烷基或c3-c6环烷基任选被r6b取代。
45、在一些实施方案中,x3选自cr6,x4选自n,x3、x4以双键相连,r6选自任选被卤素取代的c1-c3烷基。
46、在一些实施方案中,x3选自cr6,x4选自n,x3、x4以双键相连,r6选自任选被f取代的c1-c3烷基。
47、在一些实施方案中,x3选自cr6,x4选自n,x3、x4以双键相连,r6选自c(ch3)2f。
48、在一些实施方案中,x3、x4相连共同形成4-7元杂环基,x3、x4以双键相连,所述4-7元杂环基任选被r9b取代。
49、在一些实施方案中,x3、x4相连共同形成5-6元杂环基,x3、x4以双键相连,所述5-6元杂环基任选被r9b取代。
50、在一些实施方案中,r9b选自f、cl、br、i、cn、=o或c1-c3烷基。
51、在一些实施方案中,x3、x4相连共同形成在一些实施方案中,式(i)所示化合物或其药学上可接受的盐选自以下式(i-1)、式(i-2)、式(i-3)、式(i-4)或式(i-5)所示化合物或其药学可接受的盐:
52、
53、
54、其中,
55、n选自0、1、2、3、4或5;r5选自oh或nh2,所述oh或nh2任选被r5b取代;所述r2b、r5b如上文定义。
56、在一些实施方案中,式(i-1)、式(i-2)、式(i-3)、式(i-4)或式(i-5)所示化合物中的n选自0、1或2。
57、在一些实施方案中,式(i-1)、式(i-2)、式(i-3)、式(i-4)或式(i-5)所示化合物中的n选自0。
58、在一些实施方案中,式(i)所示化合物或其药学上可接受的盐选自以下式(i-6)所示化合物或其药学可接受的盐:
59、
60、所述x1、x2、x3、x4、r3、r4如上文定义。
61、在一些实施方案中,式(i)所示化合物或其药学上可接受的盐选自以下式(i-7)所示化合物或其药学可接受的盐:
62、
63、所述x1、x2、x3、x4、r3、r4如上文定义。
64、在一些实施方案中,式(i-7)所示化合物中x1选自n或cr1,r1选自sh或所述sh任选被r1b取代。
65、在一些实施方案中,式(i-7)所示化合物中x1选自cr1,r1选自sch3或
66、在一些实施方案中,式(i)所示化合物或其药学上可接受的盐选自以下化合物或其药学可接受的盐:
67、
68、
69、本发明还提供药物组合物,其包含式(i)所示化合物或其药学可接受的盐和药学上可接受的辅料。
70、进一步地,本发明涉及式(i)所示的化合物或其药学上可接受的盐,或其药物组合物在制备预防或者治疗hpk1相关疾病的药物中的用途。
71、进一步地,本发明涉及式(i)所示的化合物或其药学上可接受的盐,或其药物组合物在制备预防或者治疗肿瘤的药物中的用途。
72、进一步地,本发明涉及式(i)所示的化合物或其药学上可接受的盐,或其药物组合物在预防或者治疗hpk1相关疾病中的用途。
73、进一步地,本发明涉及式(i)所示的化合物或其药学上可接受的盐,或其药物组合物在预防或者治疗肿瘤中的用途。
74、进一步地,本发明涉及预防或者治疗hpk1相关疾病的式(i)化合物或其药学上可接受的盐,或其药物组合物。
75、进一步地,本发明涉及预防或者治疗肿瘤的式(i)化合物或其药学上可接受的盐,或其药物组合物。
76、本发明还涉及治疗hpk1相关疾病的方法,该方法包括给以患者治疗上有效剂量的包含本发明所述的式(i)化合物或其药学上可接受的盐的药物制剂。
77、本发明还涉及治疗肿瘤的方法,该方法包括给以患者治疗上有效剂量的包含本发明所述的式(i)化合物或其药学上可接受的盐的药物制剂。
78、在一些实施方案中,hpk1相关疾病选自肿瘤。
79、术语定义和说明
80、除非另有说明,本发明中所用的术语具有下列含义,本发明中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。一个特定的术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照本领域普通的含义去理解。当本文中出现商品名时,意在指代其对应的商品或其活性成分。
81、本文中表示连接位点。
82、本文中消旋体或者对映体纯的化合物的图示法来自maehr,j.chem.ed.1985,62:114-120。除非另有说明,用楔形键和虚楔键表示一个立体中心的绝对构型,用黑实键和虚键表示一个立体中心的相对构型(如脂环化合物的顺反构型)。
83、术语“互变异构体”是指因分子中某一原子在两个位置迅速移动而产生的官能团异构体。本发明化合物可表现出互变异构现象。互变异构的化合物可以存在两种或多种可相互转化的种类。互变异构体一般以平衡形式存在,尝试分离单一互变异构体时通常产生一种混合物,其理化性质与化合物的混合物是一致的。平衡的位置取决于分子内的化学特性。例如,在很多脂族醛和酮如乙醛中,酮型占优势;而在酚中,烯醇型占优势。本发明包含化合物的所有互变异构形式。
84、术语“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,包括顺反异构体、对映异构体和非对映异构体。
85、本发明的化合物可以具有不对称原子如碳原子、硫原子、氮原子、磷原子或不对称双键,因此本发明的化合物可以存在特定的几何或立体异构体形式。特定的几何或立体异构体形式可以是顺式和反式异构体、e型和z型几何异构体、(-)-和(+)-对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,以及其外消旋混合物或其它混合物,例如对映异构体或非对映体富集的混合物,以上所有这些异构体以及它们的混合物都属于本发明化合物的定义范围之内。烷基等取代基中可存在另外的不对称碳原子、不对称硫原子、不对称氮原子或不对称磷原子,所有取代基中涉及到的这些异构体以及它们的混合物,也均包括在本发明化合物的定义范围之内。本发明的含有不对称原子的化合物可以以光学活性纯的形式或外消旋形式被分离出来,光学活性纯的形式可以从外消旋混合物拆分,或通过使用手性原料或手性试剂合成。
86、术语“被取代”是指特定原子上的任意一个或多个氢原子被取代基取代,只要特定原子的价态是正常的并且取代后的化合物是稳定的。当取代基为氧代(即=o)时,意味着两个氢原子被取代,氧代不会发生在芳香基上。
87、术语“任选”或“任选地”是指随后描述的事件或情况可以发生或不发生,该描述包括发生所述事件或情况和不发生所述事件或情况。例如,乙基“任选”被卤素取代,是指乙基可以是未被取代的(ch2ch3)、单取代的(ch2ch2f、ch2ch2cl等)、多取代的(chfch2f、ch2chf2、chfch2cl、ch2chcl2等)或完全被取代的(cf2cf3、cf2ccl3、ccl2ccl3等)。本领域技术人员可理解,对于包含一个或多个取代基的任何基团,不会引入任何在空间上不可能存在和/或不能合成的取代或取代模式。
88、当任何变量(例如ra、rb)在化合物的组成或结构中出现一次以上时,其在每一种情况下的定义都是独立的。例如,如果一个基团被2个rb所取代,则每个rb都有独立的选项。
89、当一个连接基团的数量为0时,比如-(ch2)0-,表示该连接基团为键。
90、当其中一个变量选自化学键或不存在时,表示其连接的两个基团直接相连,比如a-l-z中l代表键时表示该结构实际上是a-z。
91、当本文中涉及到的连接基团若没有指明其连接方向,则其连接方向是任意的。例如当结构单元中的l1选自“c1-c3亚烷基-o”时,此时l1既可以按照与从左到右的方向连接环q和r1构成“环q-c1-c3亚烷基-o-r1”,也可以按照从右到左的方向连接环q和r1构成“环q-o-c1-c3亚烷基-r1”。
92、当一个取代基的键交叉连接到一个环上的两个原子时,这种取代基可以与这个环上的任意原子相键合。例如,结构单元表示r5可在苯环上的任意一个位置发生取代。
93、本文中,由实线和虚线描绘的键表示单键或双键。
94、本文中的cm-cn是指具有m-n范围中的整数个碳原子。例如“c1-c10”是指该基团可具有1个碳原子、2个碳原子、3个碳原子、4个碳原子、5个碳原子、6个碳原子、7个碳原子、8个碳原子、9个碳原子或10个碳原子。
95、术语“烷基”是指通式为cnh2n+1的烃基,该烷基可以是直链或支链的。术语“c1-c10烷基”可理解为表示具有1、2、3、4、5、6、7、8、9或10个碳原子的直链或支链饱和烃基。所述烷基的具体实例包括但不限于甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、2-甲基丁基、1-甲基丁基、1-乙基丙基、1,2-二甲基丙基、新戊基、1,1-二甲基丙基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2-乙基丁基、1-乙基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2,3-二甲基丁基、1,3-二甲基丁基或1,2-二甲基丁基等;术语“c1-c6烷基”可理解为表示具有1至6个碳原子的烷基,具体实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、1-甲基丁基、2-甲基丁基、3-甲基丁基、新戊基、己基、2-甲基戊基等。术语“c1-c3烷基”可理解为表示具有1至3个碳原子的直链或支链饱和烷基。所述“c1-c10烷基”可以包含“c1-c6烷基”或“c1-c3烷基”等范围,所述“c1-c6烷基”可以进一步包含“c1-c3烷基”。
96、术语“烷氧基”是指直链或支链醇类失去羟基上的氢原子产生的基团,可理解为“烷基氧基”或“烷基-o-”。术语“c1-c10烷氧基”可理解为“c1-c10烷基氧基”或“c1-c10烷基-o-”;术语“c1-c6烷氧基”可理解为“c1-c6烷基氧基”或“c1-c6烷基-o-”。所述“c1-c10烷氧基”可以包含“c1-c6烷氧基”和“c1-c3烷氧基”等范围,所述“c1-c6烷氧基”可以进一步包含“c1-c3烷氧基”。
97、术语“烯基”是指由碳原子和氢原子组成的直链或支链的且具有至少一个双键的不饱和脂肪族烃基。术语“c2-c3烯基”实例包括乙烯基、(e)-2-甲基乙烯基、(z)-2-甲基乙烯基等。
98、术语“炔基”是指由碳原子和氢原子组成的直链或支链的具有至少一个三键的不饱和脂肪族烃基。术语“c2-c3炔基”实例包括乙炔基(-c≡ch)、丙-1-炔基(-c≡cch3)等。
99、术语“环烷基”是指完全饱和的且以单环、稠环、桥环或螺环等形式存在的碳环。除非另有指示,该碳环通常为3至12元环。术语“c3-c10环烷基”可理解为表示饱和的单环、稠环、螺环或桥环,其具有3、4、5、6、7、8、9或10个碳原子。所述环烷基的具体实例包括但不限于环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基,降冰片基(双环[2.2.1]庚基)、双环[2.2.2]辛基、金刚烷基、螺[4.5]癸烷基等。术语“c3-c10环烷基”可以包含“c3-c6环烷基”,术语“c3-c6环烷基”可理解为表示饱和的单环或双环烃环,其具有3、4、5或6个碳原子,具体实例包括但不限于环丙基、环丁基、环戊基或环己基等。
100、术语“环烷基氧基”可理解为“环烷基-o-”。
101、术语“杂环基”是指完全饱和的或部分饱和的单环、稠环、螺环或桥环基团,其环原子中含有1、2、3、4或5个杂原子或杂原子团(即含有杂原子的原子团),所述“杂原子或杂原子团”包括但不限于氮原子(n)、氧原子(o)、硫原子(s)、磷原子(p)、硼原子(b)、-s(=o)2-、-s(=o)-、-p(=o)2-、-p(=o)-、-nh-、-s(=o)(=nh)-、-c(=o)nh-或-nhc(=o)nh-等。术语“4-14元杂环基”是指环原子数目为4、5、6、7、8、9、10、11、12、13或14的杂环基,且其环原子中含有1-5个独立选自上文所述的杂原子或杂原子团。“4-14元杂环基”可以包含“4-7元杂环基”、“5-6元杂环基”等范围。术语“4-7元杂环基”是指环原子数目为4、5、6或7的杂环基,且其环原子中含有1、2、3、4或5个独立选自上文所述的杂原子或杂原子团。术语“5-6元杂环基”是指环原子数目为5或6的杂环基,且其环原子中含有1、2、3或4个独立选自上文所述的杂原子或杂原子团。其中,4元杂环基的具体实例包括但不限于氮杂环丁烷基或氧杂环丁烷基;5元杂环基的具体实例包括但不限于四氢呋喃基、二氧杂环戊烯基、吡咯烷基、咪唑烷基、吡唑烷基、吡咯啉基、4,5-二氢噁唑基或2,5-二氢-1h-吡咯基;6元杂环基的具体实例包括但不限于四氢吡喃基、哌啶基、吗啉基、二噻烷基、硫代吗啉基、哌嗪基、三噻烷基、四氢吡啶基或4h-[1,3,4]噻二嗪基;7元杂环基的具体实例包括但不限于二氮杂环庚烷基。所述杂环基还可以是双环杂环基和三环杂环基,其中,5,5元双环基的具体实例包括但不限于六氢环戊并[c]吡咯-2(1h)-基;5,6元双环基的具体实例包括但不限于六氢吡咯并[1,2-a]吡嗪-2(1h)-基、5,6,7,8-四氢-[1,2,4]三唑并[4,3-a]吡嗪基或5,6,7,8-四氢咪唑并[1,5-a]吡嗪基。本发明中的“杂环基”可以包含“杂环烷基”,例如“4-7元杂环基”可以包含“4-7元杂环烷基”等范围。本发明中尽管有些双环类杂环基部分地含有一个苯环或一个杂芳环,但所述杂环基整体上仍是无芳香性的。
102、术语“杂环基氧基”可理解为“杂环基-o-”。
103、术语“杂芳基”是指具有芳香性的单环或稠合多环体系,其中含有至少一个选自n、o、s的环原子,其余环原子为c的芳香环基。术语“5-10元杂芳基”可理解为包括这样的单环或双环芳族环系:其具有5、6、7、8、9或10个环原子,特别是5或6或9或10个环原子,且其包含1-5个,优选1-3个独立选自n、o和s的杂原子。特别地,杂芳基选自噻吩基、呋喃基、吡咯基、噁唑基、噻唑基、咪唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基或噻二唑基等以及它们的苯并衍生物,例如苯并呋喃基、苯并噻吩基、苯并噻唑基、苯并噁唑基、苯并异噁唑基、苯并咪唑基、苯并三唑基、吲唑基、吲哚基或异吲哚基等;或吡啶基、哒嗪基、嘧啶基、吡嗪基或三嗪基等以及它们的苯并衍生物,例如喹啉基、喹唑啉基或异喹啉基等;或吖辛因基、吲嗪基、嘌呤基等以及它们的苯并衍生物;或噌啉基、酞嗪基、喹唑啉基、喹喔啉基、萘啶基、蝶啶基、咔唑基、吖啶基、吩嗪基、吩噻嗪基或吩噁嗪基等。术语“5-6元杂芳基”指具有5或6个环原子的芳族环系,且其包含1-3个,优选1-2个独立选自n、o和s的杂原子。
104、术语“卤”或“卤素”是指氟、氯、溴或碘。
105、术语“治疗有效量”意指(i)治疗或预防特定疾病、病况或障碍,(ii)减轻、改善或消除特定疾病、病况或障碍的一种或多种症状,或(iii)预防或延迟本文中所述的特定疾病、病况或障碍的一种或多种症状发作的本发明化合物的用量。构成“治疗有效量”的本发明化合物的量取决于该化合物、疾病状态及其严重性、给药方式以及待被治疗的哺乳动物的年龄而改变,但可例行性地由本领域技术人员根据其自身的知识及本公开内容而确定。
106、术语“药学上可接受的”,是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
107、术语“药学上可接受的盐”是指药学上可接受的酸或碱的盐,包括化合物与无机酸或有机酸形成的盐,以及化合物与无机碱或有机碱形成的盐。
108、术语“药物组合物”是指一种或多种本发明的化合物或其盐与药学上可接受的辅料组成的混合物。药物组合物的目的是有利于对有机体给予本发明的化合物。
109、术语“药学上可接受的辅料”是指对有机体无明显刺激作用,而且不会损害该活性化合物的生物活性及性能的那些辅料。合适的辅料是本领域技术人员熟知的,例如碳水化合物、蜡、水溶性和/或水可膨胀的聚合物、亲水性或疏水性材料、明胶、油、溶剂、水等。
110、词语“包括(comprise)”或“包含(comprise)”及其英文变体例如comprises或comprising可理解为开放的、非排他性的意义,即“包括但不限于”。
111、本发明还包括与本文中记载的那些相同的,但一个或多个原子被原子量或质量数不同于自然中通常发现的原子量或质量数的原子置换的同位素标记的本发明化合物。可结合到本发明化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、碘和氯的同位素,诸如分别为2h、3h、11c、13c、14c、13n、15n、15o、17o、18o、31p、32p、35s、18f、123i、125i和36cl等。
112、某些同位素标记的本发明化合物(例如用3h及14c标记)可用于化合物和/或底物组织分布分析中。氚化(即3h)和碳-14(即14c)同位素对于由于它们易于制备和可检测性是尤其优选的。正电子发射同位素,诸如15o、13n、11c和18f可用于正电子发射断层扫描(pet)研究以测定底物占有率。通常可以通过与公开于下文的方案和/或实施例中的那些类似的下列程序,通过同位素标记试剂取代未经同位素标记的试剂来制备同位素标记的本发明化合物。
113、本发明的药物组合物可通过将本发明的化合物与适宜的药学上可接受的辅料组合而制备,例如可配制成固态、半固态、液态或气态制剂,如片剂、丸剂、胶囊剂、粉剂、颗粒剂、膏剂、乳剂、悬浮剂、栓剂、注射剂、吸入剂、凝胶剂、微球及气溶胶等。
114、给予本发明化合物或其药学上可接受的盐或其药物组合物的典型途径包括但不限于口服、直肠、局部、吸入、肠胃外、舌下、阴道内、鼻内、眼内、腹膜内、肌内、皮下、静脉内给药。
115、本发明的药物组合物可以采用本领域众所周知的方法制造,如常规的混合法、溶解法、制粒法、乳化法、冷冻干燥法等。
116、在一些实施方案中,药物组合物是口服形式。对于口服给药,可以通过将活性化合物与本领域熟知的药学上可接受的辅料混合,来配制该药物组合物。这些辅料能使本发明的化合物被配制成片剂、丸剂、锭剂、糖衣剂、胶囊剂、液体、凝胶剂、浆剂、悬浮剂等,用于对患者的口服给药。
117、可以通过常规的混合、填充或压片方法来制备固体口服组合物。例如,可通过下述方法获得:将所述的活性化合物与固体辅料混合,任选地碾磨所得的混合物,如果需要则加入其它合适的辅料,然后将该混合物加工成颗粒,得到了片剂或糖衣剂的核心。适合的辅料包括但不限于:粘合剂、稀释剂、崩解剂、润滑剂、助流剂或矫味剂等。
118、药物组合物还可适用于肠胃外给药,如合适的单位剂型的无菌溶液剂、混悬剂或冻干产品。
119、本文所述的通式ⅰ化合物的所有施用方法中,每天给药的剂量为0.01mg/kg到200mg/kg体重,优选为0.05mg/kg到50mg/kg体重,更优选0.1mg/kg到30mg/kg体重,以单独或分开剂量的形式。
120、本发明的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其它化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
121、本发明具体实施方式的化学反应是在合适的溶剂中完成的,所述的溶剂须适合于本发明的化学变化及其所需的试剂和物料。为了获得本发明的化合物,有时需要本领域技术人员在已有实施方式的基础上对合成步骤或者反应流程进行修改或选择。
122、本发明采用下述缩略词:
123、
- 还没有人留言评论。精彩留言会获得点赞!