一种基因编辑间充质干细胞及其制备方法与应用
1.本发明涉及生物药物技术领域,具体涉及一种基因编辑间充质干细胞及其制备方法与应用。
背景技术:
2.骨关节炎又称退行性骨关节炎、骨关节病,主要是指关节软骨随着年龄的增长,或因劳损、活动量的增多、过多,引起关节软骨的退变、磨损,软骨下骨的裸露。目前治疗骨关节炎的方法主要分为非手术治疗和手术治疗。非手术治疗以疼痛管理为主,通过非甾体类抗炎药、关节内透明质酸、糖皮质激素等的应用,减轻关节疼痛和炎症反应。而手术治疗最常见的方法是人工关节置换术。人工关节置换术可以缓解患者症状,可以有效地恢复关节功能,提高患者生活质量。非手术治疗仅解决疼痛和炎症问题,但无法解决其他问题。手术治疗无法解决软骨受损导致的关节完整性缺失问题。且手术治疗过程中,手术费用较高,给病人家庭及社会医疗资源造成严重压力;同时由于不是本体组织,人工关节不能与自身骨骼系统融为一体,不可避免的会发生假体松动、下沉等远期并发症,导致手术失败,需二次翻修手术,增加了社会效益和经济效益。
3.间充质干细胞(mesenchymal stem cells,mscs)具有多向分化的潜能,其可以分化为成骨细胞、脂肪细胞、成纤维细胞、软骨细胞等多种细胞,是目前组织工程理想的种子细胞。与其他组织来源的mscs一样,骨髓来源的间充质干细胞(bone marrow mesenchymal stem cells,bmscs)也具有多种分化能力。临床上若使用自体骨髓间充质干细胞引入关节腔内进行相关治疗,为临床上oa的治疗提供了更多可能性。
4.越来越多的研究表明,炎症机制在骨关节炎的发生和发展中起着重要作用,其通过调控炎症细胞因子及相关信号通路,引起细胞外基质的降解和软骨细胞的功能障碍,最终导致骨关节炎的发生。我们的研究亦证实,oa动物模型中关节液内il-6的表达显著升高,结合近年来兴起的干细胞基因编辑技术,将为针对骨关节炎的干细胞定向分化治疗带来希望。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一种基因编辑间充质干细胞及其制备方法与应用。本发明基于oa动物模型中关节液内il-6的表达显著升高,借助il6/jak/stat3信号通路,将stat3连接至ube3a上游,制备一种基因编辑间充质干细胞。
6.为实现上述目的,本发明采取的技术方案为:一种基因编辑间充质干细胞的制备方法,包括以下步骤:将stat3启动子与ube3a片段连接,构建慢病毒表达载体;将慢病毒表达载体转染间充质干细胞,筛选得到所述基因编辑间充质干细胞。janus激酶/信号转导和转录活化因子(janus kinase/signal transducer and activator of transcription,jak/stat)是目前临床研究较多的信号通路,本通路有多种蛋白调节酶,主要介导信号转导以及基因转录和活化,最终介导靶基因激活的作用。本技术发明人研究发现,oa大鼠关节液
il-6的表达显著升高,导致stat3磷酸化并促进其入核。在此基础上,本发明将stat3启动子连接至ube3a上游,构建得到p-stat3-ube3a载体,并采用该载体转染间充质干细胞,获得基因编辑间充质干细胞p-stat3-ube3a-msc,该细胞对骨关节炎具有良好的修复作用。
7.作为本发明所述基因编辑间充质干细胞的制备方法的优选实施方式,所述间充质干细胞为骨髓间充质干细胞。
8.本发明还提供一种基因编辑间充质干细胞,采用所述的基因编辑间充质干细胞的制备方法制备得到。
9.作为本发明所述的基因编辑间充质干细胞的优选实施方式,所述基因编辑间充质干细胞在il-6或oa关节液刺激下向成软骨分化。
10.作为本发明所述的基因编辑间充质干细胞的优选实施方式,所述基因编辑间充质干细胞中ube3a表达上调。
11.作为本发明所述的基因编辑间充质干细胞的优选实施方式,所述基因编辑间充质干细胞中mettl1表达下调。
12.本发明还提供一种用于治疗骨关节炎的药物组合物,包括所述的基因编辑间充质干细胞和药学上可接受的载体。
13.本发明还提供所述的基因编辑间充质干细胞在制备治疗骨关节炎的药物中的应用。
14.本发明还提供敲低mettl1的骨髓间充质干细胞在制备治疗骨关节炎的药物中的应用。
15.本发明还提供过表达ube3a的骨髓间充质干细胞在制备治疗骨关节炎的药物中的应用。泛素-蛋白酶体途径是调节多种细胞生物学过程的重要机制,介导了真核生物体内80%-85%的蛋白质降解。而介导这一过程的关键是泛素蛋白连接酶(e3),ube3a(e6-ap)是泛素蛋白连接酶(e3)家族的重要成员之一,最初发现其泛素连接酶活性是与hpv16编码的e6原癌蛋白形成e6/e6-ap蛋白复合物,通过泛素-蛋白酶体途径降解p53蛋白,随后研究发现大量的细胞蛋白通过e6-ap介导的泛素-蛋白酶体途径降解,如bak,c-myc,mcm-7,hscrib,hhr23a以及src-3等。本技术发明人研究发现,ube3a通过调控mettl1降解促进bmscs细胞成软骨分化。
16.本发明的有益效果:本发明提供一种基因编辑间充质干细胞,本发明的基因编辑间充质干细胞高表达ube3a,促进mettl1的泛素化和mettl1蛋白质的降解,能够促进间充质干细胞向成软骨方向分化的效率,为骨关节炎软骨的修复提供一种新的治疗途径。
附图说明
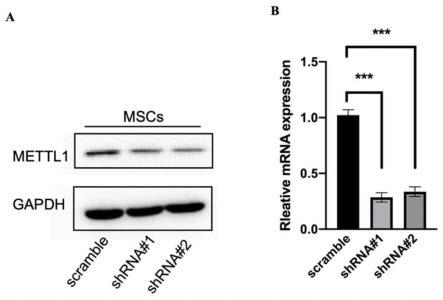
17.图1为mettl1在对照组以及敲低mettl1的bmscs中表达情况,其中a为western blot检测mettl1蛋白水平的表达;b为qrt-pcr检测mettl1的mrna水平表达,actb作为内参,n=3,***p《0.001。
18.图2为wb检测敲低metll1及对照组的bmscs成软骨诱导分化过程中软骨细胞标志物表达变化情况。
19.图3:a为免疫共沉淀证实mettl1可以和ube3a相互作用;b为western法检验ube3a敲降效率;c为western法检验ube3a高表达效果;d为wb显示ube3a敲降后mettl1表达上调,
ube3a高表达后mettl1表达下降。
20.图4为chx蛋白质合成抑制剂处理后mettl1蛋白水平的变化.
21.图5为体外泛素化实验结果图。
22.图6为ube3a高表达后,软骨分化诱导效率变化图。
23.图7为stat3启动子驱动下ube3a表达质粒构建,其中a为stat3启动子驱动下ube3a表达质粒(p-stat3-ube3a)示意图;b为wb评估转染p-stat3-ube3a后在il-6刺激或oa滑膜液刺激下磷酸化stat3,ube3a及mettl1等蛋白表达水平。
24.图8为wb和阿尔新蓝染色结果图。
25.图9为流式细胞术检测各组外周血中treg细胞的含量;n=3,***p《0.01。
26.图10为流式细胞术检测骨关节炎小鼠接受msc治疗或p-stat3-ube3a-msc治疗后外周血th17细胞比例。
27.图11为流式细胞术检测骨关节炎小鼠接受msc治疗或p-stat3-ube3a-msc治疗后关节液中m1巨噬细胞比例;n=3,**p《0.01。
28.图12为msc及p-stat3-ube3a-msc对oa大鼠膝关节软骨病理的影响(he染色,
×
400);n=3,**p《0.01,***p《0.001。
具体实施方式
29.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
30.实施例1
31.本实施例通过实验验证敲低mettl1促进骨髓间充质干细胞向成软骨细胞方向分化,具体实验方法如下:
32.(1)原代骨髓间充质干细胞的分离培养:取4周龄雄性大鼠,颈椎脱臼法初四后75%酒精浸泡5分钟,取出双侧腿骨,置于装有pbs溶液的培养皿中剔除肌肉组织,移入装有10% fbs的低糖dmem中,减去腿骨两端,用1ml注射器抽取培养液反复冲洗骨髓腔,收集培养液后反复吹打后静置10min,将上清液移至10ml无菌离心管中,3000rpm离心三分钟后弃上清,用含有10%fbs的低糖dmem培养液重悬细胞,调整细胞密度为50
×
105接种于培养瓶中,在5%co2,37℃中培养,每天换液并观察细胞形态;间充质干细胞表型鉴定:收集培养第三代msc,0.01mol/l pbs洗涤一次,分别加入cd45,cd90,cd31,cd25,cd105,工作浓度1:100,4℃孵育30分钟后,pbs洗涤,加入异硫氰酸荧光素标记的二抗,工作浓度为1:100,4℃孵育30分钟,pbs洗涤两次,流式细胞仪检测;
33.(2)构建敲低mettl1的bmscs稳定细胞株:将中山大学附属第一医院精准医学中心林水宾教授构建得到的特异性敲低mettl1的plko.1-shmettl1-1-puro,plko.1-shmettl1-5-puro质粒载体以及对照plko.1-shgfp-puro质粒载体,分别与包装质粒一起转染hek-293t细胞,收集病毒液后感染bmscs,经过嘌呤霉素筛选约一周后扩大培养获得稳定细胞株。分别用qrt-pcr和wb检测mettl1的mrna和蛋白水平表达,发现与对照组bmscs相比,mettl1的表达水平明显降低(如图1所示),结果表明成功构建了敲低mettl1的bmscs稳定细胞株;
34.(3)取第3代对数生长期骨髓间充质干细胞,实验组使用含2mg/l胰岛素、3mg/l转铁蛋白、1mmol/l丙酮酸、100nmol/l地塞米松和10μg/l转化生长因子β1的低糖dmem培养基诱导人骨髓间充质干细胞向软骨细胞分化,对照组细胞以低糖dmem基础培养液培养。倒置显微镜观察形态,诱导7-21天,western法检测sox9,col2a1的表达,蕃红花o-亮绿染色分析蛋白多糖粘多糖含量。结果如图2所示,敲低mettl1后bmscs诱导分化来的软骨细胞表达相关软骨细胞标志物明显增多。
35.实施例2
36.本实施例通过实验验证ube3a通过调控mettl1降解促进bmscs细胞成软骨分化,具体实验方法如下:
37.(1)免疫共沉淀验证mettl1与ube3a的相互作用关系:收集间充质干细胞由预冷pbs清洗两遍,用np-40四度裂解30分钟,与mettl1抗体孵育过夜,加入100 l蛋白a(蛋白g或sepharose)轻轻振荡1h或4℃过夜以捕获免疫沉淀复合物;通过脉冲离心(14000rpm,5s)收集琼脂糖/sepharose珠子,弃掉上清,用800l冰冷的改良ripa缓冲液洗涤珠子3次;将琼脂糖/sepharose珠子重悬于60l 2
×
sds蛋白上样缓冲液中,混匀后煮沸5min,200g离心1min弃掉珠子;将上清转移至一新离心管中-20℃冻存或进行sds-page电泳。
38.(2)将过表达ube3a的ppb-cag-ube3a与特异性敲低ube3a的质粒分别转入bmscs中,用wb检测转染效率。
39.(3)用wb检测mettl1在上述对照bmscs,敲低ube3a的bmscs,以及过表达ube3a质粒的bmscs中的蛋白水平。
40.(4)在对照bmscs及敲低ube3a的bmscs中加入蛋白合成抑制剂,放线菌酮(chx),分别处理0h、2h、4h和6h后,用wb验证mettl1蛋白表达水平的变化。
41.(5)体外泛素化实验:间充质干细胞高表达ha-mettl1以及flag-ube3a。72小时后,间充质干细胞离心沉淀,ripa细胞裂解液裂解;加入10mm蛋白酶抑制剂以及10mm的nem;在超裂解和离心后,上清加入抗ha的抗体及琼脂糖/sepharose珠子4度过夜,洗净后,sds电泳,western法检测。
42.(6)采用高表达ube3a的bmscs和普通bmscs分别诱导成软骨分化,然后用wb检测各组诱导后的软骨细胞标志物的蛋白水平表达情况。
43.实验结果如图3~6所示。图3a表明抗mettl1抗体可以募集到ube3a蛋白,说明ube3a与mettl1之间存在相互作用;图3b~c表明敲低ube3a的bmscs其ube3a蛋白水平明显下降,相反,过表达质粒在目的细胞中成功过表达ube3a,说明成功构建了ube3a过表达及敲低质粒;图3d表明ube3a沉默后能增强mettl1的蛋白水平表达,以上实验结果说明ube3a和mettl1表达存在相关性。由图4可知,随着chx的作用时间延长,对照组的mettl1表达水平逐渐下降,提示chx阻止了mettl1蛋白的合成;但是在ube3a敲低组中,mettl1的蛋白稳定性并没有发生显著性改变。由图5可以看出,在共表达mettl1与ube3a的bmscs中,ube3a蛋白表达促进mettl1蛋白泛素化降解;在沉默ube3a表达的bmscs中mettl1泛素化明显减少。这些结果说明mettl1是ube3a的底物,ube3a可促进mettl1泛素化降解。由图6可以看出,高表达ube3a后bmscs诱导分化来的软骨细胞表达相关软骨细胞标志物增多。
44.实施例3
45.本实施例提供一种基因编辑间充质干细胞的制备方法,包括以下步骤:
46.(1)采用慢病毒骨架载体,通过oe-pcr将stat3启动子区序列与指示基因ube3a连接,插入至质粒多克隆位点。转化感受态,挑选菌落,摇菌扩增质粒,使用质粒大量提取试剂盒提取质粒。将核心质粒以及慢病毒辅助质粒phelper1,phelper2共同转染293t细胞,3日后收取病毒上清感染骨髓间充质干细胞,感染间充质干细胞后嘌呤霉素筛选,得基因编辑间充质干细胞p-stat3-ube3a-msc。
47.(2)实验组加入500pg il6处理24小时,对照组不处理,采用wb评估ube3a及mettl1的表达水平。
48.实验结果如图7所示,转染p-stat3-ube3a后只有在il-6刺激或oa滑膜液刺激下,才能使得stat3磷酸化从而促进ube3a高表达,mettl1表达降低。
49.(3)在il-6刺激下,诱导野生型间充质干细胞和p-stat3-ube3a-msc成软骨,阿利新蓝染色法及wb评估间充质干细胞向软骨分化的水平。
50.实验结果如图8所示,相比野生型间充质干细胞,p-stat3-ube3a-msc诱导分化来的软骨细胞表达相关软骨细胞标志物明显增多,同样的,阿尔新蓝染色显示,在il-6作用下,转染p-stat3-ube3a软骨分化诱导效率明显提高。
51.实施例4
52.本实施例通过实验探究p-stat3-ube3a-msc对骨关节炎的保护机制,以及对cd4+t细胞亚群的影响,具体实验方法如下:
53.(1)膝关节骨关节炎模型的建立:40只成年sd雄性大鼠,体重为(280
±
20)g,除正常组外,其余各组大鼠在造模前检测痛阈后,以水合氯醛(40mg/kg,腹腔注射)麻醉,将0.3mg单体碘乙酸(monomer sodium iodic acid,mia)溶液注入大鼠左侧膝骨关节腔内,并配合持续的抽屉样关节运动。具体操作步骤为,将3mg mia溶入到50ml 0.9%的生理盐水中,清理关节附近的鼠毛,将关节屈曲到最大限度后于左膝关节腔注入配置好的溶液,于右膝处注入同等剂量的生理盐水。正常组用同样的方法于两膝注入50ml生理盐水。所有老鼠每日同时做相同的驱赶运动约30min。造模成功后15d,实验组关节腔内注射p-stat3-ube3a-msc,对照组关节腔内注射野生间充质干细胞(msc组),正常组(oa组)不做干预。造模后第43d称重,于造模前、造模后行疼痛行为学机械性缩足阈值测试。检测各组小鼠外周血中treg细胞占cd4+细胞的百分含量、th17细胞比例。
54.结果如图9所示,msc组及p-stat3-ube3a-msc组的外周血中treg细胞占cd4+细胞的百分含量明显高于oa组,且差异有统计学意义;msc组和p-stat3-ube3a-msc组相比,差异无统计学意义,说明骨关节炎小鼠接受msc治疗或p-stat3-ube3a-msc治疗后周围血中调节性t细胞明比例显上升。
55.如图10所示,骨关节炎小鼠接受msc治疗或p-stat3-ube3a-msc治疗后外周血th17细胞比例没有明显改变,msc组和p-stat3-ube3a-msc组相比,差异亦无统计学意义,说明骨关节炎大鼠接受msc治疗或p-stat3-ube3a-msc治疗后周围血中th17细胞未见明显变化。
56.(2)关节滑膜液获取后,完全培养基稀释,室温500g离心20分钟,滑膜液的有核细胞由ficoll-hypaque液分层离心获取,完全培养基洗涤,孵育抗体后流式细胞仪检测。关节软骨下骨单细胞悬液的制备,胫骨平台pbs清洗,解剖显微镜下分离软骨和软骨下骨,矢状切碎骨骼至一毫米,在8毫升amem加0.6mg/ml胶原酶ia内消化,37℃旋转搅拌消化4小时。消化后,悬浮液过70 m筛网,上机评估是否具有对角线效应,如果有,则使用fvd或7-aad染色
鉴别死活以消除对角线效应,如果没有,则可以直接使用多聚甲醛固定,标本染色前使用pbs悬浮离心清洗3遍以上。检测各组小鼠关节液中m1型巨噬细胞的含量变化。
57.结果如图11所示,与自身外周血比较,各oa治疗组关节液中m1巨噬细胞的比例显著降低。mscs组和p-stat3-ube3a-msc治疗组关节液中m1巨噬细胞的百分含量均明显低于未治疗的oa对照组,msc组和p-stat3-ube3a-msc组相比,差异无统计学意义,说明骨关节炎大鼠在接受msc治疗或p-stat3-ube3a-msc治疗后关节液中m1型巨噬细胞比例明显下降。
58.(3)处死大鼠后,获取其胫骨软骨下骨,冰冻切片切为10μm,将冰冻切片于37℃烘箱中放置60min,将其水分烘干;pbs漂洗3次,每次10min,甩掉并擦干组织周围液体,将切片平放于湿盒中;用免疫组化笔在组织周围画圈,5%bsa/pbs于37℃湿盒内封闭30min;甩去多余液体,滴加100ul的抗rankl抗体(使用5% bsa 1:100稀释)于组织上,4℃过夜。第二日,将切片用pbs洗3次,每次10min;将残留液体甩干,加荧光二抗(使用5% bsa 1:100稀释),37℃避光孵育1h;pbs洗3次,每次10min;于荧光显微镜下观察。
59.结果如图12所示,oa组大鼠见软骨表面破坏严重,潮线缺损或消失,软骨细胞形态破坏,数量明显减少,细胞弥漫性增加。mscs及p-stat3-ube3a-msc治疗组大鼠的膝关节软骨破坏情况得到明显改善。oarsi评分结果显示,与未治疗oa对照组相比,mscs及p-stat3-ube3a-msc治疗oa大鼠后软骨细胞破坏程度均明显下降,尤其p-stat3-ube3a-msc治疗组效果更佳。
60.最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1