非终末抗体发现方法和单细胞测定与流程
背景技术:
1、基于针对不同复杂程度的蛋白质靶标的多克隆血清效价,传统的基于动物的抗体发现方法涉及处死动物。虽然一些抗体发现活动具有简单的设计目标(例如,与靶标结合),但是大多数更为复杂并且需要所需的抗体具有多种特征(例如,交叉反应性、与特定表位结合、以特定的亲和力结合等)。传统的抗体发现方法依赖于询问多克隆分泌的抗体(血清)反应来选择用于b细胞收获和抗体产生的动物。“血清效价”方法不太理想,因为其测量所有分泌抗体(即,其为多克隆混合物)的总反应性,并且不能用于鉴定检测到的抗体的b细胞来源(即,存在与来源b细胞的物理分离和时间分离两者)。表型(抗体效价测量)和基因型(编码抗体的负责的来源b细胞)之间缺乏直接联系使得解释b细胞反应的质量变得困难。除了确定血清中是否存在可溶性抗原特异性抗体之外,很难从这种多克隆分析中获得可以有助于动物选择的另外的有用信息。
2、此外,传统方法学对于动物而言是终末的,并且因此代表了捕获动物的相关b细胞库的‘一次性’尝试。未能捕获此库可能由技术问题、选择具有次优抗体产生的动物和/或库采样深度的缺乏(即,传统病毒永生化和杂交瘤方法的低效率导致b细胞库的非常小一部分(小于0.1%)的融合)引起,导致宝贵资源的浪费并且迫使使用替代性免疫动物或全新的免疫接种活动。此外,传统方法排除了利用同一动物的免疫系统进化抗体反应的连续方法的可能性。
3、尽管有这些限制,传统方法仍被广泛使用,部分原因是它们允许捕获免疫库的可接受部分并且提供可以容易地扩展以适应下游测定的可更新的抗体来源。
4、在越来越多的情况下,这些传统方法太慢而无法满足项目时间表,捕获错误的b细胞群,对b细胞库采样不足,或者不允许实时监测进化的b细胞反应。此外,许多抗体靶标类别(例如,复合膜蛋白、具有最小表位空间的靶标、与直系同源物高度相似的蛋白质等)的挑战性质可能使得由于缺乏强烈的免疫原性而难以提高动物中的b细胞反应。再加上一些抗体设计目标的极端复杂性,产生具有所需免疫谱(即b细胞库)的免疫动物可能是困难的。
5、鉴于上述情况,需要更有效的抗体发现方法。例如,可以更好地定位传统动物免疫接种的抗体发现方法和成功发现抗体的b细胞方法将大大增强基于动物的抗体发现。
技术实现思路
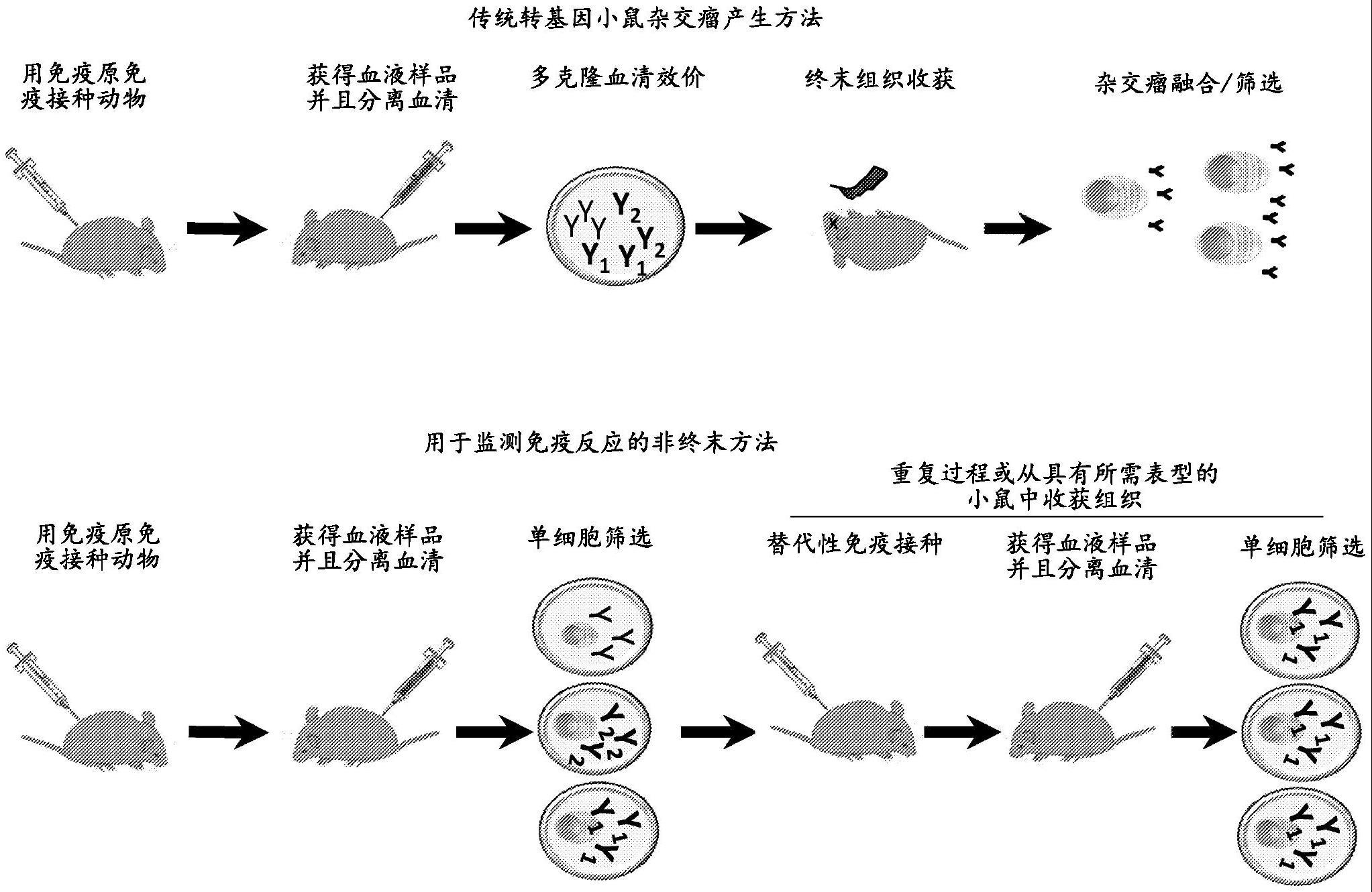
1、首次提供了可用于抗体发现的基本原理、实验方法和数据展示技术。在示例性方面,这些方法涉及直接从活的非人动物的外周血中鉴定抗原特异性抗体。有利地,本文提供的此类方法允许在不需要处死动物的情况下进行抗体发现,这与依赖于动物安乐死随后收获免疫器官(例如,脾、淋巴结和骨髓)的传统方法不同。因为此类方法是非终末的(例如,不涉及产生抗体的动物的安乐死),这些方法可以在相同动物中重复多次,直到例如获得目的抗体。与传统方法相比,在相同动物中重复该方法的能力具有几个优点。例如,在同一动物中重复该方法降低了抗体发现方法的总成本。此外,由于动物保持存活,本发明披露的方法允许对抗体库进行实时的活体采样,使得如果例如动物不产生表达目的靶抗体的b细胞,则可以基于观察到的b细胞反应(来自先前的免疫接种)对免疫接种方案(用于下一次免疫接种)进行战略性调整。因此,本发明的方法允许合理的库整形(repertoire shaping)和/或对免疫反应进行有目的的引导以匹配抗体设计目标。本披露的示例性方法在图1b-1e中示出。图1b示出了用于监测免疫反应的示例性非终末方法,该示例性非终末方法包括筛选从经免疫接种的动物的血液样品中获得的单细胞。基于单细胞筛选的结果,可以对动物进行重复轮次的免疫接种(例如,替代性免疫接种),随后对来自从经免疫接种的动物中获得的血液样品的细胞进行单细胞筛选,或者如果该筛选确定动物表现出所需表型,该动物可以经历组织收获。图1c示出了监测选定抗体的产生的示例性非终末方法,其中在单细胞水平上筛选从经免疫接种的动物中获得的血液样品中纯化的抗体分泌细胞(asc)。重复该方法,直到达到设计目标和/或产生选定抗体。图1d示出了指导抗体产生以产生选定抗体的示例性非终末方法,其中初级策略用于免疫接种动物,并且针对所需表型筛选从经免疫接种的动物中分离的pbmc获得的asc。如果该筛选确定没有达到设计目标,则用替代性策略(例如,不同于初级策略的策略)对动物进行免疫接种,并且针对所需表型筛选从经免疫接种的动物分离的pbmc获得的asc。重复该方法,直到筛选确定达到设计目标。当达到设计目标时以及如果达到设计目标,可以使用杂交瘤、单细胞平台或基于序列的发现来收获终末组织用于抗体拯救。图1e示出了筛选动物和b细胞谱分析的示例性非终末方法,其中用免疫原免疫接种一系列动物,并且筛选从获自每只动物的血液样品中获得的asc并对b细胞库进行谱分析。在示例性方法的各个方面,从经免疫接种的小鼠的外周血中纯化抗体分泌细胞(asc),例如浆母细胞,并且然后以单细胞分辨率筛选相关活性或表型。与通常需要约8周并且需要高水平技术技能的传统杂交瘤产生方法(如图1a所示)相比,本披露的方法劳动强度较低并且需要较少的时间。
2、因此,本披露提供了监测非人动物中选定抗体的产生的方法。在示例性实施例中,该方法包括(a)用免疫原免疫接种非人动物;(b)从所述非人动物中获得包含抗体分泌细胞(asc)的血液样品;和(c)测定(例如单独地测定)在血液样品或其级分中存在的asc的选定抗体产生。在各种情况下,该方法进一步包括重复(b)和(c)一次或多次,直到达到设计目标,例如,直到产生选定抗体。图1c示出了本披露的这一示例性方面。本披露还提供了在非人动物中指导抗体产生以产生选定抗体的方法。在示例性实施例中,该方法包括(a)用免疫原对非人动物进行初始免疫接种;(b)从所述非人动物中获得包含asc的血液样品;(c)测定(例如单独地测定)在血液样品或其级分中存在的asc的选定抗体产生;和(d)当产生选定抗体的asc的百分比低于阈值时,执行步骤循环,其中该循环包括(i)当产生选定抗体的asc的百分比低于阈值时,用免疫原对非人动物进行后续免疫接种,(ii)从所述非人动物中获得包含asc的血液样品,和(iii)测定(例如,单独地测定)在血液样品或其级分中存在的asc的选定抗体产生。
3、在各个方面,该测定包括单细胞活细胞测定。如本文所用,短语“单独地测定asc”意指在单细胞水平上或以单细胞分辨率测定或检查asc。在示例性情况下,“单独地测定asc”提供与单一asc相关的结果。任选地,同时测定多个asc。在各个方面,同时单独地测定多个asc。在示例性方面,以非终末方式从非人动物中获得血液样品,例如,在血液样品采集期间不杀死非人动物。在示例性情况下,该方法包括从非人动物进行非终末抽血。在各种情况下,该方法包括将血液样品或其级分施加到基质,并且将该基质的唯一地址分配给每一asc。任选地,测定的结果是对产生选定抗体的每一asc的鉴定。在某些方面,测定的结果是对产生选定抗体的每一asc的唯一地址的鉴定。在示例性情况下,该方法包括以下各项的至少一个循环:(i)当产生选定抗体的asc的百分比低于阈值时,用免疫原对非人动物进行后续免疫接种,(ii)从所述非人动物中获得包含asc的血液样品,(iii)测定(例如,单独地测定)在血液样品或其级分中存在的asc的选定抗体产生。任选地,重复该循环,直到如(iii)中所测定的,产生选定抗体的asc的百分比等于或高于阈值。在各种情况下,该循环重复至少两次。
4、在示例性方面,后续免疫接种的免疫原可以不同于初始免疫接种的免疫原。例如,在示例性方面,每次后续免疫接种与先前免疫接种的不同之处在于:(a)将不同的免疫原、佐剂和/或免疫调节剂施用至非人动物,(b)将不同剂量的免疫原施用至非人动物,(c)免疫原、佐剂、免疫调节剂的每次施用之间的时间不同,和/或(d)免疫原、佐剂、免疫调节剂的每次施用的施用途径不同。任选地,每次免疫接种非人动物时使用不同的免疫原。图1d示出了指导抗体产生以产生选定抗体的示例性方法。
5、本披露进一步提供了在非人动物中产生选定抗体的方法。在示例性实施例中,该方法包括根据本发明披露的指导抗体产生的方法在非人动物中指导抗体产生以产生选定抗体,并且然后分离选定抗体和/或产生选定抗体的asc。在示例性实施例中,该方法包括(a)用免疫原对非人动物进行初始免疫接种活动;(b)从所述非人动物中获得包含抗体分泌细胞(asc)的血液样品;(c)测定(例如单独地测定)在血液样品或其级分中存在的asc的选定抗体产生;(d)当产生选定抗体的asc的百分比低于阈值时,执行步骤循环,其中该循环包括(i)当产生选定抗体的asc的百分比低于阈值时,用免疫原对非人动物进行后续免疫接种,(ii)从所述非人动物中获得包含asc的血液样品,和(iii)测定(例如,单独地测定)在血液样品或其级分中存在的asc的选定抗体产生;和(e)分离选定抗体和/或产生选定抗体的asc。在各个方面,该方法包括(f)确定编码由asc(例如,产生选定抗体的分离的asc)产生的选定抗体的重链可变区的核苷酸序列和编码由asc产生的选定抗体的轻链可变区的核苷酸序列,(g)将包含编码选定抗体的重链可变区的核苷酸序列的第一载体和包含编码选定抗体的轻链可变区的核苷酸序列的第二载体引入宿主细胞中,和(h)分离由宿主细胞产生的抗体。
6、在示例性方面,本发明披露的方法的测定包括(a)将基质内的asc与结合选定抗体并在结合选定抗体后产生可检测信号(例如,荧光信号)的试剂组合。在各个方面,本发明披露的方法的测定包括(a)将基质内的asc与结合至选定抗体的fc结构域的至少一种试剂以及与选定抗体结合的至少一种试剂(例如,结合至选定抗体的抗原结合结构域的试剂)组合,其中这些试剂中的至少一种附接至可检测标记。在示例性情况下,将asc与结合至选定抗体的fc结构域并且包含第一可检测标记的检测试剂以及与选定抗体结合的靶标(例如,结合至选定抗体的抗原结合结构域的试剂)组合。图2a-2c示出了在本发明披露的方法的背景下的示例性测定。在各种情况下,靶标被与第一可检测标记不同的第二可检测标记所标记。在一些情况下,将结合至选定抗体的fc结构域并且包含固体支持物的捕获试剂进一步与asc、检测试剂和经标记的靶标组合。在各种情况下,该方法进一步包括(b)测定第一可检测标记和第二可检测标记;和(c)鉴定在基质内检测到该第一可检测标记和该第二可检测标记的位置,其中每个所鉴定位置定位产生选定抗体的单独asc。图2a和2b示出了用经标记的靶标和捕获试剂进行的这样的示例性测定。图2a将基质作为一个孔示出。图2b将基质作为多笔式芯片(multi-pen chip)或多孔板示出,并且每一asc被置于单个笔或孔中。在各种情况下,靶标由细胞表达,并且将表达靶标的细胞与asc和检测试剂组合。在示例性方面,该方法进一步包括(b)测定第一可检测标记;和(c)鉴定在基质内检测到该第一可检测标记的位置,其中每个所鉴定位置定位产生选定抗体的单独asc。图2c示出了用表达靶标的细胞进行的这样的示例性测定。在示例性情况下,本发明披露的方法的测定包括(a)将基质内的asc与(i)结合至选定抗体并且包含固体支持物的捕获试剂、(ii)结合至选定抗体并且包含第一可检测标记的检测试剂和(iii)与选定抗体结合的经标记的靶标组合,其中该经标记的靶标包含与第一可检测标记不同的第二可检测标记;(b)测定该第一可检测标记和该第二可检测标记;和(c)鉴定在基质内检测到该第一可检测标记和该第二可检测标记两者的位置,其中每个所鉴定位置定位产生选定抗体的单独asc。任选地,捕获剂包含结合至与固体支持物附接的抗体fc结构域的抗体。在示例性情况下,检测剂包含结合至与第一可检测标记附接的抗体fc结构域的抗体。在各个方面,结合至捕获剂的抗体fc结构域的抗体与检测剂的抗体相同。在示例性情况下,该组合发生在孔中,并且捕获剂在孔中形成单层。在各个方面,该方法包括鉴定在孔内检测到该第一可检测标记和该第二可检测标记两者的位置,其中每个所鉴定位置定位产生选定抗体的单独asc。
7、本披露另外还提供了用于鉴定产生选定抗体的asc的单细胞测定。本披露提供了测定产生选定抗体的asc的方法。在示例性实施例中,该测定或方法包括(a)在孔中组合(i)从用免疫原免疫接种的非人动物中获得的血液样品或其级分,其中该血液样品包含asc,(ii)结合至选定抗体并且包含第一可检测标记的检测试剂,和(iii)与选定抗体结合的靶标,其中(a)该靶标是包含与第一可检测标记不同的第二可检测标记的经标记的靶标,并且在孔中进一步组合结合至选定抗体并且包含固体支持物的捕获试剂以在孔中形成单层,或者(b)该靶标在细胞表面上表达,并且在孔中组合这些细胞以在孔中形成单层;(b)当该靶标是经标记的靶标时,测定第一可检测标记和任选地测定第二可检测标记;和(c)鉴定在孔内检测到第一可检测标记或检测到第一可检测标记和第二可检测标记的位置,其中每个所鉴定位置定位产生选定抗体的单独asc。在各个方面,该测定或方法包括(a)在孔中组合(i)从用免疫原免疫接种的非人动物中获得的血液样品或其级分,(ii)捕获试剂,该捕获试剂包含结合至与固体支持物附接的抗体fc的抗体,(iii)检测试剂,该检测试剂包含结合至与第一可检测标记附接的抗体fc的抗体,和(iv)经标记的靶标,该经标记的靶标包含附接至跟第一可检测标记不同的第二可检测标记的免疫原或其部分,其中该捕获剂在孔中形成单层;(b)测定第一可检测标记;(c)测定第二可检测标记;和(d)鉴定在孔内检测到该第一可检测标记和该第二可检测标记两者的位置,其中每个所鉴定位置定位产生选定抗体的单独asc。在各个方面,该测定或方法包括(a)在孔中组合(i)从用免疫原免疫接种的非人动物中获得的血液样品或其级分,(ii)结合至选定抗体的检测试剂,和(iii)在细胞表面上表达与选定抗体结合的靶标的细胞,其中在孔中组合这些细胞以在孔中形成单层,(b)测定第一可检测标记;和(c)鉴定在孔内检测到该第一可检测标记和该第二可检测标记两者的位置,其中每个所鉴定位置定位产生选定抗体的单独asc。
8、在本发明披露的方法的各个方面,非人动物既不经历一个或多个次级淋巴器官的切除,也不经历安乐死。此外,在各种情况下,来自血液样品的asc不用于制造杂交瘤。在示例性方面,非人动物是一系列非人动物中的一只,并且测定的结果是对产生选定抗体的asc的百分比低于阈值和/或需要进一步免疫接种的非人动物的鉴定。在替代性方面,该方法包括当产生选定抗体的asc的百分比等于或高于阈值时,处死非人动物并且从非人动物中收获组织。在各种情况下,该方法的步骤在一系列非人动物上执行,并且该方法包括对该系列中的每只非人动物的血液样品的b细胞库进行谱分析,并且选择该系列中具有靶b细胞谱的亚组。图1e示出了此类步骤。
9、合理的免疫库产生和选择是基于动物的抗体发现技术的关键组分。尽管从传统的b细胞永生化发展到直接的b细胞平台,例如(但不限于)nanoblast(在纳米流体装置上的抗体发现方法)和微胶囊化,但是输入b细胞的多样性和质量仍然是达到抗体设计目标的重要决定因素。评价免疫动物的传统方法依赖于询问多克隆分泌抗体(血清)来评价免疫反应并选择用于b细胞收获和抗体产生的动物。“血清效价”方法不太理想,因为其测量所有分泌抗体的总反应性,而不是检测到的抗体的单独b细胞来源的质量。抗体效价测量与负责的b细胞来源之间缺乏直接联系使得解释b细胞反应的质量变得困难。除了确定血清中是否存在可溶性抗原特异性抗体之外,很难从这种多克隆分析中获得可以有助于动物选择或免疫引导策略的另外的有用信息。本文提供了使用来源自非终末外周血的样品来询问免疫动物的b细胞反应的asc测定,其将解决这些挑战。因此,本披露提供了一种筛选非人动物的产生选定抗体的抗体分泌细胞(asc)的方法。示例性实施例中的方法包括(a)用免疫原免疫接种一系列非人动物;(b)从该系列的每只非人动物中获得包含asc的血液样品;和(c)单独地测定血液样品或其级分中存在的asc的选定抗体产生,其中,对于该系列的每只非人动物,确定产生选定抗体的asc的百分比。在各个方面,筛选方法进一步包括当产生选定抗体的asc的百分比等于或高于阈值时,选择该一只或多只非人动物进行处死和/或组织收获。在各个方面,筛选方法进一步包括当产生选定抗体的asc的百分比低于阈值时,选择该一只或多只非人动物进行后续免疫接种。因此,在各种实施例中,筛选方法基于产生选定抗体的asc的百分比来鉴定要处死的动物与进行后续免疫接种的动物。
10、与前述描述一致,提供了选择经免疫接种的非人动物进行后续免疫接种的方法。在示例性实施例中,该方法包括根据本发明披露的方法中的任何一种监测非人动物中的选定抗体产生,其中该方法在一系列非人动物上执行,其中对于该系列中的每只非人动物,鉴定产生选定抗体的asc的数量,并且当动物的产生选定抗体的asc的百分比低于阈值时,选择该动物进行后续免疫接种。本文还提供了选择经免疫接种的非人动物进行安乐死和次级淋巴收获的方法。在示例性实施例中,该方法包括根据本发明披露的方法中的任何一种监测非人动物中的选定抗体产生,其中该方法在一系列非人动物上执行,其中对于该系列中的每只非人动物,鉴定产生选定抗体的asc的数量,并且当动物的产生选定抗体的asc的百分比等于或高于阈值时,选择该动物进行安乐死和次级淋巴收获。
- 还没有人留言评论。精彩留言会获得点赞!