几种呋喃并嘧啶-布洛芬杂合衍生物的合成方法及抗肿瘤的应用
本发明涉及基于布洛芬先导化合物,设计、合成不同系列的呋喃并嘧啶-布洛芬杂合衍生物及其抗肿瘤活性研究。通过cck8法体外对a549肺癌细胞、hepg2肝癌细胞系增殖抑制活性测试,结果显示:目标化合物对两种细胞都显示出良好的增殖抑制活性,其中化合物10h、12a、13c对肺癌细胞(a549)的活性最为优异,ic50分别为0.039μm、0.038μm、0.068μm。化合物10c、13c、13i对肝癌细胞(hepg2)的活性最为优异,ic50分别为0.021μm、0.144μm、0.232μm。均优于抗肿瘤对照药物吉非替尼。
背景技术:
1、癌症严重威胁着人类的健康,据世界卫生组织(who)统计,2020年全球新发癌症病例1929万例,死亡病例996万例,预计到2030年因癌症死亡的人数将达到1320万人[1]。在癌症的治疗过程中为了增加药物的疗效或减轻药物毒副作用通常会采用联合用药的方式。研究表明,癌症的发展与炎症密切相关,炎症反应的持续发生在癌症的引发、促进、转移等过程中起到重要的作用[2]。因此在癌症的治疗过程中常伴随着抗炎治疗。抗炎药物作为预防给药时可以降低肿瘤发生率,用作治疗给药时可以减慢肿瘤发展进度、降低死亡率[3],但抗炎治疗并不能杀伤肿瘤细胞,需联合抗肿瘤药物进行常规治疗[4]。因此我们想要联合抗癌药物和抗炎药物设计出一种新型的小分子化合物以期达到“1+1>2”的效果。
2、布洛芬作为一种非甾体抗炎药通过非选择性抑制环氧化酶(cox)、减少前列腺素的合成表现出较好的抗炎镇痛作用,在临床上通常用于治疗头痛、牙痛等[5,6],但长期使用布洛芬会导致严重的胃肠道损害和肾功能不全等副作用。该副作用主要是布洛芬结构中游离羧酸和与cox-1的抑制作用有关[7]。另外,研究表明cox-2在胃癌、肝癌、肺癌和前列腺癌中过表达,将其抑制能降低癌症发展的风险[8]。因此,近年来,基于布洛芬先导化合物的结构修饰备受关注,通过对布洛芬羧基修饰可以提升布洛芬对cox-2的选择性。利用前药原理将羧基修饰成其酯基、酰胺基等,以减小羧基对胃肠道的刺激,或利用拼合原理(combinationprinciples)将布洛芬与具有相似或不同药理作用的药物通过共价键相连,以增强布洛芬的抗炎活性或产生新的药理活性[9-11]。
3、另外,呋喃并嘧啶作为一类重要的杂环化合物,在结构上是嘌呤的生物等排体,通常作为抗肿瘤药物设计的模板,具有如抗癌、抗炎、抗菌、抗病毒、抗氧化及抑制血小板聚集等多种生物活性[12-16],在不同的疾病中起着重要的作用,近年来尤以其抗肿瘤作用而备受瞩目。
4、活性亚结构拼接作为强效抗肿瘤药物新实体设计的有效工具,为多靶点药物的研发提供了新的思路[17]。根据拼合原理将两个或多个药物药效基团通过化学键进行连接得到一个新分子,所形成的拼合分子通常会继承参与拼合的药效基团的药理活性,并同时降低药效基团的毒副作用[18]。
5、基于以上原因,我们基于布洛芬先导化合物,设计、合成了三种系列的呋喃并嘧啶-布洛芬杂合衍生物,即呋喃并嘧啶并三唑-布洛芬杂合衍生物(10a-10h和12a-12b);呋喃并嘧啶-酰肼(双酰肼)-布洛芬杂合衍生物(11a-11g和13a-13m);呋喃并[2,3-d]嘧啶-1,3,4-噁二唑-布洛芬杂合衍生物(13a-13m)。通过cck8法,分别测试了三类目标化合物对a549肺癌细胞、hepg2肝癌细胞系的增殖抑制活性。结果显示目标化合物对两种细胞都显示出良好的增殖抑制活性,其中化合物10h、12a、13c对肺癌细胞(a549)的活性最为优异,ic50分别为0.039μm、0.038μm、0.068μm。化合物10c、13c、13i对肝癌细胞(hepg2)的活性最为优异,ic50分别为0.021μm、0.144μm、0.232μm,均优于对照药物吉非替尼。
6、参考文献
7、[1]刘宗超,李哲轩,张阳,周彤,张婧莹,游伟程,潘凯枫,李文庆.2020全球癌症统计报告解读[j].肿瘤综合治疗电子杂志,2021,7(02):1-14.
8、[2]karki r,man sm,kanneganti td.inflammasomes and cancer[j].cancerimmunol res.2017;5(2):94-99.
9、[3]chung c,seo w,silwal p,jo ek.crosstalks between inflammasome andautophagy in cancer[j].jhematol oncol.2020;13(1):100.
10、[4]姚静,胡容,郭青龙.炎症与癌症的发生发展[j].药物生物技术,2011,18(04):372-376.
11、[5]张霄鹏,徐志.布洛芬的合成及应用研究进展[j].国外医药(抗生素分册),2020,41(5):404-410.
12、[6]irvine j,afrose a,islam n.formulation and delivery strategies ofibuprofen:challenges and opportunities[j].drug dev indpharm,2018,44(2):173-183.
13、[7]samik bindu,somnath mazumder,uday bandyopadhyay.non-steroidalanti-inflammatory drugs(nsaids)andorgan damage:acurrentperspective[j].biochemicalpharmacology,2020,180:114174.
14、[8]sakr asmaa,rezq samar,ibrahim samy m,soliman eman,baraka mohamedm,romero damian g,kothayer hend.design and synthesis of novel quinazolinonesconjugated ibuprofen,indole acetamide,or thioacetohydrazide as selective cox-2inhibitors:anti-inflammatory,analgesic and anticancer activities.[j].journalofenzyme inhibition andmedicinal chemistry,2021,36(1):1810-1828.
15、[9]罗潇,朱玉超,霍童雨,焦宁.基于布洛芬的结构修饰研究进展[j].中国医药工业杂志,2018,49(06):707-721.
16、[10]ghanimam,girgis as,kariuki bm,et al.design and synthesisofibuprofen-quinoline conjugates as potential anti-inflammatory andanalgesicdrugcandidates[j].bioorg chem.2022;119:105557.
17、[11]shokri bahareh,zarghi afshin,shahhoseini soraya,mohammadi reza,kobarfard farzad.design,synthesis and biological evaluation of peptide-nsaidconjugates for targeted cancer therapy[j].archiv der pharmazie,2019,352(8):1800379.
18、[12]yazhou wang,wei huang,minhang xin,pan chen,li gui,xinxin zhao,xinrong zhu,hongpeng luo,xin cong,jia wang,fei liu.discovery ofpotent anti-inflammatory 4-(4,5,6,7-tetrahydrofuro[3,2-c]pyridin-2-yl)pyrimidin-2-aminesfor use as janus kinase inhibitors[j].bioorganic&medicinal chemistry,2019,27(12):2592-2597.
19、[13]simon hayek,nicolas pietrancosta,anna a.hovhannisyan,rodolphealves de sousa,nassima bekaddour,laura ermellino,enzo tramontano,stéphaniearnould,claude sardet,julien dairou,olivier diaz,vincent lotteau,sébastiennisole,gagik melikyan,jean-philippe herbeuval.cerpegin-derived furo[3,4-c]pyridine-3,4(1h,5h)-diones enhance cellular response to interferons by denovo pyrimidine biosynthesis inhibition[j].europeanjournal ofmedicinalchemistry,2020,186(15):111855.
20、[14]sirakanyan samveln,spinelli domenico,geronikakiathina,hakobyanelmirak,sahakyanharutyun,arabyan erik,zakaryan hovakim,nersesyanlusine e,aharonyan anahit s,danielyan irina s,muradyan rafayel e,hovakimyananush a.synthesis,antitumor activity,and docking analysis of new pyrido[3',2':4,5]furo(thieno)[3,2-d]pyrimidin-8-amines.[j].molecules(basel,switzerland),2019,24(21):3952.
21、[15]mai a m,lasheen d s,gaber h m,et al.elaborating piperazinyl-furopyrimidine based scaffolds as phosphoinositol-3-kinase enzyme alpha(pi3kα)inhibitors to combatpancreatic cancer[j].rsc advances,2020,10(53):32103-32112.
22、[16]monia hossam,deena s.lasheen,nasser s m.ismail,ahmed esmat,ahmedm.mansour,abdel nasser b.singab,khaled a m.abouzid.discovery of anilino-furo[2,3-d]pyrimidine derivatives as dual inhibitors of egfr/her2 tyrosine kinaseand their anticancer activity[j].european journal of medicinal chemistry,2018,144:330-348.
23、[17]康璐.香豆素查耳酮杂合衍生物的合成及对胆碱酯酶作用的研究[d].湖南大学,2018.
24、[18]刘敏,章文军,高宁.拼合原理及其在新药设计中的应用[j].化学试剂,2009,31(10):795-797.
技术实现思路
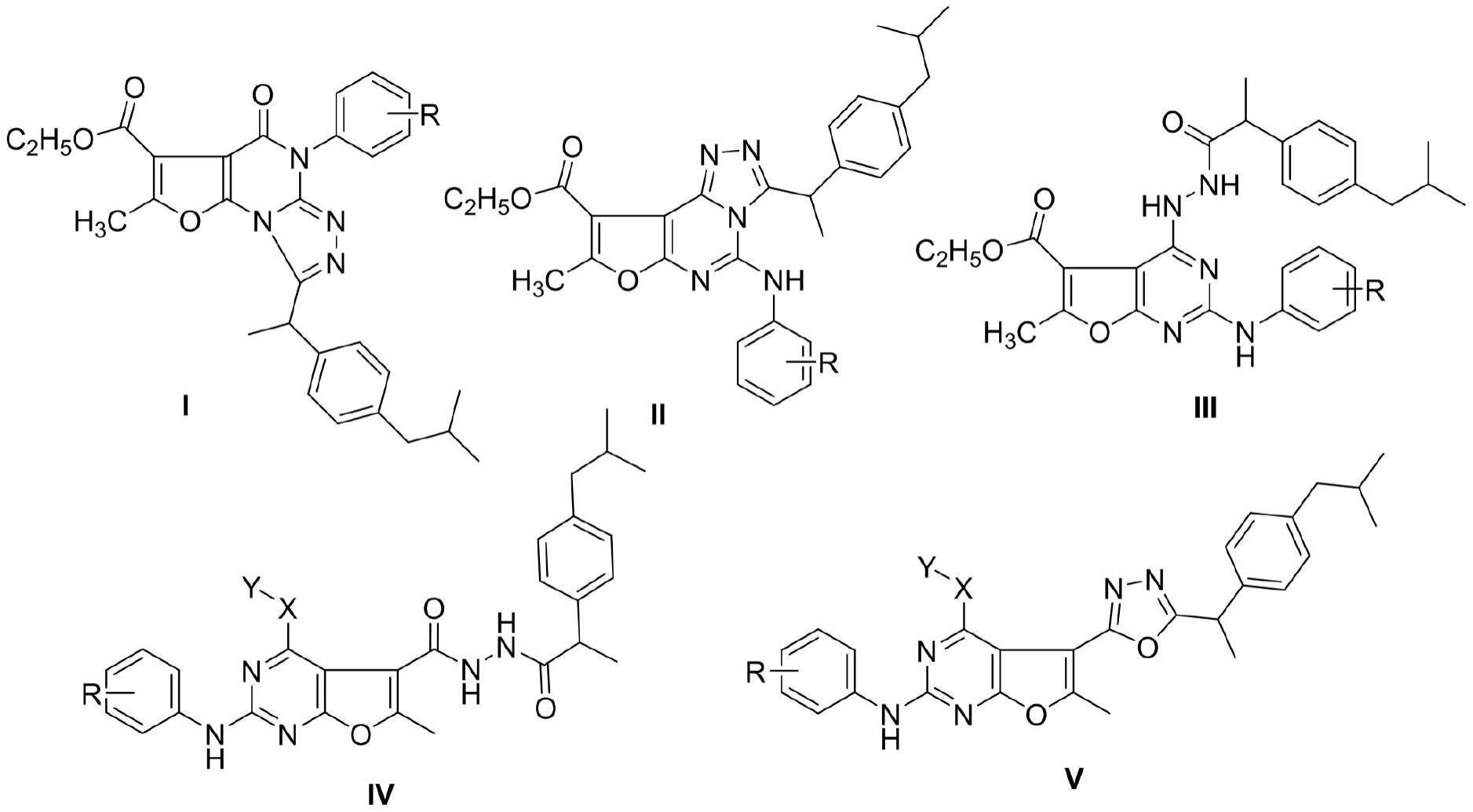
1、本发明提供了一种几种呋喃并嘧啶-布洛芬杂合衍生物的合成方法及抗肿瘤的应用,该类化合物以布洛芬为先导化合物,2-氨基-5-甲基-呋喃-3,4-二甲酸乙酯等起始原料,运用aza-wittig反应等反应,在乙醇钠,三氯氧磷,碳酸钾等催化下,设计合成了呋喃并嘧啶并三唑-布洛芬杂合衍生物(10a-10h和12a-12b);呋喃并嘧啶-酰肼(双酰肼)-布洛芬杂合衍生物(11a-11g和13a-13m);通过cck8法体外药效学试验证明目标化合物对a549肺癌细胞、hepg2肝癌细胞系的增殖抑制活性。
2、1.本发明所述的不同系列的呋喃并嘧啶-布洛芬杂合衍生物,其特征在于该类化合物的结构如下所示:
3、1.1呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-布洛芬杂合衍生物(10a-10h)
4、
5、1.2呋喃并[2,3-d]嘧啶-布洛芬-酰肼杂合衍生物(11a-11g)
6、
7、
8、1.3呋喃并[2,3-d]嘧啶--布洛芬-双酰肼杂合衍生物(13a-13m)
9、
10、1.4呋喃并[2,3-d]嘧啶-1,3,4-噁二唑-布洛芬类化合物(14a-14e)
11、
12、其中:
13、化合物10a为2-甲基-4-酮-5-苯基-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
14、化合物10b为2-甲基-4-酮-5-对甲苯基-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
15、化合物10c为2-甲基-4-酮-5-(4-氟苯基)-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
16、化合物10d为2-甲基-4-酮-5-(3,5-二甲基苯基)-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
17、化合物10e为2-甲基-4-酮-5-间甲苯基-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
18、化合物10f为2-甲基-4-酮-5-(5-氯-2-甲基苯基)-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
19、化合物10g为2-甲基-4-酮-5-(3-氯-4-甲基苯基)-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
20、化合物10h为2-甲基-4-酮-5-(4-三氟甲氧基苯基)-8-(1-(4-异丁基苯基)乙基)-呋喃并[3,2-e][1,3,4]三唑并[1,5-a]嘧啶-3-甲酸乙酯
21、化合物11a为4-((2-(4-异丁基苯基)丙酰基)肼基)-2-(间甲基苯基氨基)-6-甲基-呋喃并[2,3-d]嘧啶-5-甲酸乙酯
22、化合物11b为4-((2-(4-异丁基苯基)丙酰基)肼基)-2-(对甲基苯基氨基)-6-甲基-呋喃并[2,3-d]嘧啶-5-甲酸乙酯
23、化合物11c为4-((2-(4-异丁基苯基)丙酰基)肼基)-2-(3,5-二甲基苯基氨基)-6-甲基-呋喃并[2,3-d]嘧啶-5-甲酸乙酯
24、化合物11d为4-((2-(4-异丁基苯基)丙酰基)肼基)-2-(3,4-二氯苯基氨基)-6-甲基-呋喃并[2,3-d]嘧啶-5-甲酸乙酯
25、化合物11e为4-((2-(4-异丁基苯基)丙酰基)肼基)-2-(4-三氟甲氧基苯基氨基)-6-甲基-呋喃并[2,3-d]嘧啶-5-甲酸乙酯
26、化合物11f为4-((2-(4-异丁基苯基)丙酰基)肼基)-2-(4-氯苯基氨基)-6-甲基-呋喃并[2,3-d]嘧啶-5-甲酸乙酯
27、化合物11g为4-((2-(4-异丁基苯基)丙酰基)肼基)-2-(4-氟苯基氨基)-6-甲基-呋喃并[2,3-d]嘧啶-5-甲酸乙酯
28、化合物12a为8-甲基-5-(苯基氨基)-3-(1-(4-异丁基苯基)乙基)呋喃并[3,2-e][1,3,4]三唑并[1,5-c]嘧啶-9-甲酸乙酯
29、化合物12b为8-甲基-5-(5-氯-2甲基苯基氨基)-3-(1-(4-异丁基苯基)乙基)呋喃并[3,2-e][1,3,4]三唑并[1,5-c]嘧啶-9-甲酸乙酯
30、化合物13a为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-吗啉-2-(苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
31、化合物13b为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-吗啉-2-(对苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
32、化合物13c为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-(4-甲基派嗪-1-基)-2-(苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
33、化合物13d为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-二乙胺基-2-(对苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
34、化合物13e为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-(4-甲基派嗪-1-基)-2-(4-(三氟甲氧基)苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
35、化合物13f为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-二正丙胺基-2-(对苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
36、化合物13g为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-二乙胺基-2-(苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
37、化合物13h为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-吗啉-2-(4-氯苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
38、化合物13i为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-(4-甲基派嗪-1-基)-2-(5-氯-2甲基苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
39、化合物13j为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-吗啉-2-(3-氯-4-甲基苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
40、化合物13k为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-吗啉-2-(间甲基苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
41、化合物13l为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-二乙胺基-2-(5-氯-2-甲基苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
42、化合物13m为n’-(2-(4-异丁基苯基)丙酰基)-6-甲基-4-(4-甲基派嗪-1-基)-2-(对甲基苯基氨基)呋喃并[2,3-d]嘧啶-5-碳酰肼
43、化合物14a为5-(5-(1-(4-异丁基苯基)乙基)-1,3,4-噁二唑基-2-基)-6-甲基-4-吗啉-n-p-对苯基呋喃并[2,3-d]嘧啶-2-胺
44、化合物14b为n4,n4-二乙基-5-(5-(1-(4-异丁基苯基)乙基)-1,3,4-噁二唑基-2-基)-6-甲基-n2-苯基呋喃并[2,3-d]嘧啶-2,4-二胺
45、化合物14c为5-(5-(1-(4-异丁基苯基)乙基)-1,3,4-噁二唑基-2-基)-6-甲基-4-吗啉-n-苯基呋喃并[2,3-d]嘧啶-2-胺
46、化合物14d为n-(4-氯苯基)-5-(5-(1-(4-异丁基苯基)乙基)-1,3,4-噁二唑基-2-基)-6-甲基-4-吗啉基呋喃并[2,3-d]嘧啶-2-胺
47、化合物14e为n-(3-氯-4-甲基苯基)-5-(5-(1-(4-异丁基苯基)乙基)-1,3,4-噁二唑基-2-基)-6-甲基-4-吗啉基呋喃并[2,3-d]嘧啶-2-胺
48、本发明还提供了一种几种呋喃并嘧啶-布洛芬杂合衍生物的抗肿瘤的应用,具体是:三系列呋喃并嘧啶-布洛芬杂合衍生物10a-10h、11a-11g、12a-12b、13a-13m和14a-14e在制备抗肿瘤药物中的应用。
49、进一步地,化合物对a549肺癌细胞、hepg2肝癌细胞都表现出潜在的抗肿瘤活性,其中化合物10h、12a、13c对肺癌细胞(a549)的活性最为优异,ic50分别为0.039μm、0.038μm、0.068μm。化合物10c、13c、13i对肝癌细胞(hepg2)的活性最为优异,ic50分别为0.021μm、0.144μm、0.232μm。均优于对照药物吉非替尼的抗肿瘤作用。
50、有益效果:
51、本发明所述的一种几种呋喃并嘧啶-布洛芬杂合衍生物的合成方法及抗肿瘤的应用,涉及基于布洛芬先导化合物和呋喃并嘧啶药效骨架,应该aza-wittig反应、分子内环化、取代反应、水解酸化反应等反应,以稠合三氮唑、酰肼、双酰肼、噁二唑为键桥键链接,制备方法简单,高效的合成了不同系列的呋喃并嘧啶-布洛芬杂合衍生物。通过cck8法体外药效学试验证明目标化合物对a549肺癌细胞、hepg2肝癌细胞系的增殖抑制活性。测试结果显示目标化合物对两种细胞都显示出良好的增殖抑制活性,其中化合物10h、12a、13a对肺癌细胞(a549)的活性最为优异,ic50分别为0.039μm、0.038μm、0.068μm。化合物10c、13c、13i对肝癌细胞(hepg2)的活性最为优异,ic50分别为0.021μm、0.144μm、0.232μm,均优于对照药物吉非替尼。
- 还没有人留言评论。精彩留言会获得点赞!