一种基于多西环素诱导介导型CRISPR基因敲入技术的药物筛选方法与流程
本发明涉及生物,特别是涉及一种基于多西环素诱导介导型crispr基因敲入技术的药物筛选方法。
背景技术:
1、药物发现计划启动来源于当疾病或临床状况出现时,现有药物没办法满足新的疾病需求,正是这种未满足的临床需求是项目的潜在驱动力。新药研发从无到有,要历经药物发现、临床前研究和临床试验“三部曲”,最后用于疾病治疗。然而在传统的医药研发中,新候选药物的发现和测试通常需要十多年的时间,与药物发现过程相关的总成本可能超过10亿美元。此外,只有少数候选药物能够真正上市,一种新药真正上市的几率只有五千分之一。新药开发的高成本和漫长的努力也使药物开发成为制药公司的一项冒险工作,从而阻碍了新药研发进度。
2、随着生物技术的不断发展,近些年crispr介导的基因编辑已成为新药研发的强大工具已然成为释放潜在药物靶标的关键,将对现代药物发现和开发产生深远影响。截至目前crispr介导的新药研发已经为包括遗传性遗传疾病和病原体感染在内的许多疾病诊疗提供了强有力的支持。通过crispr高通量特点系统性敲除大量候选基因不仅能够同时使用hts检查数百万种化合物加速新药研发,还有助于揭示新的药物靶标和疾病相关性。高通量化合物筛选方法包括生化筛选和基于细胞的筛选。生化筛选主要涉及评估化合物与目标之间的相互作用和结合亲和力,而基于细胞的筛选则利用此类相互作用的功能关系的知识。近年来,crispr改进了基于细胞的筛选,通过准确再现疾病的精确基因组编辑从而构建具有疾病特异性遗传背景的细胞系(永生细胞系、原代细胞和干细胞)和类器官实现快速、经济的模型生成,使研究人员能够对化合物进行高通量筛选进而确定最有效的治疗药物分子。该模式可以彻底改变药物设计、节省时间、降低成本并加速药物发现过程。
3、然而,crispr介导的基因编辑存在潜在的脱靶效应,会对后续的筛选和研究产生无法估量的影响,且基因编辑后的细胞代谢会发生改变等问题也制约着药物研发进度。此外,由于一些疾病是由于基因缺失造成的,而长期过量表达缺失基因会对细胞以及动物生存构成威胁,因此,设计高通量的筛选体系对于药物研发具有重要意义。
4、基于药物筛选体系的现状,本领域需要研究一种可诱导基因编辑模型表达特定靶点从而利于药物筛选的方法,不仅能够在靶细胞特异性诱导表达缺失基因,而且能够对模型的有效性进行指征,从而利于靶点药物的研发和筛选。
技术实现思路
1、为解决上述技术问题,本发明提供的一种基于多西环素诱导介导型crispr基因敲入技术的药物筛选方法,包括以下步骤:
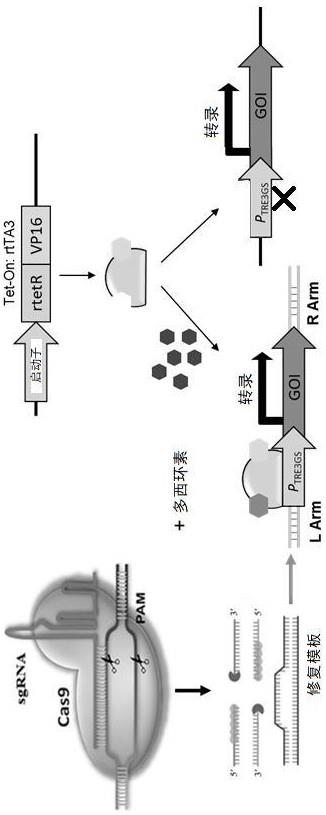
2、步骤1、构建plvx-ef1a-ires-puro-rtta3质粒,所述plvx-ef1a-ires-puro-rtta3质粒的序列如seq id no:1所示,将pspax2质粒、pmd2.g质粒和所述plvx-ef1a-ires-puro-rtta3质粒组成三质粒系统,进行慢病毒包装;
3、步骤2、将步骤1得到的三质粒系统先与jetprime转染试剂缓冲液混匀,涡旋振荡后加入jetprime转染试剂,混匀后瞬离,静置,所得试剂作为转染试剂备用;
4、步骤3、将293ft细胞进行预处理后加入10cm无抗培养皿中,过夜培养后,向所述无抗培养皿中加入步骤2得到的所述转染试剂,进行转染,转染完成后使用嘌呤霉素筛选293ft细胞,再使用连续梯度稀释法将嘌呤霉素筛选后的细胞铺于96孔板进行培养;
5、步骤4、步骤3所得的细胞形成单克隆扩增后提取基因组dna进行pcr测序,检测目标基因rtta3的表达情况,得到目标基因rtta3稳定表达的单克隆细胞系;
6、所述pcr测序使用microgem的prepgem universal基因提取试剂盒完成,每20000个细胞使用10μl 提取试剂来提取基因组dna,pcr酶采用primestar hs dna polymerase;
7、步骤5、构建lenti-v2-gapdh-sgrna质粒和bpk1520-donor-gapdh-egfp-ikzf2质粒,所述lenti-v2-gapdh-sgrna质粒的序列如seq id no:2所示,所述bpk1520-donor-gapdh-egfp-ikzf2质粒的序列如seq id no:3所示;
8、步骤6、使用步骤4得到的稳定表达的rtta3单克隆细胞系共转lenti-v2-gapdh-sgrna质粒和bpk1520-donor-gapdh-egfp-ikzf2质粒,共转完成后使用连续梯度稀释法将细胞铺于96孔板并培养,所述连续梯度稀释法是将细胞消化传代并稀释至密度为每10毫升中有50个细胞,之后取100μl在96孔板中铺板;
9、待细胞形成单克隆扩增后使用pcr方法验证并筛选得到稳定表达的ikzf2 单克隆细胞系;
10、所述pcr测序使用microgem的prepgem universal基因提取试剂盒完成,每20000个细胞使用10μl 提取试剂来提取基因组dna,pcr酶采用primestar hs dna polymerase;
11、步骤7、在步骤6中得到的稳定表达的ikzf2单克隆细胞系中加入多西环素诱导ikzf2表达,使用靶蛋白特异性的抑制剂处理细胞,检测靶蛋白降解趋势、gfp蛋白表达情况和细胞活性,完成药物筛选。
12、具体地,步骤2中,所述三质粒系统中,所述plvx-ef1a-ires-puro-rtta3质粒的用量为10.65 μg,所述pspax2质粒的用量为8.598 μg,所述pmd2.g质粒的用量为2.591 μg。
13、具体地,步骤2中,所述jetprime转染试剂缓冲液的用量为1 ml,所述jetprime转染试剂的用量为三质粒系统中的质粒用量总和的2-3倍。
14、具体地,步骤2中,所述静置的条件为室温下静置10-15 min。
15、具体地,步骤3中,所述预处理是指用胰酶消化293ft细胞并重悬,所述293ft细胞的接种量为10×106。
16、具体地,步骤3中,所述转染试剂均匀打入所述无抗培养皿的底部。
17、具体地,步骤3中,转染的操作包括以下步骤:
18、a1、先在培养箱中培养4-6h,之后更换新鲜的无抗培养基继续培养48-72h;
19、a2、培养结束后收集上清液并置入50ml离心管内,在3000rpm条件下离心10min,分装冻存至-80℃;
20、a3、取1ml步骤a2所得的病毒液,用无血清培养基稀释到moi为1-5并与聚凝胺混匀;
21、a4、取5×105的293ft细胞在6孔板中过夜培养,细胞密度达到70%时,将步骤a3所得的混合液加入细胞中,在37℃条件下置于co2培养箱中培养;
22、a5、培养12-24h后,更换新鲜的无抗培养基继续培养,培养2天后,完成转染。
23、具体地,所述聚凝胺的浓度为6-8μg/ml。
24、具体地,步骤6中,所述共转的操作包括如下步骤:
25、b1、取5×105步骤3获得的rtta3单克隆细胞在6孔板中过夜培养;
26、b2、取200μl的jetprime转染试剂缓冲液,加入lenti-v2-gapdh-sgrna质粒 0.5μg与 bpk1520-donor-gapdh-egfp-ikzf2质粒 2.5μg,涡旋振荡并加入jetprime转染试剂混匀,室温静置10-15 min,所述jetprime转染试剂的用量为所用质粒用量总和的2-3倍;
27、b3、将步骤b2得到的混合液缓慢均匀地打入步骤b1所得细胞的培养基下,晃匀并放入培养箱中培养;
28、b4、培养4-6h后更换新鲜培养基继续培养,培养72h后完成共转。
29、具体地,所述步骤7中,所述靶蛋白特异性的抑制剂为nvp-dky709抑制剂。
30、具体地,所述步骤7中,所述多西环素诱导的操作包括如下步骤:
31、c1、取稳定表达的ikzf2单克隆细胞,并在细胞培养基中加入100 ng/ml的多西环素诱导表达48h;
32、c2、将诱导后的细胞用胰酶消化并重悬于含100 ng/ml的多西环素的细胞培养基中备用;
33、c3、将步骤c2所得细胞铺板在96孔细胞培养板中,并在37℃,5% co2条件的培养箱中过夜培养;
34、c4、将nvp-dky709抑制剂用二甲基亚砜配置成4mm的储存液,并在96孔锥形板中连续稀释nvp-dky709混合液,得到400倍nvp-dky709存储液;
35、c5、取2μl步骤c4所得的400倍nvp-dky709存储液到u型96孔板中,加入78μl步骤c3所得的细胞混匀,得到10倍nvp-dky709母液;
36、c6、取10μl步骤c5所得的10倍nvp-dky709母液加入到96孔细胞培养板中,设置溶媒对照组和空白对照组,再向所有孔中加入90μl步骤c3得到的细胞悬液,使所有孔中二甲基亚砜终浓度为0.25%;
37、c7、将96孔细胞板放回培养箱中培养6 h~24h,随后用荧光显微镜检测gfp蛋白表达结果;
38、c8、将步骤c6中培养24h的细胞培养板置于室温下,使用荧光读板仪检测荧光强度,计算靶蛋白降解趋势。
39、本发明的基于多西环素诱导介导型crispr基因敲入技术的药物筛选方法具有以下有益效果:
40、1、本发明提供的方法,利用多西环素诱导系统与crispr基因敲入技术相结合,在基因组层面上进行编辑,通过增加多西环素诱导介导的方式,有效避免了长期引入外源基因而导致的可能发生的细胞突变等情况,增加了药物筛选体系的稳定性。
41、2、本发明提供的方法,通过引入gfp荧光蛋白检测体系,可实现对基因敲入模型的有效性实现指征,从而克服基因编辑技术潜在的脱靶效应,进一步有利于药物筛选体系的稳定性。
42、3、本发明提供的方法,通过构建bpk1520-donor-gapdh-egfp-ikzf2质粒,改造donor质粒实现了诱导敲除的目的,其中,gapdh内含子、外显子7、外显子8之间内含子部分ttctcatccaagactggctc序列的定点插入不仅不会破坏细胞原有结构还能够引入新的可编辑序列,基因编辑位于内含子区,不改变目的细胞原本的表达谱,更有利于基因敲入和表达的实现。
43、4、本发明提供的药物筛选方法,不仅能够在靶细胞特异性诱导表达缺失基因,而且能够对模型的有效性进行指征,从而利于靶点药物的筛选,进一步助力于新药的研发。
- 还没有人留言评论。精彩留言会获得点赞!