一种3-芳基/烷基-β-萘甲醚类化合物的制备方法与流程
本发明属于有机化合物的合成,涉及一种3-芳基/烷基-β-萘甲醚类化合物的制备。
背景技术:
1、3-芳基/烷基-β-萘醚化合物是众多有机功能分子中的一类重要骨架结构。在天然产物、生物活性药物、有机材料、配体和催化剂的合成等方面具有重要的应用前景。
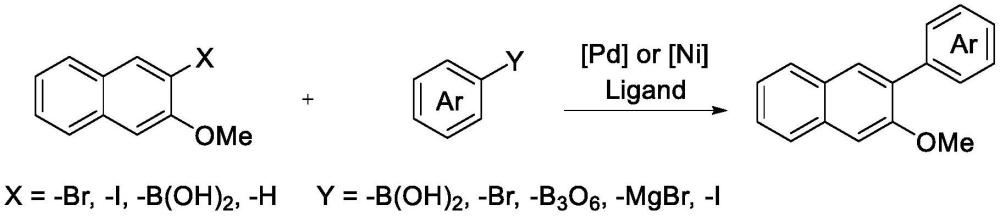
2、由于萘醚化合物具有重要的应用,因此合成多种官能团化的萘醚化合物具有重要的意义。例如,传统的3-芳基-β-萘醚合成方法主要是利用过渡金属催化的芳基卤化物、芳基硼酸、芳基格氏试剂等与含官能团化的萘醚发生c-c偶联反应实现的,如下反应流程所示。
3、
4、尽管上述这些合成方法转化率高和选择性好,在药物合成中具有潜在的价值。但是,这些方法往往需要使用那些设计复杂的配体/催化剂和经历线性多步合成预先官能团化的萘醚类化合物,有时因为使用一些带有对湿气或氧气敏感的官能团的底物而导致操作过程相对复杂。因为官能团化的萘醚种类非常有限,使用上述方法只能合成一些结构简单的3-芳基-β-萘醚。
5、文献调研发现,由于含有炔基的底物易于获得和合成步骤经济的原因,炔烃的环化反应已经成为合成碳环化合物的一种重要而有效的方法。近年来,仅有少数文献报道利用炔烃环化的方式直接合成萘醚类衍生物,例如:
6、(1)2014年,balamurugan课题组报道了一例使用原甲酸三甲酯作为碳源,经三氟甲磺酸催化的分子内环化反应合成多取代α-萘甲醚的新反应。在这个串联反应中,炔基酮与原甲酸三甲酯首先发生三氟甲磺酸催化的缩醛化反应,原位延长一节碳原子生成中间体。然后,经分子内环化反应生成多取代α-萘甲醚:
7、
8、(2)2021年balamurugan课题组报道:在四氟硼酸银催化下,炔基与炔酮经分子内环化反应可以合成多取代α-萘甲醚。在该方法中,底物中的羰基与原甲酸三甲酯反应原位生成缩酮中间体。然后,其炔烃被银活化后发生环化反应和芳构化反应得到多取代α-萘甲醚:
9、
10、(3)2022年zhou课题组报道:碘化亚铜可以催化端炔与邻溴苯乙酮之间的环化反应生成α-萘醚衍生物。该方法首次实现了酮催化的2-溴芳基酮与端炔的环化偶联反应,可以得到中等至优良产率的官能团化的α-萘醚。该反应经历了6-endo-dig环化和c(sp2)-o偶联反应,是从简单起始材料一步合成多官能团取代萘醚的新方法:
11、
12、然而,这些合成方法大多存在着实验操作繁琐、底物预先制备复杂、副反应多、官能团容忍性差等诸多缺陷,并且,他们只能局限于合成α-位的萘醚,对于β-萘醚很难合成。
技术实现思路
1、针对现有技术的不足,本发明的目的在于提供一种3-芳基/烷基-β-萘甲醚类化合物的制备方法。
2、为达此目的,本发明采用以下技术方案:
3、一方面,本发明提供一种3-芳基/烷基-β-萘甲醚类化合物的制备方法,所述制备方法包括以下步骤:
4、原甲酸三甲酯与1,3-二芳基丙酮化合物或1-芳基-3-烷基酮化合物反应,得到3-芳基-β-萘甲醚类化合物或3-烷基-β-萘甲醚类化合物。
5、在本发明中,3-芳基/烷基-β-萘甲醚类化合物中/代表“或”的意思,也就是说3位取代基为芳基或者烷基。
6、优选地,所述原甲酸三甲酯的用量与1,3-二芳基丙酮化合物或1-芳基-3-烷基酮化合物用量摩尔比为1-9:1,例如1:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1、5:1、5.5:1、6:1、7:1、7.5:1、8:1、8.5:1或9:1。
7、优选地,所述1,3-二芳基丙酮化合物的结构如下所示:
8、其中r1和r2独立地选自氢、卤素、c1-c4烷基、c1-c4烷氧基、c6-c12芳基;r1和r2独立存在,或者与所在苯环形成环状结构。
9、优选地,所述环状结构为苯环。
10、优选地,所述1,3-二芳基丙酮化合物选自
11、中的任意一种。
12、优选地,所述1-芳基-3-烷基酮化合物的结构如下所示:
13、其中r3和r4独立地选自氢、c1-c5烷基或c1-c5烷氧基。
14、优选地,所述1-芳基-3-烷基酮化合物选自中的任意一种。
15、优选地,所述反应在酸性试剂存在下进行。
16、优选地,所述酸性试剂为磺酸类化合物中的至少一种。
17、优选地,所述酸性试剂选自三氟甲磺酸、甲基磺酸、氟磺酸或双三氟甲磺酰亚胺中的至少一种,优选为三氟甲磺酸。
18、优选地,所述酸性试剂与1,3-二芳基丙酮化合物或1-芳基-3-烷基酮化合物的摩尔比为0.2-5:1,例如0.2:1、0.5:1、0.8:1、1:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1或5:1。
19、优选地,所述反应在有机溶剂中进行。
20、优选地,所述有机溶剂选自氯代烷烃、芳香烃、腈类或原甲酸三甲酯或三氟甲磺酸中的至少一种。
21、优选地,所述有机溶剂选自1,2-二氯乙烷、二氯甲烷、三氯甲烷、乙腈、乙腈、甲苯、苯甲腈、原甲酸三甲酯或三氟甲磺酸中的至少一种,优选二氯甲烷。
22、优选地,所述反应在空气氛围中进行。
23、优选地,所述反应的温度为15-100℃,例如15℃、20℃、25℃、30℃、35℃、40℃、50℃、60℃、70℃、80℃、90℃或100℃,反应时间为0.5h-12h,例如0.5h、1h、2h、3h、4h、5h、6h、7h、8h、9h、10h、11h或12h。
24、作为本发明的优选技术方案,所述3-芳基/烷基-β-萘甲醚类化合物的制备方法包括以下步骤:
25、原甲酸三甲酯与1,3-二芳基丙酮或1-芳基-3-烷基酮在磺酸类化合物在酸性试剂磺酸类化合物存在下,于有机溶剂中在15-100℃下反应0.5h-12h,得到3-芳基-β-萘甲醚类化合物或3-烷基-β-萘甲醚类化合物,所述磺酸类化合物选自三氟甲磺酸、甲基磺酸、氟磺酸或双三氟甲磺酰亚胺中的至少一种,所述有机溶剂选自1,2-二氯乙烷、二氯甲烷、三氯甲烷、乙腈、乙腈、甲苯、原甲酸三甲酯或三氟甲磺酸中的至少一种;所述原甲酸三甲酯的用量与1,3-二芳基丙酮化合物或1-芳基-3-烷基酮化合物用量摩尔比为1-9:1,所述酸性试剂与1,3-二芳基丙酮化合物或1-芳基-3-烷基酮化合物的摩尔比为0.2-5:1。
26、相对于现有技术,本发明具有以下有益效果:
27、本发明的反应条件温和,原甲酸三甲酯廉价易得,可以同时作为甲基化试剂和延长一节碳链的碳源,反应底物范围广,官能团容忍性好;反应高效,选择性高,后处理简单,操作简便,适合大规模工业化生产;避免了传统反应中预先制备复杂的底物,无需使用传统反应所必需的金属催化,能够高化学选择性的制备联萘酚前体化合物,为烯烃氢甲酰化/氢甲酰酯化反应合成双齿配体提供更简洁高效的路线。
- 还没有人留言评论。精彩留言会获得点赞!