一种生物合成5-氨基-6-氯喹啉的方法及卤化酶突变体
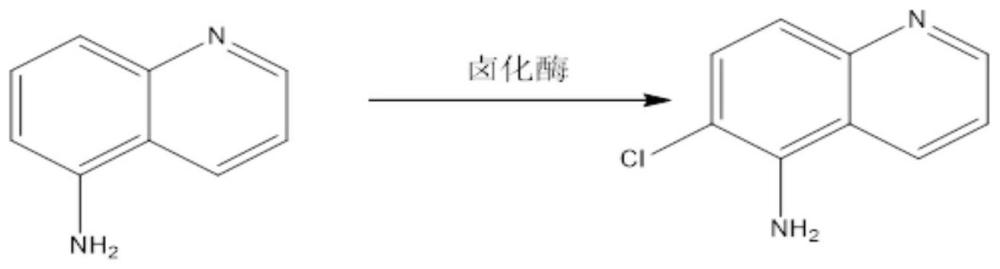
(一)本发明涉及一种生物合成5-氨基-6-氯喹啉的方法及源自微白伦茨氏菌的卤化酶突变体。
背景技术:
0、(二)背景技术
1、5-氨基-6-氯喹啉是一种重要的药物,广泛应用于治疗疟疾和自身免疫性疾病等。5-氨基-6-氯喹啉通过干扰疟原虫的dna复制过程,从而阻止其生长和繁殖,达到治疗的目的。此外,5-氨基-6-氯喹啉还具有抗炎作用。它可以通过抑制炎症介质的释放和调节免疫细胞的活性来减轻炎症反应。这对于治疗自身免疫性疾病,如风湿性关节炎和系统性红斑狼疮等具有重要意义。因此,5-氨基-6-氯喹啉的绿色高效合成受到广泛关注。
2、目前,5-氨基-6-氯喹啉主要通过硝基芳烃的催化还原合成。据报道,pt、pd和rh等贵金属催化剂对硝基芳烃的加氢催化活性高。但在以氢气为还原剂的卤代硝基芳烃氢化过程中,在高转化率、高反应温度下保持其它可还原基团,尤其是卤素基团(f、cl、br和i)的完整仍然具有挑战性。此外,贵金属催化剂的稀缺性和高成本也限制了其应用。生物催化卤化反应具有反应条件温和、立体选择性高、环境友好等特点,越来越受到关注。但是,生物催化5-氨基喹啉卤化制备5-氨基-6-氯喹啉未见报道。
技术实现思路
0、(三)
技术实现要素:
1、本发明目的是提供一种生物催化合成5-氨基-6-氯喹啉的方法及卤化酶突变体。本发明以微白伦茨氏菌(l.aerocolonigenes)来源的卤化酶为催化剂,以5-氨基喹啉为底物,以nadh、fad为辅因子,以黄素还原酶fre为辅酶,以氯化钠为氯离子供体,通过黄素还原酶fre生成fadh2提供还原力催化合成5-氨基-6-氯喹啉,反应条件温和、立体选择性高、环境友好,解决了现有化学合成方法中催化剂稀缺及成本高的问题;同时,本发明以卤化酶改造得到酶活提高的突变体为催化剂,进一步提高了5-氨基-6-氯喹啉的合成能力。
2、本发明采用的技术方案是:
3、本发明提供一种生物催化5-氨基喹啉合成5-氨基-6-氯喹啉的方法,所述方法为:以含卤化酶编码基因的重组基因工程菌经发酵培养获得的湿菌体或湿菌体超声破碎后的粗酶液为催化剂,以5-氨基喹啉为底物,以nadh、fad(黄素腺嘌呤二核苷酸)为辅因子,以黄素还原酶fre为辅酶,以氯化钠为氯离子供体,以ph 7.0~8.0的缓冲液为反应介质构成反应体系,在温度20~45℃、转速500-1200rpm条件下进行转化反应,反应结束后,将反应液分离纯化,获得5-氨基-6-氯喹啉。
4、进一步,所述卤化酶源自微白伦茨氏菌(l.aerocolonigenes),氨基酸序列如seqid no.2所示,编码基因的核苷酸序列如seq id no.1所示。
5、进一步,反应体系中,底物终浓度为200-1000μm(优选100-500μm,更优选500μm),nadh终浓度1-2.5mm(优选2mm),fad终浓度5-25μm(优选10μm),黄素还原酶fre终浓度以蛋白含量计为5-20μm(优选10μm),氯化钠终浓度为0.1-2mm(优选0.1-1mm,更优选1mm),催化剂用量以湿菌体重量计为10-100g/l(优选20-50g/l,最优选50g/l)。
6、进一步,所述催化剂按如下方法制备:
7、1)斜面培养:将含卤化酶编码基因的重组基因工程菌接种至含50μg/ml卡那霉素的lb固体培养基,在37℃培养16h,获得斜面菌体;所述lb固体培养基终浓度组成为:蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,20g/l琼脂,溶剂为去离子水,ph 7.0;
8、2)种子培养:将斜面菌体接种至含50μg/ml卡那霉素的lb液体培养基,在37℃、180rpm培养8~10h,获得种子液;所述lb液体培养基终浓度组成为:蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,溶剂为去离子水,ph 7.0;
9、3)发酵培养:将种子液以体积浓度1%的接种量接种到含50μg/ml卡那霉素抗性的lb液体培养基中,置于37℃、180rpm下培养至od600值为0.4,加入终浓度0.1mm异丙基-β-d-半乳糖苷或终浓度15g/l乳糖,置于28℃继续培养12h,离心收集湿菌体。
10、进一步,所述黄素还原酶fre以含黄素还原酶fre基因的工程菌经发酵培养获得的湿菌体超声破碎后提取纯化的酶液形式作用,所述黄素还原酶fre基因核苷酸序列如seqid no.5所示,氨基酸序列如seq id no.6所示。
11、进一步,所述黄素还原酶fre的纯酶液按如下步骤制备:将含有黄素还原酶fre基因的大肠杆菌菌株接种至含50μg/ml卡那霉素的lb液体培养基,在37℃、180rpm培养8~10h,获得种子液;将种子液以体积浓度1%的接种量接种到含50μg/ml卡那霉素抗性的lb液体培养基中,置于37℃、180rpm下培养至od600值为0.4,加入终浓度0.1mm异丙基-β-d-半乳糖苷,置于20℃继续培养18h,离心,收集湿菌体;湿菌体用0.1m的pbs缓冲液(ph7.5)混悬,超声破碎(300w、超声2.0s暂停4.0s,超声20min),离心收集上清液,得到粗酶液;将粗酶液上载至ni-nta柱中,先用50mm的pbs缓冲液(ph7.5)洗脱杂蛋白后,再用含300mm咪唑的50mm的pbs缓冲液(ph7.5)将目的蛋白从镍柱中洗脱,洗脱速度2.5ml/min,洗脱3个柱体积,收集流出液,获得黄素还原酶fre的纯酶液。
12、进一步,所述反应介质为25mm hepes缓冲液(ph 8.0)。优选反应条件为30℃、1100rpm。
13、本发明还提供一种用于生物催化5-氨基喹啉合成5-氨基-6-氯喹啉的卤化酶突变体,所述卤化酶突变体是将seq id no.2所示卤化酶的氨基酸序列的第112位进行单突变获得的。本发明将来源于微白伦茨氏菌(l.aerocolonigenes)的卤化酶基因克隆至大肠杆菌,进一步从大肠杆菌中提取含卤化酶基因的质粒,设计定点突变引物,使用pcr方法对卤化酶的核苷酸序列进行突变,通过筛选获得活力提高的突变体。
14、进一步,优选所述卤化酶突变体是将seq id no.2所示卤化酶的氨基酸序列的第112位甘氨酸突变为谷氨酸,所述突变体氨基酸序列如seq id no.4所示,编码基因核苷酸序列如seq id no.3所示。
15、本发明所述卤化酶突变体作为催化剂生物合成5-氨基-6-氯喹啉,所述催化剂是以含卤化酶突变体编码基因的重组基因工程菌经发酵培养获得的湿菌体或湿菌体超声破碎后的粗酶液,制备方法同卤化酶。
16、本发明还涉及卤化酶或其突变体的编码基因,编码基因构建的重组载体及基因工程菌。所述卤化酶的氨基酸序列如seq id no.2所示,所述卤化酶突变体氨基酸序列如seqid no.4所示。
17、本发明可通过本领域常规方法将本发明的卤化酶及其突变体的核苷酸序列连接于各种载体上构建而成。本发明的重组载体没有限制,只要其可以在原核和/或真核细胞的各种宿主细胞中保持其复制或自主复制,所述载体可为本领域常规的各种载体,如各种质粒、噬菌体或病毒载体等,优选pet-28a。较佳地,可通过下述方法获得本发明的重组表达载体:将野生型卤化酶及突变体基因与载体pet-28a连接,构建本发明的卤化酶野生型和突变基因重组表达质粒pet28a-rebh和pet28a-rebh-g112e。
18、引入编码本发明的卤化酶及其突变体的dna的宿主细胞没有限制,只要已经为其建立了重组表达系统,满足重组表达载体可以稳定自我复制且所携带的本发明的卤化酶及突变基因可以有效表达。例如大肠杆菌、枯草芽孢杆菌、酵母菌等。本发明优选大肠杆菌,更优选大肠杆菌e.coli bl21(de3)。将重组质粒pet28a-rebh和pet28a-rebh-g112e转化至e.coli bl21(de3)中,获得工程菌e.coli bl21(de3)/pet28a-rebh和e.coli bl21(de3)/pet28a-rebh-g112e。
19、本发明重组卤化酶及其突变体的制备包括培养本发明的重组表达转化体,诱导获得重组卤化酶及突变蛋白。其中,所述的培养重组表达转化体所用的培养基可以是本领域可使转化体生长并产生本发明的卤化酶的培养基,优选lb培养基:蛋白胨10g/l,酵母膏5g/l,氯化钠10g/l,溶剂为去离子水,ph 7.2。培养方法和培养条件没有特殊限制,只要使转化体能够生长并产生菌体即可。优选下述方法:将本发明涉及的重组e.coli bl21(de3)/pet28a-rebh和e.coli bl21(de3)/pet28a-rebh-g112e接种至含50μg/ml卡那霉素的lb培养基中,37℃培养至光密度od600达到0.4~1(优选0.4)时,在终浓度为0.1~1.0mm(优选1.0mm)异丙基-β-d-硫代吡喃半乳糖苷(iptg)的诱导下,即可高效表达本发明的卤化酶及其突变蛋白。
20、与现有技术相比,本发明有益效果主要体现在:本发明采用微白伦茨氏菌卤化酶作为催化剂生物催化合成5-氨基-6-氯喹啉的方法,底物和酶“一锅法”反应,直接得到终产物5-氨基-6-氯喹啉,工业成本低,转化率达到81.6%;初始原料为5-氨基喹啉,价格便宜;同时所需的微白伦茨氏菌卤化酶,可通过构建大肠杆菌基因工程菌,然后通过发酵大量制备,相对易得和廉价。本发明所提供的活力提高的卤化酶突变体,与野生型相比较,酶活力提升20%,达到218u/g,反应24小时后产物积累量提高20%,转化率达到92.3%。
- 还没有人留言评论。精彩留言会获得点赞!