一种2’-脱氧-2-氟腺苷的双酶催化制备方法与流程
本发明涉及2’-脱氧-2-氟腺苷的酶催化,具体涉及到一种2’-脱氧-2-氟腺苷的双酶催化制备方法。
背景技术:
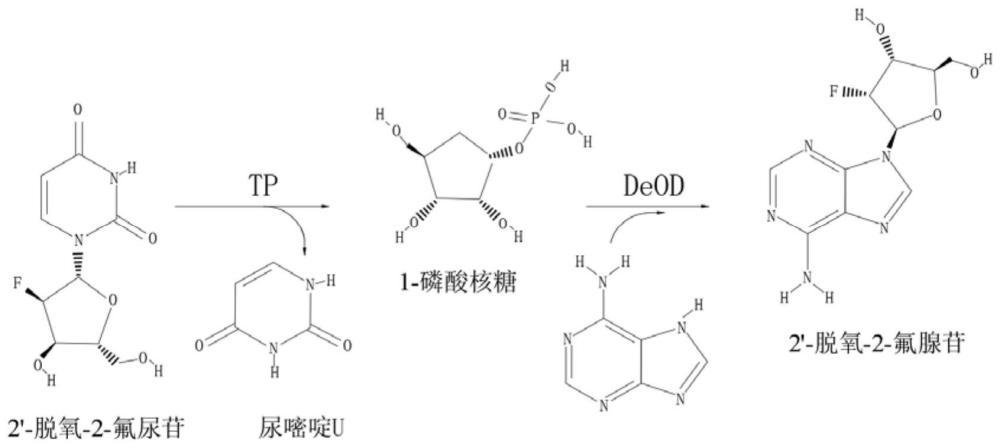
1、2'-脱氧-2-氟腺苷(2'-deoxy-2'-fluoro-d-adenosine,2'-f-dar)是一种修饰的核苷酸,其结构特征在于腺嘌呤核苷的2'-碳上取代了氢原子,而且这里是氟原子。这种修饰使得该核苷酸在rna分子中的应用具有一些独特的性质和优势。
2、2'-脱氧-2-氟腺苷及其衍生物在抗病毒药物的研发中也有应用。由于rna在一些病毒的复制中起着关键作用,通过设计能够特异性与目标rna结合的分子,可以干扰病毒的复制过程,从而具有抗病毒的潜力。比如说,2'-氟-2'-脱氧腺苷可作为有机合成中间体和医药中间体,主要用作实验室研发过程和化工生产过程中。生物活性2′-deoxy-2′-fluoroadenosine可用于合成可与rna杂交的2'-脱氧-2'chemicalbook-氟修饰的寡核苷酸。
3、经研究得到,2′-deoxy-2′-fluoroadenosine能被大肠杆菌嘌呤核苷磷酸化酶(pnp)有效地裂解成毒性物2-氟腺嘌呤(fade),对表达大肠杆菌pnp的肿瘤表现出良好的体内活性。
4、上述研究表明2'-f-dar(2'-脱氧-2'-氟腺苷)在存在大肠杆菌嘌呤核苷磷酸化酶(pnp)时,可以被有效地磷酸化并裂解成毒性物质2-氟腺嘌呤(fade)。这个过程对表达大肠杆菌pnp的肿瘤显示出良好的体内活性,具体原因如下:
5、选择性杀伤肿瘤细胞: pnp是一种嘌呤代谢酶,在大肠杆菌中催化嘌呤核苷的磷酸化反应。通过引入2'-f-dar并表达pnp,可以实现对肿瘤细胞的选择性杀伤。正常细胞可能没有足够的pnp表达,因此对它们的影响相对较小,而pnp表达丰富的肿瘤细胞则能够有效地将2'-f-dar转化为毒性的fade。
6、活性物质释放: 2'-f-dar在被磷酸化后被裂解成2-氟腺嘌呤(fade),这是一种具有毒性的嘌呤类化合物。fade可能会导致细胞死亡,从而对肿瘤细胞产生毒性效应。这种方式的活性物质释放可以提高药物的局部浓度,增强治疗效果。
7、生物安全性: 大肠杆菌是一种广泛用于生物学研究的微生物,而pnp是其天然的嘌呤代谢酶之一。因此,通过利用大肠杆菌的代谢途径来处理2'-f-dar,可以提高治疗的生物安全性。这样的方法可能会减少对宿主细胞的不良影响,从而提高治疗的安全性。
8、传统的2'-f-dar的生产采用化学合成的方式。通常涉及多个步骤的有机化学合成过程。虽然合成路线可能因研究者、公司或生产者的具体选择而有所不同,但通常会包含以下一般步骤:
9、腺苷保护基的引入: 合成通常从腺苷出发,因此首先需要引入适当的保护基,以防止在合成过程中受到不必要的干扰。这可能涉及在特定官能团上引入临时的化学保护基。
10、2'-脱氧化反应: 下一步通常是通过去氧核糖骨架上的2'-碳,生成2'-脱氧核苷。
11、2'-氟化反应: 在已经得到的2'-脱氧核苷上引入氟原子,从而生成2'-脱氧-2'-氟核苷。
12、去保护基: 在氟原子引入后,需要去除腺苷中的保护基,以还原成活性形式。
13、其他功能基团修饰: 根据具体的设计需求,可能还需要在分子中引入其他功能基团,以满足所需的性质。
14、这种化学合成方式在一定程度上解决了量产的问题,然而,这种化学合成方式中有些方法会涉及多个中间体的合成和纯化步骤,这可能使合成过程相对繁琐和时间耗费较多,存在收率低、环境污染严重、成本高的问题。
15、值得注意的是,为了提高合成效率和产率,有时候会采用新型的有机合成方法或生物酶法,以简化步骤或提高产物纯度。尽管如此,合成2'-f-dar仍然通常是一个相对复杂的有机合成过程。
16、生物酶法具有如下特点:
17、催化剂: 使用生物酶作为催化剂,如酶(enzyme)。
18、选择性: 酶通常对底物非常具有选择性,可以催化特定的反应,而不产生不需要的副产物。
19、反应条件: 通常在相对温和的条件下进行,通常在生物体温范围内。ph值和温度条件相对温和,有助于维持催化活性。
20、环境友好性: 生物酶法通常对环境友好,减少了对有毒溶剂和高温高压反应条件的依赖。
21、底物范围: 生物酶对底物的适应性较强,但有时候可能会受到特定的酶底物范围的限制。
22、对此,本发明提出一种2’-脱氧-2-氟腺苷的双酶催化制备方法。
技术实现思路
1、针对现有技术所存在的不足,本发明目的在于提出一种2’-脱氧-2-氟腺苷的双酶催化制备方法,具体方案如下:
2、一种2'-脱氧-2-氟腺苷的双酶催化制备方法,所述制备方法为:
3、将 ectp粗酶液、pnp粗酶液、 2'-f-dur和腺嘌呤a混合成混合液,再将混合液进行催化反应,得产物,产物即 2'-脱氧-2-氟腺苷。
4、进一步的, pnp粗酶液采用expnp粗酶液、bhpnp粗酶液或者ahdeod粗酶液。
5、进一步的,所述ectp粗酶液的制备过程包括如下步骤:
6、ectp基因片段重组到puc57载体上,得到重组载体ectp;
7、重组载体ectp经限制性内切酶xhoⅰ和speⅰ双酶切后,得酶切片段ectp;
8、酶切片段ectp与表达载体pbad-hisb在t4 dna连接酶作用下连接过夜,得连接液ectp;
9、连接液ectp转化top10感受态细胞,得到阳性重组质粒pbad-ectp;
10、将阳性重组质粒pbad-ectp转化表达宿主菌大肠杆菌bw25113,得到原核表达菌株pbad-ectp- bw25113;
11、原核表达菌株pbad-ectp-bw25113在加有终浓度为50μg/ml链霉素的5ml 2yt液体培养基中振荡培养过夜后,按体积比1%比例接种于含有终浓度为50μg/ml链霉素的100ml2yt液体培养基中振荡培养,得到培养液ectp;
12、待培养液ectp的od600为0.8-1.0之间时,加入终浓度为0.2 mm的诱导剂阿拉伯糖诱导过夜得诱导菌体ectp;
13、诱导菌体ectp离心后,收集菌体,悬浮于50mm tris-hcl ph7.0缓冲液中,超声破碎,得到ectp粗酶液。
14、进一步的,所述ahdeod粗酶液的制备过程包括如下步骤:
15、ahdeod基因片段重组到puc57载体上,得到重组载体ahdeod;
16、重组载体ahdeod经限制性内切酶xhoⅰ和speⅰ双酶切后,酶切片段ahdeod;
17、酶切片段ahdeod与表达载体pbad-hisb在t4 dna连接酶作用下连接过夜,得连接液ahdeod;
18、连接液ahdeod转化top10感受态细胞,得到阳性重组质粒pbad-ahdeod;
19、将阳性重组质粒pbad-ahdeod转化表达宿主菌大肠杆菌bw25113,得到原核表达菌株pbad-ahdeod- bw25113;
20、原核表达菌株pbad-ahdeod-bw25113在加有终浓度为50μg/ml链霉素的5ml 2yt液体培养基中振荡培养过夜后,按体积比1%比例接种于含有终浓度为50μg/ml链霉素的100ml2yt液体培养基中振荡培养,得到培养液ahdeod;
21、待培养液ahdeod的od600为0.8-1.0之间时,加入终浓度为0.2 mm的诱导剂阿拉伯糖诱导过夜得诱导菌体ahdeod;
22、诱导菌体ahdeod离心后,收集菌体,悬浮于50mm tris-hcl ph7.0缓冲液中,超声破碎,得到ahdeod粗酶液。
23、进一步的,所述expnp粗酶液和bhpnp粗酶液的制备过程与ahdeod粗酶液的制备过程一致。
24、进一步的,所述ectp基因片段的氨基酸序列如序列表seq id no.1所示。
25、进一步的,所述ahdeod基因片段的氨基酸序列如序列表seq id no.2所示,所述expnp基因片段的氨基酸序列如序列表seq id no.3所示,所述bhpnp基因片段的氨基酸序列如序列表seq id no.4所示。
26、进一步的,进行连接过夜时,温度设为16℃。
27、进一步的,振荡培养时,培养条件设为37℃、220rpm;
28、进行诱导过夜时,温度设为30℃。
29、进一步的,进行催化反应时,反应条件设为50℃,220rpm,10小时。
30、与现有技术相比,本发明的有益效果如下:
31、(1)采用本发明的方法,不需要纯化酶,直接用分别表达嘌呤核苷磷酸化酶和胸腺嘧啶核苷磷酸化酶的细胞破碎液,在一个反应器内一步反应即可制备2'-f-dar,不涉及中间步骤和反应,极大地简化了工艺流程,降低了生产成本,且设备利用率高。
- 还没有人留言评论。精彩留言会获得点赞!