一种调节巨噬细胞极化的方法
本发明涉及生物医药,具体来说,涉及一种调节巨噬细胞极化的方法。
背景技术:
1、在肿瘤微环境中巨噬细胞是其中一个主要的组成成分,可以分化为不同的功能表型,其中m2型的巨噬细胞可以通过多种机制促进肿瘤的生长。在高级别胶质瘤含有丰富的髓样细胞,在多形性胶质母细胞瘤(gbm)中,肿瘤相关巨噬细胞和小胶质细胞占肿瘤总质量的40%。gbms产生的细胞因子,如巨噬细胞集落刺激因子(m-csf),使巨噬细胞和小胶质细胞向免疫抑制、促进肿瘤生长的m2型极化,m-csf是一种重要的细胞因子,通过其受体csf-1r介导巨噬细胞的分化和功能。m-csf和粒细胞-巨噬细胞集落刺激因子(gm-csf)常用于诱导成熟的巨噬细胞,分别参与向m2或m1表型的极化。干扰素调节因子(irfs)是m-csf和gm-csf诱导巨噬细胞极化能力的基础,irf5激活促进il-12、il-6编码基因的转录,从而与m1极化相关,而irf4缺失导致il-1β和tnfα的产生以及m1标记物的表达增加,表明irf4激活有助于m2极化。
2、巨噬细胞是病毒感染中i型干扰素(ifn)的主要来源,而tank结合激酶1(tbk1)可以介导i型ifn基因的诱导,参与抗病毒先天免疫应答。
3、在树突状细胞中tbk1的缺失抑制了一些干扰素应答基因的表达。此外,条件性敲除tbk1的树突状细胞表现出免疫抑制因子il-10的下调和几种免疫刺激因子的上调,包括il-1β、il-12和il-23。通过调节免疫耐受,树突状细胞中tbk1缺乏可促进肿瘤逃逸。
4、在不同疾病模型的巨噬细胞中,tbk1在其中起着至关重要的抗炎作用。有研究报道将髓系细胞中tbk1特异性敲除的小鼠(mko),在老年时自发发生脂肪肥大和代谢紊乱,与脂肪组织m1型巨噬细胞浸润和促炎细胞因子表达增加有关。
5、在人单核/巨噬细胞中,趋化因子cxcl4和toll样受体8(tlr8)的共刺激可协同激活tbk1-irf5信号,导致炎症基因的增加和炎性小体的激活,这表明靶向tbk1-irf5轴可能对炎症性疾病有益。然而,tbk1在巨噬细胞中的作用,特别是在m-csf刺激的情况下,调节巨噬细胞极化以及与调节irfs的潜在的机制尚不清楚。
技术实现思路
1、(一)解决的技术问题
2、针对现有技术的不足,本发明提供了一种调节巨噬细胞极化的方法,它采用磁珠的细胞分选方案进行细胞分离,制备单细胞悬液后,用抗cd11b粒子标记肿瘤或瘤周组织的阳性细胞,标记后,使用bd imagtm磁性细胞分选仪分离细胞,收集阴性(cd11b-)和阳性(cd11b+)部分进行分析的优点,进而解决了上述背景技术中的问题。
3、(二)技术方案
4、为实现上述,采用磁珠的细胞分选方案进行细胞分离,制备单细胞悬液后,用抗cd11b粒子标记肿瘤或瘤周组织的阳性细胞,标记后,使用bd imagtm磁性细胞分选仪分离细胞,收集阴性(cd11b-)和阳性(cd11b+)部分进行分析的优点,本发明采用的具体技术方案如下:
5、一种调节巨噬细胞极化的方法,它采用磁珠的细胞分选方案进行细胞分离,制备单细胞悬液后,用抗cd11b粒子标记肿瘤或瘤周组织的阳性细胞,标记后,使用bd imagtm磁性细胞分选仪分离细胞,收集阴性(cd11b-)和阳性(cd11b+)部分进行分析,它包含骨髓来源的巨噬细胞、动物模型的建立、免疫印迹实验、免疫荧光染色、免疫组织化学与实时定量pcr分析。
6、骨髓来源的巨噬细胞的获取;用dmem冲洗tbk1fl/fllysm-cre(tbk1-mko)小鼠或tbk1fl/fl野生型(wt)小鼠的胫骨和股骨中的骨髓,将细胞通过70μm尼龙过滤器过滤;在室温下500rpm离心5min后,将细胞重悬于含有10%胎牛血清的dmem/f12中,骨髓细胞在25cm2无菌瓶中以2×106/ml的浓度在dmem/f12中培养;加入巨噬细胞集落刺激因子(m-csf,10ng/ml,peprotech),在37℃、5% co2条件下培养7天,获得分化的巨噬细胞。
7、建立动物模型;其中,动物为tbk1fl/fl小鼠与lysm-cre小鼠,通过tbk1fl/fl小鼠与lysm-cre小鼠杂交,获得tbk1fl/fllysm-cre(以下命名为tbk1-mko)和tbk1fl/fl野生型(wt)小鼠;通过pcr基因型鉴定确定基因型,选择6-8周龄小鼠用于研究,饲养条件为受控条件(光照/黑暗循环12h,相对湿度60%±10%,温度22±1℃)。
8、gbm的动物模型;将gl261细胞接种到c57bl/6小鼠的纹状体中,小鼠用2%戊巴比妥钠(3.3μl/g)静脉注射麻醉,手术区皮肤用碘伏液消毒,并将动物固定在一个小动物立体定向装置中;在眶后1mm、中线右侧2mm处做一个2-3mm的切口,暴露颅骨,使用1ml注射器和26g针在前囟右侧2mm处钻孔,用25μl汉密尔顿注射器注射1×105gl261细胞;注射完成后,等待2-3min后再逐步退出,在缝合皮肤之前用碘伏擦拭头骨;建立皮下(sc)肿瘤模型,将2x106 gl261细胞皮下注射到tbk1fl/fllysm-cre(tbk1-mko)小鼠或tbk1fl/fl野生型(wt)小鼠的腋下,每组2-4只小鼠,实验重复3次。
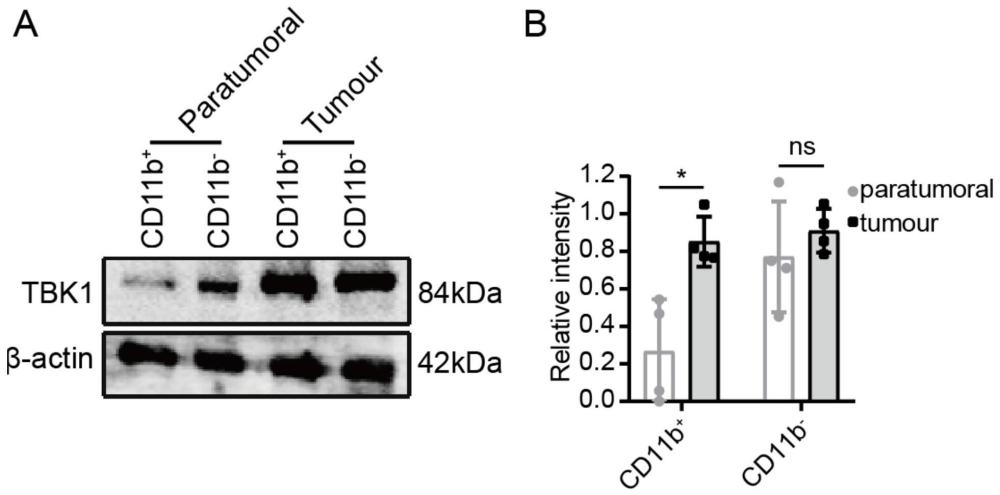
9、免疫印迹;提取细胞的蛋白质,将细胞放入含有磷酸酶抑制剂、蛋白酶抑制剂和pmsf的预冷ripa缓冲液中进行裂解;采用bca蛋白测定试剂盒测定蛋白浓度,在10%或12%的sds-聚丙烯酰胺凝胶上分离,上样量为30μg,随后将其转移到pvdf膜上。将膜与一抗在4℃下孵育过夜,二抗37℃孵育1h后,使用红外成像系统获取图像,检测感兴趣的波段,采用imagej软件进行定量分析。
10、免疫荧光染色;荷瘤小鼠于第3周麻醉,经4%多聚甲醛灌注,切除肿瘤组织,并在4%多聚甲醛中后固定,使用震荡切片机切割为25μm的切片。用马血清封闭30min后,0.3%triton x-100pbs在室温下打孔30min后,加入一抗,在4℃下孵育过夜,切片用荧光二抗孵育1h,并用hoechst33342在37℃的避光容器中进行核染色15min。使用荧光共聚焦显微镜获得图像。
11、免疫组织化学;将wt小鼠中分离的bmdms接种在24孔板的玻片上,单独用m-csf或与tbk1抑制剂一起处理,用4%多聚甲醛固定细胞;用pbs洗涤3次,使用含有10%马血清的0.3%triton x-100pbs进行细胞渗透和阻断30min,在3%过氧化氢中室温孵育15min,将细胞与抗tbk1、磷酸化tbk1、irf5、irf4、inos和arg1的抗体在4℃下孵育过夜。将载玻片与生物素偶联的二抗在室温下孵育1h,然后与hrp偶联的链霉亲和素孵育1h,并以3,3二氨基联苯胺作为显色剂孵育5min,用光镜观察和分析切片。
12、实时定量pcr;提取细胞总rna后,利用逆转录系统合成cdna,用sybr green在m3005p仪器上进行测定,所有样品在95℃反应体系中处理10min,然后在95℃、60℃、72℃分别扩增10s、20s、20s,循环40次,通过δct方法将靶基因的ct水平归一化为gapdh的水平,计算相对基因表达水平,使用δδct方法将数据进一步归一化到实验对照样本(2-δδct)。
13、(三)有益效果
14、与现有技术相比,本发明提供了一种调节巨噬细胞极化的方法,具备以下有益效果:
15、它实现了p-tbk1在m-csf刺激的巨噬细胞中高表达,tbk1的缺失诱导m-csf刺激的巨噬细胞表现出m1样表型,irf4和irf5是tbk1调控m-csf刺激下的巨噬细胞极化的重要转录因子,敲除irf5后,逆转了抑制tbk1对m-csf相关巨噬细胞极化作用的影响。
- 还没有人留言评论。精彩留言会获得点赞!