选择性癌症跟踪去除剂及其用途的制作方法
相关申请的交叉引用
本申请要求2014年11月9日提交的美国临时申请第62/077,312号和2015年11月5日提交的美国非临时申请第14/934,140号的优先权,其公开内容通过引用并入本文。
本发明涉及光动力治疗(photodynamictherapy,pdt)的新形式,其通过本发明的真正的双功能——pdt和成像——钆络合物(gd-n)的设计来实现,其能够特异性地靶向癌症细胞。本发明提供了可以特异性地定位于癌细胞的阴离子细胞膜的pdt药物,其中可以监测其激光激发的光发射信号,而不会在预期激发(dueexcitation)之前引起活性氧——单线态氧(singletoxygen)——的光毒性产生。本发明还提供了gd-n作为肿瘤选择性pdt光敏剂形式的用途。
背景技术:
科学家在开发光动力治疗(pdt)作为癌症的可靠临床治疗中面临肿瘤细胞识别、深度光穿透和原位监测的重大挑战。为了解决穿透深度和分子成像问题,使用近红外(nir)激发(通过多光子/上转换过程)和“生物窗口”(例如第1窗口:600-950nm,第2窗口:1-1.35μm,第3窗口:1.5-1.8μm)内的发射提供了令人满意的分辨率,这是因为nir光子可以深入穿透到组织中并且急剧重新发射,即使在血液介质中也不会被细胞吸收以及引起损伤。可以获得清晰的图像,然后与通常的生物自发荧光背景区分。近来,双光子吸收光动力治疗(tpa-pdt)受到越来越多的关注。基于卟啉的光敏剂被认为是主要的候选物,因为其双光子(tp)诱导的单线态氧(1o2)产生和红/近红外发射(~650和~750nm)非常地有效和强烈。已经在文献中报道了用于tpa-pdt光敏剂的多种设计策略,但是这些化合物中仅有极少数是肿瘤细胞特异性的或已在体外和体内研究,特别关于卟啉和镧系元素。例如,最近已经证明了使用大tp吸收截面的卟啉二聚体通过体内双光子激发pdt选择性关闭血管;还发现两亲性光敏剂的肿瘤选择性与其和负责将卟啉转运到肿瘤组织的低密度脂蛋白有效结合相关。基本上,高分子量卟啉优先在实体瘤上积聚,并预期被内化到膜限制的细胞器中,从而实现在细胞间隔室的受控定位。然而,对于pdt探针与癌细胞接触仍然很困难,尤其与光动力治疗的市售或文献报道的光敏剂有关的两个主要问题是:(i)癌细胞的识别和(ii)其有效性的监测。在这方面,本发明的申请人之前在zhangt,chancf,haojh,lawgl,wongwk和wongkl(2013).fastuptake,water-soluble,mitochondria-specificerbiumcomplexfordualfunctionmolecularprobe-imagingandphotodynamictherapy.rscadv3,382-385中报道了一种特异性磷脂标记——镱-卟啉络合物(yb-n),其与溶液中的阴离子磷脂物质具有很强的结合,并且可以通过长寿命的可见至nir镧系元素发光来鉴定多种癌细胞中的多种阴离子磷脂物质。这种络合物的限制是其不能光产生1o2。没有在对于癌症的干细胞和基因治疗中达到100%效率,为了人类福利,必须探索任何潜在的替代方法。
本发明的目的是提供解决以下三个问题的pdt探针,即(i)癌细胞的识别;(ii)其有效性的监测和(iii)光产生1o2——单线态氧。
技术实现要素:
在本发明的第一方面,提供了一种用于癌细胞的光动力学治疗和成像的组合物,其包含具有以下分子式的钆络合物:
其中ln是gd或卟啉钆(gd-n)或其药学上可接受的盐。
在本发明第一方面的第一个实施方案中,提供了一种用于癌细胞的光动力学治疗和成像的组合物,其中所述癌细胞具有阴离子细胞膜。
在本发明的第二方面,提供了一种使用根据本发明第一方面的组合物的癌细胞的光动力治疗和成像的方法,其中向有需要的受试者施用所述组合物并且使用辐射源照射有需要的受试者中的癌细胞。
在本发明第二方面的第一个实施方案中,提供了根据本发明第一方面的组合物在制备用于受试者中的癌细胞的光动力治疗和成像的药物或试剂中的用途,其中所述药物或试剂的施用是在所述受试者中经静脉内进行或通过注射至所述癌细胞的部位进行。
在本发明第二方面的第二个实施方案中,提供了根据本发明第一方面的组合物在制备用于受试者中的癌细胞的光动力治疗和成像的药物或试剂中的用途,其中在施用所述药物或试剂之后施加辐射源,并且所述辐射源是波长约860nm的光源。
在本发明的第三方面,提供了一种合成根据本发明第一方面的组合物的方法,其包括根据方案1的步骤:
a)(i)gd[n(sime3)2]3-[licl(thf)3]x,甲苯,回流,12h;(ii)na{η5-c5h5)co[p(=o)(ome)2]3},甲苯,rt,1h;b)(i)tbaf(tfif,1m),ch2cl2,rt,30min;(ii)a)4-碘苯酚,pd(pph3)4,cui,thf,net3,40℃,12h;c)四甘醇二碘化物,dmf,k2co3,80℃,8h;d)三乙胺,dmf,85℃,24h.
方案1
其中
步骤a):从gd[n(sime3)2]3·[li(thf)3cl]x的溶液中除去溶剂以形成licl沉淀;将二氯甲烷(ch2cl2)加入到所述licl沉淀中以形成第一混合物,其中将所述第一混合物离心分离以从所述第一混合物中分离澄清层;将所述澄清层转移到溶解在甲苯溶液中的卟啉游离碱tfp-tms中以形成第二混合物;回流所述第二混合物,直到大部分所述游离碱与金属离子配位,以形成经回流的第二混合物;将所述经回流的第二混合物冷却至室温以形成冷却的经回流的第二混合物;将无水na{(η5-c5h5)co[p(=o)(ome)2]3}加入到所述冷却的经回流的第二混合物中以形成第三混合物;搅拌所述第三混合物;从所述第三混合物中除去溶剂以形成第一残余物;将所述第一残余物溶解在ch2cl2中以形成第四混合物;过滤所述第四混合物并使用ch2cl2/己烷作为洗脱液对其进行柱色谱分离以产生gd-tms;
步骤b):将四丁基氟化铵加入到gd-tms在ch2cl2中的溶液中,并搅拌溶液以产生化学反应;在所述化学反应完成后,使所述溶液通过柱色谱以形成第五混合物;'从所述第五混合物中除去溶剂,得到中间体;将所述中间体和4-碘苯酚溶解在无水四氢呋喃和三乙胺中以形成第六混合物;将所述第六混合物与氮混合以形成氮化的第六混合物;将pd(pph3)4和cui加入所述氮化的第六混合物中以形成第七混合物;将所述第七混合物在氮气氛下在至少35℃下搅拌至少10小时以产生经搅拌的第七混合物;从所述经搅拌的第七混合物中除去溶剂以产生第二残余物;使用以ch2cl2/甲醇作为洗脱液的柱色谱纯化所述第二残余物,以产生gd-oh;
步骤c):将无水k2co3加入到gd-oh和四甘醇二碘化物在无水n,n-二甲基甲酰胺中的溶液中以形成第八混合物;将所述第八混合物在氮气氛下加热至至少80℃并持续至少8小时以形成经加热的第八混合物;从所述经加热的第八混合物中除去溶剂以形成第一粗产物;使用通过ch2cl2/ch3oh洗脱的柱色谱纯化所述第一粗产物以产生gd-i,以及
步骤d):将无水net3加入到gd-i在无水dmf中的溶液中以形成第九混合物;将所述第九混合物在氮气氛下加热至至少85℃并持续至少24小时以形成经加热的第九混合物;从所述经加热的第九混合物中除去溶剂,得到第二粗产物;使用以ch2cl2/ch3oh作为洗脱液的第一柱色谱纯化所述第二粗产物,以除去未反应的gd-i和其他杂质,然后使用以ch2cl2/ch3oh作为洗脱液的第二柱色谱进一步纯化,得到gd-n。
在本发明第三方面的第一个实施方案中,提供了一种合成根据本发明第一方面的组合物的方法,其中在真空中进行从给定混合物或溶液中除去溶剂的步骤。
在本发明第三方面的第二个实施方案中,提供了一种合成根据本发明第一方面的组合物的方法,其中步骤b)中将所述第六混合物与氮混合以形成氮化的第六混合物的过程为通过在所述第六混合物中氮气鼓泡至少30分钟。
在本发明第三方面的第三个实施方案中,提供了一种合成根据本发明第一方面的组合物的方法,其中步骤a)至d)中使用柱色谱的过程是硅胶上的柱色谱。
在本发明第三方面的第四个实施方案中,提供了一种合成根据本发明第一方面的组合物的方法,其中步骤d)中利用ch2cl2/ch3oh的柱色谱的体积/体积为80:1,接着10:1。
结合本发明的特定方面、实施方案或实施例描述的特征、整体、特性、化合物、化学部分或基团应理解为适用于本文描述的任何其他方面、实施方案或实施例,除非与其不相容。
本领域技术人员将认识到,除了具体描述的那些之外,易于对本文描述的本发明进行变化和修改。
本发明包括所有这些变化和修改。本发明还包括在说明书中单独地或集体地提及或指示的所有步骤和特征,以及任何和所有组合或任何两个或多个步骤或特征。
在整个本说明书中,除非上下文另有要求,否则词语“包括(comprises)”或诸如“包括(comprises)”或“包括(comprising)”的变体应理解为暗示包括指出的整体或整体的组,但不排除任何其他整体或整体的组。还要指出的是,在本公开中,特别是在权利要求和/或段落中,诸如“包括(comprises)”、“包括(comprised)”、“包括(comprising)”等的术语可以具有在美国专利法中赋予其的含义;例如其可以意指“包含(includes)”、“包含(included)”、“包含(including”)”等等;诸如“基本上由...组成(consistingessentiallyof)”和“基本上由...组成(consistsessentiallyof)”的术语具有美国专利法中赋予其的含义,例如,其允许没有明确叙述的元素,但是排除在现有技术中发现的或影响本发明的基本或新特征的元素。
此外,在整个说明书和权利要求书中,除非上下文另有要求,否则词语“包含(include)”或诸如“包含(includes)”或“包含(including)”的变体应理解为暗示包括指出的整体或整体的组,但不排除任何其他整体或整体的组。
本文使用的所选术语的其他定义可以在本发明的详细描述内找到并且在全文适用。除非另有定义,否则本文使用的所有其他技术术语具有与本发明所属领域的普通技术人员通常理解相同的含义。
通过回顾以下描述,本发明的其他方面和优点对于本领域技术人员是明显的。
附图说明
结合附图,本发明的上述和其他目的和特征将从以下对本发明的描述中变得明显,其中:
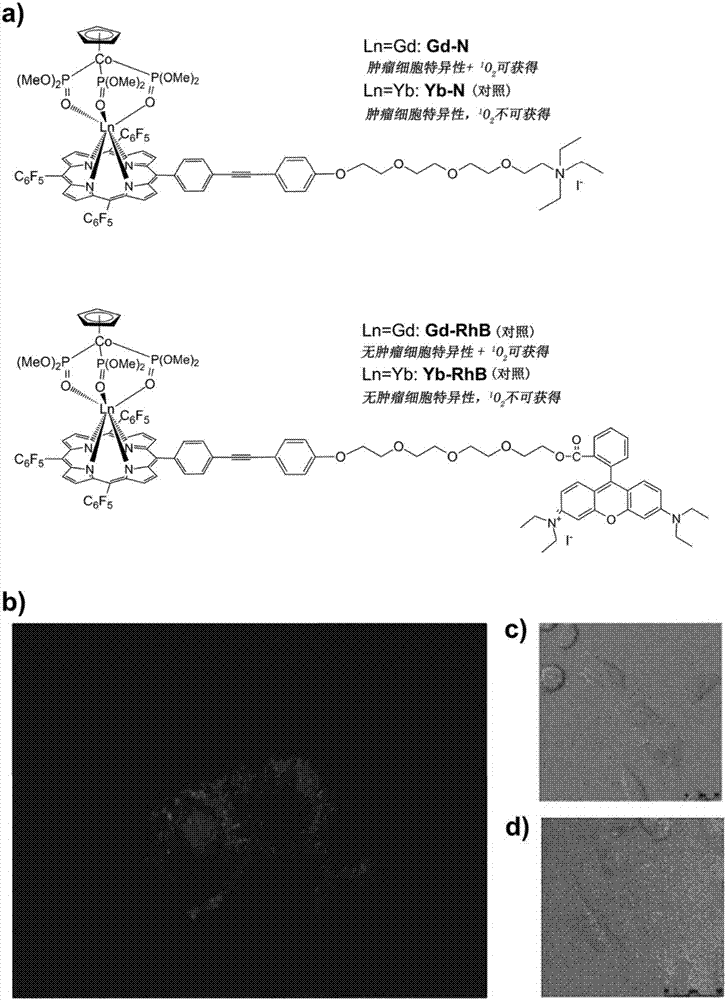
图1示出了a)智能癌细胞特异性光动力治疗剂(gd-n)及其对照类似物yb-n和gd-rhb的分子结构;b)在hela细胞中孵育15小时后,gd-n的3d体外成像;c)和d)gd-n在癌细胞(hela)和正常细胞中的亚细胞定位的差异。(wpmy-1)。
图2示出了gd-n(hepes缓冲溶液,10μm,λex=430nm,ph=7.4)的发射光谱和1o2量子产率测量(1o2chcl3的近红外磷光谱,10μm,λex=430nm,abs(λex)=0.03)。yb-n和h2tpp类似测量作为对照。
图3示出了在2小时孵育后,肿瘤细胞hela和正常细胞mrc5(作为对照)中gd-n和gd-rhb的体外成像。在860nm激发后引起pdt效应。a)hela中的gd-rhb;b)mrc-5中的gd-rhb;c)hela中的gd-n;d)mrc-5中的gd-n(1μm)。
图4示出了gd-n、gd-rhb(对照)和yb-n(对照)对(a)癌细胞(hela)和(b)正常细胞(qsg7701)的光细胞毒性。gd-n(1o2可获得,肿瘤特异性,在癌细胞中强的光细胞毒性,但在正常细胞中无光细胞毒性),gd-rhb(对照-1o2可获得,无肿瘤特异性,强的癌症和正常细胞光细胞毒性)和yb-n(对照,1o2不可获得,在癌细胞和正常细胞两者中均无光细胞毒性)。使用1μm缀合物和0至1j/cm2的各种光剂量获得光细胞毒性曲线;孵育24小时后进行mtt测定。(37℃,5%二氧化碳)。
图5示出了四种肿瘤细胞系(hela、sk-n-sh、hk-1和a549)中和三种正常细胞系(qsg7701、mrc-5、wpmy-1)中肿瘤特异性gd-n以及两种对照yb-n和gd-rhb的体外光细胞毒性测定(λex=430nm)。
图6示出了gd-n作为癌细胞特异性pdt剂的体内研究。a)使用860nm激光进行激发的pdt后肿瘤的代表性总体图像,候选物分为四组(组1:yb-n;组2:gd-n;组3:yb-rhb;组4:gd-rhb);b)a)中肿瘤体积的测量;c)通过icp-ms研究的gd-n的体内生物分布;d)c)中肿瘤样品的双光子显微镜图像;e)gd-n的体内肿瘤抑制测定;f)通过尾静脉注射的gd-n诱导1o2的体内肿瘤抑制。
图7示出了gd-n和gd-rhb诱导的1o2激活凋亡蛋白家族和mtor途径的抑制剂。a-收集用1μmgd-n或gd-rhb给药并用0.5j/cm2照射的hela细胞用于western印迹。未处理或不含化学品的样品作为对照。b-a中western印迹带的使用gel-proanalyzer软件对细胞蛋白质变化进行半定量测定,并表示为与β-肌动蛋白的比例(总蛋白的负载对照)。在未处理和gd-n或gd-rhb加激光组之间通过单因素方差分析计算p值。
图8示出了a)gd-n的高分辨率maldi-tof质谱;b)分子离子的同位素图谱;c)分子离子gd-n的计算的ms图谱(使用软件:isopro3.0)。
图9示出了gd-n和gd-rhb的吸收光谱。
图10示出了(a)卟啉钆络合物(gd-n)和(b)卟啉镱络合物(yb-n)中的能量吸收、迁移和发射(通过
图11示出了在dmso(5μm)中在800nm激发的gd-n(351gm)和gd-rhb(418gm)的开孔z扫描迹线。激光束的平均功率为0.271mw。
具体实施方式
本发明不限于本文所述的任何具体实施方案的范围。以下实施方案仅用于举例说明。
不希望受理论约束,本发明的申请人开发了卟啉钆(gd-n),其为在yb-n的基础上合成的pdt试剂,其表现出51%单线态氧量子产率,在光激发后具有卟啉的特征nir发射。(图1a)其综合研究表明,gd-n可以在前6个给药小时内通过阴离子磷脂酰丝氨酸膜识别肿瘤细胞,并且在给予一定波长的激光照射后,除了表现出tp诱导的nir发射外,还可以进入肿瘤细胞并产生1o2。体内小鼠模型和生物分布测定的结果进一步说明,在将gd-n简单注射到血管中后,发现gd-n位于肿瘤中。在从卟啉中释放出1o2后,发现实体瘤在24小时治疗后减小。根据现有技术中目前的知识,在文献中缺少体内基于镧系元素的pdt试剂的实例。因此,本发明的gd-n可以作为开发下一代智能pdt试剂的好的蓝图,其使用镧系元素卟啉化物用于实际的癌症跟踪、成像和杀灭。
结果和讨论
gd-n具有在本发明人之前工作中报道的镱络合物(yb-n)的基序结构,其详细合成和表征可以参考方案1和图8中提供的信息。gd-n和yb-n在结构上或多或少相同(与gd-n结合载体也与yb-n相同),只是络合物中存在所述镧系离子。不言而喻的是,卟啉与不同镧系元素的配位不仅可以引起自身的nir发射中的变化,而且同时还有1o2产生中的变化。(图2和图9)原则上这种现象是因为金属中心和配体之间更好的轨道重叠导致更好的能量转移的事实(即,由比gd更小的原子半径组成的yb的键合轨道因此与卟啉的轨道更优选和相容地重叠)。镧系元素引起的重原子效应也可以增加三线态衰变速率,并导致卟啉体系的更高三线态量子产率。根据光谱研究,yb-n的单线态氧量子产率测定为0%,gd-n测定为51%。计算基于(i)由两种络合物产生的1o2的nir磷光强度(在1270nm)和(ii)镱2f5/2(~10200cm-1)和钆6p7/2(~32000cm-1)各自的最低激发态。应该注意的是,6p7/2的后一能级远高于卟啉单元的单/三线态水平(单线态=~23200和15300cm-1;三线态=12500cm-1)。假设对于卟啉和gd之间的这种大的能隙,没有能量从卟啉转移到gd;所获得的能量可以纯粹以光的形式消散或用于形成单线态氧,使得直接决定了可用的1o2量子产率。(图10a)yb则完全不一样。由于卟啉和yb之间的能隙较小,卟啉单元吸收的大部分能量只能简单地有效转移到镱中(通过重原子效应),并且仅提供特征f-f发射。(图10b)这两个百分比已经清楚地表明,gd-n的卟啉吸收的能量的近半部分将参与1o2产生,而其余部分通常用于卟啉的nir发射;相比之下,对于yb-n,在相同光激发下1.08μm处的镱的f-f发光是主要的能量消耗过程。(分别在430nm和860nm处的线性和双光子激发;gd-n和yb-n的双光子吸收截面近似于~351gm(图11)。关于图10中的测量,采用以下方法:“根据光谱研究,yb-n的单线态氧量子产率测定为0%,gd-n测定为51%。计算基于(i)由两种络合物产生的1o2的nir磷光强度(在1270nm)和(ii)镱2f5/2(~10200cm-1)和钆6p7/2(~32000cm-1)各自的最低激发态。应该注意的是,6p7/2的后一能级远高于卟啉单元的单/三线态(单线态=~23200和15300cm-1;三线态=12500cm-1)。假设对于卟啉和gd之间的这种大的能隙,没有可用的能量转换;所获得的能量可以纯粹以光的形式消散或用于形成单线态氧,使得直接决定了可用的1o2量子产率。(图10a)yb则完全不一样,卟啉单元吸收的大部分能量只能简单地有效转移到镱中(通过重原子效应),并且仅提供特征f-f发射。(图10b)这两个百分比已经清楚地表明,gd-n卟啉吸收的能量的近半部分将参与1o2产生,而其余部分通常用于卟啉的nir发射;相比之下,对于yb-n,在相同光激发下1.08μm处的镱的f-f发光是主要的能量消耗过程。”
在肿瘤选择性、细胞毒性和光细胞毒性、成像、pdt效率以及生物分布方面,已经完成了与体外和特别是体内gd-n的实际pdt应用相关的研究。gd-n对肿瘤和正常细胞的选择性优异。如图1b)-d)所示,在hela癌细胞中,在孵育2小时后,可以在周边,即膜表面观察到来自gd-n的卟啉的强红色发射;在孵育超过15小时后,多个红色发射甚至可以进入细胞质并且在内部散射。然而,在正常细胞mrc-5中,即使在孵育12小时后,也不能在细胞表面或细胞内检测到发射。为了公平比较,合成gd-rhb用于对照实验。罗丹明b(rhb)是通常用于缀合的周知的线粒体载体。在相同的实验条件(孵育时间、浓度、细胞系和激光功率)下,申请人可以在正常细胞和癌细胞的线粒体中发现gd-rhb的发射,这一观察结果成为gd-n的肿瘤特异性的明确的、认可的和令人信服的证据。(图3)通过mtt测定,可以随后确定在黑暗中三种络合物gd-n、yb-n和gd-rhb对于两种细胞系的细胞毒性。癌细胞(hela)中其ic50值分别为0.78、0.80和0.65mm,正常细胞(mrc-5)中分别为0.70、0.70和0.45mm。与其他两种相比,gd-rhb在黑暗中对于癌细胞/正常细胞的细胞毒性的巨大差异的根本原因可能在很大程度上是由于其非选择性。再一次,本发明的gd-n的一个实施方案的特征是可以表现出关键的肿瘤选择性。使用体外共焦显微镜和光细胞毒性测定评估三种络合物的体外pdt作用。将gd-n、yb-n和gd-rhb络合物在hela细胞和mrc-5细胞中给药6小时,然后在860nm进行激发以引起任何pdt效应。(三种络合物都可用于tp诱导的体外成像,tp横截面为~351gm;鉴于共焦分光镜的限制,仅监测600nm到750nm的卟啉的发射)。在图3中,在线粒体中可以注意到gd-rhb的发射。在合适的激光诱导下,仅产生少量的1o2,但可以在几分钟内杀死癌细胞;实际上,在相同条件下也可以快速杀死正常细胞。因此,gd-rhb的pdt效应是充分有效的,但是明显不合需要;其可以积累在癌细胞和正常细胞的线粒体内,没有选择性地消灭它们。虽然yb-n是癌症特异性的,但是其不能产生任何1o2导致了其任何pdt实践的限制。令人惊讶的是,当提到红色发射gd-n时,其不仅可以识别和定位在肿瘤细胞的阴离子膜上,而且还可以进入细胞质的某些部分并且在9分钟光剂量闪烁(每分钟5秒)后通过1o2诱导癌细胞凋亡。当然,在确定的激光照射后,需要更多的时间来触发gd-n导致的癌细胞死亡;然而,在正常细胞中没有明显的细胞死亡,远远超过其缓慢反应的缺陷。
作为任何新一代pdt剂,还已经在癌细胞和正常细胞中在0.25至1j/cm2的不同光剂量下测量了gd-n、yb-n和gd-rhb的浓度依赖性光细胞毒性。获得的光剂量-反应曲线示出在图4a中。在hela癌细胞中,gd-rhb和gd-n具有强烈的光细胞毒性,而yb-n(无单线态氧)没有光细胞毒性。从图4b可以看出,在正常细胞qsg7701中,未发现来自gd-n的光细胞毒性,而gd-rhb给出了与其在癌细胞中的表现非常类似isi的结果。这种趋势似乎与癌细胞和正常细胞对gd-n的选择性细胞摄取有关。申请人通过使用更多的癌细胞和正常细胞系扩展了研究,结果如图5所示——gd-n可以对总共7个细胞系(四个癌细胞和三个正常细胞)保持良好的肿瘤选择性,从而充当了杰出和特异性pdt试剂。
为了更多地了解本发明络合物的体内摄取,已经通过异种移植小鼠模型和icp-ms进行了对这些络合物对特定器官感染的特异性的生物分布的研究。在第一个概念验证实验中,将四种络合物分为四组。将分别与gd-n、yb-n、gd-rhb和yb-rhb预孵育的hela细胞皮下注射到balb/c裸小鼠中,然后用860nm激光照射注射部位。两周后,对小鼠照相,测量肿瘤体积(其中小鼠图像和肿瘤体积的测量分别示出在图6a和6b中),并且发现与其对应物的yb-n和yb-rhb相比,在gd-n和gd-rhb组中发现肿瘤被有效抑制;在四种络合物中,gd-n是最佳的体内pdt试剂,其可以以100%效率破坏肿瘤。以生物分布研究的方式,对具有达到约0.1cm3的肿瘤异种移植物的balb/c裸小鼠尾静脉注射gd-n(1.0mg/kg)。化学品施用两天后,使用icp-ms检测不同组织或循环血液中的浓度。如图6c所示,肿瘤具有最大的gd-n富集(4.84ppm/g),这表明gd-n对肿瘤细胞的特异性识别。
通过从施用gd-n的balb/c裸小鼠提取的肿瘤组织的双光子显微镜成像也证实了该结果。具有来自gd-n的明显的双光子显微信号(gd-n的图像,圆圈点),而对照图像(显示为背景,通过亮场成像)未显示特定信号。合并图像是背景和gd-n的重叠光子,其示出在图6d中。通过分别用gd-n(2.0mg/kg)、gd-rhb(2.0mg/kg)和ala(60mg/kg)(5-氨基乙酰丙酸,其可以在活细胞中产生原卟啉,并且在这里用作对照pdt化学品)瘤内注射约0.3cm3的hela异种移植肿瘤的balb/c裸小鼠并且在络合物注射后用860nm光照射3小时,来进一步验证gd-n和gd-rhb对荷瘤小鼠中肿瘤生长的抑制作用。肿瘤总光剂量为50j/cm2。然后允许肿瘤生长另外7天,并进行最终提取和拍照。如图6e所示,这些研究的结果确实表明,gd-n能够在短时间内极大地抑制实体肿瘤,甚至将实体肿瘤的尺寸从2cm减小到1cm。
或者,向具有异种移植肿瘤的小鼠尾静脉注射gd-n和gd-rhb(2.0mg/kg体重),并允许全循环6小时。然后与上述类似地用860nm的光照射肿瘤。对侧的肿瘤作为对照(未光处理)。在接下来的几天内,以每天一次的方式重复处理三次。一致地,发现与其对侧肿瘤对照或gd-rhb组相比,gd-n加光处理的肿瘤被抑制。药代动力学分析显示,gd-n在动物中以较大mrt(平均停留时间(meanresistancetime))值持续较长时间(12.50小时),而gd-rhb被快速清除(mrt为5.04小时)(结果示出在图6f和表1中)。
表1.分别向balb/c裸小鼠(n=3)尾静脉注射20nmol的gd-n(37.34μg)或gd-rhb(44.28μg)后血浆中gd-n和gd-rhb的药代动力学参数。auc,浓度-时间曲线下面积;平均停留时间;t1/2,统计半衰期;vd,分布体积。
关于pdt的分子机制,还研究了pdt处理的hela细胞的蛋白质裂解物中细胞存活素和凋亡蛋白家族抑制剂(iap)的蛋白质水平。正如提出的,在gd-n加激光处理样品中,存活素和iap家族成员c-iap1、c-iap2和xiap都显著表达。此外,惊奇地发现mtor途径可能参与对癌细胞的pdt治疗的反应。在gd-n或gd-rhb诱导的1o2应激刺激下,两种关键成员mtor和gβl的水平明显升高。这些结果表明gd-n的成功细胞杀伤作用在分子水平促进光动力治疗,也可以揭示当前pdt药物的设计和改进的新前景。(图7)
结论
本发明提供用作抗癌武器的治疗诊断性钆络合物gd-n,其配备有用于成像的可见至nir发射、肿瘤细胞选择性和1o2产生。通过一系列体外和体内研究,发现本发明gd-n的有效性和优点得到充分证实,并证明了本发明的gd-n是下一代智能双功能pdt剂。本发明的一个实施方案是使用本发明的gd-n以及选择性光动力学治疗来追踪和成像长期活癌细胞的方法。
实验方法
线性诱导的光物理性质
申请人已经分别用hpuv-8453分光光度计和配备有在氮流冷却的壳体内的uv至可见灵敏光电倍增管的爱丁堡仪器fls920组合荧光寿命和稳态分光光度计(edinburghinstrumentfls920combinedfluorescencelifetimeandsteadystatespectrophotometer)记录了所有本发明络合物的uv-可见吸收光谱(范围从200至1100nm)和单光子发光光谱。申请人已经校正了来自检测器响应和杂散背景光磷光的所有光谱,通过在爱丁堡仪器fls920中提供有两个进入端口的可拆卸的142mm(内)直径的硫化钡涂覆的积分球来测量镧系元素络合物的量子产率。
单线态氧量子产率
对于1270nm的磷光,申请人已经在ptiqm4发光分光计上用ingaas检测器检测了单线态氧,并且通过将样品溶液的1o2发射强度与参考材料[4](h2tpp,chcl3中φδ=0.55)相比较确定了chcl3中所有化合物的量子产率(фδ),如下式所示:
其中фδ表示单线态氧量子产率,gδ表示积分发射强度,a表示操作激发波长处的吸光度,n表示溶剂的折射率,已知上标ref和s分别表示参考和样品。在所有情况下,申请人已经测量了正常激发时的1o2发射光谱。为了减少发射光的再吸收的影响,所有吸光度也设定为0.05。
细胞培养
人hela(宫颈癌)和wpmy-1(正常前列腺基质永生化细胞)细胞生长在dmem培养基中;a549(肺腺瘤)保持在ham'sf12k培养基和l-谷氨酰胺(n3520,sigma,st.louis,mo,usa)的混合物中;qsg7701(正常肝细胞)、hk-1、hone1(鼻咽癌)生长在rmpi-1640培养基中;mrc-5(正常肺成纤维细胞)和sk-n-sh(神经母细胞瘤)细胞生长在mem培养基中。还添加了(i)10%(v/v)胎牛血清(fbs),(ii)100μg/ml链霉素,和(iii)100单位/ml青霉素。
体外成像
为了测试本发明的水溶性络合物作为生物探针的适用性,申请人使用商业共聚焦激光扫描显微镜——配备有ti:蓝宝石激光(libraii,coherent)的leicatcssp5以及用于激发的980nm波长激光,对与本发明的五种络合物孵育的hela/wpmy-1/mrc-5细胞进行体外成像。
mtt细胞活力测定
24小时后,将水溶性络合物和处理的靶细胞与3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(0.5mg/ml)(也称为mtt)进一步温育续4小时,使得随着细胞的代谢途径形成甲臜(formazan)。然后,申请人提取甲臜并用二甲基亚砜(dmso)溶解,随后在bio-radimark酶标仪(490nm)中测量溶液的吸光度。一式四份进行,并且申请人通过使用graphpadprism5软件绘图来解释和分析数据。
光动力学治疗(pdt)测定
首先在96孔板上将癌细胞(2×104/孔)孵育过夜,然后用本发明的络合物和对照类似物在黑暗中处理接下来的6小时。在将旧培养基替换成新鲜培养基之后,将细胞相应在mw/cm2流畅度下暴露于配备有隔热滤波器和500nm畅通滤波器的400w钨灯产生的黄光(1-8j/cm2)。之后,申请人在24小时后通过mtt测定检查了pdt后细胞活力。申请人用pbs冲洗细胞单层,之后与250μg/mlmtt溶液在37℃下孵育3小时。然后通过96孔板读数器(elx800吸光度微板读数器)在540和690nm对形成并且溶解在dmso中的甲臜进行吸光度测量。
动物:申请人在获自广东医学实验动物中心(许可证编号:scxk-2008-0002)的无胸腺裸小鼠(balb/c-nu/nu)上进行了所有需要动物模型的实验。根据“国家动物管理和使用程序标准”(20080820)的严格议定书养育和操作小鼠。
药代动力学分析:将gd-n和gd-rhb(各1.0μmol/kg体重)经尾静脉注射到小鼠中。然后在如所示的0-20小时的不同时间点收集血清。通过perkinelmerenvisionmultilabelreader2104在570nm处测量gd-n和gd-rhb的浓度,并通过浓度曲线使用标准吸收进行计算。通过与单室模型拟合计算药代动力学参数(t1/2、vd、mrt、auc)。
通过icp-ms的体内生物分布
为了更好地理解本发明络合物的体内摄取,通过icp-ms进行对特定器官/细菌感染具有特异性的络合物的体内分布研究。当发现肿瘤异种移植物已经达到大约0.1cm3的大小时,申请人以1.0μmol/kg体重的剂量向小鼠施用gd-n和gd-phb。两天后,收集肿瘤、肝、肺、肾、脾、脑、前列腺和皮肤中约0.02-0.04克样品组织;血液(80-90μl)也不例外。申请人将所有样品与500μl硝酸一起在37℃孵育,除了溶解干扰性有机分子外,用于还释放金属离子用于进一步icp-ms检查。
体内光动力治疗研究
为了建立小鼠肿瘤异种移植模式,将细胞进行胰蛋白酶消化,收获并悬浮在培养基中。申请人将100μl体积中的1×106个细胞皮下(s.c.)注射到雌性无胸腺裸小鼠(5周龄)的侧面,并等待10-15天。当肿瘤体积达到100-150mm3的大小时,申请人将动物随机分成不同的组用于进一步实验。用卡尺(精度为0.02mm)测量肿瘤体积,然后根据等式v=(l×w2)/2独立计算,其中l和w分别对应于较大和较小尺寸。通过graphpadprism5.0软件评估组间统计学显著性的单因素方差分析。
材料和方法
使用的所有化学品均为试剂级,并购自sigma-aldrich,不经进一步纯化即可使用。中间体yb[n(sime3)2]3·[licl(thf)3]1和起始卟啉游离碱tfp-tms2的制备根据文献程序进行。3对照化合物gd-rhb、yb-rhb4和yb-n5的制备分别根据本发明人之前的程序完成。所有分析级溶剂在使用前通过标准程序干燥、蒸馏和脱气。在brukerautoflexmaldi-tof质谱仪上获得报告为m/z的高分辨率质谱。元素分析在中国西北大学化学工程学院进行。中间体和gd-n的合成路线如方案1所示:
a)(i)gd[n(sime3)2]3-[licl(thf)3]x,甲苯,回流,12h;(ii)na{η5-c5h5)co[p(=o)(ome)2]3},甲苯,rt,1h;b)(i)tbaf(tfif,1m),ch2cl2,rt,30min;(ii)a)4-碘苯酚,pd(pph3)4,cui,thf,net3,40℃,12h;c)甘醇二碘化物,dmf,k2co3,80℃,8h;d)三乙胺,dmf,85℃,24h.
方案1.gd-ngd-tms的合成路线:将gd[n(sime3)2]3·[li(thf)3cl]x(5.0ml,0.6mmolgd)的溶液转移到schlenk烧瓶中并在真空下除去溶剂。然后加入10ml二氯甲烷(ch2cl2)用于沉淀出licl。将混合物离心分离,将澄清层转移到具有溶解在20ml甲苯中的卟啉游离碱tfp-tms(196mg,0.2mmol)的另一schlenk烧瓶中。将所得溶液回流12小时,直到大部分游离碱与金属离子配位。将反应溶液冷却至室温。然后向混合物中加入无水na{(η5-c5h5)co[p(=o)(ome)2]3}(104mg,0.22mmol),将其再磁力搅拌1小时。反应完成后,在真空下除去溶剂,将残余物溶解在ch2cl2中,过滤并使用ch2cl2/己烷作为洗脱液在硅胶上进行色谱分离,得到作为红色固体的纯产物。产率:86%;maldi-tofms:[m+]的计算值:m.p.>300℃;1587.1965,实测值:1587.2154;[c60h44cof15n4o9p3sigd]的分析计算值:c,45.40;h,2.79;n,3.53%,实测值:c,45.46;h,2.83;n,3.51%;uv/vis(dmso,25℃):λmax(logε)=427(5.68),558(4.34),597(3.29dm3mol–1cm–1)。
gd-oh:将四丁基氟化铵(tbaf,thf中1.0m,200μl,0.2mmol)加入到gd-tms(182mg,0.1mmol)在10mlch2cl2中的溶液中,并将溶液搅拌30分钟。通过tlc监测反应进程。反应完成后,使混合物通过硅胶短柱。除去溶剂后,获得中间体,其用于下一步骤而不需进一步纯化。然后将得到的中间体和4-碘苯酚(33mg,0.15mmol)溶解在无水四氢呋喃(thf,15ml)和三乙胺(net3,5ml)中,并将混合物用氮气鼓泡30分钟。之后,向上述溶液中加入pd(pph3)4(12mg0.01mmol)和cui(3.8mg,0.02mmol)。将反应混合物在氮气氛下在至少35℃下搅拌至少10小时。然后减压下除去溶剂。将残余物使用ch2cl2/甲醇(50:1)作为洗脱液在硅胶上进行色谱分离,得到作为红色固体的纯产物。产率:73%(表2);m.p.>300℃;maldi-tofms:[m+]的计算值:1607.0291,实测值:1608.0308;[c63h40cof15n4o10p3gd]的分析计算值:c,47.08;h,2.51;n,3.49%,实测值:c,47.10;h,2.49;n,3.51%;uv/vis(dmso,25℃):λmax(logε)=426(5.70),555nm(4.48dm3mol–1cm–1)。
表2不同交联反应条件下的产率(%)。考虑时间和温度,选择40℃和12小时作为主要反应条件。
gd-i:向gd-oh(161mg,0.1mmol)和四甘醇二碘化物(207mg,0.5mmol)在无水n,n-二甲基甲酰胺(dmf,10ml)中的溶液中加入无水k2co3(69mg,0.5mmol),并将混合物在氮气氛下加热至80℃并持续8小时。然后在减压下除去溶剂。将粗产物在通过ch2cl2/ch3oh(v/v,100:1)洗脱的硅胶上通过柱色谱纯化,得到作为红色固体的纯产物。产率:82%;m.p.>300℃;maldi-tofms:[m+]的计算值:1893.2210,实测值1893.1038;[c71h55cof15in4o13p3gd]的分析计算值:c,45.04;h,2.94;n,3.11%,实测值:c,45.21;h,2.99;n,3.06%;uv/vis(dmso,25℃):λmax(logε)=425(5.71),555nm(4.50dm3mol–1cm–1)。
gd-n:向gd-i(95mg,0.05mmol)在无水dmf(10ml)中的溶液中加入无水net3(1ml,过量),将混合物在氮气氛下加热至85℃并持续24小时。然后在减压下除去溶剂。将所得粗产物使用ch2cl2/ch3oh(v/v,80:1)作为洗脱液通过硅胶柱色谱法纯化,以除去未反应的gd-1和其他杂质,然后使用ch2cl2/ch3oh(v/v,10:1),得到作为红色固体的纯产物。产率:80%;m.p.>300℃;maldi-tofms:[m+]的计算值:1867.5095,1867.2538实测值;[c99h85cof15n6o16p3gd]的分析计算值:c,46.37;h,3.54;n,3.51%,实测值:c,46.40;h,3.59;n,3.48%;uv/vis(dmso,25℃):λmax(logε)=426(5.74),555nm(4.53dm3mol–1cm–1)。
双光子吸收测量
通过开孔z扫描方法在800nm处测量双光子吸收光谱(即,z扫描迹线),所述方法使用来自在ti:蓝宝石再生放大器系统产生的1khz重复率下操作的光学参数放大器的峰值功率为276gwcm–2的100fs激光脉冲。激光束被分束器分成两部分。一个通过光电二极管(d1)监测为入射强度参考i0,另一个通过另一个光电二极管(d2)检测为透射强度。在通过f=20cm的透镜后,激光束聚焦并通过石英池。样品池z的位置通过计算机控制的可平移表沿着激光束的方向(z轴)移动,使得可以在恒定的入射强度激光功率水平下改变样品室内的局部功率密度。最后,通过光电二极管d2检测来自样品池的透射强度。光电二极管d2与计算机接口,用于信号采集和平均。每个透射强度数据代表超过100次测量的平均值。假设高斯光束剖面,可以通过使用方程式(1)6曲线拟合到观察到的开孔轨迹t(z),得到非线性吸收系数β,其中a0是线性吸收系数,l是样品长度(1mm石英池),z0是入射光束的衍射长度。获得非线性吸收系数β后,可以通过使用等式(2)确定样品分子的2pa横截面σ(2)(以1gm=10–50cm4光子-1为单位),其中na是阿伏伽德罗常数(avogadro’sconstant),d是溶液中样品化合物的浓度,h是普朗克常数(planck’sconstant),v是入射激光束的频率
(1)
(2)
工业实用性
本发明公开了光动力治疗(photodynamictherapy,pdt)的新形式,其通过本发明的真正的双功能——pdt和成像——钆络合物(gd-n)的设计来实现,其能够细胞特异性地靶向癌症。在本发明的一个实施方案中,提供了可以特异性定位于癌细胞的阴离子细胞膜的pdt药物,其中可以监测其激光激发的光发射信号,而不会在预期激发之前引起活性氧——单线态氧——的光毒性产生。已经进行了全面的体外和体内研究,以证实gd-n作为抗肿瘤治疗的新的肿瘤选择性pdt光敏剂形态的有效性。
如果需要,本文讨论的不同功能彼此可以以不同的顺序和/或同时执行。此外,如果需要,上述功能中的一个或多个可以是可选的或可以组合。
虽然已经关于多个实施方案和实施例描述了前述发明,但是应当理解,其他实施方案也在所附权利要求及其等同物中表示的本发明的范围内。此外,上述具体实施例将解释为仅仅是说明性的,而不是以任何方式限制本公开的其余部分。无需进一步的阐述,相信本领域技术人员可以基于本文的描述最大程度地利用本发明。本文所述的所有出版物的全部内容通过引用并入本文。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于包括轻质、选择性支撑的纺织部件的鞋类物品的部件的制造方法与工艺
- 用于选择性地破坏视频编码中的预测的方法和系统与制造工艺
- 双流准恒包络正交频分复用系统中基于空闲子载波的频偏估计及补偿方法与制造工艺
- 一种可选择性识别Cr3+的金属‑有机框架及其制备方法与制造工艺
- 选择性降低卷烟烟气中CO释放量的负载型烟基功能材料的制备方法及应用与制造工艺
- 一种用于C2H2/CO2和C2H2/CH4高效选择性分离吸附的双重贯穿金属有机框架材料及其制备方法与制造工艺
- 选择性寻求最佳扭矩目标的动力总成及控制方法与制造工艺
- 一种FTO薄膜表面选择性一步制备波纹结构的方法与制造工艺
- 一种干扰上报的方法及装置与制造工艺
- 一种干扰管理的方法及系统与制造工艺