作为用于电致发光装置的发光元件的芴衍生物的制作方法
相关申请案的交叉引用本申请案要求2014年12月30日提交的美国临时专利申请案第62/097,720号的优先权,其全部内容以引用的方式并入本文中。
背景技术:
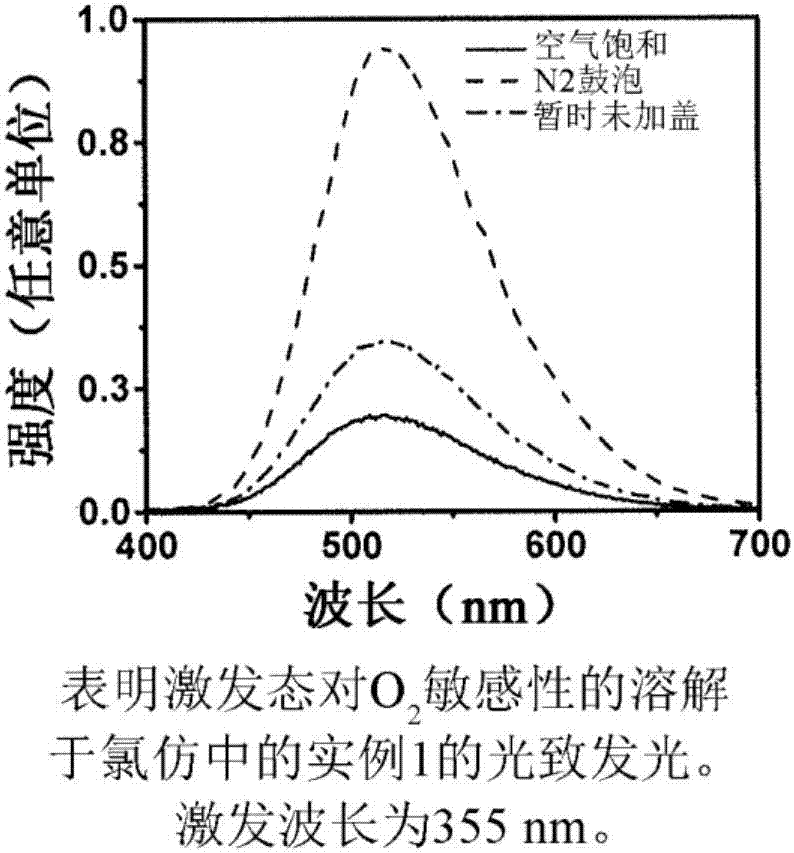
:oled(有机发光二极管)是一种发光二极管(led),其中发射电致发光层为响应于电流而发光的有机化合物的膜。典型的oled具有多层结构,并且通常包括氧化铟锡(ito)阳极和金属阴极。夹在ito阳极与金属阴极之间的是若干有机层,如空穴注入层(hil)、空穴传输层(htl)、发射材料层(eml)、电子传输层(etl)和电子注入层(eil)。常规oled装置使用基于昂贵铱磷光络合物或低效荧光类有机小分子的发射材料。本领域认识到对于比常规铱类发射材料或荧光类发射材料更经济和/或更高效的新发射材料的持续需要。具体地说,本领域认识到对于用于有机热激活延迟荧光(tadf)发射极的此类发射材料的需要。技术实现要素:本公开提供一种涉及新颖类别的有机热激活延迟荧光(tadf)发射极的组合物。本公开提供一种包含选自由如下所示的化合物1、化合物2和其组合组成的群组的至少一种化合物的组合物:其中,对于化合物1和化合物2,独立地,r1和r2各自独立地选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的杂烷基、未经取代的杂烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中,对于化合物1和化合物2,独立地,组分a选自由基团a)到基团h)组成的群组:并且其中对于基团a),r3和r4各自独立地选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中对于基团b),r5、r6、r7和r8各自独立地选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中对于基团c),r5、r6、r7和r8各自独立地选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中对于基团d),r5、r6、r7和r8各自独立地选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中对于基团e),r9选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中对于基团f),r9选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中对于基团g),r9选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;其中对于基团h),r9选自由以下组成的群组:氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基;并且其中,对于化合物2,组分z选自由以下组成的群组:c(rz)2、nrz、p(o)rz、prz、s、so、so2、si(rz)2和o;其中每个rz独立地选自由以下组成的群组:氢、未经取代的烷基、未经取代的芳基和烷氧基;并且其中,任选地,对于化合物1和化合物2,独立地,一个或多个氢原子可经氘取代附图说明图1为根据本公开的一实施例的组合物的光致发光光谱。图2为根据本公开的一实施例的组合物的光致发光光谱。图3为根据本公开的一实施例的化合物的时间-分辨发射光谱(tres)。具体实施方式定义除非相反地陈述,自上下文所暗示或本领域惯用,否则所有份数以及百分比均以重量计。出于美国专利实践的目的,任何所参考的专利、专利申请案或公开的内容都以全文引用的方式并入(或其等效美国版本如此以引用的方式并入),尤其在本领域中的定义(在不会与本公开具体提供的任何定义不一致的程度上)和常识的公开方面。本文所公开的数值范围包括从(并且包括)下限值和上限值的所有值。对于含有确切值的范围(例如1或2或3到5或6或7),任何两个确切值之间的任何子范围包括在内(例如1到2;2到6;5到7;3到7;5到6等)。如本文所述,术语“烷氧基”是指其中至少一个氢原子经氧原子o取代的烷基。如本文所述,术语“烷基”是指通过从脂肪族烃中去除一个氢原子而衍生自脂肪族烃的有机基团。烷基可为直链、分支链、环状或其组合。如本文所用,术语“经取代的烷基”是指其中至少一个氢原子经包含至少一个杂原子的取代基取代的烷基。杂原子包括(但不限于)o、n、p和s。取代基包括(但不限于)卤素、or'、nr'2、pr'2、p(=o)r'2、sir'3;其中每个r'独立地为c1-c20烃基。如本文所述,术语“芳基”是指通过从芳香族烃中去除一个氢原子而衍生自芳香族烃的有机基团。芳基可为单环和/或稠环系统,其中每个环适当地含有5个到7个,优选地5个或6个原子。其中两个或多于两个芳基通过(一个或多个)单键组合的结构也包括在内。具体实例包括(但不限于)苯基、甲苯基、萘基、联苯基、蒽基、茚基、芴基、苯并芴基、菲基、联亚三苯基、芘基、苝基、屈基、稠四苯基、荧蒽基等。萘基可为1-萘基或2-萘基,蒽基可为1-蒽基、2-蒽基或9-蒽基,并且芴基可为1-芴基、2-芴基、3-芴基、4-芴基和9-芴基中的任一个。如本文所用,术语“经取代的芳基”是指其中至少一个氢原子经包含至少一个杂原子的取代基取代的芳基。杂原子包括(但不限于)o、n、p和s。取代基包括(但不限于)卤素or'、nr'2、pr'2、p(=o)r'2、sir'3;其中每个r'独立地为c1-c20烃基。术语“包含”、“包括”、“具有”以及其衍生词并非旨在排除任何附加组分、步骤或程序的存在,而不论是否具体地公开所述组分、步骤或程序。为了避免任何疑问,除非相反地陈述,否则通过使用术语“包含”所要求的所有组合物可包括任何附加添加剂、佐剂或化合物(无论聚合或以其它方式)。相反地,术语“基本上由……组成”从任何随后列举的范围排除任何其它组分、步骤或程序,除了对可操作性来说不是必不可少的那些之外。术语“由……组成”排除未专门叙述或列出的任何组分、步骤或程序。“掺杂剂”和类似术语是指经历从激发态的辐射发射的材料。此激发态可通过在电致发光装置中的施用电流生成,并且其在特征为单态或三重态任一者。如本文所用,术语“荧光发射”是指从单态激发态辐射发射。如本文所用,术语“磷光发射”是指从三重态激发态的辐射发射。对于主要经历荧光发射的掺杂剂,如本文所用,术语“三重态捕获”是指此外捕获三重态激子的能力。如本文所用,术语“热激活延迟荧光(tadf)”是指通过可热获取单态激发态实现的利用三重态捕获的荧光发射。“电子伏特”或“ev”是通过单个电子的电荷移跨一伏特的电势差而获得(或损失)的能量的量。“发射层”和类似术语是指由掺杂剂和一种或多种主体材料构成的层。如本文所述,术语“杂烷基”是指其中至少一个碳原子或ch基团或ch2经杂原子或含有至少一个杂原子的化学基团取代的烷基。杂原子包括(但不限于)o、n、p和s。杂烷基可为直链、分支链、环状或其组合。如本文所用,术语“经取代的杂烷基”是指其中至少一个氢原子经包含至少一个杂原子的取代基取代的杂烷基。杂原子包括(但不限于)o、n、p和s。取代基包括(但不限于)卤素、or'、nr'2、pr'2、p(=o)r'2、sir'3;其中每个r'独立地为c1-c20烃基。如本文所述,术语“杂芳基”是指其中至少一个碳原子或ch基团或ch2经杂原子或含有至少一个杂原子的化学基团取代的芳基。杂原子包括(但不限于)o、n、p和s。杂芳基可为5元或6元单环杂芳基或与一个或多个苯环稠合的多环杂芳基并且可为部分饱和的。具有通过单键键结的一个或多个杂芳基的结构也包括在内。杂芳基可包括二价芳基,其中杂原子经氧化或季铵化以形成n-氧化物、季盐等。具体实例包括(但不限于)单环杂芳基,如呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、噻唑基、噻二唑基、异噻唑基、异噁唑基、噁唑基、噁二唑基、三嗪基、四嗪基、三唑基、四唑基、呋吖基、吡啶基、吡嗪基、嘧啶基、哒嗪基;多环杂芳基,如苯并呋喃基、芴并[4,3-b]苯并呋喃基、苯并噻吩基、芴并[4,3-b]苯并噻吩基、异苯并呋喃基、苯并咪唑基、苯并噻唑基、苯并异噻唑基、苯并异噁唑基、苯并噁唑基、异吲哚基、吲哚基、吲唑基、苯并噻二唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喏啉基、咔唑基、啡啶基和苯并间二氧杂环戊烯基;和其对应的n-氧化物(例如吡啶基n-氧化物、喹啉基n-氧化物)和季盐。如本文所用,术语“经取代的杂芳基”是指其中至少一个氢原子经包含至少一个杂原子的取代基取代的杂芳基。杂原子包括(但不限于)o、n、p和s。取代基包括(但不限于)卤素or'、nr'2、pr'2、p(=o)r'2、sir'3;其中每个r'独立地为c1-c20烃基。“空穴传输层(htl)”和类似术语是指由传输空穴的材料制成的层。对于oled装置,推荐高空穴迁移率。htl用于帮助阻断由发射层传输的电子的通过。通常需要小电子亲和性以阻断电子。htl应理想地具有更大三重态以阻断激子从相邻eml层迁移。htl化合物的实例包括(但不限于)二(对甲苯基)氨基苯基]-环己烷(tpac)、n,n-二苯基-n,n-双(3-甲基苯基)-1,1-联苯基-4,4-二胺(tpd)和n,n'-二苯基-n,n'-双(1-萘基)-(1,1'-联苯基)-4,4'-二胺(npb)。“主体”和类似术语是指掺杂有掺杂剂的材料。基于使用的掺杂剂(磷光或荧光)的类型,主体材料的光电特性可不同。对于荧光掺杂剂,辅助主体材料应在掺杂剂的吸附与主体的发射之间具有良好的光谱重叠,以向掺杂剂诱导良好的福斯特(forster)转移。对于磷光掺杂剂和tadf掺杂剂,辅助主体材料应具有高三重态能量以限制在掺杂剂上的三重态。如本文所用,术语“烃”是指仅含有氢原子和碳原子的化学基团。如本文所用,术语“经取代的烃”是指其中至少一个氢原子经包含至少一个杂原子的取代基取代的烃。杂原子包括(但不限于)卤素、o、n、p以及s。取代基包括(但不限于)卤素、or'、nr'2、pr'2、p(=o)r'2、sir'3;其中每个r'独立地为c1-c20烃基。术语“独立地”或“各自独立地选自”或类似术语是指对目标基团内每个个别成员的元素的独立选择。举例来说,术语“对于化合物1到化合物5中的每一个,独立地,r1到r5各自独立地选自甲基、乙基和丙基”意指(i)相对于每种化合物1到5,给定取代基r1到r5的特性为独立和个别的(即,化合物1的r1(甲基)可为与化合物2、3、4或5的r1(甲基、乙基或丙基)相同或不同的元素),和(ii)对取代基r1到r5的选择对于每个个别取代基为独立的(即,相对于r2r3、r4和r5(甲基、乙基或丙基),r1(乙基)可为相同或不同的元素)。s1-t1能隙被定义为在最低能量单态激发态和最低能量三重态激发态之间的能量差。1.组合物本公开提供一种组合物。组合物包括选自化合物1、化合物2以及化合物1和化合物2的组合的至少一种化合物。对于化合物1和化合物2的结构在下文提供。对于化合物1和化合物2,独立地,r1和r2各自独立地选自氢、经取代的烷基、未经取代的烷基、经取代的杂烷基、未经取代的杂烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于化合物1和化合物2,独立地,组分a选自基团a)到基团h)。对于基团a)到基团h)中的每个的结构在下文提供。对于基团a),r3和r4各自独立地选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基、未经取代的杂芳基。对于基团b),r5、r6、r7和r8各自独立地选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于基团c),r5、r6、r7和r8各自独立地选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于基团d),r5、r6、r7和r8各自独立地选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于基团e),r9选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于基团f),r9选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于基团g),r9选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于基团h),r9选自氢、经取代的烷基、未经取代的烷基、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于化合物2,组分z选自cr(z)2、nrz、p(o)rz、prz、s、so、so2、sir(z)2和o。rz选自氢、未经取代的烷基、未经取代的芳基和烷氧基。在实施例中,化合物1和化合物2中的每一种独立地具有如通过例如高效液相色谱(hplc)、液相色谱(lc)和/或液相色谱法-质谱(lc-ms或hplc-ms)分析方法测定的大于99百分比(%)的纯度。在实施例中,化合物1和化合物2中的每一种独立地具有-4.5电子伏特(ev)或-4.75ev或-5.0ev或-5.25ev到-5.50ev或-5.75ev或-6.0ev的最高占用分子轨道(homo)能级。在实施例中,化合物1和化合物2中的每一种独立地具有-1.2ev或-1.3ev或-1.4ev或-1.5ev到-1.6ev或-1.8ev或-2.0ev或-2.2ev的最低未占用分子轨道(lumo)能级。在实施例中,化合物1和化合物2中的每一种独立地具有2.5ev或2.6ev或2.7ev到2.8ev或2.9ev或3.0ev或3.1ev或3.2ev的三重态能级(t1)。在实施例中,化合物1和化合物2中的每一种独立地具有0.01ev或0.05ev或0.1ev或0.20ev或0.25ev到0.29ev、0.30ev、或0.34ev或0.35ev或0.39ev或0.4ev的s1-t1能隙。a.化合物1在实施例中,组合物包括如下所示的化合物1。对于化合物1,r1和r2各自独立地选自经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。在实施例中,组合物包括化合物1。对于化合物1,r1和r2各自独立地选自未经取代的芳基和未经取代的杂芳基。在实施例中,组合物包括化合物1。对于化合物1,组分a为以下基团a)。对于基团a),r3和r4各自独立地选自氢、未经取代的芳基或未经取代的杂芳基。在实施例中,组合物包括具有基团a)的化合物1。具有基团a)的化合物1具有以下结构(i)。对于结构(i),r1和r2各自独立地选自未经取代的芳基和未经取代的杂芳基。在实施例中,组合物包括具有基团a)的化合物1。具有基团a)的化合物1具有以下结构(ii):在实施例中,组合物包括具有基团a)的化合物1。化合物1具有如下所示的结构(iii)。在实施例中,组合物包括具有基团a)的化合物1。化合物1具有如下所示的结构(iv)。在实施例中,组合物包括具有基团a)的化合物1。化合物1具有如下所示的结构(v)。在实施例中,组合物包括化合物1。对于化合物1,组分a为基团b)。对于基团b),r5、r6、r7和r8各自独立地选自氢、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。在实施例中,组合物包括具有基团b)的化合物1。具有基团b)的化合物1具有以下结构(vi)。对于结构(vi),r1和r2各自独立地选自未经取代的芳基和未经取代的杂芳基。在实施例中,组合物包括具有基团b)的化合物1。具有基团b)的化合物1具有以下结构(vii)。在实施例中,组合物包括化合物1。化合物1可具有如先前公开的结构(i)到结构(vii)中的任一个。化合物1具有0.01ev或0.05ev或0.1ev或0.20ev或0.25ev到0.29ev、0.30ev或0.34ev或0.35ev或0.39ev或0.4ev的s1-t1能隙。在实施例中,组合物包括化合物1。化合物1可具有如先前公开的结构(i)到结构(vii)中的任一个。化合物1具有1.7ev或1.9ev或2.0ev或2.5ev到2.7ev或2.9ev或3.0ev或3.1ev或3.2ev的三重态能级。化合物1可包含两个或更多个本文所公开的实施例。b.化合物2在实施例中,组合物包括如下所示的化合物2。对于化合物2,r1和r2各自独立地选自经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于化合物2,组分a选自如上所述的基团a)到基团h)。对于化合物2,组分z选自cr(z)2、nrz、p(o)rz、prz、s、so、so2、sir(z)2和o。对于组分z,rz选自未经取代的烷基、未经取代的芳基和烷氧基。在实施例中,组合物包括化合物2。对于化合物2,r1和r2各自独立地选自未经取代的芳基和未经取代的杂芳基。在实施例中,组合物包括化合物2。对于化合物2,组分a为如下所示的基团a)。对于基团a),r3和r4各自独立地为氢、未经取代的芳基或未经取代的杂芳基。在实施例中,组合物包括具有基团a)的化合物2。具有基团a)的化合物2具有以下结构(viii)。对于结构(viii),r1和r2各自独立地选自经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。对于结构(viii),组分z选自cr(z)2、nrz、p(o)rz、prz、s、so、so2、sir(z)2和o。rz选自氢、未经取代的烷基、未经取代的芳基和烷氧基。在实施例中,组合物包括具有基团a)的化合物2,并且组分z为nrz。化合物2基团a)具有如下所示的结构(ix)。在实施例中,组合物包括具有基团a)的化合物2,并且组分z为p(o)rz。化合物2具有如下所示的结构(x)。在实施例中,组合物包括具有基团a)的化合物2,并且组分z为cr(z)2。化合物2具有如下所示的结构(xi)。在实施例中,组合物包括具有基团a)的化合物2,并且组分z为硫,s。化合物2具有如下所示的结构(xii)。在实施例中,组合物包括具有基团a)的化合物2,并且组分z为so2。化合物2具有如下所示的结构(xiii)。在实施例中,组合物包括化合物2。对于化合物2,组分a为以下所示的基团b)。对于基团b),r5、r6、r7和r8各自独立地选自氢、经取代的芳基、未经取代的芳基、经取代的杂芳基和未经取代的杂芳基。在实施例中,组合物包括化合物2。化合物2具有如下所示的结构(xiv)。对于结构(xiv),r1和r2各自独立地选自未经取代的芳基和未经取代的杂芳基。对于结构(xiv),组分z选自cr(z)2、nrz、p(o)rz、prz、s、so、so2、sir(z)2和o。对于组分z,rz选自氢、未经取代的烷基、未经取代的芳基和烷氧基。在实施例中,组合物包括具有基团b)的化合物2,并且组分z为nrz。化合物2具有如下所示的结构(xv)。在实施例中,组合物包括具有基团b)的化合物2,并且组分z为so2。化合物2具有如下所示的结构(xvi)。在实施例中,组合物包括具有基团b)的化合物2,并且组分z为p(o)rz。化合物2具有如下所示的结构(xvii)。在实施例中,组合物包括具有基团b)的化合物2,并且组分z为so2。化合物2具有如下所示的结构(xviii)。在实施例中,组合物包括具有基团b)的化合物2,并且组分z为so2。化合物2具有如下所示的结构(xix)。在实施例中,组合物包括化合物2。化合物2可具有如先前公开的结构(viii)到结构(xix)中的任一个。化合物2具有0.01ev或0.05ev或0.1ev或0.20ev或0.25ev到0.29ev、0.30ev或0.34ev或0.35ev或0.39ev或0.4ev的s1-t1能隙。在实施例中,组合物包括化合物2。化合物2可具有如先前公开的结构(viii)到结构(xix)中的任一个。化合物2具有1.7ev或1.9ev或2.0ev或2.5ev到2.7ev或2.9ev或3.0ev或3.1ev或3.2ev的三重态能级。化合物2可包含两个或更多个本文所公开的实施例。2.膜本公开提供一种膜。膜包括本发明组合物或以其它方式由本发明组合物形成。在实施例中,膜包括由化合物1、化合物2,或化合物1和化合物2的组合构成的组合物。化合物1和化合物2可具有本文先前公开的任何结构。在实施例中,膜包括由化合物1、化合物2,或化合物1和化合物2的组合构成的组合物。化合物1和化合物中的每一个单独地包括选自基团a)、基团b)、基团c)、基团d)、基团e)和基团f)、基团g)和基团h)的组分a。化合物2包括选自c(rz)2、nrz、p(o)rz、prz、s、so、so2、si(rz)2和o的组分z。在实施例中,膜包括由两种或更多种化合物构成的组合物。两种或更多种化合物可为(i)具有不同的基团a)到基团h)的任何两种或更多种化合物1,(ii)单独或与两种或更多种不同z组分组合具有不同的基团a)到基团h)的任何两种或更多种化合物2,和(iii)(i)和(ii)的任何组合。在实施例中,膜由通过tadf发射光形成的本发明组合物。在实施例中,膜用蒸发方法形成。在实施例中,膜在溶液方法中形成。本发明膜可包含两个或更多个本文所公开的实施例。3.装置本公开提供一种电子装置。电子装置包括至少一个组件,所述至少一个组件包括本发明组合物或以其它方式由本发明组合物形成。在实施例中,电子装置包括膜或膜层。膜或膜层包括如本文先前公开的任何膜。在实施例中,电子装置具有包括由化合物1、化合物2,或化合物1和化合物2的组合构成的组合物的组件。化合物1和化合物2可具有本文先前公开的任何结构。在实施例中,电子装置具有包括由化合物1、化合物2,或化合物1和化合物2的组合构成的组合物的组件。化合物1和化合物2中的每一种单独地包括选自基团a)、基团b)、基团c)、基团d)、基团e)和基团f)、基团g)和基团h)的组分a。化合物2包括选自c(rz)2、nrz、p(o)rz、prz、s、so、so2、si(rz)2和o的组分z。在实施例中,电子装置具有包括由两种或更多种化合物构成的组合物的组件。两种或更多种化合物可为(i)具有不同的基团a)到基团h)的任何两种或更多种化合物1,(ii)单独或与两种或更多种不同z组分组合具有不同的基团a)到基团h)的任何两种或更多种化合物2,和(iii)(i)和(ii)的任何组合。在实施例中,电子装置为有机发光二极管(oled)装置。本发明组合物可存在于以下层中的一个、一些或所有中:空穴注入层(hil)、空穴传输层(htl)、发射材料层(eml)、电子传输层(etl)和电子注入层(eil)。作为层,本发明组合物的层厚度为5纳米(nm)或10nm或20nm或25nm到30nm或35nm或40nm或50nm或60nm或70nm或80nm或90nm。在实施例中,本发明组合物为在oled装置中的主体材料。在实施例中,电子装置为其中在oled装置两端施用电流时发出可见光的oled装置。在实施例中,电子装置为oled装置,并且本发明组合物为在发射层中的掺杂剂。当本发明组合物为掺杂剂时,主体材料具有比掺杂的发射极分子更高的三重态能级。当本发明组合物为掺杂剂时,合适的主体材料的非限制性实例为(氧基双(2,1-亚苯基))双(二苯基膦氧化物)(dpepo)。附加主体材料可在yook等人“用于深蓝色磷光有机发光二极管的有机材料(organicmaterialsfordeepbluephosphorescentorganiclight-emittingdiodes)”《先进材料(adv.mater.)》2012,24,3169-3190中和在mi等人“用于在有机发光二极管中的三重态发射极的分子主体和相对应的工作原理(molecularhostsfortripletemittersinorganiclight-emittingdiodesandthecorrespondingworkingprinciple)”《中国科学化学(sci.chinachem.)》2010,53,1679中发现。在实施例中,本发明组合物在oled装置的发射层中,并且以发射层的总重量计,存在量为1.0wt%或5wt%或15wt%到25wt%或30wt%或40wt%。在实施例中,oled装置在发射层中含有本发明组合物,并且所述oled装置借助于tadf发射光。在另一实施例中,tadf-发射的光为可见光。本发明电子装置可包含两个或更多个本文所公开的实施例的组合。现将在以下实例中详细描述本公开的一些实施例。实例1.试剂和测试方法所有溶剂及试剂均获自商业销售商,包括西格玛-奥德里奇(sigma-aldrich)、combiblocks和akscientific,并且以最高可用的纯度使用和/或在必需时在使用之前再结晶。干燥溶剂购自西格玛-奥德里奇。所有涉及“水敏感性化合物”的实验都在“烘箱干燥的”玻璃器皿中在氮气气氛下或在手套箱中进行。通过在配备有zorbaxsb-c8(4.6mm×150mm,3.5微米)柱的agilent1260infinityhplc上的高效液相色谱(hplc)监测反应。在具有graceresolv筒柱的iscocombiflash系统上进行急骤色谱。除非另外指出,否则1h-nmr光谱在配备有b-acs60样品变换器和具有z-梯度的5mmpabbo宽频带探针的bruker400mhz光谱仪上获得。化学位移参考cdcl3中的tms(δ=0.00)。13c-nmr光谱(100mhz)在配备有配备有b-acs60样品变换器和具有z-梯度的5mmpabbo宽频带探针的bruker400mhz光谱仪上获得,并且参考在cdcl3中的tms(δ=0.00)。如下进行常规lc/ms研究。将五微升样品的等分试样,如“在thf中3mg/ml”,注射到agilent1200sl二元梯度液相色谱上,其经由在pi模式中操作的双喷雾电喷射(esi)接口耦合到四极-飞行时间ms系统的agilent6520qt。使用以下分析条件:柱:150mm×4.6mmid,3.5μmzorbaxsb-c8;柱温:40℃;流动相:在40分钟下75/25a/b到15/85a/b;溶剂a=在水中的0.1v%甲酸;溶剂b=thf;流量1.0ml/min;uv检测:二极管阵列210到600nm(提取波长250nm、280nm);esi条件:气体温度365℃;气体流量-8ml/min;毛细管-3.5kv;雾化器-40psi;碎裂器-145v。对于所有循环,使用2000仪器以10℃/min的扫描速率并且在氮气气氛中进行dsc。从室温到300℃、冷却到-60℃以及再加热到300℃来扫描样品(约7mg到10mg)。在第二次加热扫描时测量玻璃化转变温度(tg)。使用ta通用分析软件进行数据分析。使用“中点拐点(mid-pointofinflection)”法计算tg。2.建模所有计算采用gaussian09程序1。借助混合密度泛函理论(dft)方法b3lyp2和6-31g*基底函数组3进行计算。单态计算使用闭合壳层近似法(closedshellapproximation),并且三重态计算使用开放壳层近似法(openshellapproximation)。所有值以电子伏特(ev)引用。从单态基态的经优化几何结构的轨道能量测定homo和lumo值。将三重态能量测定为经优化三重态与经优化单重态的总能量之间的差。单态-三重态能隙为在使用含时密度泛函理论(tddft)对经优化的三重态几何结构计算的第一三重态(t1)和单态(s1)之间的能量差。1.gaussian09,修订a.02,frisch,m.j.;trucks,g.w.;schlegel,h.b.;scuseria,g.e.;robb,m.a.;cheeseman,j.r.;scalmani,g.;barone,v.;mennucci,b.;petersson,g.a.;nakatsuji,h.;caricato,m.;li,x.;hratchian,h.p.;izmaylov,a.f.;bloino,j.;zheng,g.;sonnenberg,j.l.;hada,m.;ehara,m.;toyota,k.;fukuda,r.;hasegawa,j.;ishida,m.;nakajima,t.;honda,y.;kitao,o.;nakai,n.;vreven,t.;montgomery,jr.,j.a.;peralta,j.e.;ogliaro,f.;bearpark,m.;heyd,j.j.;brothers,e.;kudin,k.n.;staroverov,v.n.;kobayashi,r.;normand,j.;raghavachari,k.;rendell,a.;burant,j.c.;iyengar,s.s.;tomasi,j.;cossi,m.;rega,n.;millam,j.m.;klene,m.;knox,j.e.;cross,j.b.;bakken,v.;adamo,c.;jaramillo,j.;gomperts,r.;stratmann,r.e.;yazyev,o.;austin,a.j.;cammi,r.;pomelli,c.;ochterski,j.w.;martin,r.l.;morokuma,k.;zakrzewski,v.g.;voth,g.a.;salvador,p.;dannenberg,j.j.;dapprich,s.;daniels,a.d.;farkas,o.;foresman,j.b.;ortiz,j.v.;cioslowski,j.;fox,d.j.,高斯公司(gaussian,inc.),康狄涅格州沃林福德(wallingfordct),2009。2.(a)becke,a.d.《化学物理杂志(j.chem.phys.)》1993,98,5648。(b)lee,c.;yang,w.;parr,r.g.《物理综述b(phys.revb)》1988,37,785。(c)miehlich,b.;savin,a.;stoll,h.;preuss,h.《化学物理快报(chem.phys.lett.)》1989,157,200。3.(a)ditchfield,r.;hehre,w.j.;pople,j.a.《化学物理杂志》1971,54,724。(b)hehre,w.j.;ditchfield,r.;pople,j.a.《化学物理杂志》1972,56,2257。(c)gordon,m.s.《化学物理快报》1980,76,163。表1.如通过b3lyp/6-31g*方法计算的homo、lumo、三重态和s1-t1能隙值。homo(ev)lumo(ev)t1(ev)s1-t1能隙(ev)结构(ii)-4.88-1.843.040.03结构(iii)-4.74-1.822.940.05结构(iv)-4.83-1.862.990.02结构(v)-4.69-1.852.920.03结构(ix)-4.80-1.802.900.03结构(x)-4.75-1.982.790.04结构(xi)-4.87-1.843.010.01结构(xii)-5.03-1.793.020.16结构(xiii)-5.18-1.823.110.08结构(xv)-4.83-1.233.160.20结构(xvi)-4.90-1.572.980.29结构(xvii)-4.92-1.523.030.32结构(xviii)-4.97-1.313.060.20结构(xix)-4.65-1.652.640.383.合成实例1.合成结构(ii)(4-溴苯基)(4,6-二苯基-1,3,5-三嗪-2-基)甲醇配备有搅拌棒和氮气入口的50ml三颈圆底烧瓶装入碘二苯基三嗪(peng,z.;haag,b.a.;knochel,p.《有机化学通讯(org.lett.)》2010,12,5398)(4.7g,13.09mmol)和无水四氢呋喃(thf,13ml),并且将烧瓶用干冰/丙酮浴冷却。经5分钟添加丁基氯化镁(在thf中2m,7.5ml,15mmol),并且将混合物在-78℃下搅拌30分钟。添加4-溴苯甲醛(2.79g,15.08mmol),并且去除干冰浴。反应物首先变成暗色,但是经一小时变成淡黄色。两小时之后在室温下用盐水猝灭反应物,并且用二氯甲烷(3×)萃取。使油水界层与有机层分离,将水留在此层中。合并的有机层经硫酸镁干燥,过滤,并且通过旋转蒸发来浓缩。将粗物质干燥加载到硅胶上,并且在combiflash(乙酸乙酯/己烷)上纯化。收集级分1b到4c,得到呈白色固体状的标题化合物(2.36g,5.64mmol,43%)。1hnmr(400mhz,氯仿-d)δ8.67-8.59(m,4h),7.68-7.59(m,2h),7.59-7.52(m,6h),7.53-7.43(m,2h),5.87(d,j=5.7hz,1h),4.97(d,j=5.8hz,1h)。(4-溴苯基)(4,6-二苯基-1,3,5-三嗪-2-基)甲酮具有氮气入口的250ml烧瓶装入仲醇(2.3g,5.5mmol)和二氯甲烷(65ml),得到澄清溶液。添加二氧化锰(2.9g),并且将反应物在室温下搅拌4小时(h)。将混合物过滤通过硅藻土,并且用二氯甲烷洗涤。滤液通过旋转蒸发来浓缩,得到白色固体(1.92g,84%)。不进行进一步纯化。1hnmr(400mhz,氯仿-d)δ8.72-8.66(m,4h),8.06-7.98(m,2h),7.72-7.66(m,2h),7.67-7.60(m,2h),7.60-7.53(m,4h)。[1,1'-联苯基]-2-基(4-溴苯基)(4,6-二苯基-1,3,5-三嗪-2-基)甲醇100ml三颈圆底烧瓶装入2-溴联苯(0.760g,3.26mmol)和无水thf(40ml)并且冷却到-78℃。经5分钟添加在己烷中的1.6m正丁基锂(1.9ml,3.04mmol)并且将反应物在-78℃下搅拌30min。将在20ml无水thf中的酮(1.14g,2.74mmol)添加到锂化物质,形成暗色混合物。在-78℃下15min之后,去除冰浴,并且将反应物在室温下搅拌2h。将水、2nhcl和二氯甲烷添加到反应。水层用二氯甲烷反萃取1×,并且合并的有机层经硫酸镁干燥,过滤并且浓缩,得到1.86g的黄色固体,其不经纯化被带入下一反应。1hnmr(400mhz,氯仿-d)δ8.45-8.35(m,4h),7.86(d,j=8.7hz,2h),7.63-7.55(m,4h),7.54-7.47(m,4h),7.47-7.38(m,5h),7.39-7.32(m,2h),7.14(dd,j=7.6,1.6hz,2h)。2-(9-(4-溴苯基)-9h-芴-9-基)-4,6-二苯基-1,3,5-三嗪将叔醇(1.86g)溶解于二氯甲烷中,并且转移到100ml三颈圆底烧瓶,并且用氮气吹掉二氯甲烷。烧瓶配备有搅拌棒、热电偶、加热套和具有氮气入口的冷凝器。将乙酸(40ml)和浓盐酸(1ml)添加到所述固体,形成不溶的混合物。将反应加热到112℃维持17小时(材料经加热的前30分钟溶解)。使反应冷却到室温,并且倒入300ml的水中,使材料沉淀出。二氯甲烷(300ml)用于执行第一萃取,并且分层。水层用二氯甲烷(3×100ml)反萃取,并且合并的有机层经硫酸镁干燥,过滤,并且通过旋转蒸发来浓缩。将粗物质溶解于二氯甲烷中,并且浓缩到硅胶上,并且在combiflash上纯化以得到呈白色/粉红固体状的标题化合物(0.61g,1.1mmol,经2步40%)。1hnmr(400mhz,氯仿-d)δ8.59-8.49(m,4h),7.88(ddd,j=7.6,1.2,0.7hz,2h),7.79(ddd,j=7.6,1.3,0.6hz,2h),7.59-7.52(m,2h),7.52-7.46(m,4h),7.43(td,j=7.5,1.2hz,2h),7.37(td,j=7.5,1.3hz,2h),7.32(d,j=8.6hz,2h),6.96(d,j=8.6hz,2h)。13cnmr(101mhz,cdcl3)δ171.28,143.93,140.83,135.90,132.65,131.46,129.19,129.01,128.64,128.16,127.45,119.93。结构(ii)(ph=苯基)4-(9-(4,6-二苯基-1,3,5-三嗪-2-基)-9h-芴-9-基)-n,n-二苯基苯胺将芳基溴化物(0.610g,1.1mmol)作为二氯甲烷溶液转移到100ml3颈圆底烧瓶,并且用氮气流吹掉二氯甲烷。添加二苯胺(0.187,1.1mmol)、叔丁醇钠(0.161g,1.7mmol)和pd(巴豆基)(ptbu3)cl(0.020g,0.05mmol),并且烧瓶配备有热电偶、搅拌棒和具有氮气入口的水冷凝器。添加已用氮气鼓泡5分钟的甲苯(60ml),并且将反应加热到110℃维持2小时。使反应冷却到室温,并且过滤通过硅胶垫,并且用二氯甲烷洗涤。材料溶解于二氯甲烷(~40ml)中,并且添加丙酮(~50ml),并且将混合物在室温下搅拌30分钟,经该时间开始形成固体。添加更多丙酮(~40ml),并且将混合物放入冰箱中2小时,并且然后过滤并用丙酮洗涤,得到呈灰白色固体状的标题化合物(0.367g,52%,通过hplc,~98%纯度)。在旋转蒸发器上将滤液浓缩到~10ml,并且冷却到室温,形成通过过滤分离的更多固体。用丙酮洗涤淡黄色固体,得到第二批材料(0.154g,22%,通过hplc,~90%纯)。1hnmr(400mhz,氯仿-d)δ8.62-8.53(m,4h),8.07-8.00(m,2h),7.81-7.74(m,2h),7.60-7.53(m,2h),7.50(ddt,j=8.4,6.6,1.5hz,4h),7.46-7.36(m,4h),7.22-7.15(m,4h),7.07-7.00(m,4h),7.00-6.91(m,4h),6.90-6.84(m,2h)。13cnmr(101mhz,cdcl3)δ180.14,171.10,148.06,147.62,146.26,140.79,138.40,136.12,132.51,129.14,129.03,128.60,128.53,128.07,127.90,127.16,124.37,123.20,122.76,119.73,67.42。实例2.合成结构(ix)(4-溴苯基)(4,6-二苯基-1,3,5-三嗪-2-基)(2-(二苯氨基)苯基)甲醇50ml三颈圆底烧瓶装入(2-溴苯基)二苯胺(0.527g,1.63mmol)和无水thf(20ml),并且冷却到-78℃。经5分钟添加在己烷中的1.6m正丁基锂(1.0ml,1.6mmol),并且将反应物在-78℃下搅拌30min。将在10ml无水thf中的酮(0.547g,1.31mmol)添加到锂化物质,形成暗色混合物。在-78℃下5min之后,去除冰浴,并且将黄色反应物在室温下搅拌过夜(在1.5h完成)。将水、2nhcl和二氯甲烷添加到反应。水层用二氯甲烷反萃取1×,并且合并的有机层经硫酸镁干燥,过滤并且浓缩,得到黄色固体,其不经纯化带入下一反应。1hnmr(400mhz,氯仿-d)δ8.52-8.43(m,4h),7.86(d,j=8.7hz,2h),7.64-7.56(m,2h),7.55-7.48(m,4h),7.45(d,j=8.7hz,2h),7.35(ddd,j=7.8,6.9,2.0hz,1h),7.25-7.18(m,1h),7.12-7.03(m,4h),7.00-6.92(m,2h),6.76-6.68(m,2h),6.63-6.56(m,2h),6.55-6.43(m,2h)。9-(4-溴苯基)-9-(4,6-二苯基-1,3,5-三嗪-2-基)-10-苯基-9,10-二氢吖啶将叔醇溶解于二氯甲烷中,并且转移到50ml三颈圆底烧瓶,并且用氮气吹掉二氯甲烷。烧瓶配备有搅拌棒、热电偶、加热套和具有氮气入口的冷凝器。将乙酸(20ml)和浓盐酸(0.5ml)添加到所述固体,形成不溶的混合物。将反应加热直到112℃维持5h(材料经加热的前1h溶解,经反应的过程变成墨绿色)。使反应冷却到室温。添加二氯甲烷和水,并且分层。水层用二氯甲烷反萃取,并且合并的有机层用10wt%naoh洗涤,绿色溶液变成暗黄色。合并的有机层经硫酸镁干燥,过滤并且浓缩。将粗物质浓缩到硅胶上,并且通过急骤色谱(二氯甲烷/己烷)纯化,得到0.80g产物,经两个步骤89%。1hnmr(400mhz,氯仿-d)δ8.48-8.40(m,4h),7.59-7.50(m,4h),7.50-7.41(m,7h),7.34-7.26(m,2h),7.25-7.19(m,2h),7.09-6.97(m,4h),6.83(ddd,j=7.8,7.2,1.2hz,2h),6.35(dd,j=8.3,1.2hz,2h)。13cnmr(101mhz,cdcl3)δ171.24,145.94,141.59,140.85,136.01,132.74,132.52,131.37,131.26,130.74,130.69,128.99,128.59,128.29,127.47,125.76,120.50,120.14,114.03。结构(ix)(ph=苯基)4-(9-(4,6-二苯基-1,3,5-三嗪-2-基)-10-苯基-9,10-二氢吖啶-9-基)-n,n-二苯基苯胺将芳基溴化物(0.8g,1.2mmol)作为二氯甲烷溶液转移到250ml3颈圆底烧瓶中,并且用氮气流吹掉二氯甲烷。添加二苯胺(0.217,1.3mmol)、叔丁醇钠(0.187g,1.9mmol)和pd(巴豆基)(ptbu3)cl(colacot,t.j.等人,《有机化学杂志(j.org.chem.)》2011,76,7918-7932)(0.025g,0.06mmol),并且烧瓶配备有热电偶、搅拌棒和具有氮气入口的水冷凝器。添加已用氮气鼓泡5分钟的甲苯(68ml),并且将反应加热到110℃维持1h。使反应冷却到室温并且分配在二氯甲烷和水之间。有机层经硫酸镁干燥,过滤并且浓缩。材料通过急骤色谱(二氯甲烷/己烷)纯化以提供呈白色固体状的标题化合物。添加丙酮(~15ml),并且固体通过过滤分离,用丙酮洗涤(0.52g,0.7mmol,57%)。1hnmr(400mhz,氯仿-d)δ8.49-8.39(m,4h),7.59-7.49(m,4h),7.49-7.40(m,5h),7.29-7.21(m,4h),7.21-7.12(m,9h),7.08-6.97(m,7h),6.89(ddd,j=7.7,7.1,1.2hz,2h),6.36(dd,j=8.3,1.2hz,2h)。13cnmr(101mhz,cdcl3)δ171.08,141.72,132.38,131.41,131.37,130.64,129.20,129.02,128.53,127.20,124.37,122.75,122.58,119.97,113.93。实例3.合成结构(x)(4-溴苯基)(4,6-二苯基-1,3,5-三嗪-2-基)(2-(二苯基磷基)苯基)甲醇50ml三颈圆底烧瓶装入(2-溴苯基)二苯基膦(0.5g,1.47mmol)和无水thf(20ml)并且冷却到-78℃。经5分钟添加在己烷中的1.6m正丁基锂(1ml,1.6mmol)并且将反应物在-78℃下搅拌30min。将在thf(10ml)中的酮(0.555g,1.33mmol)添加到锂化物质,形成暗色混合物。在-78℃下5min之后去除冰浴,并且将反应物在室温下搅拌3h。反应分配在二氯甲烷和水之间。有机层经硫酸镁干燥,过滤并且浓缩,得到发粘的油状物。材料不经进一步纯化用于下一反应。10-(4-溴苯基)-10-(4,6-二苯基-1,3,5-三嗪-2-基)-5-苯基-10h-吖啶膦5-氧化物将叔醇溶解于二氯甲烷中,并且转移到50ml三颈圆底烧瓶,并且用氮气吹掉二氯甲烷。烧瓶配备有搅拌棒、热电偶、加热套和具有氮气入口的冷凝器。将乙酸(20ml)和浓盐酸(0.5ml)添加到所述固体,形成不溶的混合物。将反应加热直到112℃维持17h(材料经加热的前1h溶解)。使反应冷却到室温。添加二氯甲烷和水,并且分层。有机层用饱和碳酸氢钠洗涤,并且有机层经硫酸镁干燥,过滤并且浓缩。材料通过急骤色谱(甲醇/二氯甲烷)纯化,得到呈灰白色固体状的标题化合物(0.450g,0.066mmol,59%)。1hnmr(400mhz,氯仿-d)δ8.47-8.40(m,4h),7.78(dd,j=7.9,4.1hz,1h),7.65(ddd,j=11.9,8.2,1.4hz,2h),7.60-7.37(m,10h),7.36-7.30(m,2h),7.23-7.16(m,3h),7.12-7.02(m,1h),7.01(d,j=1.2hz,1h),7.00-6.92(m,3h)。31pnmr(162mhz,cdcl3)δ32.06。结构(x)(ph=苯基)10-(4,6-二苯基-1,3,5-三嗪-2-基)-10-(4-(二苯氨基)苯基)-5-苯基-10h-吖啶膦5-氧化物将芳基溴化物(0.45g,0.7mmol)作为二氯甲烷溶液转移到100ml3颈圆底烧瓶,并且用氮气流吹掉二氯甲烷。添加二苯胺(0.121g,0.7mmol)、叔丁醇钠(0.096g,1.0mmol)和pd(巴豆基)(ptbu3)cl(colacot,t.j.等人,《有机化学杂志(j.org.chem.)》2011,76,7918-7932)(0.014g,0.04mmol),并且烧瓶配备有热电偶、搅拌棒和具有氮气入口的水冷凝器。添加已用氮气鼓泡5分钟的甲苯(40ml)并且将反应加热到110℃维持2h。使反应冷却到室温并且分配在二氯甲烷和水之间。有机层经硫酸镁干燥,过滤并且浓缩。材料通过急骤色谱(乙酸乙酯/二氯甲烷)纯化,提供标题化合物(0.07g,14%)。1hnmr(400mhz,氯仿-d)δ8.49-8.39(m,4h),7.98-7.92(m,1h),7.73-7.64(m,2h),7.64-7.58(m,1h),7.58-7.53(m,2h),7.52-7.39(m,7h),7.24-7.13(m,7h),7.08(ddd,j=14.2,7.8,1.4hz,1h),7.05-7.00(m,4h),6.99-6.88(m,8h)。31pnmr(162mhz,cdcl3)δ31.78。实例4.合成结构(xv)2-溴-4,6-二苯基吡啶配备有氮气入口和搅拌棒的3-颈500ml圆底烧瓶装入2-二甲基氨基乙醇(4.0ml,39.76mmol)和己烷(40ml)。烧瓶然后用冰水混合物冷却到0℃。然后添加正丁基锂(在己烷中1.6m,48ml,76.8mmol),保持内部温度<5℃。使混合物在0℃下搅拌30min。在20ml小瓶中,2,4-二苯基吡啶(3.0092g,13.01mmol)溶解于己烷(10ml)中,并且然后添加到正丁基锂溶液,保持温度<5℃。然后使反应混合物在0℃下搅拌1h。然后使用干冰/丙酮混合物将温度降低到-69℃。然后缓慢添加在己烷(45ml)中的四溴甲烷(30.12g,90.82mmol),保持内部温度<-50℃。然后使混合物在-70℃下搅拌1h。然后去除干冰/丙酮混合物,并且使rbf升温到室温。在1h之后,烧瓶再冷却到0℃,并且通过添加50ml的水进行水解(观察到15℃放热)。然后将混合物倒入分液漏斗中并且用二氯甲烷萃取。合并的有机层经硫酸镁干燥,过滤,并且通过旋转蒸发来浓缩。将粗物质干燥加载到硅胶上,并且通过急骤色谱(己烷/乙酸乙酯)纯化,以提供标题化合物(3.35g,10.8mmol,83%)。1hnmr(400mhz,氯仿-d)δ8.06-8.01(m,2h),7.86(d,j=1.4hz,1h),7.68-7.63(m,2h),7.62(d,j=1.4hz,1h),7.55-7.40(m,6h)。13cnmr(101mhz,cdcl3)δ158.88,151.96,142.78,137.84,137.24,129.65,129.59,129.28,129.24,128.89,128.82,127.24,127.12,124.20,117.56。(4-溴苯基)(4,6-二苯基吡啶-2-基)甲醇配备有热电偶和搅拌棒的50ml三颈圆底烧瓶装入2-溴-4,6-二苯基吡啶(0.45g,1.45mmol)和无水thf(15ml),并且用干冰/丙酮浴冷却到<-60℃。经~5分钟逐滴添加正丁基锂(在己烷中1.6m,0.9ml,1.44mmol),保持温度低于-55℃。溶液变成黑色。在<-60℃下30分钟之后,添加4-溴苯甲醛(0.275,1.49mmol),并且去除冰浴。在20分钟之后,反应完成,但是在用水(~10ml)和2mhcl(~5ml)淬灭之前使其在室温下搅拌过夜。分层,并且水层用二氯甲烷反萃取。合并的有机层经硫酸镁干燥,过滤,并且通过旋转蒸发来浓缩。将粗暗红色油状物溶解于丙酮中,并且浓缩到硅胶上,并且通过急骤色谱(己烷/乙酸乙酯)纯化以提供呈黄色油状的标题化合物(0.36g,0.86mmol,60%)。1hnmr(400mhz,氯仿-d)δ8.14-8.07(m,2h),7.89-7.82(m,1h),7.63-7.56(m,2h),7.56-7.39(m,8h),7.39-7.34(m,2h),7.21(dd,j=1.4,0.6hz,1h),5.81(s,1h)。13cnmr(101mhz,cdcl3)δ160.51,156.12,150.70,138.57,138.21,131.74,129.46,129.28,129.13,128.94,128.86,128.77,127.16,127.10,127.05,121.85,117.84,117.78。(4-溴苯基)(4,6-二苯基吡啶-2-基)甲酮配备有搅拌棒的40ml小瓶装入仲醇(0.36g,0.86mmol)、二氯甲烷(10ml)和氧化锰(iv)(0.48,5.52mmol)。密封小瓶并且在室温下搅拌过夜。反应过滤通过硅藻土垫,用二氯甲烷(~120ml)洗涤。材料通过旋转蒸发来浓缩,得到淡黄色固体(0.30g,0.72mmol,84%)。材料不经进一步纯化带入下一反应。1hnmr(400mhz,氯仿-d)δ8.25(d,j=1.6hz,1h),8.19-8.13(m,3h),8.10-8.05(m,2h),7.81-7.75(m,2h),7.69-7.65(m,2h),7.59-7.42(m,6h)。(4-溴苯基)(2-(二苯氨基)苯基)(4,6-二苯基吡啶-2-基)甲醇50ml三颈圆底烧瓶装入(2-溴苯基)二苯胺(0.255g,0.79mmol)和无水thf(10ml)并且冷却到-78℃。经5分钟添加在己烷中的1.6m正丁基锂(0.5ml,0.8mmol),并且将反应物在-78℃下搅拌30min。将在5ml无水thf中的酮(0.3g,0.72mmol)添加到锂化物质,形成暗色混合物。在-78℃下5min之后,去除冰浴,并且将黄色反应物在室温下搅拌1.5h。将水、2nhcl和二氯甲烷添加到反应。水层用二氯甲烷反萃取1×,并且合并的有机层经硫酸镁干燥,过滤并且浓缩,得到黄色固体,其不经纯化带入下一反应。9-(4-溴苯基)-9-(4,6-二苯基吡啶-2-基)-10-苯基-9,10-二氢吖啶将叔醇溶解于二氯甲烷中,并且转移到50ml三颈圆底烧瓶,并且用氮气吹掉二氯甲烷。烧瓶配备有搅拌棒、热电偶、加热套和具有氮气入口的冷凝器。将乙酸(10ml)和浓盐酸(0.25ml)添加到固体,形成不溶的混合物。将反应加热直到112℃维持15h(材料经加热的前1h溶解,经反应的过程变成墨绿色)。使反应冷却到室温。添加二氯甲烷和水,并且分层。水层用二氯甲烷反萃取,并且合并的有机层用10wt%naoh洗涤,绿色溶液变成暗黄色。合并的有机层经硫酸镁干燥,过滤并且浓缩。将粗物质浓缩到硅胶上,通过急骤色谱(己烷/二氯甲烷)纯化,得到0.360g产物,经两个步骤78%。1hnmr(400mhz,氯仿-d)δ7.98-7.90(m,2h),7.81(d,j=1.4hz,1h),7.60-7.32(m,13h),7.22-7.15(m,2h),7.14-7.08(m,2h),7.08-6.98(m,5h),6.92-6.82(m,2h),6.37(dd,j=8.3,1.2hz,2h)。结构(xv)(ph=苯基)4-(9-(4,6-二苯基吡啶-2-基)-10-苯基-9,10-二氢吖啶-9-基)-n,n-二苯基苯胺将芳基溴化物(0.36g,0.6mmol)作为二氯甲烷溶液转移到100ml3颈圆底烧瓶中,并且用氮气流吹掉二氯甲烷。添加二苯胺(0.100,0.6mmol)、叔丁醇钠(0.083g,0.9mmol)和pd(巴豆基)(ptbu3)cl(0.012g,0.03mmol),并且烧瓶配备有热电偶、搅拌棒和具有氮气入口的水冷凝器。添加已用氮气鼓泡5分钟的甲苯(28ml),并且将反应加热到110℃维持3h。使反应冷却到室温,并且过滤通过硅胶垫,用二氯甲烷洗涤。材料通过急骤色谱(0到30%二氯甲烷/己烷)纯化以提供呈淡黄色固体状的标题化合物(0.15g,0.205mmol,34%)。1hnmr(400mhz,氯仿-d)δ7.97-7.90(m,2h),7.80(d,j=1.4hz,1h),7.58-7.48(m,4h),7.48-7.31(m,7h),7.27-7.19(m,4h),7.19-7.08(m,9h),7.07-6.95(m,8h),6.90(td,j=7.5,1.3hz,2h),6.40(dd,j=8.2,1.1hz,2h)。13cnmr(101mhz,cdcl3)δ165.61,155.62,148.89,147.88,145.54,141.95,141.57,140.97,139.12,131.45,131.36,130.82,130.56,129.15,128.97,128.79,128.72,128.54,128.51,128.16,127.09,126.96,126.91,124.14,122.92,122.53,121.42,120.08,115.24,113.94。4.膜制备和光致发光表征代表性膜制备:在氮气吹扫的手套箱中,将实例1(结构(ii))(10.2mg)添加到配备有磁力搅拌棒的20ml螺旋盖小瓶。添加含有25wt%聚甲基-甲基丙烯酸酯(pmma)的二氯甲烷溶液(1ml)。将小瓶加盖,并且将混合物/溶液搅拌过夜。将一滴或两滴的混合物/溶液过滤通过ptfe过滤器(0.2mm)到玻璃显微镜盖玻片上并且使其干燥过夜。膜进一步在真空烘箱中在60℃下干燥48小时。然后烘箱冷却到室温,并且迅速地将膜放入手套箱直到发射表征。发射光谱和量子产率在pti荧光计上收集。根据以下参考文献在pmma掺杂膜上测量并且使用耦合到光谱仪的积分球获得量子产率:demello,j.c.;wittman,h.f.;friend,r.h.《先进材料(adv.mater.)》1997,9,230-232。使用355nm的激发波长收集发光。将膜测量三次,其中在每次测量之间,将膜去除、再定位和替换。在室温或77k下使用以355nm为中心的激发波长对在pti荧光计的样品室内的聚合物膜收集稳态或时间分辨发射曲线。膜容纳于放入顶端为石英的epr杜瓦瓶中的标准硼硅酸盐nmr管中。在用液氮填充杜瓦瓶之后采集低温光谱。利用pti荧光计的脉冲能力在相同样品上采集本文报道的时间分辨发射光谱。通过对于本发明组合物的掺杂的pmma膜收集时间分辨发射光谱获得对于s1-t1能隙的实验估计值。三重态能级(t1)被定义为在基态单态和最低能量三重态激发态之间的能量差。此值通过对在77开尔文(k)下获得的发射光谱的延迟分量的高能量侧绘制的切线的x轴交点以实验方式估计。单态能级(s1)由在基态单重态能和最低能量单态激发态之间的能量差定义。此值通过对在77k下的发射光谱的瞬时部分的高能量侧绘制的切线的x轴交点以实验方式估计。s1-t1能隙通过s1值减去t1值获得。图1示出了在室温和77k下收集的在pmma中实例1(结构(ii))的光致发光光谱。在室温下,实例1显示具有~61%的量子产率的在475nm下的发射最大值(详细参见表2)。图2示出了当溶解于氯仿中时实例1(结构(ii))的光致发光光谱。在溶液用n2鼓泡,置换在溶液中任何溶解的o2(虚线)时,发光的初始强度(黑色实线)提高。一旦比色皿盖已暂时去除,强度随后降低(点划线)。结合在一起,这些数据指示实例1(结构(ii))的激发态对o2敏感。图3示出了在77k下在pmma中实例1(结构(ii))的时间分辨发射光谱(tres)。在早期(在脉冲中)延迟中观察到更高的能量瞬时单态发射分量。在更长的延迟时间下,在更低能量下观察到三重态发射。基于此分析,估计在两个激发态之间~0.08ev的能量间隔。概述实例1到4的光物理表征的细节在表2中示出。这些数据指示高量子效率可从掺杂有由化合物1和/或化合物2构成的组合物的膜获得。另外,对于s1-t1能隙的小实验估计值与计算值良好一致,并且支持这些组合物可进行热激活延迟荧光。表2.在pmma中实例1到4的光致发光表征电致发光装置使用以下构建电致发光装置:在标准阳极(ito)和负极(al)之间htl、掺杂剂/主体(10wt%掺杂剂)和etl层,如表3中所示。homo-lumo能隙被定义为在homo值和lumo值之间的差。表3:以ev计的具有计算的能量的电致发光装置htl掺杂剂主体etl材料tpd结构(ii)dpepoalq3lumo-0.78-1.84-1.00-1.73homo-lumo能隙-3.89-3.04-5.33-3.27homo-4.67-4.88-6.33-5三重态3.13.03.442.88以下提供对于tpd、alq3和dpepo的结构。特别期望的是,本公开不限于本文所含有的实施例和说明,但包括那些实施例的修改形式,所述修改形式包括在所附权利要求书范围内出现的实施例的部分和不同实施例的要素的组合。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1