一种检测精氨酸的上转换发光纳米传感材料及在精氨酸检测中的应用的制作方法
本发明属于分析化学技术领域,具体涉及一种新型用于检测精氨酸的溶酶体细胞定位发光共振能量转移机理的比率发光上转换纳米传感材料。
背景技术:
在构成蛋白质的20种氨基酸中,精氨酸是动物体内可以构成最为多样蛋白质的氨基酸之一,它在不仅是蛋白质合成的前体,也是产生一氧化氮、尿素、多胺、脯氨酸、谷氨酸、肌酸和胍丁胺等的前体。精氨酸在细胞分裂、伤口愈合、免疫功能和激素的释放中起着至关重要的作用。
但是由于精氨酸具有强亲水性及其与受体间弱的相互作用,使其检测面临极大的挑战。目前已经报道的探针很少,2015年parveen,s.d.s.等人和2014年he,l.分别报道了两例检测精氨酸的化学探针【parveen,s.d.s.,affrose,a.,pitchumani,k.,2015.sens.actuatorsb221,521-527.he,l.;so,v.l.l.;xinj.h.;2014.sens.actuatorsb192,496-502.】。
分子成像标记材料包括有机染料、荧光蛋白、量子点、稀土纳米材料等等,传统的生物标记染料具有水溶性好、易于标记等特点,但一般基于单光子激发,光源处于紫外或可见光区,长时间激发可能会对生物造成伤害,另外无法避免生物体的自发荧光,组织穿透能力差。上转换发光材料由近红外光激发,发射谱带窄,寿命常、反斯托克斯位移大、光稳定性强等特点。另外,比率型荧光探针可以同时检测两个不同波长处的荧光强度,建立内部标度,可以克服单一荧光探针由于如仪器效率、检测环境、探针浓度等因素影响检测信号的问题。
溶酶体是细胞中一种重要的亚细胞器,其内部由单层膜结构组成的囊状颗粒,大小在0.025微米到0.8微米之间。溶酶体内部含有丰富的水解酶,到目前为止已发现60多种,例如:蛋白水解酶、核酸水解酶、脂肪水解酶、磷酸酯水解酶、糖苷水解酶等,主要用于分解和代谢细胞内的蛋白和大分子。溶酶体内丰富的水解酶使其内部的ph值保持在5左右,此时的溶酶体活性最高。当外界物种进入溶酶体后,溶酶体内的水解酶会发挥作用将外来物种分解为细胞所需的物质。当溶酶体内的膜结构发生破坏时,其内部大量水解酶会逸出到细胞内,使得细胞发生自溶。因此,溶酶体在细胞内发挥着至关重要的作用。如果探针能够实现溶酶体定位,对细胞溶酶体进行实时成像,就可以对正常及药物刺激下的细胞溶酶体内精氨酸变化进行相关研究。
技术实现要素:
本发明目的在于提供有机分子修饰的上转换纳米材料,具有发光共振能量转移机理的比率发光上转换纳米探针的制备方法,以及在精氨酸荧光成像方面的应用。
为实现上述目的,本发明采用的技术方案是,一种检测精氨酸的上转换发光纳米传感材料,采用以下方法制备:将稀土上转换发光纳米晶采用聚丙烯酸改性得到聚丙烯酸修饰的上转换纳米颗粒,再将化合物1组装在聚丙烯酸修饰的上转换纳米材料的表面,即得所述的检测精氨酸的上转换发光纳米传感材料;所述化合物1的结构式如下:
优选的,所述稀土上转换发光纳米晶为镱和/或铒掺杂的nayf4。
优选的,所述稀土上转换发光纳米晶粒径为13-30nm,晶格间距为0.30nm,为(110)六方晶相。
优选的,所述的稀土上转换发光纳米晶的制备方法如下:①将稀土硝酸盐和硬脂酸的乙醇溶液逐渐加热至78℃回流,然后滴加naoh的乙醇溶液,回流,混合物过滤,滤饼水洗两次,醇洗一次,真空干燥,得到稀土硬脂酸前驱体;②将稀土硬脂酸前驱体和naf加入h2o、etoh和油酸中,搅拌转移至水热反应器中,反应24小时后将反应混合物冷却,分离出沉淀物;③将chcl3和etoh加入沉淀物中,然后离心得到粗产物白色粉末,再用h2o-etoh洗三次、醇洗一次后,得到所述的稀土上转换发光纳米晶。
优选的,所述稀土硝酸盐为yno3、ybno3和erno3的混合物;yno3、ybno3和erno3的摩尔比为0.78∶0.20∶0.02。
优选的,所述将稀土上转换发光纳米晶采用聚丙烯酸改性得到聚丙烯酸修饰的上转换纳米颗粒的具体步骤如下:将稀土上转换发光纳米晶用氯仿分散得到稀土上转换发光纳米晶氯仿胶体溶液,然后滴加入nobf4的饱和二氯甲烷溶液,搅拌,然后离心分离,将沉淀物用乙醇冲洗三次再分散在n,n-二甲基甲酰胺(dmf)中,加入过量的甲苯,离心分离,产物分散入dmf中得到稀土上转换发光纳米晶的dmf溶液;将聚丙烯酸(paa)(25%皂化)的dmf溶液缓慢加入到上述稀土上转换发光纳米晶的dmf溶液,再加入丙酮搅拌,离心,然后水洗,得到聚丙烯酸修饰的上转换纳米颗粒。
优选的,将化合物1组装在聚丙烯酸修饰的上转换纳米材料的表面的具体步骤如下:将聚丙烯酸修饰的上转换纳米材料分散在水中,然后将化合物1的dmso(二甲基亚砜)溶液逐滴加入,室温下搅拌过夜,离心得到沉淀,水洗,得到所述检测精氨酸的上转换发光纳米传感材料。
所述的检测精氨酸的上转换发光纳米传感材料在精氨酸检测中的应用。
在本发明的比率发光上转换纳米纳米材料中上转换纳米颗粒一方面起到能量供体的作用,另一方面上转换纳米颗粒起到有机分子锚定位点的作用。
本发明产生的有益效果是:本发明的比率发光上转换纳米材料的激发波长为980nm,对细胞的伤害小,可以有效避免生物体的自发荧光,组织穿透能力强。以比率发光的方式检测精氨酸,作为传感器,可以同时检测两个不同波长处的荧光强度,建立内部标度,可以克服单一荧光探针由于如仪器效率、检测环境、探针浓度等因素影响检测信号的问题。并且作为新型用于检测精氨酸的溶酶体细胞定位发光共振能量转移机理的比率发光上转换传感器,具有稳定性好、抗干扰性好等优点,适用于精氨酸检测的比率生物发光成像。
附图说明
图1(a)为nayf4∶yb,er纳米粒子的电镜图像,(b)为原位制备的nayf4∶yb,er的高分辨透射电镜图像,(c)聚丙烯酸(paa)修饰的nayf4∶yb,er纳米粒子的电镜图像,(d)油酸(oa)改性的nayf4∶yb,er和聚丙烯酸(paa)改性的nayf4∶yb,er纳米粒子xrd图样;
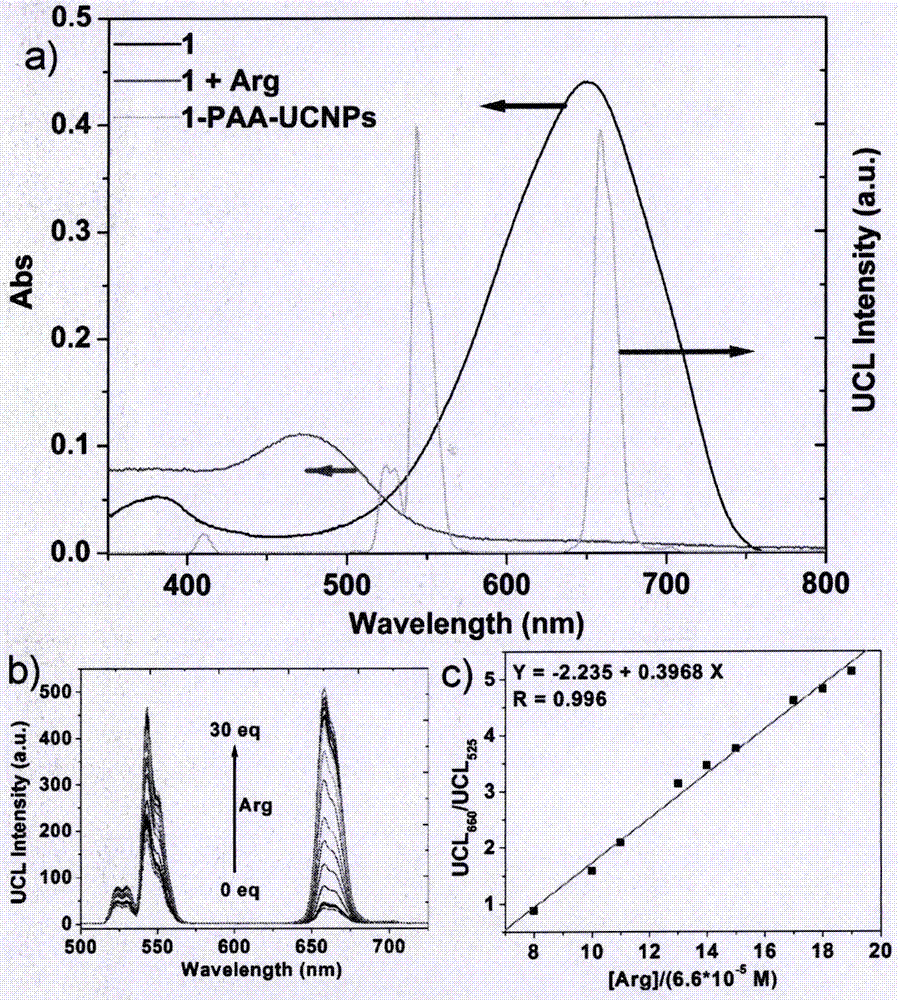
图2(a)化合物1(7.3×10-5m)在水/dmso溶液(8∶2(v/v))中的吸收光谱和paa-ucnps(0.15mg/ml)在980nm光激发下在水中的发光光谱;(b)paa-ucnps-1(0.25mg/ml)在水/dmso溶液(8∶2(v/v))中滴加精氨酸水溶液在980nm光激发下的上转换发光光谱;(c)随精氨酸浓度增加660nm处与525nm处发光强度比率线性关系图;
图3探针paa-ucnps-1[0.25mg/ml分散于8∶2(v/v)water/dmso中]在660nm处与525nm处的发光强度随精氨酸浓度(分别为1.0×10-5m,5.0×10-5m,1.0×10-4m,1.5×10-4m,2.0×10-4m,3.0×10-4m,4.0×10-4m,5.0×10-4m),激发波长980nm;(b)980nm光激发下探针paa-ucnps-1[0.25mg/ml分散于8∶2(v/v)water/dmso中]在660nm处与525nm处发光强度比率时间变化曲线;(c)980nm光激发下探针paa-ucnps-1[0.25mg/ml分散于8∶2(v/v)water/dmso中]在660nm处与525nm处发光强度比率温度变化曲线;
图4(a)在980nm光激发下paa-ucnps-1[0.25mg/ml分散于8∶2(v/v)water/dmso中]加入不同的生物相关小分子(3.6×10-4m)的上转换发光响应情况及paa-ucnps-1和精氨酸(浓度5.0×10-4m,水为溶剂)的混合物加入过量的其他生物相关小分子(3.6×10-4m)后的上转换发光响应情况,激发光波长为980nm,反应时间为20分钟;ucl660和ucl525分别代表660nm和525nm处上转换发光强度;生物相关小分子为ala,asp,glu,gly,iie,leu,lys,met,phe,pro,ser,thr,trp,tyr,val,cys,hcy,glc,和h2o2;(b)黑暗环境下的经探针paa-ucnps-1处理的hela细胞的活性测定;
图5以0.006mg/ml的paa-ucnps-1和不同浓度的精氨酸((a1)0,(a2)2.0×10-5m,和(a3)2.8×10-5m)染色15分钟的海拉细胞的共聚焦荧光图像(通道1:λex=980nm,λem=660nm);以溶酶体定位红色染料(2.0mm)和不同浓度的精氨酸((b1)0,(b2)2.0×10-5m,and(b3)2.0×10-5m)染色15分钟的海拉细胞的共聚焦荧光图像(通道2:λex=543nm,λem=590nm);(c1,c2andc3)(a)和(b)的合并图像;
图6(a)为加入paa-ucnps-1(0.006mg/ml)后的hela细胞的共聚焦显微镜图片,图6(b)、(c)为加入paa-ucnps-1(0.006mg/ml)和不同浓度的精氨酸(b2.0×10-5m,c2.8×10-5m)后hela细胞的共聚焦显微镜图片;明场图像(d,e,f)。激发波长为980nm,图像660nm处收集;图7化合物paa-ucnps,、化合物1和paa-ucnps-1的红外光谱;
图8化合物1浓度与紫外可见光谱之间关系图(外图),650nm处的吸收与强度函数关系图(插图);有机分子修饰的上转换纳米颗粒(paa-ucnps-1)中化合物1的浓度为7.51wt%,经图中函数计算得到有机分子修饰的上转换纳米颗粒(paa-ucnps-1)中的有机分子1浓度为6.6×10-5m;
图9滴加精氨酸(化合物1的0-30.0当量)水溶液反应20分钟的化合物1[1.0×10-5min8∶2(v/v)water/dmso]的吸收光谱;
图10激发波长为980nm聚丙烯酸修饰的上转换纳米颗粒paa-ucnps(0.15mg/ml)的8∶2(v/v)的水/二甲基亚砜溶液滴加精氨酸水溶液的上转换发光光谱;
图11有机分子修饰的上转换纳米颗粒paa-ucnps-1[0.25mg/mlin8∶2(v/v)water/dmso]溶液中加入不同的金属离子(0.11摩尔/升)的荧光相应强度(浅色柱analyte)及有机分子修饰的上转换纳米颗粒paa-ucnps-1[0.25mg/mlin8∶2(v/v)water/dmso]与精氨酸(2.2×10-3摩尔/升水溶液)的溶液加入过量的指定金属离子的发光强度(深色柱arg+analyte),激发波长为980nm,反应时间为20分钟;ucl660和ucl525分别代表660nm和525nm处上转换发光强度;所使用金属离子分别为na+,mg2+,k+,ca2+,mn2+,co2+和zn2+;
图12有机分子修饰的上转换纳米颗粒paa-ucnps-1[0.25mg/mlin8∶2(v/v)water/dmso]溶液中加入不同的阴离子(0.11摩尔/升)的荧光相应强度(浅色柱analyte)及有机分子修饰的上转换纳米颗粒paa-ucnps-1[0.25mg/mlin8∶2(v/v)water/dmso]与精氨酸(2.2×10-3摩尔/升水溶液)的溶液加入过量的指定阴离子的发光强度(深色柱arg+analyte),激发波长为980nm,反应时间为20分钟;ucl660和ucl525分别代表660nm和525nm处上转换发光强度。所使用阴离子分别为f-,cl-,br-,i-,n3-,no3-,clo32-,clo4-,c2o42-,sh-,s2o32-,so32-,hso32-,so42-和hpo42-。
具体实施方式
实施例1
化合物1的制备采用如下合成路线:
1)合成3-吡咯烷基-1-苯酚(化合物6):
将3-氨基苯酚(1.0913g,10.0mmol)、碳酸钾(1.5203g,11.0mmol)和1,4-二溴丁烷(1340μl,11.0mmol)溶解于10mldmf中。加热至80℃,反应2小时,冷却至室温。过柱提纯(展开剂为乙酸乙酯∶石油醚=1∶10),得到3-吡咯烷基苯酚,产率:58.8%。
表征如下:1hnmr(400mhz,dmso-d6,tms):δh7.10(t,1h),6.19(t,2h),6.09(s,1h),4.86(s,1h),3.28(t,4h),2.02(t,4h).13cnmr(100mhz,dmso-d6):δc156.55,149.47,130.06,104.81,102.57,98.69,47.71,and25.44。
2)合成2-亚硝基-5-吡咯烷-1-苯酚(化合物5):
将3-吡咯烷基苯酚(324.6毫克,2毫摩尔)溶解在12毫升的浓盐酸(37wt%)和4ml的水混合溶剂中,将亚硝酸钠(138毫克,2毫摩尔)的4毫升水溶液加入到低于5℃的上述溶液中,混合物反应1.5小时并过滤。固体用饱和醋酸钠溶液洗涤三次,获得呈红褐色固体最终产物(340毫克,产率:88.4%)。
表征如下:1hnmr(400mhz,dmso-d6,tms):δh7.30(d,1h),6.72(d,1h),5.91(s,1h),5.32(s,1h),3.44(t,4h),1.92(t,4h).13cnmr(100mhz,dmso-d6):δc173.88,169.19,156.46,134.66,117.30,96.28,49.63,and23.49。
3)合成3-甲基-7-(吡咯烷-1-)-2h-苯并[b][1,4]噁嗪-2-酮(化合物4):
将2-亚硝基-5-吡咯烷-1-苯酚(720.75毫克,2.5毫摩尔)和1563微升80%的水合肼加入到17毫升乙醇中,将混合物加热至30-40℃,然后加入41.5毫克pd-c催化剂。将上述混合物回流直至溶液的红色在氩气氛消失。加入2.5毫升丙酮酸乙酯,将反应溶液回流4小时。通过真空蒸馏得到的粗产物,并用乙酸乙酯/石油醚(1/20)为洗脱液过柱提纯得到终产物,产率为68%。
表征如下:1hnmr(400mhz,dmso-d6,tms):δh7.40(d,1h),6.56(d,1h),6.37(s,1h),3.31(t,4h),1.98(t,4h),1.26(s,3h).13cnmr(100mhz,dmso-d6):δc149.39,148.96,146.66,129.21,122.24,110.08,97.11,61.96,and48.04。
4)合成7-(吡咯烷-1-)-2h-苯并[b][1,4]噁嗪-3-甲醛(化合物3):
将3-甲基-7-(吡咯烷-1-)-2h-苯并[b][1,4]噁嗪-2-酮(345.4毫克,1.5毫摩尔)与seo2(204.4毫克,1.8毫摩尔)溶解在12ml1,4-二氧六环中,回流7小时。减压蒸馏,过柱分离提纯(展开剂为二氯甲烷/乙醇=500∶1)得到产物(式iii),产率:84.7%。
表征如下:1hnmr(400mhz,cdcl3,tms):δh10.08(s,1h),7.67(d,1h),6.68(d,1h),6.31(s,1h),3.51(t,4h),2.15(t,4h).13cnmr(100mhz,cdcl3):δc187.86,153.07,152.64,151.30,134.17,133.42,124.64,112.46,96.96,48.59,and25.33。
5)化合物2的制备:
称取4-羧基苯肼盐酸盐(500mg,2.46mmol)和氢氧化钠(98.5mg,2.46mmol)于100ml的茄形瓶中,加入适量的乙醇超声,室温条件下搅拌,溶解30min,随后将乙醇旋出,将剩余的固体转移至100ml三口瓶中,加入16ml冰乙酸溶解,再加入醋酸钠(405mg,4.94mmol),超声溶解,最后加入3-甲基-2-丁酮(397μl,3.7mmol),加热至100℃,回流16h,待反应完全后,停止反应,冷却至室温,减压蒸馏,旋出冰乙酸,用冰水冷却至0℃,慢慢加入饱和的碳酸钠溶液,直至没气泡产生为止,用盐酸调节ph=4,用二氯甲烷萃取三次,收集油相,用无水硫酸钠干燥,抽滤,再旋出二氯甲烷,得红色油状物2,3,3-三甲基-3h-吲哚-5-羧酸(405mg,产率为81%)。
将2,3,3-三甲基-3h-吲哚-5-羧酸(1.0g,4.93mmol)和碘甲烷(700mg,4.93mmol)溶解于10毫升乙腈中。混合物加热回流反应12小时,冷却至室温。过滤旋蒸除去溶剂得到化合物2(0.76g,44.7%)。
化合物2表征如下:1hnmr(400mhz,dmso-d6,tms):δh8.38(s,1h),8.19(d,1h),8.03(d,21h),4.00(s,3h),2.82(s,3h),1.57(sd,6h).13cnmr(100mhz,dmso-d6):δc199.48,166.95,142.42,141.72,132.04,130.83,124.68,115.85,54.72,35.52,21.96,and15.12。
6)化合物1的制备:
将化合物3(209.9毫克,0.64毫摩尔)和化合物2(155.3毫克,0.64毫摩尔)溶解在17毫升乙醇中,加热至78℃并回流12小时。将反应溶液冷却至室温后过滤,滤饼用乙醚洗涤三次,得到为暗绿色固体,产率:76.4%。
化合物1的表征如下:hrms(ei)m/z:calcdforc26h26n3o4[m-i],444.1923;found,444.1921.1hnmr(400mhz,dmso-d6,tms):δh8.39(s,1h),8.24(s,1h),8.19(d,1h),8.02(d,1h),7.80(d,1h),7.66(d,1h),6.96(d,1h),6.67(s,1h),4.04(s,3h),3.59(t,4h),2.00(t,4h),1.79(s,6h).13cnmr(100mhz,dmso-d6):δc166.99,153.39,145.75,143.88,133.14,131.55,131.04,127.48,124.22,115.58,114.86,98.14,52.30,49.49,34.98,26.22,and25.25。
稀土上转换发光纳米晶的制备
将y2o3(0.8807g,3.9mmol)、yb2o3(0.3941g,1.0mmol)和er2o3(0.0383g,0.1mmol)溶解于20ml浓硝酸中,加热出去过量的硝酸,得到白色粉末状的稀土的硝酸盐,y3+,yb3+和er3+的摩尔比为0.78∶0.20∶0.02;将上述稀土硝酸盐和硬脂酸8.5344g(30mmol)的80ml乙醇溶液逐渐加热至78℃回流,然后滴加naoh(1.1900g,30mmol)的20ml乙醇溶液,回流1小时。混合物过滤,滤饼水洗两次,醇洗一次,真空干燥12小时得到稀土硬脂酸前驱体。将上一步得到的稀土硬脂酸前驱体(0.9577g,1.0mmol)和naf(0.2099g,5mmol)加入10mlh2o、15mletoh(乙醇)和5ml油酸的混合溶液中,搅拌15分钟后转移至水热反应器中。150℃下反应24小时后将反应混合物冷却至60℃,分离出沉淀物。将chcl3和etoh(v/v=1∶6)共20毫升加入沉淀物中,然后离心(7800转/分钟,10分钟)得到粗产物白色粉末,再用h2o-etoh(v/v=1∶2)洗三次、醇洗一次后,得到所述的稀土上转换发光纳米晶(nayf4∶yb,er)。
制备聚丙烯酸修饰的上转换纳米颗粒
将稀土上转换发光纳米晶(nayf4∶yb,er)分散于30毫升氯仿中得到得到稀土上转换发光纳米晶(nayf4∶yb,er)氯仿胶体溶液,然后滴加入50mgnobf4的饱和二氯甲烷溶液,搅拌15分钟。然后离心分离(18000转/分,15分钟),将沉淀物用乙醇冲洗三次再分散在20毫升n,n-二甲基甲酰胺(dmf)中。加入过量的甲苯(50ml),离心分离(18000转/分,15分钟)产物分散入10毫升dmf中得到nayf4∶yb,er的dmf溶液。将300毫克的聚丙烯酸(paa)(25%皂化)的10毫升dmf溶液缓慢加入到上述nayf4∶yb,er的dmf溶液,再加入60毫升丙酮搅拌12小时,离心(18000转/分,15分钟),然后水洗,收集聚丙烯酸修饰的上转换纳米颗粒(paa-ucnps)并分散在水中得到paa-ucnps溶液。
将化合物1组装在聚丙烯酸修饰的上转换纳米材料的表面(paa-ucnps-1):
化合物1(45.72mg)的dmso(0.5ml)溶液逐滴加入圆底烧瓶中的所制备的paa-ucnps(5mg/ml)溶液中,然后混合物室温下搅拌过夜得到均相液体。混合物离心后,反复用水冲洗三次,收集固相,得到所述的检测精氨酸的上转换发光纳米传感材料(paa-ucnps-1)。(paa-ucnps-1需在去离子水中分散保持)。
本实施例中制备的检测精氨酸的上转换发光纳米传感材料作为荧光探针的应用。
本发明中有机分子修饰的上转换纳米颗粒paa-ucnps-1中的稀土纳米颗粒由溶剂热法制备,paa修饰的稀土纳米颗粒由配体交换过程制备。如图1所示有机分子修饰的上转换纳米材料(paa-ucnps-1)的电镜图片可以看到纳米颗粒的尺寸形状均一,颗粒直径在13nm到30nm之间。其高分辨电镜显示晶格间距为0.30nm,对应于nayf4∶yb,er纳米颗粒的(110)六方晶相。原位(油酸)制备的nayf4∶yb,er和paa-ucnps的xrd图样与标准图样相一致(jcpds28-1192),说明表面修饰并未改变纳米颗粒晶相。
图2中化合物1的吸收光谱和纳米颗粒paa-ucnps在980nm光激发下在水中的发光光谱相重叠,识别精氨酸后化合物1的吸收光谱蓝移,使得有机分子修饰的上转换纳米颗粒的发光出现比率变化(图3);并且种变化不随时间和温度的变化而变化。
由图4可以看到精氨酸影响有机分子探针的吸收光谱和荧光发射光谱,对上转换纳米颗粒的发光没有影响,并且除精氨酸外的其他生物相关小分子ala,asp,glu,gly,iie,leu,lys,met,phe,pro,ser,thr,trp,tyr,val,cys,hcy,glc,和h2o2对上转换发光无影响。暗毒性测试表明在测试浓度下有机分子修饰的上转换纳米颗粒探针paa-ucnps-1对细胞毒性较小;图5的hela细胞的共聚焦显微镜图片证实复合细胞实验(图5、图6)证明有机分子修饰的上转换纳米探针paa-ucnps-1可以实现溶酶体细胞定位,并以比率发光的方式实现精氨酸的细胞检测成像。
图7的化合物paa-ucnps、1和paa-ucnps-1的红外光谱证实有机荧光探针负载于复合上转换纳米探针;图8化合物1浓度与紫外可见光谱之间关系图和650nm处的吸收与强度函数关系图确认负载的有机荧光探针的量;图9滴加精氨酸水溶液反应20分钟的化合物1的吸收光谱和图10激发波长为980nm聚丙烯酸修饰的上转换纳米颗粒paa-ucnps溶液滴加精氨酸水溶液的上转换发光光谱证实精氨酸对有机化合物1的吸收光谱和上转换纳米颗粒的发光光谱的不同作用,是其机理的重要证据。图11有机分子修饰的上转换纳米颗粒paa-ucnps-1识别精氨酸的na+,mg2+,k+,ca2+,mn2+,co2+和zn2+金属离子和f-,cl-,br-,i-,n3-,no3-,clo32-,clo4-,c2o42-,sh-,s2o32-,so32-,hso32-,so42-和hpo42-阴离子干扰实验证实有机复合上转换纳米颗粒paa-ucnps-1具有很好的抗干扰性。
综上所述,本发明提供了一种新型用于检测精氨酸的溶酶体细胞定位发光共振能量转移机理的比率发光上转换纳米探针。该纳米探针在精氨酸的发光呈现出比率变化。该传感器具有很好的精氨酸检测性质,很好的光和热稳定性、抗干扰性,适用于检测精氨酸的比率的生物发光成像。
- 还没有人留言评论。精彩留言会获得点赞!