一种基于生物炭固定降解菌的土壤修复方法与流程
本发明涉及环境治理技术领域,尤其涉及一种基于生物炭固定降解菌的土壤修复方法。
背景技术:
聚丙烯酰胺(polyacrylamide,pam)以其相对高分子量、高粘度的特性而在许多行业具有广泛的应用。pam本身无毒,但其中间单体丙烯酰胺已被世界卫生组织确认为2a类污染物。随着pam的广泛使用,尤其是油田三次采油过程中聚合物驱油技术的大面积推广,大量含有pam的废弃物随着采出水一起进入环境中,在水环境和土壤中不断累积,对农产品和人体健康的潜在影响逐渐凸显。
微生物降解是自然环境中有机污染物完全矿化的主要过程,也是修复土壤有机污染的重要方法,在微生物作用下,pam被逐步分解成为丙烯酰胺、丙烯酸等小分子物质,然后进一步被完全降解。早期研究者认为微生物能在酰胺酶的作用下分解酰胺基获得氮源,因此pam能作为氮源被微生物利用,近年来不断有研究证明部分细菌在单加氧酶的氧化催化作用下,能够把pam作为碳源利用。
目前国内外对环境中pam的降解研究主要集中在液态体系中,固态体系中的研究较少,且固定化菌应用于去除土壤中pam的研究少有报道。
技术实现要素:
为了解决上述相关领域中的不足,本发明提供一种基于生物炭固定降解菌的土壤修复方法。
本发明的一种基于生物炭固定降解菌的土壤修复方法是通过以下技术方案实现的:
一种基于生物炭固定降解菌的土壤修复方法,包括:
步骤1,取样:采集待修复的土壤样本,并将所述土壤样本置于室温环境中放置保存,所述土壤样本包括含pam的土壤以及含pam的污泥;
步骤2,活化:在所述土壤样本中加入液态无机盐培养基,振荡使其活化1天,所述液态无机盐培养基与所述土壤样本的用量比为1g土:3ml无机盐培养基;
步骤3,活化完成后,加入降解材料搅拌均匀,并将处理后的土壤样本在室温条件下放置8天及以上,即可对所述土壤样本中的pam进行降解;所述降解材料包括生物炭、降解菌与固定化菌中的一种或多种。
优选地,所述生物炭是通过以下方法得到的:
步骤a,干燥:将原材料放入烘箱内干燥至含水率低于10%为止;
步骤b,过滤:分别将干燥的原材料粉碎,并过100目筛,得到粒径较小的原材料颗粒;
步骤c,炭化:将原材料颗粒混合均匀,送入马弗炉500℃热解炭化45分钟,得到炭化产物;
步骤d,浸渍:用2.5mol/l氢氧化钾溶液与冷却后的炭化产物混合均匀,混合均匀后室温放置12小时,使其充分活化;
步骤e,热解活化:缓慢倒掉上层清液,将下层产物送入烘箱烘干,然后在马弗炉800℃的条件下热解活化;
步骤f,洗涤:将冷却后的热解活化产物用3mol/l盐酸充分洗涤,去除热解活化产物的大部分灰分,然后用纯水漂洗至中性;
步骤g,将洗涤后的产物送入烘箱烘干,即得到所述生物炭。
优选地,所述固定化菌是通过以下方法得到的:
步骤a,制备生物炭溶液:将在121℃下灭菌30min的生物炭与灭菌并冷却后的lb培养液按1g生物炭加入20mllb培养液的比例制备生物炭溶液;
步骤b,制备降解菌液:在无菌环境下将甘油保藏的降解菌株接种到lb培养液里,并在35℃,140r/min的水浴锅中进行培养,培养到降解菌液od600为1.8为止;
步骤c,负载降解菌:将体积为生物炭溶液三倍的降解菌液在3500r/min下离心10min,并将离心得到的沉淀加入生物炭溶液中在35℃、80r/min条件下振荡48h,得到负载上降解菌的生物炭。
优选地,所述降解菌为降解菌pcx,所述降解菌pcx是以pam为唯一碳源和唯一氮源的克雷伯氏菌属降解菌。
优选地,所述原材料包括植物基原材料和动物基原材料中的一种或两种;所述植物基原材料包括秸秆、椰壳;所述动物基原材料包括鸡粪、污泥。
优选地,所述生物炭的用量为每克土壤0.05~0.11g生物炭。
优选地,所述降解菌的用量为每克土壤0.5×109~1.1×109cfu降解菌。
优选地,所述固定化菌的用量为每克土壤0.05g~0.11g固定化菌。
优选地,所述lb培养液包括10g/l胰蛋白胨,5g/l酵母提取物,和10g/l氯化钠。
优选地,所述液态无机盐培养基包括0.5g/l氯化钠,0.25g/l硫酸镁,0.1g/l氯化钙,0.5g/l磷酸二氢钠和1.0g/l磷酸氢二钾。
本发明相对于现有技术而言,具备以下有益效果:
1)生物炭作为pam降解菌的载体,能够强化降解菌的活性,增加和污染物接触反应的时间;
2)生物炭也可以刺激土著pam降解菌的生长,从而增强土壤修复效果,同时将农林废弃物变废为宝,实现了污染治理的可持续发展;
3)降解菌pcx能够同时以pam为唯一碳源和氮源;
4)在接菌量为5%,初始pam浓度为1.2g/l,温度35℃,初始ph为7.0,不外加氮源和碳源的条件下,培养48小时后,降解菌pcx对pam的降解率能够达到43%;
5)降解菌pcx在高效降解pam过程中的产物对水生生物无毒害作用。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。
图1为不同原材料制备生物炭的产率和碘值;
图2为污泥-椰壳生物炭的扫描电镜,放大倍数10000倍;
图3为固定化菌(生物炭固定化降解菌)的扫描电镜,放大倍数10000倍;
图4为各组处理的pam降解率;
图5为固定化菌组处理的pam降解率;
图6固定化菌用量(a)、土壤ph(b)和温度(c)对固定化菌去除土壤中pam的影响;
图7为降解菌pcx随时间变化的生长曲线和降解的曲线图;
图8为pam降解前后的红外光谱图;
图9为pam降解产物的凝胶色谱图。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。本发明中未详细说明的结构或工作原理属于现有技术和本领域的公知常识,本技术领域的技术人员应当知晓。
一种基于生物炭固定降解菌的土壤修复方法,包括:
步骤1,取样:采集待修复的土壤样本,并将所述土壤样本置于室温环境中放置保存,所述土壤样本包括含pam的土壤以及含pam的污泥;
步骤2,活化:在所述土壤样本中加入液态无机盐培养基,振荡使其活化1天,所述液态无机盐培养基与所述土壤样本的用量比为1g土:3ml无机盐培养基;
步骤3,活化完成后,加入降解材料搅拌均匀,并将处理后的土壤样本在室温条件下放置8天及以上,即可对所述土壤样本中的pam进行降解;所述降解材料包括生物炭、降解菌与固定化菌中的一种或多种。
优选地,所述生物炭是通过以下方法得到的:
步骤a,干燥:将原材料放入烘箱内干燥至含水率低于10%为止;
步骤b,过滤:分别将干燥的原材料粉碎,并过100目筛,得到粒径较小的原材料颗粒;
步骤c,炭化:将原材料颗粒混合均匀,送入马弗炉500℃热解炭化45分钟,得到炭化产物;
步骤d,浸渍:用2.5mol/l氢氧化钾溶液与冷却后的炭化产物混合均匀,混合均匀后室温放置12小时,使其充分活化;
步骤e,热解活化:缓慢倒掉上层清液,将下层产物送入烘箱烘干,然后在马弗炉800℃的条件下热解活化;
步骤f,洗涤:将冷却后的热解活化产物用3mol/l盐酸充分洗涤,去除热解活化产物的大部分灰分,然后用纯水漂洗至中性;
步骤g,将洗涤后的产物送入烘箱烘干,即得到所述生物炭。
优选地,所述固定化菌是通过以下方法得到的:
步骤a,制备生物炭溶液:将在121℃下灭菌30min的生物炭与灭菌并冷却后的lb培养液按1g生物炭加入20mllb培养液的比例制备生物炭溶液;
步骤b,制备降解菌液:在无菌环境下将甘油保藏的降解菌株接种到lb培养液里,并在35℃,140r/min的水浴锅中进行培养,培养到降解菌液od600为1.8为止;
步骤c,负载降解菌:将体积为生物炭溶液三倍的降解菌液在3500r/min下离心10min,并将离心得到的沉淀加入生物炭溶液中在35℃、80r/min条件下振荡48h,得到负载上降解菌的生物炭。
优选地,所述降解菌为降解菌pcx,所述降解菌pcx是以pam为唯一碳源和唯一氮源的克雷伯氏菌属降解菌。
优选地,所述原材料包括植物基原材料和动物基原材料中的一种或两种;所述植物基原材料包括秸秆、椰壳;所述动物基原材料包括鸡粪、污泥。
优选地,所述生物炭的用量为每克土壤0.05~0.11g生物炭。
优选地,所述降解菌的用量为每克土壤0.5×109~1.1×109cfu降解菌。
优选地,所述固定化菌的用量为每克土壤0.05g~0.11g固定化菌。
优选地,所述lb培养液包括10g/l胰蛋白胨,5g/l酵母提取物,和10g/l氯化钠。
优选地,所述液态无机盐培养基包括0.5g/l氯化钠,0.25g/l硫酸镁,0.1g/l氯化钙,0.5g/l磷酸二氢钠和1.0g/l磷酸氢二钾。
实验部分
一、实验原料
本发明所使用的降解菌为pcx降解菌,本发明所使用的降解菌pcx是根据2019年《生物技术通报》上公开的《一株聚丙烯酰胺降解菌的筛选及降解特性研究》(doi:10.7666/d.y1679044)中的方法得到的。
1.仪器设备
表1实验所涉及的主要仪器设备
2.实验药品
表2实验所涉及的主要药品
二、实验方法
1.生物炭的制备
分为6组,即实施例1-6,以不同的原材料按照上述方法制备不同的生物炭,如表3所示。
表3生物炭原材料及所对应的生物炭
2.降解菌液的制备
在超净工作台内,在无菌环境下将甘油保藏的降解菌株接种到ph中性的lb培养液里,并在35℃,140r/min的水浴锅中进行培养,培养到降解菌液od600为1.8为止。
3.固定化菌的制备
将od600为1.8条件下富集的降解菌液作为椰壳-活性污泥生物炭的负载菌液,按照上述方法,得到固定化菌,即椰壳-活性污泥生物炭固定的降解菌。
4.去除聚丙烯酰胺
(1)原料
实验土壤为不含pam的土壤。
(2)分组
土著微生物组(空白组):称取10g风干且研磨过的土壤,加入一定量聚丙烯酰胺溶液,混合均匀,于25℃的恒温环境下放置2天,制得聚丙烯酰胺浓度为1.5mg/g的土壤,于30℃条件下处理30天,期间取样测定聚丙烯酰胺浓度。
灭菌组:与土著微生物组的不同在于,将称好的土壤置于高压蒸汽灭菌锅中,在120℃温度下,灭菌2小时,在无菌环境下冷却至室温,加入聚丙烯酰胺溶液,得到聚丙烯酰胺浓度为1.5mg/g的土壤,于25℃的无菌环境下放置2天,然后按照1g土壤对应3ml水的比例补加无菌水,然后于30℃条件下处理30天,期间取样测定聚丙烯酰胺浓度。
降解菌组:与土著微生物组的不同在于,制得聚丙烯酰胺浓度为1.5mg/g的土壤后补加液态无机盐培养基,按照1g土:3ml无机盐培养基的比例加入液态无机盐培养基,震荡活化1天,然后再投加pcx降解菌,使得pcx降解菌的浓度为0.5×109cfu/g,混合均匀,于30℃条件下处理30天,期间取样测定聚丙烯酰胺浓度。
生物炭组:与土著微生物组的不同在于,制得聚丙烯酰胺浓度为1.5mg/g的土壤后补加液态无机盐培养基,按照1g土:3ml无机盐培养基的比例加入液态无机盐培养基,震荡活化1天,然后投加生物炭,投加量为0.05g/g,混合均匀,于30℃条件下处理30天,期间取样测定聚丙烯酰胺浓度。
生物炭+降解菌组:与土著微生物组的不同在于,制得聚丙烯酰胺浓度为1.5mg/g的土壤后补加液态无机盐培养基,按照1g土:3ml无机盐培养基的比例加入液态无机盐培养基,震荡活化1天,然后先投加生物炭,投加量为0.05g/g,混合均匀后投加pcx菌液,使得pcx的浓度为0.5×109cfu/g,再次混合均匀,于30℃条件下处理30天,期间取样测定聚丙烯酰胺浓度。
固定化菌:与土著微生物组的不同在于,制得聚丙烯酰胺浓度为1.5mg/g的土壤后,投加固定化菌,投加量为0.05g/g,生物炭上固定化降解菌的浓度为1.0×109cfu/g,混合均匀,于30℃条件下处理30天,期间取样测定聚丙烯酰胺浓度。
(3)聚丙烯酰胺的测定
分别将土著微生物组、降解菌组、灭菌组、生物炭组、生物炭+降解菌组和固定化菌的土样低温烘干至衡重,然后加入两倍质量的纯水,以140r/min振荡24小时,以8000r/min离心3min,收集上清液进行pam分析。采用淀粉-碘化镉法测定pam浓度。
具体是按照以下方法进行测试的:
将土样真空干燥至恒重,并与去离子水按1:2(m/v)混合,然后以140r/min振荡24小时,以8000r/min离心3min,收集上清液进行pam分析。采用淀粉-碘化镉法测定pam浓度,测定步骤如下:
1)pam储备溶液的制备:
将1.000gpam溶解在1000ml去离子水中,并在25℃的避光条件下放置1周,以获得均匀的溶液。将配制好的聚丙烯酰胺溶液用去离子水分别配制成50、100、150、200、250、300、350、400、450、500mg·l-1的聚合物溶液各50ml。
2)1mhoac-naoac缓冲溶液的配制:
将28.9ml冰醋酸加入到300ml去离子水中,滴加1%的氢氧化钠溶液,将溶液的ph值调至3.5,加入6ml酰胺溶液(50ml/l),然后用去离子水稀释至500ml。
3)0.02m溴水溶液的配制:
向300ml去离子水中加入1.60g液体br2,持续搅拌直至完全溶解,然后加去离子水定容至500ml。
4)0.04m甲酸钠溶液的配制:
将1.36g甲酸钠溶于500ml去离子水中。
5)0.25%淀粉-0.03m碘化镉溶液:
称取1.25g水溶性线状淀粉,用5ml去离子水湿润,然后加入到300ml沸腾的去离子水中,持续搅拌至溶液澄清。将溶液冷却至室温,加入5.49g碘化镉,搅拌溶解,加去离子水定容至500ml,然后用细滤纸(如whatman5号或42号)过滤溶液,以去除不溶性颗粒。
6)pam测定:
准确称取含有pam的土样1.0g于20ml带螺旋盖的玻璃瓶中。加入2ml去离子水和1mlhoac-naoac缓冲溶液并充分混合。加入1ml溴水溶液并再次混合,将小瓶装在摇床上,在室温下反应1h。加入1ml甲酸钠溶液,并充分混合,5分钟后,加入1ml淀粉-碘化镉溶液,形成蓝色络合物。
由于反应发生在颗粒表面吸附的pam与溶液中的试剂之间,因此需要在添加每个试剂后通过涡流混合器进行剧烈混合,并在反应时间内持续适度摇动,以确保完全反应。最后,用离心机分离溶液和基质颗粒,在分光光度计上以570nm的波测定蓝色上清液的吸光度,用空白试剂作参比。
(4)响应曲面实验的设计
为了优化固定化菌剂降解土壤中聚丙烯酰胺的实验条件,设计3因素、1响应值的中心组合实验,以3次平行实验的测定均值建立二次回归模型。3变量为ph(x1)、固定化菌加量(x2)、温度(x3),响应值(y)为pam降解率。应用designexpert10.0.7软件进行实验设计,如表4所示。
表4固定化微生物降解效果优化的中心复合设计
三、结果分析
1.生物炭吸附性能
按照《木制活性炭实验方法碘吸附值的测定》(gb/t12496.8-1999)测定不同种类生物炭的碘吸附值,间接表示生物炭的吸附能力,如图1所示,可以看出,秸秆生物炭的产率较低;而鸡粪生物炭的产率较高,但其碘吸附值最低,为258mg/g;其中,秸秆-污泥生物炭的产率为39.7%,碘值为525mg/g,椰壳-污泥生物炭的产率为47.5%,碘值为672mg/g。
2.生物炭的扫描电镜
如图2所示,生物炭的扫描电镜表明,由椰壳和活性污泥所制成的生物炭表面有不均匀的多孔结构,质地松散,部分表面存在片层结构;孔隙范围分布广且不均匀,大孔、中孔和小孔交错分布,部分孔隙呈现出近似平行的狭缝状细孔结构,可作为负载聚丙烯酰胺降解菌的载体材料。
3.固定化菌的扫描电镜
如图3所示,负载培养两天后,聚丙烯酰胺降解菌pcx附着在生物炭上的扫描电镜,表明生物炭可作为固定化微生物载体。从扫描电镜图上可以看出,降解菌pcx不仅分布在椰壳-活性污泥生物炭的表面,而且充满了椰壳-活性污泥生物炭的孔道结构中,同时可以看出椰壳-活性污泥生物炭的表面越粗糙,降解菌pcx与椰壳-活性污泥生物炭结合的越紧密,部分降解菌pcx成团聚集在椰壳-活性污泥生物炭表面。对比图2可以看出降解菌pcx改变了椰壳-活性污泥生物炭的表面形貌,表明椰壳-活性污泥生物炭成分中的含碳类物质可能被降解菌利用,增强了降解菌pcx与椰壳-活性污泥生物炭的附着力度。
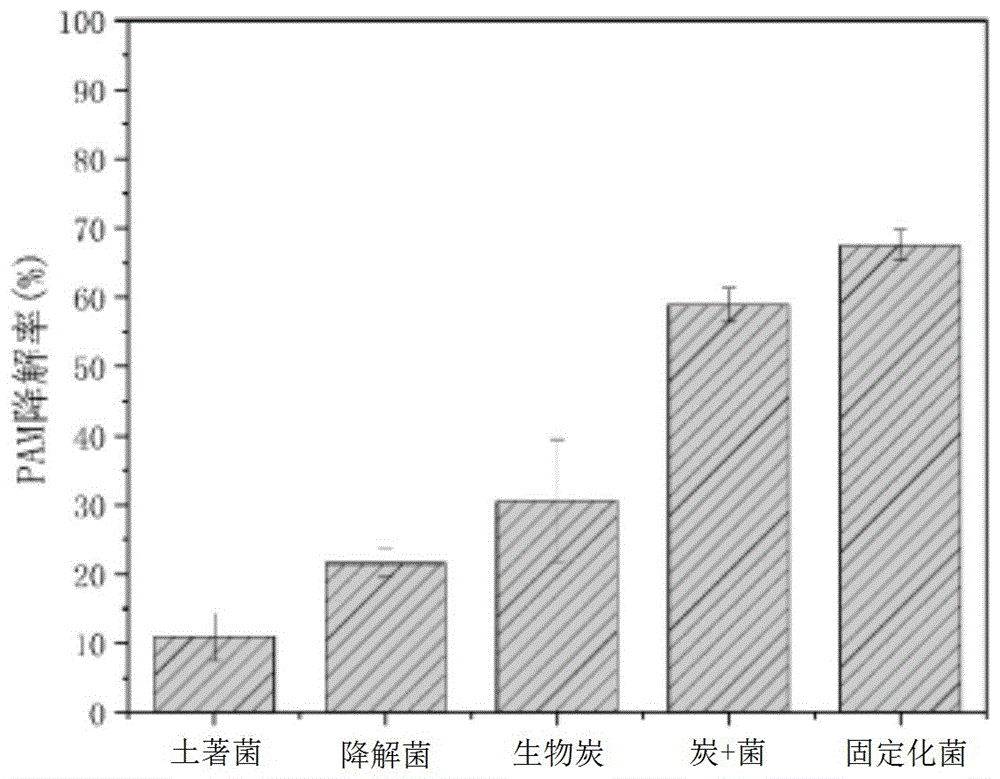
4.不同组别去除聚丙烯酰胺的效果
(1)降解菌组
天然的农田土壤中含有原位微生物,原位微生物在土壤中存在一定的数量和竞争优势,可以利用土壤中的各种营养物质。如图4所示,土著菌在第30天对pam的去除率为11%,表明土壤中存在部分可以利用pam的微生物,而且土壤中存在相应的可以分解酰胺类物质的酶。土壤灭菌后,pam去除率在第30天达到8.2%,表明自然光或者紫外的照射可能使聚丙烯酰胺发生降解,在处理过程中,自然光的作用使得少量pam碳链断裂,但本实验结果表明该降解过程十分缓慢和低效。
投加降解菌pcx到含聚丙烯酰胺土壤中,随着时间推进,pam的去除率不断升高,第30天去除率即达到21.5%,表明pcx对土壤中pam有一定的降解作用。一方面,前期实验表明降解菌pcx既能把pam作为碳源利用,又能将其作为氮源利用,在胞外酰胺酶的作用下,pam侧链的酰胺基被pcx作为氮源利用,pam的主碳链在多种酶的协同作用下断裂成小分子物质,进一步被pcx利用,转化成微生物细胞、能量、二氧化碳和水。另一方面,外源的降解菌pcx能够和土壤中的原位微生物协作共同降解pam,pcx的胞外酶先将pam断裂为小分子,小分子物质能够被一些不能直接利用pam的原位微生物利用,从而激发了原位微生物的活力,增强了降解效果。
(2)生物炭组
椰壳-活性污泥生物炭含有高浓度的碳元素,可直接为土壤提供营养,也可用作微生物的养分,同时增加了土壤的孔隙度。如图4所示,直接投加生物炭到含pam土壤中,在第30天对pam的去除率为30.6%,与不加椰壳-活性污泥生物炭的土著菌处理组比较,去除率提高了9.1%,表明椰壳-活性污泥生物炭可以增强土壤中pam的去除效果。一方面可能是椰壳-活性污泥生物炭的多孔结构具有很强的吸附性,吸附了大量了pam到生物炭表面,可以延缓高浓度pam暴露于土壤微生物的速度,起到缓冲作用。另一方面可能是生物炭在一定程度上增强了原位微生物利用pam的能力,椰壳-活性污泥生物炭表面的微孔也可以给微生物提供生长的空间,并且增加空气和水分的交换量,以及土壤中的碳氮源和可以作为碳氮源被利用的pam等营养物质的停留时间,使得土著菌的活性增强。
(3)生物炭+降解菌组
如图4所示,在处理第30天时,单独投加游离降解菌到含pam的土壤时,对pam的去除率为21.5%,单独投加椰壳-活性污泥生物炭时对pam的去除率为30.6%,同时投加椰壳-活性污泥生物炭和降解菌时pam的去除率升高至58.9%,表明椰壳-活性污泥生物炭和降解菌分别投加到土壤中,对pam降解有一定的强化作用。一方面椰壳-活性污泥生物炭施加到土壤中后,由于其疏松多孔的特性,能够为土壤留存更多氧气,加大土壤氧气的流通,有利于降解菌pcx合成代谢反应的进行,增强其对营养物质的利用,从而加强了对土壤中pam的降解效果。另一方面当先投加椰壳-活性污泥生物炭到土壤中时,椰壳-活性污泥生物炭将土壤中游离的pam吸附到表面,增加了后续降解菌pcx利用pam的时间,使得pcx利用pam的周期变长,也延缓了高浓度pam暴露于降解菌pcx的速度,起到缓冲作用。
(3)固定化菌组
固定化微生物技术与直接施加游离微生物相比,可以降低高浓度污染物对微生物的毒害、降低土壤原位微生物对降解菌的竞争优势、减少土壤ph等不利环境因素变化对微生物活动的影响,使得降解菌能够适应复杂的土壤环境。如图4所示和图5所示,投加固定化菌到含聚丙烯酰胺的土壤中,在第30天对pam的去除率为67.5%,施加相同量的降解菌,在第30天对pam的去除率为58.9%,表明固定化菌增强了pcx的降解能力,强化了土壤中pam去除的效果。一方面,固定化技术能够增强降解菌的效果,主要体现在生物炭吸附pam,延长了降解菌与其接触的时间;同时增强了降解菌pcx的利用pam的速度,不受其他微生物干扰。另一方面,生物炭的多孔结构保证了降解菌pcx的活动空间以及提供充足的氧气,同时延缓了高浓度pam对pcx的抑制作用。最后,生物炭可以为降解菌提供丰富的碳源,保证降解反应的持续进行。
对比不同处理组,可以得出固定化菌的效果最好,为了进一步研究固定化菌去除土壤中pam的影响因素,后续采用响应曲面实验优化处理条件。
5.固定化菌去除土壤中pam的响应曲面模型
根据中心复合设计(centralcompositedesign,ccd)原理,根据单因素的实验结果,选取对土壤中pam的去除较为重要和影响较为显著的3个因素,按表5设计20组实验,每组三个平行,处理30天后,实验结果如表5所示。运用designexpert10.0.7对实验结果进行多元回归模拟分析,得到回归方程如式所示:
y=66.21-4.19x1+7.63x2+8.32x3+0.84x1x2+0.36x1x3+4.94x2x3-10.13x12-9.54x22-13.34x32。
表5实验结果
为了验证上述二次多项式模型对响应结果进行模拟的显著性,对模型进行充分性和统计学意义评估(anova),分析结果见表6。
表6回归模型方差分析
由表6可以看出模型的f值和p值分别20.98和<0.0001,表明模型在95%的置信区间内显著。交互项bc显著(p=0.0408)、ac和ab不显著,p值分别为0.8666和0.6988。二次项a2、b2和c2均显著(p值小于或等于0.001)。该模型的f值为20.98,p值小于0.0001,表明方程拟合良好。此外,失拟项(lackoffit)的f值为2.87,与纯误差的相关性不显著。
(1)土壤ph对固定化菌去除土壤中pam的影响
图6b表明,随着土壤ph的降低,pam的降解率不断升高。一方面可能由于土壤的ph的变化能够引起生物炭的表面官能团发生改变,影响pam分子在生物炭表面的附着。另一方面,pam降解菌pcx偏好中性和弱酸性的环境,在该条件下能够更好的进行细胞活动和酶促反应,有利于降解从土壤迁移到生物炭表面的pam。根据等高线图可以看出,土壤ph对于pam的降解有显著的影响。ph会影响土壤中氮元素和磷元素的存在状态,在偏酸的状态下,两者更易被微生物利用,同时也会影响脲酶、酰胺酶等胞外酶促反应的正常进行。
(1)加量对固定化菌去除土壤中pam的影响
图6a表明,固定化菌加量和温度两因素之间存在较强的交互作用,这与方差分析的结果一致(p=0.0408)。当固定化菌加量接近0.07g/g时,随着温度的上升,pam降解率不断升高,这可能是因为较高的温度有利于土壤中的传质速率,有利于水分在不同组分之间的交换,加强了土壤中pam到达生物炭表面的几率,为降解菌利用pam创造了更好的条件。相反地,当固定化菌加量小于0.05g/g时,随着温度的上升,pam降解率呈现先升高后降低的趋势。总的来说,相比另外两个因素,固定化菌加量对于土壤pam的降解率的影响较小,一方面由于土壤为非均质,投加固体生物炭很难使其与土壤的各个部分充分接触,降低了降解反应的效率;另一方面实验总体反应时间较短,难以看出固定化菌投加量对于去除土壤中pam的长期效果。
(3)温度对固定化菌去除土壤中pam的影响
由图6c可以看出,ph和温度对于pam降解率的影响是极显著的(p<0.0001)。并且随着温度升高、ph降低,pam的降解率不断升高。适宜的温度和ph对土壤中微生物活动有促进作用,温度影响酶促反应的进行;土壤ph能够影响渗透压,从而影响微生物对于营养物质的吸收,两者同时影响降解菌pcx和土壤原位微生物对pam的共同作用,最终影响pam在土壤中的迁移转化和降解。
根据模型所预测的生物炭固定化降解菌对土壤中pam的降解最佳条件为ph为6.6、固定化菌加量0.07g/g、温度38.0℃,最终的预测响应值pam降解率为70.1%。根据该最佳处理条件,进行3组平行实验结果分别为71.3%、69.3%和66.8%,pam降解率的平均值69.1%,与模型预测值的相对偏差为-1.0%,表明该模型能够较好地与预测响应值拟合。
6.生物急性毒性分析
pcx接种到以聚丙烯酰胺为唯一营养源的培养基中,随时间变化的生长曲线和降解曲线如图7所示。
微生物的生长期可以分为适应期、对数增长期和稳定期。如图7所示,pcx在接种后2个小时进入对数增长期,菌体数量不断增加,聚丙烯酰胺降解率也随着菌体数的增长而升高。培养48小时后细菌进入稳定期,细菌代谢产物不断积累,细菌繁殖速度下降,相对细菌死亡数开始逐渐增加,细菌总数趋于稳定,聚丙烯酰胺降解率也在48小时后趋于平缓,达到43%。pcx在生长进入对数期后,聚丙烯酰胺的降解率也不断升高,说明pcx能够分解代谢聚丙烯酰胺,使得溶液中聚丙烯酰胺的浓度下降。
对微生物降解前后的聚丙烯酰胺进行了红外光谱分析,如图8所示,与生物降解前聚丙烯酰胺样品的光谱中的峰相比,由生物降解后的pam样品的光谱中的c=o伸缩振动峰的位置发生移动,2925cm-1为亚甲基反对称伸缩振动的特征吸收峰,2854cm-1为亚甲基对称伸缩振动的特征吸收峰。c-n伸缩振动峰(生物降解前pam样品的光谱图中在1405cm-1处)和n-h弯曲振动(生物降解前pam样品的光谱图中在1452cm-1处)消失,3300~3500cm-1波长范围内变成了一个宽大的吸收峰,表明生物降解产物中的酰胺基已经通过微生物的降解完全转化为羧基。刘永建等人的研究表明微生物可将聚丙烯酰胺作为氮源利用,其观点与本文一致,表明pam的酰胺基从pam主链上剥落并被微生物利用。
表7pam降解产物的凝胶色谱测定结果
聚丙烯酰胺经过降解菌pcx降解后的产物的凝胶色谱结果如图9和表7所示,降解产物的数均分子量(mn)、重均分子量(mw)和峰位分子量(mp)分别为602da、647da和619da。聚丙烯酰胺降解前的分子量为3×106da,表明在微生物的作用下,pam主碳链发生断裂,被降解成为小分子物质。微生物利用聚丙烯酰胺有两种方式,一方面pam的主碳链可以在氧化还原酶的作用下断裂,产生的小分子更有利于微生物利用;一方面胞外酰胺酶可以将pam侧链上的酰胺基转化为氨基,作为氮源被微生物利用。结合淀粉碘化镉测定pam浓度的结果,表明降解菌pcx可以同时将pam作为碳源和氮源加以利用,将其分解代谢为小分子物质。
半数效应浓度(ec50)是导致发光细菌发光强度产生50%变化时的测试样品的浓度。用spss软件的probit工具计算pam降解产物的生物急性毒性,软件分析结果表明聚丙烯酰胺降解产物在30分钟内对费希尔弧菌的ec50为106mg/l,其95%置信区间为28~489。根据欧盟指令(directive93/67/eec)给出的的化学品毒性分类规则,降解产物的半数致死浓度大于100mg/g,可以判定降解产物对水生生物无毒害作用。
- 还没有人留言评论。精彩留言会获得点赞!