多通道并流微流体芯片及基于该芯片的线性多相异质结构纤维的可控纺丝方法与流程
本发明属于组织工程仿生中微流体芯片制造技术领域,具体涉及一种多通道并流微流体芯片及基于该芯片的纺丝方法。
背景技术:
人体和哺乳动物体内广泛分布着诸如肌纤维、血管、肝索、神经束等线性结构的组织。在微米尺度,这些组织的细胞及细胞外基质复杂而高度有序的被组装起来。然而在组织工程领域,利用生物材料和种子细胞仿生构建各类线性结构组织以实现病变或损伤组织的再生及功能恢复至今被视为一大挑战。当前各种微制造技术的发展和兴起为实现微纳米级的、细胞及胞外基质时空可控的、“自下而上”的组织工程结构仿生和功能仿生提供了无限可能。在诸如光刻蚀技术、微模块自组装技术、微流体制备技术等组织工程微制造技术中,微流体制造技术受到广泛应用和关注。微流体技术是指在微观尺寸下控制、操作和检测复杂流体的技术,近年来被广泛应用于化学、医药及生命科学等领域。传统微流体芯片是通过常规的平面加工工艺(光刻、腐蚀等)在硅、玻璃以及聚二甲基硅氧烷(PDMS)等材料上制作的。这种方法虽然便于设计复杂的流体通道,但制作成本高、工艺难度大、通道易堵难清理。另一种常用芯片是利用一端开口处被热拉成圆锥形的玻璃毛细管首尾直线串联组装而成的同轴微流体芯片。这种芯片虽然制作难度和成本均有所降低,但所用材料(通常为玻璃)本身导致芯片易碎,并且其同轴结构决定了该芯片只可形成简单的同轴线性流体,即只能制备多层核壳结构微纤维或空心纤维,使其在微流体纺丝和组织工程仿生支架的应用中大大受限。
技术实现要素:
针对现有微流体芯片本身及其在应用中存在的不足,本发明的第一个目的是提供一种多通道并流微流体芯片,以降低微流体芯片的工艺难度和成本,提高实用耐用性;本发明的第二个目的是提供一种基于该多通道并流微流体芯片的线性多相异质结构纤维的可控纺丝方法,以连续、快速、便利的制作出各种线性多相异质结构微纳米纤维,以用于组织工程中更大程度的组织工程仿生构建。
本发明的思路:根据流体力学规律,当雷诺数Re(Re=ρvd/μ,μ为流体粘度,ρ为流体密度,v为流速,d为通道直径)低于2300时,通道中流体保持层流状态。d越小,Re值越小,因此在小至微米级的通道中,尽管是性质迥异的流体,也较容易保持层流状态,使不同成分和性质的流体可以在同一通道中并行流动,而且不会相互对流扩散及共混。
针对本发明的第一个发明目的,本发明提供一种多通道并流微流体芯片,由在水凝胶湿纺工艺或静电纺丝工艺中供不同纺丝溶液单独流通的若干根分流毛细管和一根汇聚各分流毛细管流出的各纺丝溶液的汇流毛细管组成,各分流毛细管一端以相同深度从汇流毛细管一端口平行嵌插入汇流毛细管内固定,且对汇流毛细管的承插端口进行密封,各分流毛细管的另一端为整个多通道并流微流体芯片的入口,汇流毛细管的另一端为整个多通道并流微流体芯片的出口。
上述多通道并流微流体芯片,所述各分流毛细的长度最好相同,分流毛细嵌插入汇流毛细管内的深度最好不大于汇流毛细管长度的三分之二。
上述多通道并流微流体芯片,所述分流毛细嵌插入汇流毛细管内可通过常温硬化胶粘接固定并密封汇流毛细管的承插端口。
上述多通道并流微流体芯片,所述分流毛细管至少为3根,其没有插入汇流毛细管部分形成的管束最好为向外扩展的管束,以方便与在使用时与聚四氟乙烯毛细软管连接。分流毛细管的排布方式优选为其中一根分流毛细管位于中央,其他分流毛细管均匀地位于周围,位于中央的一根分流毛细管的直径可大于其周围的分流毛细管的直径。
上述多通道并流微流体芯片,所述分流毛细管的内径为80~800μm。
针对本发明的第二个发明目的,本发明提供基于上述多通道并流微流体芯片的线性多相异质结构米纤维的可控纺丝方法,根据纺丝工艺的类型不同,分为以下两种:
水凝胶湿纺:以所述多通道并流微流体芯片作为喷丝头,利用多通道微量注射泵将各纺丝溶液分别注入喷丝头的各分流毛细管,并控制各分流毛细管中纺丝溶液的流速以层流状态汇流于汇流毛细管并行至出口喷出,在水凝胶湿纺中,喷出的溶液丝在钙离子成胶溶液中通过离子螯合作用而凝胶化形成连续的线性多相异质结构水凝胶微纤维;
静电纺丝:以所述多通道并流微流体芯片作为喷丝头,并将喷丝头竖直悬空,出口朝下放置,在喷丝头和位于喷丝头下方用于收集溶液丝的收集装置之间加载高压静电场,利用多通道微量注射泵将各纺丝溶液分别注入喷丝头的各分流毛细管,并控制各分流毛细管中纺丝溶液的流速以层流状态汇流于汇流毛细管并行至出口喷出,使喷出的溶液丝中的溶剂在抵达收集装置之前挥发,从而固化成型,得到连续的线性多相异质结构纤维。
在本发明的上述方法中,可通过在作为喷丝头的多通道并流微流体芯片构成部分的汇流毛细管出口端嵌套内径不同于汇流毛细管内径的毛细管(内径为100~800μm的毛细管)来调整线性多相异质结构纤维的直径。
在本发明的上述方法中,可通过封闭不同位置的分流毛细管进口来改变线性多相异质结构纤维的端面结构。
在本发明的上述方法中,可通过微量注射泵控制各分流毛细管中纺丝溶液的流速来调节所成微纳米纤维的直径(纤维直径在汇流毛细管出口直径左右变动,并且其直径大小与灌流速度正相关)。
在本发明的上述方法中,可通过在各分流毛细管中注入不同的纺丝溶液(如使用海藻酸钠,明胶,胶原,透明质酸等不同的水凝胶纺丝溶液),或调控纺丝溶液的浓度、成胶性能、成胶方式、收集条件来获得所需的线性多相异质结构微纳米纤维。如水凝胶湿纺中,通过使钙离子成胶溶液定向流动形成剪切流体在纤维成胶的过程中拉伸纤维使其变细,通过控制剪切流速来调控纤维拉伸程度和直径。具体可设计盛放钙离子成胶溶液收集槽为可定速旋转的圆筒形,且具有中心轴,旋转带动收集槽中的钙离子成胶溶液绕中心轴定向流动形成剪切流,纺丝溶液从浸没于钙离子成胶溶液中的多通道并流微流体芯片的出口端喷出的水凝胶纺丝溶液在成胶的同时,受到定向流动的钙离子成胶溶液的剪切拉伸而变细(其直径可小至30μm),其变细程度与收集槽的转速正相关。在静电纺丝中,通过控制环境温度、电压、纺丝液浓度等来调控纤维的直径。纤维最终尺寸与喷丝头与收集槽之间加载的静电压大小呈反向关系,而与微量注射泵的灌流速度以及汇流毛细管的直径呈正相关,与纺丝溶液浓度呈正向关系。
在本发明的上述方法中,可通过设计各分流毛细管中水凝胶纺丝溶液是否凝胶化的不同组合(如某些纺丝溶液凝胶化而其它纺丝溶液不成胶),或者在纤维凝胶化成型后在刻蚀溶液中浸泡降解掉指定的成分,来获得带有沟槽结构的多相异质结构微纳米纤维。
在本发明的上述方法中,可通过改变分流毛细管根数或/和在汇流毛细管一端口内的并排方式来获得多种结构的线性多相异质结构微纳米纤维。
在实际微流体湿纺工艺中,可以根据所需纤维的直径来有目的选择以上调控手段,或者相互结合,可以实现在30~1000μm的范围内有效调控水凝胶微纤维的直径,在200~1000nm有效调控静电纺丝纳米纤维的直径。
在本发明的上述方法中,根据组织仿生的需要,在各通道中通入对应的“组织细胞-水凝胶预聚液”的细胞悬浮液,可以在微观水平上对各种线性组织(如肌纤维、血管、肝索、神经束)的细胞种类和胞外基质的组成和空间分布实现精细的仿生构建。
与现有技术相比,本发明具有以下有益效果:
1、本发明所述多通道并流微流体芯片结构和制作工艺简单,成本低,坚固耐用,不仅克服了常规的PDMS芯片制作成本高、工艺难度大、通道易堵难清理等问题,同时也不存在玻璃同轴微流体芯片易碎和结构单一的局限性,除了用于常规的干湿纺丝工艺,也可以作为静电纺丝的喷丝头,制备线性多相异质结构微纳米纤维,应用适配性广。
2、本发明所述方法通过使用多通道并流微流体芯片,制备得到线性多相异质结构微纳米纤维,可以在组织工程应用中模仿哺乳动物天然的线性结构组织,在微纳米尺度实现细胞种类、胞外基质组分及其空间分布和结构上的组织工程仿生构建,为更大程度的仿生构建肌纤维、血管、肝索、神经束等线性结构的组织提供了可行而便利的实现方案。
附图说明
图1为本发明所述三通道并流微流体芯片的立体结构图和横截面示意图;
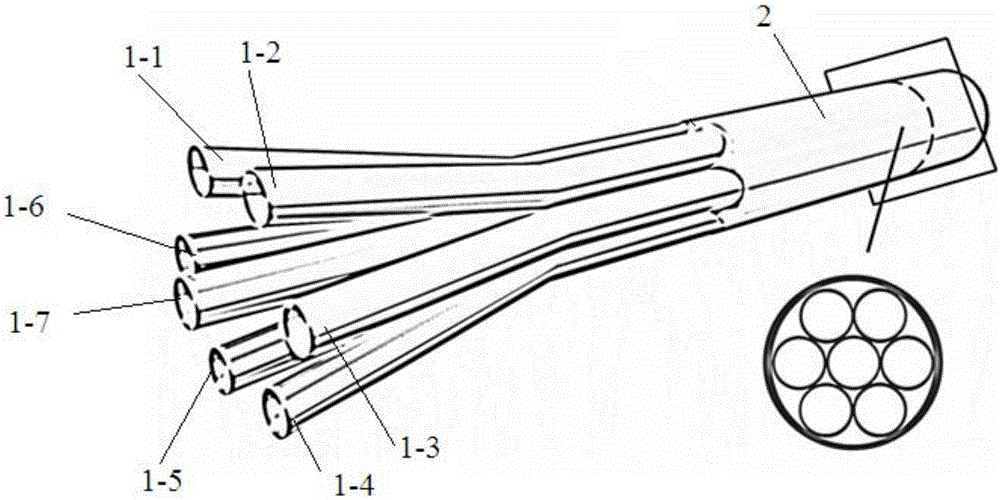
图2为本发明所述七通道并流微流体芯片的立体结构图和横截面示意图;
图3为本发明所述九通道并流微流体芯片的立体结构图和横截面示意图;
图4为各实施例利用图3中七通道并流微流体芯片制备的线性多相异质结构微纳米纤维的横截面示意图。
图中,1,1-1,1-2,1-3,1-4,1-5,1-6,1-7—分流毛细管,2—汇流毛细管。
具体实施方式
下面以七通道并流微流体芯片的制作过程,及其在微流体纺丝、静电纺丝以及组织工程仿生支架方面的应用为例,对本发明所述多通道并流微流体芯片及基于该芯片的线性多相异质结构微纳米纤维的可控纺丝方法作进一步说明。
以下实施例中,溶液的百分数浓度均为质量浓度。
实施例1
七通道并流微流体芯片的结构:
结构如图2所示,由供各纺丝溶液单独流通的7根内径80μm、外径200μm、长25mm的不锈钢分流毛细管1-1,1-2,1-3,1-4,1-5,1-6,1-7,和一根汇聚各分流毛细管流出的各纺丝溶液的内径600μm、外径900um、长25mm的不锈钢汇流毛细管2组成,各分流毛细管一端以相同深度从汇流毛细管一端口平行嵌插入汇流毛细管内,通过常温硬化胶粘接固定在汇流毛细管的该端口,且常温硬化胶对汇流毛细管的承插端口进行密封。分流毛细嵌插入汇流毛细管内的深度为10mm。分流毛细管并排的方式为使并排后形成的毛细管束的截面为正六边形,如图2所示。各分流毛细管的另一端为整个多通道并流微流体芯片的入口,汇流毛细管的另一端为整个多通道并流微流体芯片的出口。将入口端的除六边形中心以外的六根毛细管向外掰开,形成向外扩展的毛细管束。
纺丝装置的连接:
取7个10mL医用注射器,根据所需纤维结构需要,分别预装不同的纺丝溶液,并安装在多通道微量注射泵上,根据纺丝工艺需要设置好多通道微量注射泵的灌流参数(3~60mL/h)。将7根聚四氟乙烯毛细软管的一端分别与7个注射器的针头连接,根据纺丝的结构需要将7根聚四氟乙烯毛细软管的另一端与七通道并流微流体芯片入口端的7根分流毛细管连接。
实施例2
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,按照实施例1中的方式连接好纺丝装置后进行以下水凝胶湿纺。
空心管状结构微纤维纺丝:
利用多通道微量注射泵将2wt%的海藻酸钠溶液以10mL/h的速度通入的标号1-1~1-6的分流毛细管中,将5wt%的透明质酸溶液以10mL/h的速度通入标号为1-7的分流毛细管中;将汇流毛细管的出口(即七通道并流微流体芯片出口)浸没在100mmol/L的CaCl2溶液(成胶溶液)中。纺丝溶液进入CaCl2溶液时,海藻酸钠组分与Ca2+发生离子鳌合反应而凝胶化,透明质酸溶液不成胶,扩散到纤维之外的CaCl2溶液,从而形成空心海藻酸钠水凝胶微纤维,其直径为600μm,横截面如图4A所示。
实施例3
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,在5~30mL/h范围内调控海藻酸钠溶液的灌流速度,其余步骤和条件与实施例2相同,得到直径为600~1000μm的空心海藻酸钠水凝胶微纤维。
实施例4
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,在出口端嵌套不同内径300~600μm的毛细软管,其余步骤和条件与实施例2相同,得到300~600μm不等的空心海藻酸钠水凝胶微纤维。
实施例5
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,盛放CaCl2溶液的收集槽为可定速旋转的圆筒形,且具有中心轴,旋转带动收集槽中的CaCl2溶液绕中心轴定向流动形成剪切流,将七通道并流微流体芯片出口浸没在收集槽旋转驱动的定向流动的CaCl2溶液中,其余步骤和条件与实施例2相同,海藻酸钠溶液从浸没于CaCl2溶液中的多通道并流微流体芯片的出口端喷出,在成胶的同时,受到定向流动的CaCl2溶液的剪切拉伸而变细,通过设定收集槽的转速,得到直径30~300μm不等的空心海藻酸钠水凝胶微纤维。
实施例6
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,按照实施例1中的方式连接好纺丝装置后进行以下水凝胶湿纺。
核/壳结构的载细胞水凝胶仿生微纤维:
利用多通道微量注射泵分别将2wt%的海藻酸钠-施万细胞悬浮液以10mL/h的速度通入标号1-1~1-6的分流毛细管中;将2wt%的海藻酸钠-神经元细胞悬浮液以10mL/h的速度通入标号为1-7的分流毛细管中;将汇流毛细管出口浸没到100mmol/L的CaCl2溶液中。纺丝溶液进入CaCl2溶液时,海藻酸钠与Ca2+发生鳌合反应而凝胶化,从而模仿天然有髓神经纤维,形成由外围施万细胞包裹内部神经元细胞的核/壳结构的载细胞水凝胶仿生微纤维,直径约为600μm,横截面如图4B所示。
实施例7
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,按照实施例1中的方式连接好纺丝装置后进行以下水凝胶湿纺。
双色泳圈结构实心微纤维:
利用多通道微量注射泵分别将2wt%的甲基化海藻酸钠溶液以10mL/h的速度通入标号为1-1、1-3、1-5、1-7号分流毛细管中;将2wt%海藻酸钠-10wt%甲基化明胶混合溶液(内含0.5wt%的2959光引发剂)以10mL/h的速度通入标号为1-2、1-4、1-6的分流毛细管中;将汇流毛细管出口浸没到100mmol/L的CaCl2溶液中。纺丝溶液进入CaCl2溶液时,海藻酸钠与Ca2+发生鳌合反应而凝胶化,形成内含甲基化海藻酸钠、海藻酸钠-甲基化明胶的异质结构纤维,将所得异质结构纤维置于8w/cm2、365nm紫外光下照射20s,使其中的甲基化明胶和甲基化海藻酸钠发生不可逆光交联(非甲基化的纯海藻酸钠组分不发生光交联),再将光交联后的纤维在5%的柠檬酸三钠溶液中浸泡30min,标号为1-2、1-4、1-6的分流毛细管对应的纤维结构中的海藻酸钠成分被柠檬酸三钠溶液完全溶解释出,剩余纯光交联明胶成分,最后形成与标号为1-2、1-4、1-6的分流毛细管对应的纤维结构为纯明胶成分,而与标号为1-1、1-3、1-5、1-7的分流毛细管对应的纤维结构纯光交联海藻酸钠水凝胶的双色泳圈结构的实心微纤维,直径约为600μm,其横截面如图4C所示。
实施例8
将标号为1-7的分流毛细管中的流体换成不能光交联的5wt%透明质酸溶液,其它步骤和条件与实施例7相同,可得双色泳圈结构空心微纤维,直径约为600μm,横截面如图4D所示。
实施例9
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,按照实施例1中的方式连接好纺丝装置后进行以下水凝胶湿纺。
三叶草结构微纤维:
堵住标号为1-7的分流毛细管而不通任何溶液,其它步骤和条件与实施例7相同,可得到由光交联明胶与光交联海藻酸钠水凝胶交替组成的三叶草型异质结构微纤维,直径约为600μm,其横截面示意图如图4E所示。
实施例10
三叶草沟槽结构微纤维:
利用多通道微量注射泵向标号为1-1、1-3、1-5、1-7的分流毛细管中通以10mL/h的速度通入2wt%的海藻酸钠溶液,向标号为1-2、1-4、1-6的分流毛细管中以10mL/h的速度通入5wt%的透明质酸溶液(不成胶),其它步骤和条件与实施例2相同,得到的三叶草沟槽结构微纤维,直径约为600μm,其横截面如图4F所示。
实施例11
以实施例1中的七通道并流微流体芯片为纺丝喷丝头,按照实施例1中的方式连接好纺丝装置后进行以下静电纺丝。
以聚乳酸为核、壳聚糖为壳的核壳结构纳米纤维:
将七通道并流微流体芯片作为纺丝喷丝头竖直悬于12cm高半空,其下方铺一层铝箔用于收集纤维。然后将高压静电发生器的输出电极与微流体芯片出口连接(铝箔不用接电极,类似于默认接地作为负极)。将壳聚糖溶于醋酸三氟乙酸溶液(醋酸与三氟乙酸的体积比为10:90)中配成4wt%的溶液,以5.0μL/min的速度通入标号1-1~1-6的分流毛细管中;将聚乳酸溶于三氟乙酸中配成12wt%的溶液,以4.0μL/min通入标号为1-7的分流毛细管中。然后开启高压静电发生器电源,设置输出电压为18kV,在喷丝头与其下方铝箔之间形成高压静电场。在高压的驱动下,纺丝液中壳聚糖(壳流)与聚乳酸(核流)在汇流毛细管中汇流并在高压静电场的驱动作用下高速喷出。同时在高压静电作用下,喷出的纺丝溶液在抵达铝箔之前,纺丝液的溶剂快速挥发,剩余溶质浓缩固化成型,最后形成500nm左右的以聚乳酸为核、壳聚糖为壳的核壳结构纳米纤维。
实施例12
在1~6μL/min范围内改变纺丝溶液的灌流速度,其他条件和步骤与实施例11相同,得到直径为200~800nm不等的以聚乳酸为核、壳聚糖为壳的核壳结构纳米纤维,并且其直径大小与灌流速度正相关。
- 还没有人留言评论。精彩留言会获得点赞!