分子印迹聚合物膜修饰-两电极电化学微流控芯片及其制备方法和应用与流程
本发明涉及微流控芯片技术领域,尤其是涉及一种分子印迹聚合物膜修饰-两电极电化学微流控芯片的制备方法及其应用。
背景技术:
微流控系统是对微小体积液体在几十到几百微米管道内操控的过程,该技术在生物医学,环境监控,食品安全监测等领域具有非常广泛的应用前景。微流控器件具备下列优点,体积小,减少试剂消耗,多样品平行检测,增加可靠性,灵敏性等优点。电化学系统可以很容易的整合到微流控芯片上,与传统的分析平台相比如质谱,光学检测等,电化学微流控具有更灵巧的样品处理,优越的灵敏度和多用途性,无需借助庞大的光学检测设备。
然而,目前这些采用微流控技术对药物定量都是依赖于待检测物质自身在一定的电位下发生氧化还原反应而产生相应的电信号,利用这些微弱的电信号对物质进行定量分析,称之为“电活性”检测。而微流控芯片本身取样量就很少,进而待测物质的量也很少,所以产生的信号极弱,检测限通常只能达到μM级。然而,实际临床药物监测中很多药物的浓度都在此范围以下,这些依赖于待测物质自身产生电信号的检测方法不能满足现实需要。另外,很多药物在电催化下也不会发生氧化还原反应,因此也不会产生电信号。所以,这些依赖于待测物质自身产生电信号而进行检测的方法存在很大的局限性。
技术实现要素:
本发明针对现有技术的不足,提出一种分子印迹聚合物膜修饰-两电极电化学微流控芯片,及其制备方法,结构简单,检测快速,制作低成本,高灵敏度,具有普适性。
为了实现上述发明目的,本发明提供以下技术方案:一种分子印迹聚合物膜修饰-两电极电化学微流控芯片,由第一基板和第二基板固定连接而成,第一基板上设有贯穿的溶液进样口,第一基板内设有检测池,两块基板之间埋设有连接溶液进样口和检测池的流通管道,第一基板的外侧面上设有金丝电极、铂丝电极和废液排出口,金丝电极和铂丝电极分别穿透第一基板外侧面至检测池中,废液排出口与检测池连通;金丝电极上修饰有分子印迹聚合物。
进一步地,金丝电极和铂丝电极外周分别套设电极插管,电极插管与第一基板外侧面固定连接。
一种如上所述分子印迹聚合物膜修饰-两电极电化学微流控芯片的生产工艺,包括以下步骤:
⑴、芯片管路的刻蚀:刻蚀两块PMMA板,得第一基板和第二基板,第一基板上刻蚀有穿透的溶液进样口,内侧面上刻蚀出槽状检测池,以及连接溶液进样口与检测池的溶液流通管路,外侧面上刻蚀出与检测池连通的废液出口,检测池底部设有电极插孔;
⑵、芯片的组装:在电极插孔外粘接电极插管,将第二基板固定连接在第一基板的内侧面上,完成芯片组装;
⑶、电极的置入:将金丝及铂丝从电极插管中插入至芯片检测池中,并将电极插管末端密封处理;
⑷、电极表面的分子印迹聚合物膜修饰:以金丝为工作电极,铂丝作为对电极和参比电极,通过溶液进样口泵入含化学药物分子和功能单体的混合溶液,进行循环伏安法扫描聚合,之后向芯片中泵入洗脱溶液,进行循环伏安法扫描洗脱,去除化学药物分子。
进一步地,步骤⑷中,聚合条件为:起止电位−1~1 V,扫速50~100 mV/s,循环30~100圈;洗脱条件为:起止电位−0.5~0.5 V,扫速50~100 mV/s,循环1~5圈。
一种如上所述分子印迹聚合物膜修饰-两电极电化学微流控芯片的应用,该应用包括化学药物检测。
进一步地,该化学药物检测为华法林钠检测,具体包括:
①、金丝作为工作电极,铂丝作为对电极和参比电极,以0.5mL/min的流速经溶液进样口注入0.1 mol/L [Fe(CN)6]3−/4−,通过循环伏安扫描,扫描条件为起止电位−0.6~0.6 V,扫速100 mV/s,循环3圈,记录最大还原峰电流;
②、以0.01~0.2 mL/min的流速经溶液进样口注入样品溶液,5 min后停止泵液;
③、以0.5 mL/min流速经溶液进样口泵入蒸馏水0.5 mL;
④、继续以0.5 mL/min的流速经溶液进样口注入[Fe(CN)6]3−/4−,记录结合华法林钠后的最大还原峰电流,计算与步骤①所得峰电流的差值,利用此差值即可计算样品中华法林钠的浓度;
⑤、最后向芯片中泵入1 mL氢氧化钠溶液,通过循环伏安法洗脱掉印迹膜中的华法林钠分子,洗脱条件为起止电位−0.5~0.5 V,扫速100 mV/s,循环2圈。
与现有技术相比,本发明具有以下优点:通过对将分子印迹技术引入到微流控芯片的制备中,构建了一种新型的微流控电化学传感器平台。该传感器能够对化学药物在内的化学小分子进行高灵敏、高特异性检测,本发明以检测药物华法林钠为例,采用基于分子印迹的“门效应”检测,结果表明检测灵敏度达8×10−12 mol/L,比传统的“电活性”检测低了5个数量级,具有超高的检测灵敏度和准确性,高于其他电化学检测器件。
(1)重量轻,可便携,多功用;
(2)检测重复性强,超高灵敏度和精确度;
(3)易操作,无需专业人员和复杂的仪器设备;
(4)允许高密度检测体系整合到一个微型器件中;
(5)与小型的电化学工作站结合可在野外和家庭诊断;
(6)该器件易制备,可实现标准化,大规模生产;
(7)可以应用于医学辅助诊断,环境监控,食品安全等检测领域,比如检测尿酸,多巴胺,毒鼠强,三聚氰胺等。
附图说明
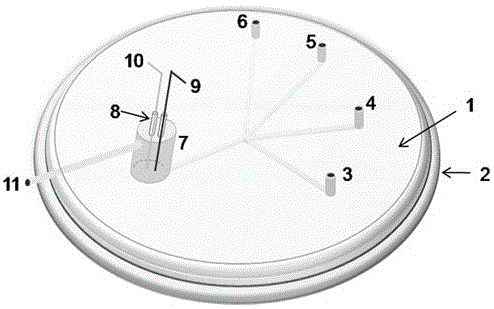
图1为分子印迹聚合物膜修饰-两电极电化学微流控芯片的结构图;
图2为所得电化学微流控芯片对系列浓度华法林钠的响应曲线;
图3为所得电化学微流控芯片对华法林钠响应电流及线性拟合;
图4为所得电化学微流控芯片测得的华法林钠在家兔血液中的药时曲线;
图5为所得电化学微流控芯片采用“电活性”检测方法对华法林钠的响应及线性。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。以下实施例中没有详细说明的操作,可以参照发明内容,发明内容也没有说明的可以参照常规操作。
本发明在电化学微流控芯片的制备中引入了分子印迹技术。分子印迹聚合物(Molecularly imprinted polymers,MIPs)是采用分子印迹技术制得的人工“抗体”,它是一种高分子聚合物,具有特定的三维结构与结合位点,可以特异性的结合预定的“抗原”,即目标检测分子。在芯片中微电极的表面修饰上分子印迹层,在不结合待检测药物分子之前,能产生电信号的小分子探针通过分子印迹层的孔穴到达电极表面,产生电信号,当分子印迹层结合了药物分子后,孔穴消失,小分子探针不能到达电极表面,进而不能产生信号,利用这种间接检测的方法来实现临床药物的分析,称之为“门效应”检测。其次,分子印迹聚合物如同“抗体-受体”一样,可特异性地结合待检测药物分子,不会结合待检测溶液中的其他分子,因此,使得检测结果不易受到样品中其他共存物质的干扰,使得结果准确、可靠。
如图1所示,一种分子印迹聚合物膜修饰-两电极电化学微流控芯片,由第一基板1和第二基板2粘接而成,第一基板1上设有贯穿的溶液进样口3,4,5,6,第一基板1内设有检测池7,两块基板之间埋设有连接溶液进样口和检测池7的流通管道,第一基板1的外侧面上设有金丝电极9、铂丝电极10和废液排出口11,金丝电极9和铂丝电极10分别穿透第一基板1外侧面至检测池7中,废液排出口11与检测池7连通;金丝电极9上修饰有分子印迹聚合物。
金丝电极9和铂丝电极10外周分别套设电极插管8,电极插管8与第一基板1外侧面固定连接。
两个基板的直径3 cm;其中流通管道深度1000 μm,宽度500 μm;圆柱形检测池底面直径3000 μm,高5000 μm,检测容积约为50 μL。
两个基板采用液体胶粘接,粘接温度最佳为50~80℃,时间为0.5~6min;最佳为50 ℃,时间为4 min。
两根电极直径分别为金丝400 μm、铂丝450 μm,插入深度均为5000 μm。
实施例1
一种分子印迹聚合物膜修饰-两电极电化学微流控芯片的制备,包括以下步骤:
(1)芯片管路的刻蚀:采用绘图软件设计微流控管道绘制掩模板,之后利用激光刻蚀机对聚甲基丙烯酸甲酯板进行刻蚀,得到基板1和基板2,其中基板1包括四个溶液进样口3、4、5、6及相应的溶液流通管路,检测池7和废液出口11;
(2)芯片的组装:将各外接聚四氟乙烯管路及电极插管8用液体胶粘接在相应的聚甲基丙烯酸甲酯基板预留口中,之后将两块基板粘在一起,置于50 ℃下4 h,使胶体固化粘结,完成芯片组装;
(3)电极的置入:将金丝9及铂丝10从电极插管8中插入至芯片检测池7中,将插管末端用银胶封口,使整个检测池密闭,防止溶液泄露。
(4)电极表面的分子印迹聚合物修饰:将芯片中电极与电化学工作站相连,以金丝9为工作电极,首先通过溶液进样口向芯片中泵入含华法林钠和功能单体的混合溶液,进行循环伏安法扫描聚合,聚合条件为起止电位−1 V~1 V,扫速50 mV/s,循环50圈,之后向芯片中泵入氢氧化钠溶液,进行循环伏安法扫描洗脱,洗脱条件为起止电位−0.5~0.5 V,扫速50 mV/s,循环2圈。
实施例2
一种分子印迹聚合物膜修饰-两电极电化学微流控芯片的制备,包括以下过程:
(1)芯片管路的刻蚀:采用绘图软件设计微流控管道绘制掩模板,之后利用激光刻蚀机对聚二甲基硅氧烷板进行刻蚀,得到基板1和基板2,其中基板1包括四个溶液进样口3、4、5、6及相应的溶液流通管路,检测池7和废液出口11;
(2)芯片的组装:将各外接聚四氟乙烯管路及电极插管8用液体胶粘接在相应的聚二甲基硅氧烷基板预留口中,之后将两块基板粘在一起,置于80 ℃下0.5 h,使胶体固化粘结,完成芯片组装;
(3)电极的置入:将金丝9及铂丝10从电极插管中插入至芯片检测池中,将插管末端用固体胶封口,使整个检测池密闭,防止溶液泄露。
(4)电极表面的分子印迹聚合物修饰:将芯片中电极与电化学工作站相连,以金丝9为工作电极,首先通过溶液进样口向芯片中泵入含华法林钠和功能单体的混合溶液,进行循环伏安法扫描聚合,聚合条件为起止电位−1 V~1 V,扫速100 mV/s,循环100圈,之后向芯片中泵入0.1mol/L 氢氧化钠溶液,进行循环伏安法扫描洗脱,洗脱条件为起止电位−0.5~0.5 V,扫速100 mV/s,循环5圈。
应用实施例1
分子印迹聚合物膜修饰-两电极电化学微流控芯片对华法林钠的检测
将制备好的分子印迹聚合物膜修饰-两电极电化学微流控芯片与电化学工作站相连,其中金丝作为工作电极,铂丝作为对电极和参比电极。以0.5mL/min的流速向芯片中注入0.1 mol/L [Fe(CN)6]3−/4−,通过循环伏安扫描,扫描条件为起止电位−0.6~0.6 V,扫速100 mV/s,循环3圈,记录最大还原峰电流;之后以0.01~0.2 mL/min的流速向芯片中注入华法林钠标准溶液,5 min后停止泵液;随后以0.5 mL/min流速向芯片中泵入蒸馏水0.5 mL;继续以0.5 mL/min的流速向芯片中注入[Fe(CN)6]3−/4−,记录结合华法林钠后的最大还原峰电流。计算两次在[Fe(CN)6]3−/4−溶液中所得峰电流的差值,利用此差值即可计算样品中华法林钠的浓度;最后向芯片中泵入1 mL0.1 mol/L NaOH,通过循环伏安法洗脱掉印迹膜中的华法林钠分子,洗脱条件为起止电位−0.5~0.5 V,扫速100 mV/s,循环2圈)。
此步骤完成后继续重复上述过程,只是改变华法林钠标准溶液的浓度,即可得到该芯片对系列浓度的华法林钠的响应信号。电化学微流控芯片对WFS系列浓度响应如图2所示。可以看出,随着浓度的增加,探针产生的氧化还原峰逐渐减小。如图3所示,结合前后电流差值ΔI(μA)与WFS浓度之间呈现对数关系,因此以浓度对数(lgC)与电流前后差值(ΔI)进行线性拟合,所得回归方程为:ΔI=181.39lgC−518.21,R2=0.997(ΔI:μA;C:pmol/L),线性范围为2×10−11~4×10−9 mol/L,检测限为8×10−12 mol/L,能满足实际检测要求。
应用实施例2
分子印迹聚合物膜修饰-两电极电化学微流控芯片对家兔血液中华法林钠的检测
健康家兔3只,禁食不禁水12 h后,耳静脉采血1 mL作空白。取华法林钠粉末约10 mg,精密称定,加入5 mL生理盐水使之溶解,采用灌胃给药方式将溶液注入家兔胃中,并在药物注入完成后继续给予5~10 mL生理盐水,以确保管路中残留药物全部注入动物体内。给药完成后于特定时刻从家兔耳静脉采集血样,每次采集1 mL,置于含肝素钠的采血管中。取0.5 mL血液,加入1 mL甲醇沉淀蛋白,于4000 rpm下离心10 min后,取上清液置于新的离心管中再次离心10 min(4000 rpm)。所得上清液稀释100倍后注入微流芯片中,按照应用例1步骤进行检测,得到了华法林钠在家兔体内的药时曲线如图4所示。
对比实施例1
分子印迹聚合物膜修饰-两电极电化学微流控芯片采用“电活性”方法对华法林钠的检测
WFS分子具有较弱的电活性,国内外关于电化学华法林钠检测的工作都是利用华法林钠自身“电活性”方法建立的。为了体现本发明芯片的突出性能,利用不修饰分子印迹聚合物膜的芯片基于“电活性”方法对华法林钠进行检测。具体采用差示脉冲伏安法(Differential-Pulse Voltammetry, DPV)建立了峰电流I(μA)与WFS浓度(μM/L)的线性。如图5所示,华法林钠在0.8 V处可产生氧化峰。当浓度为5×10−6~4×10−4 mol/L时,其氧化峰电流与WFS浓度之间存在线性关系,线性方程为:I=−0.0059C−2.010,R2=0.9921(I,μA;C,μM/L),检测限为2×10−6 mol/L。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!