聚乙二醇功能化的Fe3O4纳米粒子选择性分离富集Au(III)的方法与流程
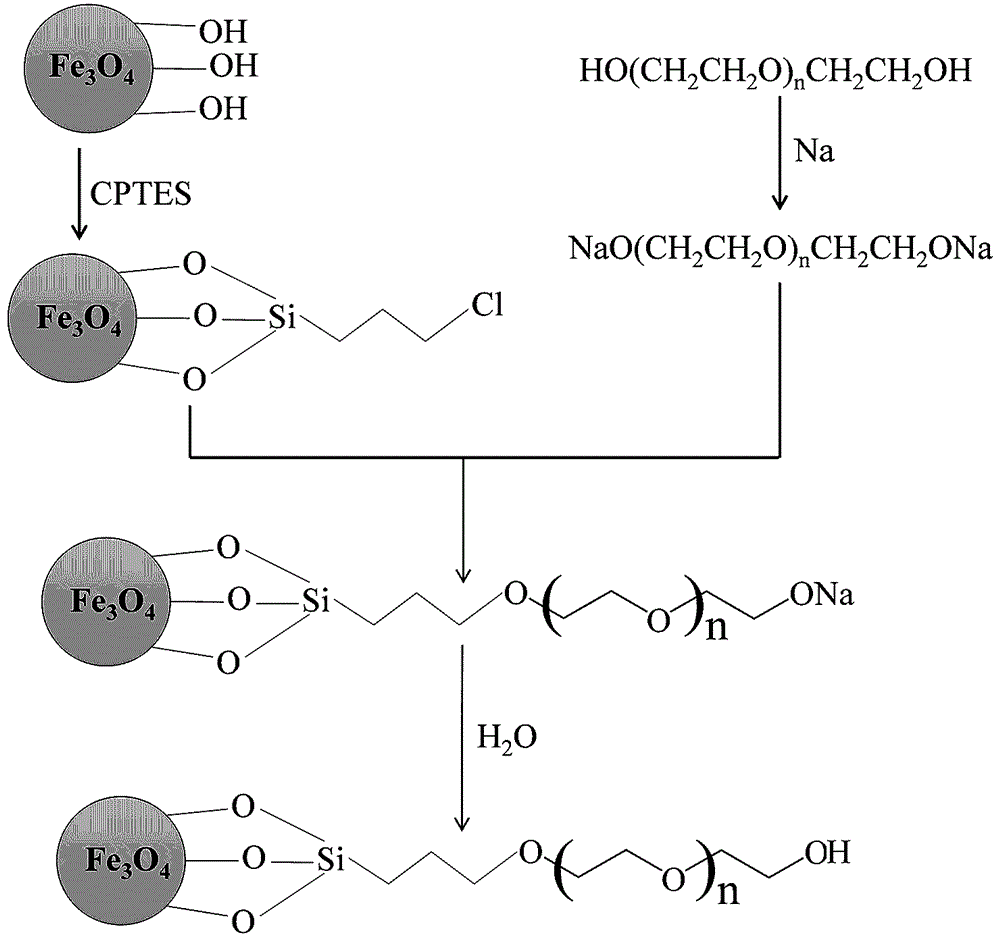
本发明涉及一种聚乙二醇功能化的fe3o4纳米粒子选择性分离富集au(iii)的方法,具体是指通过简单的两步反应将聚乙二醇修饰到fe3o4磁性纳米粒子表面上,用于在酸性(ph=1.0)haucl4水溶液中特异性吸附au(iii)。本方法属于资源再回收利用领域。
背景技术:
:黄金作为一种贵金属,在医学、电子、现代通讯等各个领域都有着重要的地位。此外,黄金因其独特的理化性质而受到公众的广泛关注。然而,令人非常遗憾的是,金矿的自然储量已开始急剧下降。因此,从二次资源中回收黄金对资源的有效利用具有十分重要的意义。在过去,人们一直致力于黄金回收方法的研究发展,其中,吸附法由于其简单、成本低、操作简单、效率高、对有毒物质不敏感等优点,被认为是目前最有希望从水溶液中回收金离子的方法。出现了比如碳纳米管,螯合树脂,活性炭,壳聚糖,氨丙基硅胶和纤维素等吸附剂。但遗憾的是,这些吸附剂的吸附能力、可重复使用性、吸附速率和选择性一直差强人意。而且,选择合适的吸附剂是实现资源环境中有效吸附金离子的关键。磁性纳米粒子由于体积小、表面积大、在溶剂中分散性好,近年来受到了广泛的关注。有报道称,一些研究人员分别将磁性纳米颗粒作为吸附剂用于铜离子、重氮离子和污染水的净化。然而,从水溶液中分离富集金离子的研究却鲜有报道。j.kim研究团队以单宁酸为吸附剂,利用光化学方法从废水中选择性、高效地回收金离子。然而,令人遗憾的是,该吸附剂由于没有很好的与磁性纳米粒子相结合,所以不能从水溶液中便捷快速地分离出来,这大大降低了该吸附剂的应用领域。虽然之后出现了一些以磁性纳米颗粒结构为内核的基础上,构建了壳聚糖和石墨碳纳米复合材料用于水溶液中金离子的分离和浓缩,然而这些吸附剂吸附能力,可重用性和化学选择性都比较差,故限制了其在很多领域的实际应用。因此,开发出以fe3o4纳米粒子为内核且具有吸附容量大、重复利用率高、吸附速率快、化学选择性高的优异性能的新型吸附剂具有很大的需求。技术实现要素:本发明要解决的技术问题在于提供一种水溶液中特异性吸附au(iii)的材料,利用这种材料可以特异性吸附水溶液中au(iii),为目前困扰金离子回收领域的种种难题提供了一种可靠的解决方法和思路。为实现上述目的,本发明所提出的聚乙二醇功能化fe3o4纳米粒子选择性分离富集au(iii)方法。其特征在于:1.一种聚乙二醇功能化的fe3o4纳米粒子选择性分离富集au(iii)的方法,其特征在于:通过两步反应(步骤见说明书附图1)将在强酸性(ph=1.0)环境中能特异性识别吸附au(iii)的聚乙二醇成功地修饰到fe3o4磁性纳米粒子上合成fe3o4@cptes@peg复合材料,这种吸附剂的合成步骤包括但不限于附图中说明的两步反应。2.如权利要求1所述的一种聚乙二醇功能化的fe3o4纳米粒子选择性分离富集au(iii)的方法,其特征在于:聚乙二醇在强酸性(ph=1.0)环境中能够特异性吸附au(iii),主要是利用了在ph=1.0中的水溶液中,h+与h2o形成h3+o后与聚乙二醇中醚键中氧原子通过氢键,结合形成带正电荷的离子缔合物{h+•a(h2o)•••b(peg)}(a和b为系数),该缔合物与带负电荷的aucl4-结合形成新的离子缔合物{h+•a(h2o)•b(peg)•••aucl4-}(a和b为系数)的特异性吸附原理,这些特异性吸附au(iii)的物质包括但不限于聚乙二醇。3.如权利要求1所述的一种聚乙二醇功能化的fe3o4纳米粒子选择性分离富集au(iii)的方法,其特征在于:利用fe3o4磁性纳米粒子易分散、可修饰性高、易被分离等优良性质,将其作为磁性材料内核,巧妙的将聚乙二醇修饰到表面,从而明显提高了吸附后的材料将其从水相中分离的容易程度,这种能作为磁性材料内核的物质包括但不限于磁性四氧化三铁(fe3o4)。4.如权利要求1所述的一种聚乙二醇功能化的fe3o4纳米粒子选择性分离富集au(iii)的方法,其特征在于:该材料不仅对ph=1.0的haucl4水溶液中的金有着优异的选择性吸附效果,而且也可用于金原矿、日用品及电子器件中金的富集、提取及检测,这些含有金且能被该材料吸附的物质包括但不限于haucl4、金原矿、日用品及电子器件。5.如权利要求1所述的一种聚乙二醇功能化的fe3o4纳米粒子选择性分离富集au(iii)的方法,其特征在于:该材料具有较高可重复利用性,吸附au(iii)后的材料可由硫酸亚铁选择性再生,简单后处理后至少可以重复利用三次及以上,这些能将吸附后的磁性材料选择性再生的物质包括但不限于硫酸亚铁。本发明的有益效果是:1)合成步骤简单,条件温和,原料易得。2)吸附容量大、重复利用率高、易被磁性分离、化学选择性高。3)为目前困扰金离子回收的种种难题提供了一种可靠的解决方法和思路。附图说明下面结合附图和具体实施方式对本发明作进一步详细的说明。图1是fe3o4@cptes@peg磁性纳米粒子的合成方法。图2是接触时间对fe3o4@cptes@peg磁性纳米粒子吸附au(iii)的影响。图3是fe3o4@cptes@peg磁性纳米粒子对au(iii)吸附的可重复利用性。图4是内蒙古阿拉善左旗的金矿粉末实际样品。图5是内蒙古阿拉善左旗的金矿粉末实际样品被王水消解后用ph=1.0的稀盐酸溶液定容配置的金离子溶液。具体实施方式实施例1:首先根据已报道的方法合成fe3o4@cptes:在250ml三口圆底烧瓶中加入200mg磁性fe3o4纳米粒子和100ml的二氯甲烷,超声分散30min分钟。之后在机械搅拌下,缓慢向其中滴加1ml3-氯丙基三乙氧基硅烷(cptes)。之后在机械搅拌和超声分散下,将此混合物反应两小时。之后停止超声,将混合物在机械搅拌下继续反应6小时。反应结束后,用磁铁收集产物,并用二氯甲烷溶液反复洗涤产物五次,并将产物在真空干燥箱中40℃下干燥,得到fe3o4@cptes(如附图1所示)。再用以下的方法合成fe3o4@cptes@peg:向100ml三口瓶中加入30ml聚乙二醇(mn=400)和1.0gna,待反应结束后加入60mgfe3o4@cptes,在超声下进行机械搅拌30min,得到分散均匀的溶液。之后去掉超声,将溶液加热至80℃反应8小时。反应结束后冷却至室温并用磁铁收集固体,之后用乙醇和超纯水交替洗涤三次,在真空干燥箱中40℃下干燥所的产物,最终得到fe3o4@cptes@peg(如附图1所示)。实施例2:在选择性吸附实验中,选择fe(iii)、mn(ii)、pb(ii)、cd(ii)、cu(ii)、cr(iii)、al(iii)、mg(ii)、zn(ii)为共存离子如表1所示。在室温和ph=1.0强酸性水溶液环境中将fe3o4@cptes@peg(10mg)磁性纳米粒子分别添加到含共存离子的10mg/lhaucl4溶液中(各离子的初始浓度为c0(mg/l))。超声机械搅拌1h,使磁性纳米粒子充分散开均匀后关闭超声继续机械搅拌24h,待吸附过程充分完成后,将fe3o4@cptes@peg磁性纳米粒子用磁铁从水溶液中去除,将上清液由0.2μm的滤膜过滤后用原子吸收仪对测试的所有金属离子进行检测,结果得到所有共存离子吸附后的浓度(各离子反应后的浓度为ce(mg/l)),结果如表1所示。故通过fe3o4@cptes@peg磁性纳米粒子可以选择性地从含fe(iii)、mn(ii)、pb(ii)、cd(ii)、cu(ii)、cr(iii)、al(iii)、mg(ii)、zn(ii)共存金属离子的水溶液中分离出au(iii)。表1共存离子对金(iii)吸附的影响组号abcdefghij共存离子fe(iii)mn(ii)pb(ii)cd(ii)cu(ii)cr(iii)al(iii)mg(ii)zn(ii)au(iii)c0(mg/l)10.010.010.010.010.010.010.010.010.010.0ce(mg/l)14.210.810.110.311.29.810.410.711.11.9实施例3:在室温和ph=1.0强酸性水溶液环境中将fe3o4@cptes@peg(10mg)磁性纳米粒子加到10mg/lhaucl4溶液中,超声机械搅拌1h,使磁性纳米粒子充分散开均匀后关闭超声继续机械搅拌20h,吸附期间每一个小时用移液枪取0.5ml吸附后的溶液,待吸附过程充分完成后,将fe3o4@cptes@peg磁性纳米粒子用磁铁从水溶液中去除,将上清液由0.2μm的滤膜过滤后用原子吸收仪对au(iii)进行检测,结果得到au(iii)吸附后的浓度,从而计算出吸附量,结果如图2所示:在10h之前磁性纳米粒子对au(iii)的吸附量逐渐增加,在10h达到饱和吸附量83mg/g,在10h以后吸附量增加的速率越来越缓慢,吸附量基本不再增加。故磁性纳米粒子对au(iii)的吸附的最佳时间为10h。实施例4:为了更好地了解fe3o4@cptes@peg磁性纳米粒子的可重复利用性,在室温和ph=1.0强酸性水溶液环境中将fe3o4@cptes@peg(10mg)磁性纳米粒子加到10mg/lhaucl4溶液中,超声机械搅拌1h,使磁性纳米粒子充分散开均匀后关闭超声继续机械搅拌10h,待吸附过程充分完成后,将fe3o4@cptes@peg磁性纳米粒子用磁铁从水溶液中分离,用超纯水和乙醇依次洗涤三次后放置于60摄氏度真空烘箱中干燥8h。之后磁性纳米材料被分散在硫酸亚铁(feso4)溶液中,超声机械搅拌1h,使磁性纳米粒子充分散开均匀后关闭超声继续机械搅拌12h,待充分反应后,将fe3o4@cptes@peg磁性纳米粒子用磁铁从水溶液中分离,用超纯水和乙醇依次洗涤三次后放置于60摄氏度真空烘箱中干燥8h。每次磁性纳米粒子对au(iii)的吸附后的溶液用0.2μm滤膜进行过滤,原子吸收仪检测每次循环吸附前后的浓度,计算相应的饱和吸附量。按照这个步骤重复吸附和解吸三次,结果如图3所示:在如此吸附和脱附循环三次以后,该磁性纳米粒子对au(iii)的最大吸附能力仍然可以达到76mg/g,说明材料可以被硫酸亚铁(feso4)有效的再生和再利用。实施例5:为了更好地了解fe3o4@cptes@peg磁性纳米粒子在现实生活生产中的应用前景,我们探究了该材料对源自内蒙古阿拉善左旗的金矿粉末进行了吸附实验。称取源自内蒙古阿拉善左旗的金矿粉末样品(如图4所示)5g,加入20ml王水,120℃消煮,待溶液剩余约1-2ml,用超纯水配制的稀盐酸溶液(ph=1.0)定容至100ml,离心并过0.2μm滤膜(如图5所示)。取金标准溶液配置不同浓度梯度用于绘制标准曲线,即0.5mg/l、1mg/l、2mg/l、4mg/l、8mg/l、16mg/l。对消解后的金矿样品溶液进行品位检测,结果为:17ppm。由于该金原矿中金的含量极低,为了检测每次加入的磁性纳米材料对于金原矿消解后的金离子的吸附效果,所以,我们将磁性纳米粒子的量缩小十倍,即称取fe3o4@cptes@peg(1mg)加入到上述消解溶液中,超声机械搅拌1h,使磁性纳米粒子充分散开均匀后关闭超声继续机械搅拌24h,待吸附过程充分完成后,将fe3o4@cptes@peg磁性纳米粒子用磁铁从水溶液中去除,将上清液由0.2μm的滤膜过滤后用原子吸收仪对au(iii)进行检测,结果得到au(iii)吸附后的浓度,从而计算出吸附效果,结果如下:1.吸附量q1为71mg/g。(即1g的fe3o4@cptes@peg磁性纳米粒子吸附了71mg金)2.吸附后剩余的金离子浓度:0.134mg/l3.吸附的金离子浓度:0.716mg/l,吸附率=84%。我们将上述吸附后剩余的0.134mg/l金离子溶液中再一次加入1mg的fe3o4@cptes@peg磁性纳米粒子进行相同的吸附实验和上机测试,结果如下:1.吸附量q2为12.7mg/g。(即1g的fe3o4@cptes@peg磁性纳米粒子吸附了12.7mg金)2.吸附后剩余的金离子浓度:0.007mg/l.3.吸附的金离子浓度:0.127mg/l,吸附率=95%。所以经过连续两次吸附以后,总计吸附了0.843mg/l,吸附率为99%,吸附后剩余的无法吸附的金离子浓度:0.007mg/l。所以该材料对实际金矿样品也能具有良好的吸附性能,为目前困扰金离子回收的种种难题提供了一种可靠的解决方法和思路。由上述实验结果可知,吸附量q1=71mg/g和吸附量q2=12.7mg/g,即(q1>q2),然而却是使用的相同量的磁性纳米粒子材料fe3o4@cptes@peg(1mg),连续两次吸附实验以后剩余的无法吸附的金离子浓度为0.007mg/l,即可以说明:当金离子浓度小于0.007mg/l时,磁性纳米材料fe3o4@cptes@peg的吸附效果较差,基本上不再继续被吸附,这就说明该磁性纳米材料fe3o4@cptes@peg对金离子吸附的最低吸附浓度下限为:0.007mg/l(0.14ppm)。上面结合附图对本发明优选的具体实施方式和实施例作了详细的说明,但是本发明并不限于上述实施方式和实施例,在本领域技术人员所具备的知识范围内,还可以在不脱离本发明构思的前提下作出各种变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺