分析方法与流程
本发明涉及分析方法的领域,并且优选对样品中存在的化合物进行分析的方法。当其中发生流控或微流控处理的分析装置(芯片实验室(lab-on-a-chip))结合离心机(并且优选提供用于相对于所施加的离心力方向来改变所述分析装置取向的装置的离心机)使用时,有利地使用所述方法。
背景技术:
用于分析某些物质或分析物的常见方法涉及使用与靶物质或分析物选择性结合的固相,所述靶物质或分析物通常为生物标志物。在一些测定中,固相可在其表面上携带或展示特异性捕获分子(capturing molecule),所述捕获分子将特异性地结合生物标志物。为了检测和定量所述生物标志物,固相-生物标志物复合体也可与附着于一种或更多种示踪物质(tracer substance)的另一组生物标志物特异性结合分子反应,形成固相-生物标志物-示踪物复合体。在另一些测定(例如竞争性免疫测定)中,样品中的生物标志物将与确定量的携带示踪物质的生物标志物竞争与固相的结合。有多种方法来安排和使用所涉及的特异性黏合剂和靶分析物,包括多种类型的固相材料和示踪物质。
在许多分析系统中,固相包括固定的实施方案,例如腔(微量滴定板孔或微通道或微腔)的壁,或固定的结构,例如柱状物或多孔膜,其上附着有与生物标志物(例如,抗原)互补的捕获分子(例如,抗体)。在其结合靶生物标志物时,含靶生物标志物的样品侧向或横向流过多孔膜是优选的固相理念。这是因为在这些膜中表面体积比非常大,允许大幅过量的捕获分子(例如抗体)且因此非常高效地结合靶生物标志物的事实。但是,这些膜难以清洗,特别是当示踪物是纳米颗粒或其团块时。这种困难由示踪物质在膜内的口袋样结构中非特异性结合或包埋(entrapment)引起。
在另一些分析系统中,固相可有利地为球形纳米级或微米级颗粒,其相对于所占据的体积暴露大的表面积。
示踪物是可以通过光学、化学、电学、磁性、放射性手段或其组合来检测和测量的任何类型的物质。另外,示踪物质也可以配制成颗粒或与颗粒缔合。通常通过光学手段使用和检测的这样的颗粒包括金属胶体(金、银、铁等),量子点,含有或携带染料或荧光染料(fluorochrome)的聚合物(乳胶)颗粒,携带信号产生分子(包括酶)的聚合物、二氧化硅(silica)或其他颗粒,或无机晶体,例如升频转换纳米颗粒(upconversion nanoparticle,UCNP)。用作示踪物质或载体的颗粒通常在纳米范围内,通常为2nm至200nm,但是在一些情况下也可使用高至100μm的更大颗粒。分别附着于固相和示踪物质的生物标志物特异性分子可以是例如抗体,其将与靶生物标志物特异性结合,后者然后称为抗原。抗体的常用替代物包括核酸探针、亲和素/链霉亲和素、凝集素和适配体以及将识别和特异性结合于配体(即,分析物或分析物的一部分)的限定分子结构的任何(生物)受体。事实上,自然界中所有蛋白质中的大部分或多或少地与一些配体特异性相互作用,所述配体可以是大分子的限定结构或小分子。通常来说,结合的特异性和亲和力越高,受体配体系统越适合于设计分析测定。为了定量固相-生物标志物-示踪物质复合体(在下文中也称为可定量珠复合体),示踪物质必须表现出某些允许鉴定和测量的特性。光学读出系统通常特别方便,因为检测器可置于测定装置外面。光学示踪物质的特性包括通过透射比或反射比测量的光吸收、光散射以及光衍射和发光现象,如化学发光、荧光、升频转换磷光(upconversion phosphorescence)等,包括其组合。在测量颜色、发光(例如荧光和磷光)、衍射、等离子体效应等时,通常涉及这些现象。
在大部分异质型分析测定中,首先允许靶生物标志物与固相和过量的示踪物质反应。这可以在同时存在珠、生物标志物和示踪物质的一个步骤中进行,或者在珠与生物标志物首先相互作用然后引入示踪物质的两个步骤中进行。之后,通过洗涤除去未与固相特异性结合的示踪物质。
为了使靶生物标志物分别结合于固相和示踪物质,其将必须直接互相作用。利用高亲和力黏合剂,反应物(即,生物标志物、固相和示踪物质)相互作用或碰撞越频繁,结合反应越快。因此,为了获得快速测定,应建立具有高亲和力和特异性结合物质的非常高的局部浓度的反应条件。为了建立这样的条件,固相应暴露挤满特异性高亲和力受体分子的大表面积。同样地,携带第二组特异性和高亲和力受体分子的示踪物质应以高浓度存在。纳米颗粒和微颗粒的悬液暴露大的表面积体积比,类似于多孔结构,例如多孔膜。应当应用将进一步促进所涉及反应物之间的碰撞的流控运动。这样的运动可以通过温和加热和搅拌来获得,但是更优选通过使样品和试剂(在非竞争性测定的情况下,包括示踪物质)通过/流过固相来获得。因此,在设计高效的结合测定中,流过固相材料如多孔膜、微通道、微柱结构或堆叠颗粒的液体是优选的。
与前段中的讨论相同的考虑同样好地适用于竞争性异质测定。在这样的测定中,固相暴露挤满结合和标记的生物标志物的大表面积。
由于若干原因,球形微颗粒和纳米颗粒作为固相材料通常是优选的:
·颗粒具有非常大的表面积体积比
·颗粒以批次高效官能化,因此可以混合形成均匀悬液。
·颗粒悬液可以以等分试样分配,所述等分试样可直接以液体形式使用,或者可以配制成干等分试样,例如片剂或冻干球。
·颗粒可以负载有为颗粒添加独特特征的材料,或者由所述材料制成。这包括独特光学特征,例如光吸收、光散射、光发射度(发光)等,以及磁性、放射性、催化/酶特性、电化学特性和其他可测量特性。
·当悬浮时,颗粒可以在微流控系统中运输。
·颗粒可以与溶液中的样品高效混合。
·可以通过重力、离心、过滤、磁力(磁性颗粒)或电力或其组合将悬液中的颗粒与溶液分离。
·根据颗粒相对于所述颗粒分散于其中的介质的密度,颗粒可以沉积、保持悬浮或漂浮。
·颗粒可以制备成单分散和完全球形,所述球形为多孔的或具无孔的光滑固体表面。
·颗粒可以堆积或堆叠在多种容器(包括柱)中。
·颗粒可以是不透明的(有色的)或基本上透明的,允许与多种基于光的测量系统相容并在其中使用。
·当紧凑的单分散颗粒堆叠在过滤器上,如在柱中,其可以形成具有规则的和限定的间隔的多孔晶格结构。液体可以以受控的和可再现的方式流过这样的柱。
使分析物和任选的示踪物质(在非竞争性测定的情况下)与附着在固相颗粒表面的固定的捕获分子相互作用的最高效方式是将颗粒以柱的形式堆积在过滤器或狭缝上,并且允许含有分析物和/或试剂(如示踪物质)的溶液通过颗粒的柱。这可以按顺序并且在重复步骤中进行,或者可以通过应用分析物和示踪物质两者的混合物并且使其在一个步骤中通过。
在反应步骤或结合步骤之后,将溶液与固相分离并且洗涤固相以除去剩下的过量示踪物质、标记的未结合分析物(在竞争性测定中)等,以获得一致和准确的分析。
从使用微流控芯片的分析方法知道了使用珠柱以获得珠与多种示踪物质和/或分析物之间的高效相互作用。
US 2009/0104077A1公开了在微流控芯片中进行ELISA测定(酶联免疫吸附测定)的方法。所公开的微流控芯片具有流体回路,其包含填充有作为固相的珠的柱结构。ELISA型反应通过首先形成珠-生物标志物-酶标记抗体复合体来在柱结构中的珠上进行。
然后通过施加离心力使洗涤液流过柱来除去过量的酶标记抗体。所述方法的重要特征是使相同洗涤流体再循环通过所述柱多次以获得改善的洗涤步骤的能力。在清洁或洗涤步骤之后,将生色物质施加到酶标记的复合体中,并且产生的颜色可以例如在柱结构中测量。柱结构的至少一端结束于受限通道,防止固相珠从柱中流出。
WO 2011/081530 A1公开了用于分析测试样品(例如,生物样品,如全血)的处理盒(processing cartridge)(即,流控或微流控芯片)。所述盒适用于离心分析仪器。所述盒可以包括描述为捕集器(trap)的特定流体回路元件。这样的元件用于形成固相颗粒(珠)的柱,其中在流体流过所述柱的同时颗粒可以保留。通过相对于盒适当地改变施加的离心力的方向,含有与固相颗粒反应的多种反应物(例如生物标志物和示踪物质)的流体重复地通过柱。捕集器的设计避免了使用过滤器或狭窄流体路径来获得颗粒或珠的柱。通过重复洗涤颗粒来获得除去过量试剂。因此,通过引用并入了捕集器及其使用的描述,以及具有流体回路的微流控芯片的构思,其中包含分析物和多种任选试剂和溶剂的样品通过所述回路的移动可以通过使用离心力来实现。
在另一些测定系统中,使用铁磁性颗粒作为固相以有助于洗涤或分离步骤。然后临时用磁铁将颗粒拉到反应容器的一个壁并且在其与液体分离时扣留它们。当反应容器远离磁铁时,颗粒自由地重悬在溶液中。但是,磁性颗粒由于含有铁磁性材料而是光学致密的,因此将显著熄灭光学读出。由于这个原因,铁磁性颗粒不适合在测定中与结合于颗粒的示踪物标记组合使用。
在样品分析的技术领域中,例如生物标志物的分析中,在测定中固定固相和可移动的固相两者的使用均是已知的。本发明尤其涉及在具有流体回路的微流控芯片(即,处理盒)中使用这样的测定,可使用离心力使包含分析物和多种任选试剂和溶剂的样品通过所述回路。这样的微流控芯片公开在例如Schultz等.Clin.Chem.1985,31,1457、美国专利no.488763以及上述专利申请US 2009/0104077A1和WO 2011/081530A1中。
在异质型分析测定中,过量未结合示踪物质与结合于固相的示踪物质的高效和可再现分离(洗涤)对于可靠的分析结果是必要的。在高灵敏度分析中,高效的洗涤特别重要。
与具有光滑表面的固相如在孔壁、微柱或球形颗粒上可得到的那些相比,具有多孔结构的固相如多孔膜更难以高效地洗涤。但是,包含紧密堆积成柱的球形颗粒(例如,珠)的固相在高效和可再现洗涤方面具有与多孔膜中遇到的那些相同的一些困难。堆积的柱中珠的紧密相互作用提供了临时多孔结构(即,由于珠之间形成的空隙),其中未结合的示踪物质(即,未结合至固相的示踪物质)容易以非特异性方式捕获在所述临时多孔结构中。在现有技术中,通过使洗涤液通过柱来洗涤这样的柱。但是,即使将这样的洗涤重复多次(参考US 2009/0104077A1的公开内容),至少一些未结合的示踪物质将保持捕获在多孔结构中并随后对测定的再现性和灵敏度具有不利影响。
基于现有技术,需要对样品(例如,生物样品)中的分析物进行分析的避免已知方法的至少一些缺点的方法。这主要与具有分析物、固相珠和示踪物质的有助于它们之间的高效相互作用(结合)的群集(constellation),以及然后产生其中获得过量示踪物质(即,未与珠结合的示踪物质,包括非竞争性测定中的分析物-示踪物质复合体)的高效分离的另一个群集有关。
本发明涉及用于异质分析测定的新方法原理,其涉及分析物与固相的结合或阻断结合(如在竞争性测定中)并且随后在易化的洗涤过程中高效分离未结合示踪物质。
发明概述
本发明提供了分析样品中的分析物的方法,其避免或减轻了现有技术的至少一些缺点。所述方法通过所附权利要求书和下文限定:
在第一个实施方案中,本发明提供了分析含有待定性和/或定量测定之分析物的样品的方法;所述方法包括结合步骤和洗涤步骤,其中所述结合步骤包括:
a)使所述分析物与密度为m1的珠相互作用;
b)获得包含密度为m2的可定量珠复合体的堆积珠结构;并且
所述洗涤步骤包括:
c)使所述堆积珠分散在密度为d>m2和m1的液体介质中;以及
d)将液体介质与包含可定量珠复合体的珠分离。
在根据本发明的方法的一个实施方案中,密度为m1的珠能够结合分析物。任选地,珠包含确定量的分析物-示踪物质单元。
在根据本发明的方法的一个实施方案中,分析物在与密度为m1的珠相互作用之前、期间或之后与示踪物质相互作用。
在根据本发明的方法的一个实施方案中,结合步骤的步骤a)包括:提供能够结合分析物的珠的第一步骤,所述珠任选地包含确定量的分析物-示踪物质单元,并且所述珠的密度为m1,以及使分析物与所述珠相互作用的第二步骤,所述分析物在与所述珠相互作用之前、期间或之后任选地与示踪物质相互作用。
在根据本发明的方法的一个实施方案中,分析物与密度为m1的珠相互作用,使得形成密度为m2的可定量珠复合体。
步骤a)中分析物与珠的相互作用提供了步骤b)中密度为m2的可定量珠复合体。可定量珠复合体的具体性质取决于所进行的测定的类型。但是,不论测定的类型,可定量珠复合体是可定量的,使得随后可以通过分析珠复合体来定量分析物。
在一个优选实施方案中,根据本发明的方法在包含内部流体回路的流控芯片中进行,其中多种反应物(包含含有至少一种分析物的样品和能够结合所述分析物的珠)通过所述内部流体回路的移动可以通过使用离心力来实现。优选地,相对于所述流体回路所述离心力的方向可在至少两个不同方向变化。
在根据本发明的方法的另一个实施方案中,通过将珠安排在流体回路的节段中来获得所述堆积珠结构,所述节段包含第一和第二开口以及能够将珠和珠-分析物复合体保持在所述节段中的颗粒保持元件(particle retaining element)。颗粒保持元件可以是设置在所述开口中的一个处的过滤元件或弯曲。优选地,所述节段的至少一部分是基本上柱状的。
在根据本发明的方法的另一个实施实施方案中,所述节段是流控芯片的内部流体回路的一部分,其中包含珠和含有至少一种分析物之样品的多种反应物通过所述流体回路的移动可以通过使用离心力来实现。优选地,通过使用离心机施加离心力,并且相对于所述节段的离心力的方向可以变化。在一个优选实施方案中,流控芯片是微流控芯片。
在根据本发明的方法的另一个实施方案中,通过过滤或倾析获得液体介质与包含可定量珠复合体的珠的分离。
在根据本发明的方法的另一个实施方案中,步骤a)在密度为d1<m1的第一液体介质中进行。
在根据本发明的方法的另一个实施方案中,结合步骤包括将第一液体介质与珠分离的步骤。
在根据本发明的方法的另一个实施方案中,在步骤c)之前向堆积珠中添加密度为d2>m2和m1的第二液体介质。
在根据本发明的方法的另一个实施方案中,珠是合成聚合物珠,例如聚苯乙烯(PS)和聚甲基丙烯酸甲酯(PMMA)珠。所述珠的直径可优选地为0.1至50μm、0.5至50μm和2μm至20μm。
在根据本发明的方法的另一个实施方案中,在结合步骤之前所述珠和/或示踪物质以干燥制剂提供。
在根据本发明的方法的另一个实施方案中,结合步骤包括通过施加相对于所述节段的第一方向上的离心力来堆积所述珠,使得可获得步骤b)中的所述堆积珠结构。第一方向优选使得所述珠朝向所述颗粒保持元件移动。
在根据本发明的方法的另一个实施方案中,洗涤步骤包括在步骤d)期间施加基本上在第一方向上的离心力。
在根据本发明的方法的另一个实施方案中,通过在步骤d)中施加具有不同于第一方向的第二方向上的离心力来从所述节段中转移包含可定量珠复合体的珠。
在根据本发明的方法的另一个实施方案中,所述方法包括分析可定量珠复合体的步骤,使得定性和/或定量地测定样品的分析物。分析可以在流体回路的与步骤a-d相同的节段中进行,或者在独立的分析节段中进行。分析手段将取决于可定量珠复合体中存在的示踪物质的类型。
在根据本发明的方法的另一个实施方案中,示踪物质密度n>m2。
在根据本发明的方法的另一个实施方案中,珠和示踪物质与标准化分析物反应以获得步骤a)的包含确定量的分析物-示踪物质的珠。例如,在流控芯片中进行所述方法的情况下,包含确定量的珠-示踪物质的珠通常预先制备,并且通常作为干制剂在流控芯片中提供。标准化分析物仅需要包含与样品中的分析物结合共同的珠所需的相关结构基序。
在根据本发明的方法的另一个实施方案中,分析物是生物标志物。
在根据本发明的方法的另一个实施方案中,示踪物质是纳米颗粒,和/或密度为至少1.1g/cm3、至少1.5g/cm3、至少2.0g/cm3,甚至更优选至少3.0g/cm3。
在根据本发明的方法的另一个实施方案中,示踪物质和所得可定量珠复合体是光学可检测的,优选通过发光或通过具有独特的可测量的吸收或光散射特征。
在根据本发明的方法的另一个实施方案中,珠的密度小于1.5g/cm3、小于1.3g/cm3、小于1.2g/cm3或小于1.1g/cm3。
在另一个方面,本发明还提供了根据本发明的方法在用于离心机设备的流控芯片中的用途,所述离心机设备能够相对于所施加的离心力来改变所述流控芯片的取向,所述流控芯片包含内部流体回路,其中所述方法的包含珠和含有至少一种分析物之样品的多种反应物通过所述内部流体回路的移动可以通过使用离心力来实现。
在另一个方面,本发明提供了用于根据任意前述实施方案的方法的流控芯片,所述流控芯片适合于能够相对于所施加的离心力来改变所述流控芯片的取向的离心机设备并且包含内部流体回路,其中所述方法的包含珠和含有至少一种分析物之样品的多种反应物通过所述内部流体回路的移动可以通过使用离心力来实现。
在所有方面,本发明方法中使用的流控芯片可有利地为微流控芯片。但是,在一些情况下,预期体积在ml范围的流控芯片可以是优选的。
附图简述
图1a-1k是示出了在根据本发明的方法中使用的步骤的示意图。
图1l-1p是示出了用于在微流控回路中移动珠的发明构思的示意图。所述构思可有利地与根据本发明的方法组合。
图2a-2b是示出了用于在微流控回路中分离不同密度的珠的发明构思的示意图。
图3是示出了适用于根据本发明的方法的微流控回路的进一步细节的示意图。
发明详述
术语定义
本发明上下文中使用的术语“分析物”应理解为包括可在根据本发明的方法中定量或定性地测定的任何化合物。特别地,术语“分析物”旨在包括可用作生物体(优选人体)的特定疾病状态或一些其他生理状态的指示物(即,生物标志物)的任何化合物。生物标志物可例如是贫血的生物标志物,例如红细胞生成素(EPO)铁蛋白、可溶性转铁蛋白受体(sTrR)、叶酸(叶酸盐)、转铁蛋白、血红蛋白、维生素B12;骨疾病的生物标志物,例如碱性磷酸酶(ALP)、骨钙素、甲状旁腺激素(PTH)、骨特异性碱性磷酸酶(BSAP)、1,25二羟基维生素D、C末端I型胶原蛋白端肽(CTx)、25羟基维生素D、N末端I型胶原蛋白端肽(NTx);心脏病的生物标志物,例如载脂蛋白E(Apo E)、脑钠肽(BNP)、LDH、CK、CKMB、Pro-B型利尿钠肽(Pro-BNP)、C反应蛋白(CRP)、肌钙蛋白I、肌钙蛋白T、CRPh(超灵敏);糖尿病的生物标志物,例如C肽、HbA1c、IA-2抗体、胰岛素、果糖胺、胰岛素生长因子(IGF-1)、胰高血糖素、微量白蛋白、葡萄糖、前胰岛素、抗体;与内分泌学有关的生物标志物,例如甲胎蛋白(Alpha-Foetoprotein)、生长激素、促肾上腺皮质激素(ACTH)、生长释放因子(GRF)、皮质酮、催乳素、皮质醇、睾酮、卵泡刺激素(FSH);与胃肠病有关的生物标志物,例如胃泌素、脂肪酶;与感染性疾病有关的生物标志物,例如抗Borrelia、抗Rubella、抗HBs、抗HBc、抗Anti-HBe、抗HCV、抗HIV I/II以及感染原的其他抗体,以及作为感染原的一部分的特定抗原,例如HIV-p24、HBsAg等;与炎症/免疫力有关的生物标志物,例如免疫球蛋白(IgA、IgG、IgM、IgE、IgD及其子类)、簇集素(载脂蛋白J)、C反应蛋白(CRP)、CRPh(超灵敏)、前降钙素(PCT)、肝素结合蛋白(HPB)、钙防卫蛋白、人中性粒细胞脂质运载蛋白/中性粒细胞明胶酶相关脂质运载蛋白(HNL/NGAL)、内皮肽-1、纤维蛋白原、葡萄糖-6-磷酸脱氢酶(G-6-PDH)、IFNγ诱导的单核因子(MIG/CXCL9)、IFN-α、新蝶呤、IFNγ(IL-2、IL-4、IL-10)-4-plex、IL-10、IL-10(IL-2、IL-4、IFNγ)-4-plex、IL-1β、Rantes/CCL5、IL-2(IL-4、IL-10、IFNγ)-4-plex、IL-4(IL-2、IL-10、IFNγ)-4-plex、肿瘤生长因子(TGF-β1)、IL-6、肿瘤坏死因子(TNFα)、IL-8;与脂类代谢有关的生物标志物,例如载脂蛋白AI(Apo AI)、胆固醇、载脂蛋白AII(Apo AII)、HDL-胆固醇、载脂蛋白B-100(Apo B)、LDL-胆固醇、载脂蛋白B48(Apo B48)、卵磷脂胆固醇酰基转移酶(LCAT)、载脂蛋白CII(Apo CII)、对氧磷酶(PON1)、载脂蛋白CIII(Apo CIII)、磷脂酰肌醇聚糖F(PIGF)、载脂蛋白E(Apo E)、甘油三酯;与肾脏学有关的生物标志物,例如α-GST、β-2-微球蛋白(血清)、微量白蛋白、β-2-微球蛋白(尿)半胱氨酸蛋白酶抑制剂C、肌酸酐;与肿瘤学有关的生物标志物,例如糖类抗原19-9(CA19-9)、前列腺特异性抗原(PSA)、致癌胚胎抗原(CEA)、血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGFb);以及与甲状腺病症有关的生物标志物,例如抗甲状腺过氧化物酶Ab(TPO)、促甲状腺激素(TSH)、抗甲状腺球蛋白Ab、总甲状腺素(T4)、游离甲状腺素(FT4)、总三碘甲腺原氨酸(T3)、游离三碘甲腺原氨酸(FT3)、TSH受体Ab和甲状腺球蛋白。
术语“示踪物质”旨在涵盖能够与目标分析物(例如,生物标志物)或珠(术语珠在下文中定义)结合,并且表现出使得其通过分析化学/生物学领域中常见的任何合适的技术可定量或可鉴定(即,其可以通过光学、磁性、电学或辐射检测)的特性的任何物质。特别感兴趣的特性是能够光学检测的那些,例如示踪物质可吸收和/或散射光,例如发色团,或者表现出发光特性,例如荧光或磷光,或者示踪物不是直接光学可检测的,但是能够与另外的物质反应以提供光学可检测的反应产物。适合与目标分析物(例如,生物标志物)或珠结合的示踪物质的结合部分包括例如蛋白质、核酸、糖类和螯合化合物。特异性结合部分包括抗体、抗原、核酸探针或其他生物特异性受体配体系统。
适合于本发明方法使用的示踪物质的实例包括含纳米颗粒(优选基于金属的纳米颗粒)和酶的那些。示踪物质纳米颗粒的直径通常为3至100nm。优选的纳米颗粒包括基于金属的颗粒,例如金(ρ=19.3g/cm3)、银(ρ=10.5g/cm3)或铁(ρ=7.9g/cm3)胶体,以及无机晶体,例如升频转换纳米颗粒(UCNP,ρ通常为4至5g/cm3)。
使用基于金属的纳米颗粒作为示踪物质是公知的,对于金纳米颗粒的综述,参见例如S.Zeng等;″A review on functionalized gold nanoparticles for biosensing applications″.Plasmonics 6(3):491-506。
对于适合于本发明方法使用的UCNP的综述,参见例如Cheng等.Nanoscale,2013,5,23和Ang等.Nanomedicine,2011,6,1273。
使用荧光团作为示踪物质综合地参考例如Life TechnologiesTM的The MolecularHandbook-A Guide to Fluorescent Probes and Labeling Technologies。
其他本身非光学可检测的物质也可用作示踪物质。例如,当本发明方法用于进行ELISA型测定时,所得珠-分析物-示踪物质复合体的最终分析不依赖于示踪物质的直接光学检测,而是依赖于示踪物质上的酶与合适的底物之间反应的反应产物(提供颜色或荧光或电化学信号)。
合成合适的示踪物质的方法的实例全面公开在现有技术中,获得适合于本发明方法的示踪物质也是合成化学或生物化学领域技术人员周知的。
术语“珠”旨在涵盖任何类型的固相颗粒或珠,优选球形微米颗粒或亚微米颗粒,直径为0.1至50μm、0.5至50μm,优选直径为2μm至20μm。这些颗粒可以是多孔的或者具有光滑固体表面。其可以是紧实的或具有包围珠内的一个或更多个中央核心材料的一个或更多个壳,中央核心材料可以是固体材料、液体或气体。珠可以是不透明的或透明的。优选地,珠是基本上透明的并且由体积质量密度(ρ)稍微高于水密度(ρ=1.0g/cm3)的聚合物制成。通常来说,珠由聚苯乙烯(ρ=1.05g/cm3)、聚甲基丙烯酸甲酯(ρ=1.18g/cm3)或其他合适的材料如空心二氧化硅珠制成。此外,当用于根据本发明的分析方法时,珠包含能够结合目标分析物或示踪物质的多个共价偶联的分子结构或实体。这样的分子结构或实体可以是例如抗体或其片段、核酸、适配体、螯合结构、展示分析物的结合基序的合成分子结构等。在本公开内容中,在竞争性测定的情况下珠也可包含确定量的分析物-示踪物质单元(即,由结合于示踪物质的分析物组成的单元)。在这一点上,术语“确定量”旨在表示珠被标准化以提供已知的分析结果或信号。通过在与来自样品的竞争性分析物相互作用之后分析珠(其最初具有确定量的分析物-示踪物质单元)并且将分析结果与所述已知分析结果相比较,可以测定/测量所述分析物。
本公开内容中的术语“可定量珠复合体”旨在意指通过珠与分析物或者在一些测定中珠与示踪物质之间的相互作用形成的复合体。后者在竞争性测定类型中形成,其中珠与分析物竞争与示踪物质结合。通常来说,复合体包含珠、分析物和示踪物质。不论测定类型,可定量珠复合体的定性和/或定量分析将提供对来自样品的待测定分析物的间接的定性和/或定量分析。根据进行的测定的类型,可定量珠复合体的具体结构将不同。例如,在非竞争性测定中,复合体将理想地包含珠,其中珠仅结合于至少一个分析物-示踪物质单元,而在竞争性测定中,复合体可包含与分析物-示踪物质单元和来源于样品的不具有示踪物质的分析物二者结合的珠。仅根据测定类型,可定量珠复合体的另外的变体也是可能的。在大部分测定中,可定量珠复合体也可称为可定量珠-分析物复合体(即,所述复合体包含结合分析物的珠)或可定性和/或定量测定珠-分析物复合体。
本公开内容中的术语“夹心复合体”旨在意指包含珠、分析物和示踪物质的复合体。“夹心复合体”通常是可定量珠复合体,但是该术语在与竞争性测定相结合时也可表示包含上述确定量的分析物-示踪物质单元的珠。
术语d、d1、d2等旨在表示给定液体介质以g/cm3为单位的体积质量密度。
术语m、m1、m2等旨在表示给定固体材料以g/cm3为单位的体积质量密度。
术语“液体介质”旨在涵盖适合用于进行特定测定的任何液体。技术人员容易理解特定液体介质在特定测定中的合适性。另外,任何液体的所需体积质量密度可通过溶解在所述液体中或与所述液体混合的添加剂来改变。这适用于任何类型的所涉及材料,例如多种物质、盐、液体或气体,只要它们会适当地混合和溶解即可。密度的改变与所涉及物质的浓度和相对密度有关。具有不同于溶剂的密度的所有可溶性化合物将影响溶液/液体的密度。通常来说,海水具有比纯净淡水(1.00g/cm3)更高的密度(表面1.025g/cm3)。多种物质用于改变水溶液的密度,特别是在密度梯度离心的领域。这些包括例如蔗糖、蔗糖聚合物、多种包被的胶体和氯化铯的物质,以及多种含碘物质,例如碘克沙醇、碘海醇、甲泛葡胺等易于以高浓度溶于水的物质。
在本申请的情况中的术语“反应物”旨在作为分析方法中存在的组分的一般术语,例如分析物、示踪物质或珠上的结合分子实体。
术语“干燥制剂”是指可并入到用于运行测定的装置中的包含珠和纳米颗粒的制备物的试剂。这些干燥制剂可通过真空干燥或通过冷冻干燥制备。冷冻干燥制剂制备成具有0.1μL至200μL的限定尺寸的均匀球形等份。这些可以成批生产然后逐个分配到分析装置中。
本发明的一般原理
本发明描述了分析方法,其中第一溶液中的反应物与附着于固相颗粒表面的反应物之间的非常高效的相互作用与通过使用第二溶液使其悬浮来对固相颗粒非常高效的洗涤相结合。
固相颗粒是微型珠(micro-sized bead)或球形颗粒。
溶液中的和附着于固相颗粒表面的反应物将根据所进行的测定的类型而变化。
在夹心型非竞争性免疫测定中,溶液中的反应物将是分析物(例如存在于生物样品中的一些类型的生物标志物)和示踪物质(例如对特定生物标志物具有选择性的标记抗体)。所述反应物可以在与固相颗粒相互作用之前混合,即同时施用或作为预先形成的分析物-示踪物质单元施用,或者依次施用(即,在施用示踪物质之前将分析物附着在固相颗粒上)。固相颗粒表面上的反应物将是能够结合分析物和/或分析物-示踪物质单元的分子结构(例如抗体)。
在竞争性免疫测定中,溶液中的反应物可以是样品中存在的分析物与通过样品分析物从珠替换的一定量的分析物-示踪物质单元的混合物。固相颗粒(即珠)表面上的反应物将包含能够结合样品中存在的分析物的分子实体或结构(例如抗体),并且其中分子结构最初与分析物-示踪物质单元键合。
为了获得高效的相互作用,固相颗粒紧密地堆积成结构例如柱。这优选通过使固相颗粒保持在测定装置(例如微流控芯片)中的流体回路的节段或腔中来实现。该节段或腔可以有利地是大致柱状,但是其他形状或形式也是合适的。固相颗粒优选通过安排在流体回路的节段或腔中的颗粒保持元件(例如过滤元件)保留在腔中。WO2011/081530A1中公开的捕集器是用于提供包含颗粒保持元件而不需要使用过滤元件的腔的替代解决方案。
过滤元件被设计或选择为具有不允许固相颗粒从其通过的孔径或狭缝尺寸。通过施加离心力将液体溶液从固相颗粒柱或颗粒悬液中除去,离心力从柱的与过滤元件相对的一侧作用并朝向所述元件。以这种方式,迫使液体溶液通过固相颗粒柱和过滤器结构。
可以通过改变离心力相对于柱的角度或通过改变颗粒保持元件的流动阻力来控制通过堆叠的珠的流动。
可以使用控制通过过滤器的液体出口的阀来控制通过过滤器的液体流。当液柱基本上平行于包含固相颗粒的柱状腔浸入时,这可作为替代地通过控制施加到出口液体的反压力来实现。然后可以通过相对于离心力改变测定装置(例如微流控芯片)的取向从颗粒中除去液体。
为了获得固相颗粒的高效洗涤,通过添加第二液体溶液使颗粒悬浮。第二液体溶液具有高于固相颗粒的体积密度的密度。当暴露于离心力时,固相颗粒将在该液体中从其柱状结构开始解体(unpacking),并通过漂浮朝向最接近离心轴的高密度液体的表面移动。通过这种方式,在溶液中的反应物与固相相互作用期间,固相颗粒将在其朝向表面的路径上分散在溶液中,并且还从任何未结合的示踪剂试剂(例如未结合的示踪物质或未结合的分析物-示踪物质单元)和捕获在堆积的固相颗粒的柱状结构中其他可溶性或可分散的组分中分离。当通过过滤从柱状腔排出第二液体溶液时,通过漂浮获得的固相颗粒在第二液体溶液中的分散将由此允许这些颗粒的高效洗涤。
当这些后者材料包含具有比第二液体更高的密度的颗粒时,可以进一步促进“低密度”固相颗粒和其他可分散材料之间的分离。这些颗粒可以是高密度纳米颗粒,例如具有比第二液体更高的密度的金属胶体或聚合物微粒。在这种情况下,具有比第二液体高的密度的颗粒被从离心轴拉离,而低密度颗粒朝向旋转轴移动。分离程度将取决于涉及的组分和液体的密度的差异、颗粒的尺寸、施加的离心力和离心时间。
因此,通过改变围绕颗粒的溶液的密度来使堆积的固相颗粒悬浮。当该溶液(即第二液体溶液)的密度高于颗粒本身的密度时,所述颗粒将漂浮,即沿与施加的重力或离心力的方向相反的方向移动。当离心力作用在比围绕它们的液体更低的密度的颗粒上时,其将逐渐移动到最接近离心中心的溶液的表面,而比液体更高密度的组分将倾向于沉积,即移动到溶液的离离心中心最远的体积。通过在进行测定的结合步骤之后使固相颗粒悬浮获得的主要优点是,由于通过将固相颗粒堆积成柱获得的多孔结构而以非特异性方式截留或捕获的任何过量的示踪物质被释放,因此更容易除去。
通过这种方式,例如,比液体具有更高密度的示踪物质可以高效地从比液体更低密度的组分中分离。然后,包含分散在液体中的较高密度组分的液体可以通过滤器排出,而固相颗粒将在到达过滤器时停止。固相颗粒的重复洗涤步骤可以通过重复的再悬浮和排出步骤进行。
具有高于固相颗粒的密度的示踪物质是有利的,但是当示踪物质具有与固相颗粒相等或更低的体积密度时,堆积成柱的固相颗粒的再悬浮也将提供大大改进的洗涤步骤。在后一种情况下,如上所讨论的,示踪物质仍然从多孔结构释放,因此当第二液体溶液通过过滤元件排出时,更容易从固相颗粒中除去。
该方案提供了用于洗掉过量的示踪物质的简单方式。
在芯片实验室装置(即微流控芯片、处理盒等)中使用固相颗粒或珠的另外的优点是,在整个测定中,悬液中的珠可转移到装置中的不同位置/部位。这可以包括将颗粒以微流控转移到流体回路的先前没有被示踪物质污染的节段或腔和/或专门设计用于各步骤的优化功能的腔中。这可以例如允许首先在优化用于存储的腔中具有珠,然后将珠转移到优化用于快速相互作用的腔(即,柱状结构)中,然后将珠转移到优化用于洗涤的腔中,进一步到优化用于读出的腔中,并且最终转移到用于废物存储的腔中。
如所描述的,用于分析样品的装置可以是特别设计用于根据特定程序对样品和试剂两者进行微流控处理的微流控芯片或盒。这些盒通常由通过泵、阀、离心力或其他物理装置处理盒内的流体的仪器运作。特别地,本发明涉及通过离心力或重力在微流控芯片内运作的测定系统。
在第一发明构思中,本申请还公开了用于分离不同密度的珠或固相颗粒的高效方法。该构思允许在同一时间分析多种分析物,随后容易地分离不同的所得可定量珠复合体。下面进一步描述第一构思。
除了包括相互作用或结合步骤之后是高度有效和简单的洗涤步骤的本发明的方法之外,本申请还公开了第二发明构思,通过该方法珠可以通过以下方式从一个腔有效地转移到另一个腔:使用具有比珠更高的密度的液体通过倾析,从而将漂浮在液体的上级分中的珠,即已经在朝向产生离心力的旋转轴线的方向上移动(或漂浮)的珠,转移到另一个腔。下面进一步描述第二构思。
第一和第二发明构思两者可有利地与本申请的发明组合,但是不以任何方式限于这样的使用。
发明详述
在图1a-k中示出了根据本发明的方法的示意图。该方法旨在用于针对一种或更多种目标分析物分析样品。该方法适用于可以溶解在液体中的任何类型的样品,以及还用于检测/定量所述样品中的任何类型的化合物或物质,对于所述样品可以提供用于进行此类分析的测定。
在下文中,假定样品是生物样品,并且目标化合物或物质优选是生物标志物,并且可以是蛋白质(抗原、酶、抗体)、核酸、药物、激素、营养物、代谢物、微生物、细胞或可在包括一种或更多种选择性结合剂的测定中测量的任何此类分子或分子集合。该方法基于使生物标志物与固相颗粒(即微型珠、球形颗粒等)反应的公知原理,其中固相颗粒包含能够与生物标志物结合的分子结构或实体。如果生物标志物是抗原的话,合适的分子实体是例如抗体。除了固相颗粒和生物标志物之外,必须存在示踪物质。示踪物质的特征为能够结合生物标志物的分子实体。
固相颗粒或珠如上所定义。
示踪物质如上所定义。
典型的异质免疫测定的第一步骤由使包含待定量或鉴定的生物标志物的生物样品与第一液体介质中的珠和/或示踪物质相互作用、接触、孵育、冲洗或混合,参见图1a-e。在这种情况下建立了夹心型构型,其中靶生物标志物作为固相颗粒与示踪物质之间的连接体。这些相互作用可以以两种顺序依次进行,或者将所有涉及的反应物一起施加。优选地,确定了在这些“夹心复合体”中生物标志物与示踪物质之间的固定化学计量比为1∶1。在非竞争性测定中,珠和示踪物质两者都能够结合生物标志物。示踪物质和固相颗粒可以携带多种生物标志物特异性受体,因此可与多种生物标志物分子结合。然而,通常来说,将测定设计为相对于生物标志物包含大量过量的示踪物质。在统计学上,每个生物标志物分子将因此仅与一个示踪物质结合。然而,每个微球珠暴露非常大的表面,并且可以结合许多靶生物标志物和随后的示踪物质。
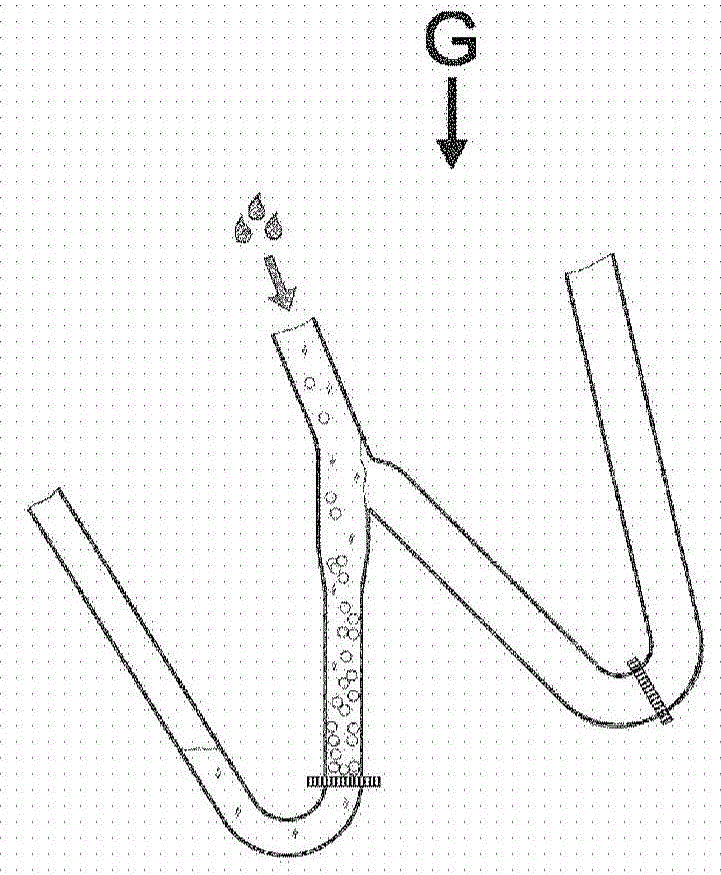
在用于原理说明的所示的该具体简化实施方案中,在W形腔、流体回路或试管装置1中进行测定。腔1包含第一出口2和第二出口3、入口4以及第一过滤元件5和第二过滤元件6。第一过滤元件5设置在入口4与第一出口2之间。设置在入口与第一过滤元件之间的节段形成柱结构7。箭头G表示相对于腔或试管施加的离心力(或重力,尽管使用重力仅可提供显著更慢的测定并且可能不实用)的方向。腔1可以是流控或微流控芯片中的流体回路的一部分,例如在本公开内容的背景技术部分中描述的现有技术中公开的微流控芯片。在这种情况下,腔可以被认为设置在垂直于微流控芯片外部的旋转轴线的平面中。因此,通过围绕所述轴线旋转微流控芯片获得所需的离心力G,并且可以通过旋转微流控芯片本身来改变相对于微流控芯片中的腔的离心力的方向。
在图1a-1p中,W形腔(或流体回路的节段)的多个部分被示出为在一个平面中,例如设置在流控芯片内的相同水平面。然而,在许多情况下,W形腔的部分可以有利地设置在通过基本垂直定向的通道连接的不同水平面。如图3所示,W形腔或流控回路的节段可以设置在两个或更多个水平面,其中横向通道15、16和17连接如L1和L2内所示的侧向通道。过滤器(5细节A)和/或包括颗粒捕集器的其他功能元件优选地放置在一个或更多个这种横向通道(6细节B)内或基于一个或更多个这样的横向通道。
通过图1a-e示出的特定测定是非竞争性测定。在这样的测定中,可以任意选择其中测定的多个组分相互作用、接触或混合的顺序,因为珠8和示踪物质9(参见图1d)都以大量过量提供,并且它们在不存在中间生物标志物的情况下彼此不反应。此外,混合、相互作用或接触(即结合步骤)可有利地包括使上述第一液体介质通过由珠8形成的塞或柱,以确保珠、示踪物质9和生物标志物之间的反应尽可能完全。通过使珠堆积在柱状腔7或体积中来获得塞或柱。柱状腔7可以优选地是芯片实验室装置中的流体回路(即,微流控芯片或处理盒中的流体回路)的一部分。尽管通过使用非竞争性测定举例说明了根据本发明的分析方法,但是该方法同样有利于需要堆叠/堆积珠的洗涤步骤以除去任何类型的剩余反应物或污染物的任何其他测定。
在图1a和1b中,悬浮在液体介质中的珠通过入口4引入。液体介质的密度低于珠的密度。珠的密度表示为m1g/m3。由于离心力G,珠将堆积成由柱状腔7和第一过滤元件5限定的柱状结构,参见图1c。由于布置在所述腔的一端的第一过滤元件5,所述珠保留在柱状腔中。过滤元件可以包含过滤器、格栅(grid)、筛、窄狭缝等,并且能够防止珠从其通过。
在下一步骤中,参见图1d,悬浮在包含生物标志物的液体介质中的示踪物质9通过入口4引入。在该具体实施方案中,包含生物标志物的样品在与珠相互作用之前已经与示踪物质相互作用,样品因此可形成其中悬浮示踪物质的液体介质的一部分。从悬浮珠的液体介质和悬浮示踪物质的液体介质获得的组合液体介质具有低于珠的密度。组合液体介质表示为第一液体介质,并且所述液体介质的密度表示为d1g/cm3。
使包含示踪物质和生物标志物以及通过示踪物质与生物标志物的相互作用形成的复合体的第一液体介质通过堆积珠。当使第一液体介质通过堆积珠时,形成包含珠、生物标志物和示踪物质的“夹心复合体”。过滤元件5使得示踪物质9和由示踪物质与生物标志物的相互作用形成的复合体可以通过,参见图1d。第一液体介质通过柱,并通过改变施加的离心力G的方向从W形腔1或试管中引出,参见图1f-h。在一些作为替代的实施例中,可以例如使用位于第一过滤元件下方的阀将第一液体介质从腔引出。
珠8、示踪物质9和生物标志物之间的相互作用的顺序取决于在特定情况下哪种溶液是最合适的或合适的。因此,包含生物标志物的样品可以是其中悬浮有示踪物质9的液体介质的一部分,或其中悬浮有珠8的液体介质的一部分。
在第一液体介质单次通过堆积珠的柱之后,珠、示踪物质和生物标志物之间的相互作用可能不完全。有利地,通过再引入入口4使可能包含未反应的示踪物质、生物标志物和通过示踪物质与生物标志物的相互作用形成的复合体(即分析物-示踪物质单元)的第一液体介质重复通过堆积珠。这种再引入可以例如通过具有连接第一出口2与入口4的环结构(例如,形成为环的流体回路)来实现。当W形腔是芯片实验室装置中的流体回路的一部分时,后者的解决方案尤其有利。在再引入之后,可重复根据图1e-h的步骤。作为使用环结构来获得多次通过堆积珠的柱或结构的替代方案,可以通过重复地改变离心力相对于柱或结构的方向来迫使第一液体介质来回穿过堆积珠。
取决于测定设计和样品中生物标志物的浓度,每个珠可以携带从无到数千的生物标志物-示踪物质复合体。由于在一个优选实施方案中每个珠的体积显著大于生物标志物-示踪物质复合体的体积,所以每个珠的许多生物标志物-示踪物质复合体的结合基本上不会影响珠的体积质量密度。在一个典型的实例中,球形5μm(直径)珠的体积接近于40nm示踪物质的体积的2百万倍。
珠、示踪物质和生物标志物之间的相互作用提供了包含“夹心复合体”(即可定量的珠复合体)和未反应的示踪物质的堆积珠柱。“夹心复合体”的密度表示为m2g/cm3。在相互作用期间,由于堆积珠形成的多孔结构,一些未反应的示踪物质9以非特异性方式被截留或捕获(即,截留在珠之间的空隙体积中)。为了获得灵敏且可再现的分析结果,尽可能多的未反应的示踪物质必须与珠和“夹心复合体”分离。在现有技术中,未反应的示踪物质的分离通过使洗涤液通过堆积珠柱而重复洗涤来进行。然而,如上所讨论的,这样的洗涤不会除去所有截留的未反应示踪物质,或需要过多和耗时的重复洗涤次数。
为了改善或甚至允许未反应的示踪物质与珠和“夹心复合体”的分离,将第二液体介质添加到堆积珠中,参见图1i。第二液体介质的密度为d2g/cm3,其中d2>m1和m2。应当注意,当用于替代分析系统中时,其中通过倾析(即,不是通过使第一液体介质通过过滤元件)除去第一液体介质,第一液体介质的小部分和第二液体介质的组合的密度可以表示为d2′。然而,由于第二液体介质与第一液体介质的体积之间的高比值,d2′的数值将近似等于d2,即d2′>m1和m2。
本发明方法的基本特征是第二液体介质具有比珠和“夹心复合体”更高的密度。然后添加第二液体介质将确保堆积珠柱崩解,使得珠之间的紧密相互作用被破坏。当珠之间的紧密相互作用被破坏时,截留/捕获的未反应的示踪物质被释放到第二液体介质中。由于其相对于第二液体介质的密度较低的密度,珠和“夹心复合体”将逆着施加的离心力G的方向移动远离第一过滤元件5,参见图1j。为了除去先前在堆积珠之间截留/捕获的未反应的示踪物质,通过改变施加的离心力G的方向,将第二液体介质通过第一出口2从W形腔或试管中引出,参见图1k。在一些作为替代的实施方案中,可例如通过使用位于第一过滤元件5下方的阀从腔引出第二液体介质。
使用不同密度的第一和第二液体介质获得的最重要的效果是,珠将“沉积”在d1<m1的第一液体介质中,同时它们将“漂浮”在d2>m1的第二液体介质中。术语“沉积”和“漂浮”用于描述珠在液体介质中相对于所施加的离心力G的位置,即当珠“漂浮”时,它们沿与所施加的离心力G的方向相反的方向移动,术语”沉积”相反。
如果在除去第二液体介质之后未反应的示踪物质的剩余量太高,可以使用第二液体介质的新鲜等分试样将根据图1i-k添加和去除第二液体介质的步骤(即洗涤步骤)重复所需次数。
如在根据本发明的方法的该具体实施方案中所示,示踪物质可以有利地具有n g/cm3的体积质量密度,其中n>m1、m2和d2。这样的密度可以确保当将第二液体介质供应到珠时,过量的示踪物质将“沉积”,并且进一步促进示踪物质与珠和“夹心复合体”的分离。在一个作为替代的实施方案中这可以是特别有利的,其中通过如上所述的倾析使珠移出柱状腔。
然而,示踪物质不需要具有特定的密度。仅堆积珠柱崩解使得珠之间的紧密相互作用被破坏的事实将确保当除去第二液体介质时实现过量示踪物质的改善的去除。除了体积质量密度之外,示踪物质的另一些性质可决定其在第二液体介质中的行为。例如,如果示踪物质缔合或包含纳米颗粒,则其将倾向于在延长的时间内保持悬浮在液体介质中,即使它们的体积质量密度高于或低于第二液体介质的密度。将影响示踪物质行为的其他性质或特征包括它们在所涉及的液体介质中的溶解性或任何可使它们与漂浮珠分离的施加力(即磁性、电)的存在。
如上所述,珠、示踪物质和“夹心复合体”在第二液体介质中的混合物经受具有第一方向的离心力。珠(包括“夹心复合体”(即可定量的珠复合体))具有小于第二液体(d2)的体积质量密度(m1和m2),并且将“漂浮”(即朝最接近离心系统的旋转轴线的第二液体介质液面移动),而过量的未结合的示踪物质,如上所讨论的,根据其性质如密度n、尺寸、溶解度等,将“沉积”,即移动远离产生离心力的旋转轴线,或保持悬浮至少足以将第二液体介质和因此悬浮的示踪物质与珠和“夹心复合体”分离的时间。
在除去未反应的示踪物质之后,通过分析多个“夹心复合体”,可以原位(即在柱状腔7中)定量或鉴定生物标志物。
在一些作为替代的实施方案中,珠和“夹心复合体”被运输到不同的位点或腔用于分析。当根据本发明的方法用于芯片实验室装置,其包括具有内部流体回路的流控或微流控芯片,可使用离心力使包含珠和含有至少一种分析物之样品的多种反应物移动通过所述内部流体回路时,包含“夹心复合体”的珠可以例如被运输到专门设计用于分析此类珠的流体回路或腔。
在该具体实施方案中,包含“夹心复合体”的珠被转移到第二柱状腔10。转移通过将第二液体介质或与第二液体介质具有相同的或更高的密度的不同的液体介质的另一等分试样添加到珠中来实现,参见图1l-m。等分试样优选大于图1i-k的洗涤步骤中使用的量,使得珠可以更靠近入口4移动。将包含所有珠(包含“夹心复合体”)的最接近离心轴(或入口)的第二液体介质的级分通过倾析转移到第二柱状腔10,参见图1o。倾析通过相对于第一柱状腔稍微改变离心力G的方向的来实现。第二柱状腔10被最佳地设计用于测定中的下一个优选动作,即第二腔可以被设计用于更广泛的洗涤和/或用于定量“夹心复合体”。
在该具体实施方案中,其中堆积有珠的腔7被示出和描述为柱状。然而,在另一些实施方案中,腔可以具有任何形状或形式,只要其提供允许反应物之间的紧密相互作用的珠的堆积结构,随后将堆积结构分散在液体介质中即可。
用于在流体回路中分离不同密度的珠的第一发明构思的详细描述
在图1a-k所描述的实施方案中,本发明的方法显示为一次分析一种分析物。然而,该方法不限于一次仅分析一种分析物。
通过使用不同密度的多种类型的珠,每种类型对不同的分析物以及与包含多种类型的分析物的样品相互作用的各自的互补示踪物质具有选择性,可以在同一时间获得对应于多种类型的分析物的多种类型的“夹心复合体”。多种类型的“夹心复合体”可以同时或依次分析。在如上所述的结合或相互作用步骤之后,堆积珠的柱将包含多种类型的珠和代表待分析的多种分析物的相应的“夹心复合体”。在一些情况下,可以在不彼此分离的情况下分析多种类型的“夹心复合体”。然而,为了获得期望水平的灵敏度和再现性,可能需要分离多种类型的“夹心复合体”。
本公开内容提供了用于实现多种类型的珠/固相材料(包括如整个说明书中所描述的“夹心复合体”)的分离的第一发明构思。第一构思不依赖于根据本发明的方法,也不是其基本部分。第一个构思尤其有利于在芯片实验室设备中使用,例如包含内部流体回路的流控或微流控芯片,其中包含珠和含有至少一种分析物之样品的多种反应物通过所述内部流体回路的移动可以通过使用离心力来实现。
第一发明构思的一个实施方案在图2a和2b中示出。适于分离具有不同密度的珠的腔在图2a和2b中示出。腔包括入口12、第一出口13和第二出口14。在该特定情况下,向腔提供密度为m1的第一组珠8a和密度为m2的第二组珠8b。然后密度为d3(m1<d3<m2)的液体介质11添加到腔中的珠中。离心力G使得第一组珠8a在第一出口13的方向上移动(或漂浮),而第二组珠8b朝向第二出口14移动(或沉积)。通过改变离心力的方向,即腔相对于离心力的取向,第一组珠8a和液体介质11的一部分通过第一出口13转移,而第二组珠8b和液体介质11的一部分通过第二出口14转移。
第一发明构思也适用于其他腔设计,例如图1a中已经示出的腔设计。在如图1a所示的腔中,密度为d3的液体介质(如结合图2a和2b所述)可以首先用于分离两组珠(类似于图2a中的动作)。在两组珠分离之后,通过改变所施加的离心力G的方向,可以从柱状腔7倾析出第一组珠(类似于图1o中的珠的倾析)。因此可以将第一与第二组珠分离。通过向柱状腔7中添加密度为d4(d4>m2)的另外的液体介质,可以随后以与用于第一组珠的相同的方式从所述腔中倾析出第二组珠。
分离不同密度的珠的第一发明构思不限于仅具有不同密度的两组珠,而是可用于分离任何数量组的珠,只要其具有不同的密度,允许通过应用适当密度的液体介质分离即可。例如,在如图1a所示的腔的情况下,可以按顺序如下分离密度分别为m1、m2、m3和m4的四组珠:首先添加密度为d3(m4<d3<m3、m2、m1)的液体介质,倾析密度为m4的珠(类似于图1o中的珠),过滤掉密度为d3的剩余液体介质,并添加密度为d4(m3<d4<m2、m1)的另外的液体介质(或者,不过滤掉密度为d3的剩余液体介质,但是通过添加密度提高添加剂如另外的高密度液体将其密度提高到d4),倾析密度为m3的珠等。
另一选择是将珠分离成两个组合组的珠,其中第一组合组包含密度m1和m2的珠,而另一组合组包含密度m3和m4的珠。这可以通过首先添加密度为d4(m4、m3<d4<m2、m1)的液体介质并倾析密度为m4和m3的珠来获得。然后,将每个组合组的珠可以例如转移到如图2a所示的腔中用于进一步分离。当在分析方法(例如根据本发明的方法)中使用第一构思时,珠的组还可包含待分析的“夹心复合体”。
可如下限定第一构思:
在包含内部流体回路的流控芯片中分离珠的方法,其中包含珠和含有至少一种分析物之样品的多种反应物通过所述内部流体回路的移动可以通过使用离心力来实现,所述方法包括以下步骤:
-在所述流体回路的腔中提供至少密度为m1的第一组珠和密度为m2的第二组珠,所述腔包含至少第一出口;
-向所述腔提供第一液体介质,所述液体介质的密度为d3,使得m1<d3<m2;以及
-施加离心力,使得所述第一组珠和所述第二组珠在所述腔内沿相反方向移动。
在流控芯片中分离珠的方法的一个实施方案中,第一组珠移向第一出口。
在流控芯片中分离珠的方法的一个实施方案中,所述方法包括以下步骤:
-通过改变离心力的方向将第一组珠转移到腔外,而第二组珠保留在所述腔中,优选地使得通过第一出口倾析第一组珠。
在流控芯片中分离珠的方法的一个实施方案中,腔包括第二出口,所述方法包括以下步骤:
-改变离心力的方向,使得第一组珠通过第一出口转移,并且第二组珠通过第二出口转移。
在流控芯片中分离珠的方法的一个实施方案中,所述流控芯片是微流控芯片。
用于在流体回路中转移珠的第二发明构思的详述
关于珠的运输,本公开还提出了另一个发明构思,其不依赖于根据本发明的方法,也不是其基本部分。该构思的一个实施方案在图1l-p中公开。该构思解决了尤其与芯片实验室装置(例如流控或微流控芯片)相关的问题,其中使用离心力运输珠通过流体回路。在现有技术中,珠的运输总是在与离心力相同的方向上进行,因此限制了可用于流体回路设计的选择。该另一发明构思允许通过将密度为d2的液体介质添加到密度等于或小于m1(其中d2>m1)的珠中而沿与施加的离心力相反的方向运输珠。
虽然通过参照图1l-1p的柱状腔7示出了第二发明构思,但是该构思同样适用于具有多种形状和形式的腔。图2a和2b中示出了合适的腔的另一实例。如在上述第一发明构思的描述中所公开的,使第一组珠8a在第一出口13的方向上移动(或漂浮),该方向与所施加的离心力G的方向相反。
可如下限定第二发明构思
在包含内部流体回路的流控芯片中转移珠的方法,其中包含珠和含有至少一种分析物之样品的多种反应物通过所述内部流体回路的移动可以通过使用离心力来实现,所述方法包括以下步骤:
-在所述流体回路的腔中提供密度等于或小于m1的珠,所述腔包括至少第一出口;
-向所述腔提供第一液体介质,所述液体介质密度为d2,使得d2>m1;以及
-施加离心力,使得所述珠在离心力的相反方向上移动。
在流控芯片中转移珠的方法的一个实施方案中,珠朝向第一出口移动。
在流控芯片中转移珠的方法的一个实施方案中,所述方法包括以下步骤:
-通过改变离心力的方向将珠转移到腔外,优选地使得通过第一出口倾析珠。
在转移流控芯片中珠的方法的一个实施例中,流控芯片是微流控芯片。
- 还没有人留言评论。精彩留言会获得点赞!