分析装置以及分析方法与流程
本发明涉及一种用于分析抗体、抗原等生物物质的分析装置以及分析方法。
背景技术:
已知一种通过检测出与疾病相关联的特定的抗原或抗体来作为生物标志物,对疾病的发现、治疗效果等进行定量分析的免疫测定方法(immunoassay)。检测出通过酶标识的抗原或抗体的elisa方法(enzyme-linkedimmunosorbentassay酶联免疫吸附剂测定)为免疫测定方法之一,因成本等优势而得到广泛普及。在elisa方法中。对前处理、抗原抗体反应、b/f(bond/free)分离、酶反应等进行合计后的时间为数小时至一天左右,需要较长时间。
与此相对,提出了如下的技术:使固定在光盘的抗体与试样中的抗原结合,并使抗原与具有抗体的粒子结合,通过光头进行扫描,在短时间内对在光盘上捕捉到的粒子进行计数(专利文献1)。此外,提出了使生物试样、粒子附着在光盘的形成有跟踪构造的面上,通过光拾取器检测信号的变化的技术(专利文献2)。
现有技术文献
专利文献
专利文献1:日本特开平5-5741号公报
专利文献2:日本特表2002-530786号公报
技术实现要素:
在使用光盘的分析装置中,在检测作为检测对象的生物标志物时,光盘基板表面的细微的损伤成为噪声成分。
此外,在使用光盘的分析装置中,在光盘基板的表面上进行抗原抗体反应,因此产生由反应引起的噪声。具体地说,向基板表面固定抗体、通过脱脂牛奶或牛血清白蛋白等溶液进行的封闭处理、以及使用含有盐的缓冲液进行的测定等工序中的残渣或残留物在洗净后仍残留,从而成为噪声成分。由残渣或残留物引起的噪声等级与基板表面的细微的损伤引起的噪声等级相比,大1位数以上,成为使生物标志物的检测精度恶化的主因。
实施方式的目的在于提供一种抑制噪声成分的影响,使基于微粒子的检测对象的检测精度提高的分析装置以及分析方法。
根据实施方式的第1方式,提供一种分析装置,该分析装置具备:光扫描部,其对在表面上固定了与微粒子相结合的检测对象的基板进行光学扫描,从上述基板取得检测信号;以及脉冲波形分析部,其对上述光扫描部取得的上述检测信号的脉冲波形进行分析,上述脉冲波形分析部具有:振幅判定部,其判定上述脉冲波形的峰值是否存在于预定范围内;以及脉冲宽度判定部,其判定上述脉冲波形的脉冲宽度是否在预定范围内。
根据实施方式的第2方式,提供一种分析方法,其包括:检测信号取得步骤,对在表面上固定了与微粒子相结合的检测对象的基板进行光学扫描,从上述基板取得检测信号;振幅判定步骤,判定上述检测信号的脉冲波形的峰值是否存在于预定范围内;以及脉冲宽度判定步骤,判定上述脉冲波形的脉冲宽度是否在预定范围内。
根据实施方式的分析装置以及分析方法,能够抑制噪声成分的影响,使基于微粒子的检测对象的检测精度提高。
附图说明
图1是表示实施方式的分析装置的框图。
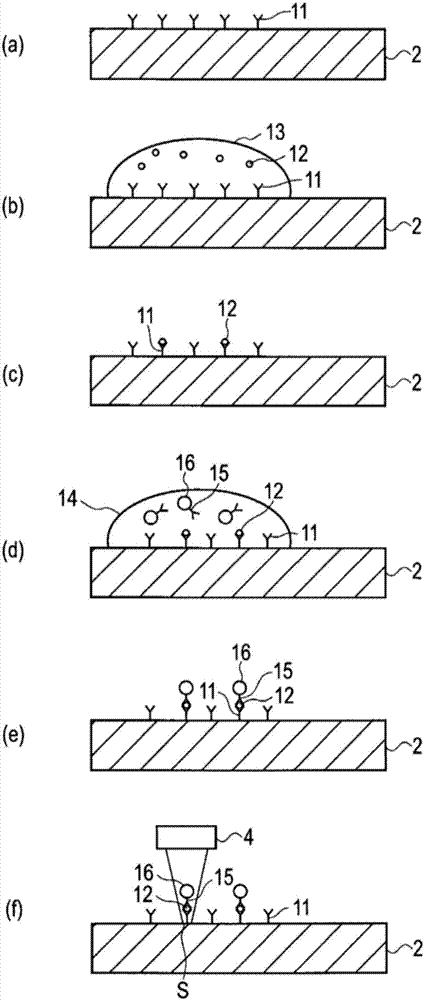
图2是用于说明通过抗原抗体反应将作为生物标志物的抗原用微球(bead)和基板进行夹心捕获来标记,并对其进行检测的方法的一例的示意图。
图3是检测信号的脉冲波形数据的一例。
图4是表示实施方式的分析方法的流程图。
图5是表示脉冲波形与各参数的关系的示意图。
图6是用于说明各基准值的设定方法的脉冲波形图。
图7是用于说明基准值的设定方法的脉冲波形图。
图8是表示微球计数数量与生物标志物量的关系的相关图。
具体实施方式
使用图1,对本实施方式的分析装置进行说明。
如图1所示,分析装置1具备基板2、由使基板2旋转的电动机等构成的驱动部3、对基板2的表面进行光学扫描的光扫描部4、对驱动部3和光扫描部4进行控制并对通过光扫描部4检测出的检测信号的脉冲波形进行分析的控制部5。控制部5可以由微处理器或微型计算机构成。
基板2例如是具有与压缩光盘(cd)、dvd、蓝光光盘(bd)等光盘相同尺寸的圆盘状。基板2例如一般由在光盘中使用的聚碳酸酯树脂或环烯烃共聚物等具有疏水性的树脂材料形成。
基板2在表面具有光扫描部4可扫描的轨道构造。轨道构造由槽(groove)、岸(land)、坑(pit)等构成,从内周侧到外周侧形成为螺旋状。在基板2的表面上,可根据需要执行薄膜形成、基于硅烷偶联剂等进行的表面处理。
如图2所示,在基板2的表面上固定有与检测对象的生物物质即抗原12特异性结合的抗体11。如后所述,抗原12与在微粒子即微球16的表面上固定的抗体15以及基板2的抗体11特异性结合。在基板2上标记通过微球16和基板2夹心捕获的抗原12。抗原12通过与抗体11以及抗体15特异性结合,从而用作成为疾病等指标的生物标志物。
如图2(a)所示,在基板2的表面上预先固定有抗体11。通过疏水结合或共价结合,在基板2的表面上结合抗体11。可以经由抗生物素蛋白等结合力强的物质将抗体11固定在基板2的表面上。
如图2(b)所示,将包含抗原12的试样溶液13滴到基板2的表面上。抗原12通过布朗运动在试样溶液13中移动而与抗体11接触,通过抗原抗体反应与抗体11特异性结合。
如图2(c)所示,使用纯水等洗净滴到基板2上的试样溶液13,由此从基板2除去包含不与抗体11结合的剩余抗原12的试样溶液13。
如图2(d)所示,将包含微球16的缓冲液14滴到基板2的表面上。也可以在残留有试样溶液13的状态下,将缓冲液14滴到基板2上。
作为生物标志物的抗原12通过抗原抗体反应与微球16的抗体15特异性结合,并与基板2的抗体11特异性结合,由此通过微球16和基板2夹心捕获抗原12,并在基板2上进行标记。
微球16例如通过内含铁氧体等磁性体的聚苯乙烯等合成树脂形成为大致球形。微球16的直径为数十纳米~200纳米程度。因为在基板2的相反侧配置有磁铁,因此在滴下缓冲液14时,微球16能够迅速集中到基板2的表面。由此,促进微球16与抗原12的反应。此外,通过同时投入抗原12和微球16,能够将直到标记在基板2上固定的抗原12为止的时间缩短至数分钟左右。
抗体11和抗体15只要是与抗原12特异性结合的特异性生物物质即可,能够选择各自与其他部位相结合的组合。
例如,把在表面发现了多种抗原12的外泌体等膜囊泡设为检测对象的情况下,通过使抗体11和抗体15为不同的种类,能够分析具有2种抗原12的生物试样。并不限于此,外泌体等与通常的抗原不同,在表面存在多个为同种蛋白质的抗原,因此也可以使抗体11和抗体15为相同种类。
如图2(e)所示,使用纯水等洗净滴到基板2上的缓冲液14,由此能够去除包含不与抗原12结合的剩余微球16的缓冲液14。
如图2(f)所示,通过光扫描部4对基板2进行光学扫描,检测微球16,由此能够对微球16标记的抗原12(生物标志物)进行分析。例如,能够对生物标志物的量(浓度)进行定量。
返回到图1,光扫描部4具备激光振荡器21、准直透镜22、分束器23、致动器24、物镜25、聚光透镜26、光检测部27。光扫描部4是对基板2进行光学扫描的光拾取器。
激光振荡器21根据控制部5的控制,向准直透镜22射出激光。激光振荡器21例如是射出波长为与bd的再生用波长相同的405nm,且输出为1mw左右的激光的半导体激光振荡器。
准直透镜22使从激光振荡器21射出的激光平行。
分束器23向物镜25反射通过准直透镜22平行后的激光。
物镜25通过与控制部5的控制相对应的致动器24的驱动,将经由分束器23的激光会聚到固定了抗体11的基板2的表面来成像出点s。物镜25的孔径值例如为0.85。会聚的激光在基板2进行反射,入射到分束器23中。
入射到分束器23的激光透射分束器23,经由聚光透镜26入射到光检测部27。聚光透镜26使在基板2反射的激光会聚到光检测部27。光检测部27例如由光电二极管构成,向控制部5输出与在基板2反射的激光的光量对应的检测信号。
控制部5具备:控制驱动部3的驱动系统控制部28、分别控制激光振荡器21和致动器24的光学系统控制部29、对从光检测部27输出的检测信号的脉冲波形进行分析的脉冲波形分析部30。
驱动部3通过驱动系统控制部28的控制,以恒定线速度(clv)方式使基板2旋转。
致动器24通过光学系统控制部29的控制,使光扫描部4在基板2的半径方向上移动,以便螺旋状地对旋转的基板2的表面进行扫描。光学系统控制部29根据从光检测部27输出的检测信号,检测聚焦误差(fe)、跟踪误差(te)等误差。光学系统控制部29根据检测出的误差,对致动器24等进行控制以便适当地对基板2的表面进行扫描。
脉冲波形分析部30具有脉冲检测部31、振幅判定部32、脉冲宽度判定部33。振幅判定部32能够由振幅滤波器构成。
使用图3~图8,说明通过脉冲波形分析部30分析从光检测部27输出的检测信号的脉冲波形的方法。
通过操作员的操作,驱动系统控制部28对驱动部3进行控制,使基板2以预定的线速度,例如以4.92m/秒进行旋转。此外,光学系统控制部29对光扫描部4进行控制,从而使激光会聚到基板2的表面成像出点s。
通过抗原抗体反应将抗原12和微球16固定在表面的基板2,通过驱动部3以恒定线速度旋转,并通过光扫描部4被光学扫描。
在光扫描部4,通过光检测部27检测从激光振荡器21射出并在基板2的表面反射的激光。光检测部27向脉冲检测部31输出与检测出的激光的光量对应的检测信号。
从光检测部27例如检测出图3所示的脉冲波形(检测信号)。图3的横轴为时间,纵轴为电压。在图3中表示了在下侧具有峰值的4个脉冲波形。
在图4的步骤s1中,脉冲检测部31取得从光检测部27输出的检测信号,并检测所取得的检测信号的脉冲波形的下降。脉冲检测部31检测低于预先设定的阈值等级(电压)vth的时间点来作为脉冲波形的下降。
另外,事先计算出通过光检测部27检测出的微球16的脉冲波形的半宽的平均值,预先将与半宽的平均值对应的电压设定为阈值等级vth。
在步骤s2中,脉冲检测部31在检测出下降的情况下(“是”)使处理向步骤s3前进,在没有检测出下降的情况下(“否”)结束处理。
在步骤s3中,脉冲检测部31取得脉冲波形低于阈值等级vth的时间点的时刻t1,对计数器标志c1、第1基准等级(电压)v1的标志l1、以及第2基准等级(电压)v2的标志l2进行复位(低0),使处理向步骤s4前进。
在步骤s4中,振幅判定部32检测脉冲波形的峰值(谷底电压)vp,判定检测出的峰值vp是否小于预先设定的第1基准等级v1。
振幅判定部32在检测出的峰值vp小于第1基准等级v1的情况下(“是”)使处理向步骤s5前进,在检测出的峰值vp大于第1基准等级v1的情况下(“否”)使处理向步骤s8前进。
在步骤s5中,振幅判定部32将标志l1设定为高1,使处理向步骤s6前进。
在步骤s6中,振幅判定部32判定脉冲波形的峰值vp是否小于预先设定的第2基准等级v2。
振幅判定部32在峰值vp小于第2基准等级v2的情况下(“是”)使处理向步骤s7前进,在峰值vp大于第2基准等级v2的情况下(“否”)使处理向步骤s8前进。
在步骤s7中,振幅判定部32将标志l2设定为高1,使处理向步骤s8前进。
在步骤s8中,振幅判定部32将标志l1为高1,且标志l2为低0的检测信号判定为有效的检测信号(“是”),使处理向步骤s9前进。此外,振幅判定部32在未判定为有效的检测信号(“否”)时结束处理。
在步骤s9中,脉冲宽度判定部33检测脉冲波形的上升。脉冲宽度判定部33检测高于在下降检测中使用的阈值等级vth的时间点来作为脉冲波形的上升。
在步骤s10中,脉冲宽度判定部33在检测出上升的情况下(“是”)使处理向步骤s11前进,在未检测出的情况下(“否”)结束处理。
在步骤s11中,脉冲宽度判定部33取得脉冲波形高于阈值等级vth的时间点的时刻t2,根据取得的时刻t2和在步骤s3中取得的下降的时刻t1取得脉冲波形的脉冲宽度t(大致相当于半宽),使处理向步骤s12前进。
在此,图5表示了脉冲波形的峰值(谷底电压)vp与第1基准等级v1和第2基准等级v2之间的关系、以及脉冲波形的脉冲宽度t与阈值等级vth、下降的时刻t1和上升的时刻t2之间关系。
如图5所示,阈值等级vth、第1基准等级v1及第2基准等级v2具有vth>v1>v2的关系。
图5所示的检测信号的脉冲波形的峰值vp存在于第1基准等级v1至第2基准等级v2的范围中。因此,图5所示的检测信号在步骤s8中被判定为是有效的检测信号。
峰值vp不存在于第1基准等级v1至第2基准等级v2的范围内的脉冲波形的检测信号被判定为是用于抑制非特异性吸附的封闭剂等检测对象以外的蛋白质聚集引起的噪声成分。
例如在图3所示的4个检测信号中,左侧的3个检测信号的脉冲波形的峰值vp存在于第1基准等级v1至第2基准等级v2的范围内,因此被判定为是有效的检测信号。另一方面,右端的检测信号的脉冲波形的峰值vp不存在于第1基准等级v1至第2基准等级v2的范围内,因此被判定为是噪声成分。
在此,对第1基准等级v1和第2基准等级v2的设定方法进行说明。
首先,准备不进行在图2中说明的基板抗体形成、封闭处理以及含有盐的缓冲液的滴下等处理,而使测定微球在光盘的底板上分散并干燥后的校正用盘。
接着,通过图1所示的分析装置1的光扫描部4对校正用盘进行光学扫描,一边用示波器等观察检测信号的脉冲波形,一边测定脉冲波形的峰值(谷底电压)。
针对测定出的峰值计算分散,例如以3σ为范围设定第1基准等级v1和第2基准等级v2。
根据本设定方法,使用实际进行分析的分析装置1,根据实际使用的微球的检测信号,设定第1基准等级v1和第2基准等级v2,因此能够容易且适当地设定第1基准等级v1和第2基准等级v2。
[实验结果1]
针对具有信号强度(振幅调制度)的平均值为0.5的特性的微球的检测信号,设定为vth=0.75、v1=0.6、v2=0.3,通过振幅判定部32实施了检测信号的滤波处理。结果,去除了大约2%的检测信号。微球的检测信号的信号强度的偏差为10%以下,即认为是峰值(谷底电压)且0.55~0.45的范围。因此,通过振幅判定部32去除的检测信号被认为是噪声成分。由此,能够使生物标志物检测精度提高大约2%。
[实验结果2]
不滴下含有检测对象的抗原(生物标志物)的试样溶液地进行测定,准备仅固定了噪声成分的光盘。针对该光盘,设定为v1=0.65、v2=0.35,通过振幅判定部32实施了检测信号的滤波处理。结果,相对于不使用振幅判定部32的情况,能够去除大约50%的噪声成分。
[实验结果3]
针对与实验结果2中使用的光盘相同的光盘,设定为v1=0.57、v2=0.45,通过振幅判定部32实施了检测信号的滤波处理。结果,相对于不使用振幅判定部32的情况,能够去除大约80%的噪声成分。然而,当滴下含有检测对象的抗原(生物标志物)的试样溶液来进行测定,并以相同的条件实施滤波处理时,本来应被计数的检测信号的一部分作为噪声成分而被去除。
根据如实验结果1~3那样改变滤波处理条件而进行实验得到的结果,来设定第1基准等级v1和第2基准等级v2,从而能够进行恰当的滤波处理。
返回到图4,在步骤s12中,脉冲宽度判定部33判定所取得的脉冲宽度t是否大于预先设定的第1基准宽度t1。
脉冲宽度判定部33在脉冲宽度t大于第1基准宽度t1的情况下(“是”)使处理向步骤s13前进,在脉冲宽度t小于第1基准宽度t1的情况下(“否”)结束处理。
在步骤s13中,脉冲宽度判定部33判定脉冲宽度t是否小于预先设定的第2基准宽度t2(t2>t1)。
脉冲宽度判定部33在脉冲宽度t小于第2基准宽度t2的情况下(“是”)输出脉冲信号s(步骤s15),在脉冲宽度t大于第2基准宽度t2的情况下(“否”)使处理向步骤s14前进。
在步骤s14中,脉冲宽度判定部33判定脉冲宽度t是否小于预先设定的第3基准宽度t3(t3>t2)。
脉冲宽度判定部33在脉冲宽度t小于第3基准宽度t3的情况下(“是”)输出脉冲信号l(步骤s16),在脉冲宽度t大于第3基准宽度t3的情况下(“否”)结束处理。
即,脉冲波形分析部30检测峰值(谷底电压)小于第1基准等级且大于第2基准等级,并且,脉冲宽度在预定范围内的脉冲波形,在检测出这样的脉冲波形的情况下输出脉冲信号s或脉冲信号l。
通过未图示的计数部对从脉冲宽度判定部33输出的脉冲信号s和脉冲信号l进行计数,由此能够高精度地分析检测对象的生物标志物的量(浓度)。另外,计数部既可以构成为控制部5的一部分,也可以在控制部5的后级构成。
此外,分别对脉冲信号s和脉冲信号l进行计数,并将它们进行比较来获知微球的聚集状态。例如,若脉冲信号s相对于脉冲信号l的比率大,则可知微球为聚集的状态,若脉冲信号s相对于脉冲信号l的比率小,则可知微球为分散的状态。
在此,使用图6和图7,对第1基准宽度t1、第2基准宽度t2和第3基准宽度t3的设定方法进行说明。图6和图7的横轴为点位置,纵轴为信号强度(振幅调制度)。在图6中,用实线表示1个微球孤立的状态下的脉冲波形d1,用一点划线表示2个微球相邻的状态下的脉冲波形d2,用虚线表示3个微球相邻的状态下的脉冲波形d3。在图7中,为了使说明便于理解,仅表示了图6的脉冲波形d1。
如图6所示,脉冲波形d2的半宽与脉冲波形d3的半宽大致相同,因此将多个微球相邻状态下的脉冲波形的半宽设为第1基准宽度t1。将第2基准宽度t2设定为第1基准宽度t1加上α而得的值。参考分析装置的抖动值等来设定α。
如图7所示,将第3基准宽度t3设定为脉冲波形d1的半宽加上α而得的值。参考分析装置的抖动值等来设定α。
根据上述的分析装置以及分析方法,通过振幅判定部32对检测信号的峰值(谷底电压)进行分析从而去除噪声成分,并且通过脉冲宽度判定部33对检测信号的脉冲宽度进行分析,由此能够去除没有被振幅判定部32去除完的噪声成分。因此,能够比以往更加抑制噪声成分的影响,能够使检测对象即生物标志物的检测精度提高。
使用图8,对使用上述分析装置1的实施例进行说明。图8的横轴为生物标志物量(浓度),纵轴为微球计数数量。另外,将不进行振幅判定部的处理而仅进行了脉冲宽度判定的情况作为比较例来表示。
图8的虚线为背景,相当于噪声成分。如图8所示,微球计数数量相对于生物标志物量的斜率在实施例、比较例中大致相同。另一方面,与比较例相比,背景在实施例中大幅度下降。即,与比较例相比,实施例去除了噪声成分。结果,检测对象即生物标志物的检测精度上升,还能够检测微量的生物标志物。
另外,本发明的实施方式并不限于上述结构,可在不脱离本发明的宗旨的范围内进行各种变更。在图1中,关于控制部5内的各部,可以至少部分地通过电路来构成,硬件和软件的分开使用是任意的。
产业上的应用
在对抗体、抗原等生物物质进行分析时,能够使用本发明。
- 还没有人留言评论。精彩留言会获得点赞!