用于纸基测定的测试条的制作方法
对相关申请的交叉引用
本申请要求2014年8月30日提交的新加坡申请号10201405360p的优先权,该新加坡申请的内容在此出于所有目的以引用的方式整体并入本文。
本发明涉及一种用于纸基测定的测试条。本发明进一步涉及一种使用所述测试条检测样品中的分析物的方法。
背景技术:
纸基测定,如浸条测试和侧流测试可供用作针对体液中的许多生理相关化合物的低成本的筛查装置。纸基测定利用测试条,所述测试条依赖于使用酶或生物/化学原理以使得能够检测分析物或与用于分析物检测的检测剂分子缀合的核苷酸或抗体。
侧流测试中所用的测试条的重要限制是测试条的灵敏度,这是因为用于结果可视化的检测剂分子的检测限不佳。不佳的检测限体现为更大的样品要求。虽然这一限制可以经由使用酶-底物或辣根过氧化物酶(hrp)-四甲基联苯胺(tmb)扩增方法来克服,但是在启动底物添加步骤之前需要极少的等待时间。因而,这引入了人为误差的可能性。如果使用者过早启动添加步骤,那么可能出现假阴性。酶-底物扩增方法的另一个限制是酶底物接触测试区的速率,这直接影响向酶运送底物的速率并且因此影响测定灵敏度。
因此需要提供一种克服了,或至少修正了上文所述的缺点中的一个或多个的测试条。
技术实现要素:
在一个方面,提供了一种用于纸基测定的测试条,所述测试条包括用于接收底物的底物添加区;以及测试区,所述测试区包括捕捉剂,其中所述底物添加区位于所述测试区的上游。
在一个方面,提供了一种纸基酶测定,所述测定包括如本文所述的测试条。
在一个方面,提供了一种检测样品中分析物的存在的方法,所述方法包括以下步骤:a)使所述样品接触到如本文所述的测试条的所述测试区上;b)将底物分配到所述底物添加区上;以及c)检测来自所述测试区的发射信号以确认所述样品中存在或不存在所述分析物。
在一个方面,提供了一种检测样品中分析物的存在的方法,所述方法包括以下步骤:a)使所述样品接触到如本文所述的测试条的所述检测剂区上;b)将底物分配到所述底物添加区上;以及c)检测来自所述测试区的发射信号以确认所述样品中存在或不存在所述分析物。
定义
如本文所用的术语“抗原结合蛋白”指的是能够结合抗原的抗体、抗体片段以及其它蛋白质构建体,如结构域。
术语“抗体”在本文以最广义用以指具有免疫球蛋白样结构域的分子并且包括单克隆抗体、重组抗体、多克隆抗体、嵌合抗体、人源化抗体、双特异性抗体以及异源缀合抗体;单可变域、结构域抗体、抗原结合片段、免疫有效片段、单链fv、双体抗体、tandabstm等(关于可选的“抗体”形式的汇总,参见holliger和hudson,naturebiotechnology,2005,第23卷,第9期,1126-1136)。
短语“单可变域”指的是独立于不同的可变区或可变域、特异性结合抗原或表位的抗原结合蛋白可变域(例如vh、vhh、vl)。
“结构域抗体”或“dab”可以被认为与能够结合抗原的“单可变域”是相同的。单可变域可以是人类抗体可变域,而且还包括来自其它物种的单抗体可变域,如啮齿类动物、护士鲨以及骆驼科动物(camelid)vhhdab。骆驼科动物vhh是源自于包括骆驼、美洲驼、羊驼、单峰骆驼、以及原驼在内的物种的免疫球蛋白单可变域多肽,其产生天然缺少轻链的重链抗体。这样的vhh结构域可以根据本领域中可用的标准技术来人源化,并且这样的结构域被认为是“结构域抗体”。如本文所用的vh包括骆驼科动物vhh结构域。
如本文所用的术语“结构域”指的是具有独立于蛋白质的其余部分的三级结构的折叠蛋白质结构。一般来说,结构域负责蛋白质的离散的功能特性,并且在很多情况下,可以被添加、去除或转移到其它蛋白质中而所述蛋白质的其余部分和/或所述结构域的功能不会丧失。“单可变域”是包含抗体可变域的特征性序列的折叠多肽结构域。因此它包括完整的抗体可变域和修饰的可变域,例如其中一个或多个环已经被不是抗体可变域特征的序列置换;或已经被截短或包含n末端或c末端延伸结构的抗体可变域;以及至少保留全长结构域的结合活性和特异性的可变域折叠片段。结构域可以独立于不同的可变区或可变域结合抗原或表位。
抗原结合片段可以借助于将一个或多个cdr布置在非抗体蛋白质支架(如结构域)上来提供。所述结构域可以是结构域抗体或可以是作为选自由以下各项组成的组的支架的衍生物的结构域:ctla-4、脂笼蛋白、spa、亲和体、高亲合性多聚体(avimer)、groel、转铁蛋白、groes、以及纤连蛋白/阿德奈汀(adnectin),所述结构域已经经蛋白质工程化以获得与抗原,而不是天然配体的结合。
抗原结合片段或免疫有效片段可以包含部分重链或轻链可变序列。片段具有至少5个、6个、8个或10个氨基酸的长度。或者,所述片段具有至少15个、至少20个、至少50个、至少75个、或至少100个氨基酸的长度。
如整个本说明书中关于抗原结合蛋白所用的术语“特异性结合”意指所述抗原结合蛋白结合所关注的特定抗原而不结合或不显著结合其它蛋白质。然而,所述术语不排除以下事实,即抗原结合蛋白还可能具有与密切相关的分子的交叉反应性。本文所述的抗原结合蛋白结合抗原的亲和力可以是它们结合密切相关的分子的亲和力的至少2倍、5倍、10倍、50倍、100倍、或1000倍。
如本文所用的术语“分析物”指的是所关注的化合物。一般将了解的是,分析物包括但不限于抗原、抗体、激素、药物、治疗剂、细胞蛋白质、核酸、心脏标志物、肿瘤标志物或癌症标志物、自身免疫性疾病标志物、或任何高分子。举例来说,抗原分析物可以是与感染因子相关的抗原,所述感染因子诸如病毒、细菌、真菌、或朊病毒。激素分析物的实例包括但不限于hcg、甲状腺素、tsh、胰高血糖素、胰岛素、松弛素、催乳素、促黄体激素、促黑激素、生长激素、促卵泡激素、胃泌素、缓激肽、血管加压素、以及其它释放因子;生理学上或病理学上关注的其它激素可以是分析物。作为癌症标志物或肿瘤标志物的分析物的实例包括但不限于前列腺特异性抗原(psa)、癌胚抗原(cea)、以及α-甲胎蛋白。然而,其它癌症标志物或肿瘤标志物可以是分析物。药物分析物的实例包括但不限于鸦片制剂。抗体分析物的实例包括但不限于免疫球蛋白,如igg、igm、iga、ige、以及igd。治疗剂分析物的实例包括但不限于阿霉素。
如本文所用的术语“样品”指的是生物样品或非生物样品。生物样品指的是从生物受试者获得的样品,包括体内或体外获得的生物组织或流体来源的样品。这些样品可以是但不限于血液、血浆、血清、颊涂片、羊水、胎儿期组织、汗液、鼻拭子或尿液、从包括人类的哺乳动物分离的器官、组织、部分、以及细胞。生物样品还可以包括生物样品(包括组织)的切片(例如器官或组织的剖面部分)。生物样品还可以包括来自生物样品的提取物,例如来自生物流体(例如血液或尿液)的抗原。非生物样品包括但不限于来自一些生态位,例如河流或湖泊的水;或实验室中使用的溶液。
如本文所用的术语“施用器”指的是将化合物施用到测试条上的装置。施用器可以是膜,包括但不限于多孔膜,如滤膜。滤膜的实例包括但不限于来自whatmantm的fusion5、玻璃纤维、对称和不对称的聚醚砜膜、cytoseptm以及纤维素滤膜。
如本文所用的术语“多孔膜”指的是具有孔隙的膜。多孔膜的实例包括但不限于可以选自由以下各项组成的组的多孔膜:醋酸纤维素、纤维素纸、滤纸、薄页纸、书写纸、纸巾、布、或多孔聚合物膜、硝化纤维素膜、聚偏二氟乙烯(pvdf)膜以及滤纸。在一个实施方案中,所述多孔膜是硝化纤维素膜,如醋酸硝化纤维素。
如本文所用的术语“施用”或“接触”对于施用器来说可以互换使用。
如本文所用的术语“核酸”指的是任何单链或双链rna或dna分子,如mrna、cdna、以及基因组dna。
如本文所用的术语“寡核苷酸”指的是由超过2个核苷酸亚单位共价连接在一起构成的单链核苷酸聚合物。优选地,存在10个至100个核苷酸单位,最优选地,12个至50个核苷酸单位连接在一起。核苷酸亚单位的糖基可以是核糖、脱氧核糖或其修饰的衍生物,如2'-o-甲基核糖。寡核苷酸的核苷酸亚单位可以由磷酸二酯键、硫代磷酸酯键、甲基膦酸酯键或由不会阻止寡核苷酸杂交的其它稀有的或非天然存在的键连接。此外,寡核苷酸可以具有不常见的核苷酸或非核苷酸部分。如本文所定义的寡核苷酸是核酸,优选地是dna,但可以是rna或具有共价连接的核糖核苷酸和脱氧核糖核苷酸的组合。具有限定序列的寡核苷酸探针和扩增寡核苷酸可以通过本领域的普通技术人员已知的技术产生,如通过化学合成或生化合成、以及通过从重组核酸分子,例如细菌或逆转录病毒载体的体外或体内表达。如由本公开所预期的那样,寡核苷酸并非由野生型染色体dna或其体内转录产物组成。探针的一种用途是作为杂交测定探针;探针还可以用作体内或体外治疗性扩增低聚物或反义剂以阻断或抑制病变细胞、受感染细胞、或病原细胞中的基因转录或翻译。
如本文所用的术语“肽”指的是由酰胺键连接的两个或更多个氨基酸分子。肽可以是天然存在的或合成的。
附图说明
在结合非限制性实施例和附图考虑时,通过参考详细说明将更好地理解本发明,其中:
图1:图示了经由组合的洗涤和底物添加步骤(即不需要单独的洗涤步骤)实现纸基elisa比色结果的方法的示意图。第一步骤需要将样品与检测剂-酶缀合物混合以及点样到测试点/线201上。在这之后进行第二步骤,即在底物垫102处添加酶底物302。在步骤1与步骤2之间不需要等待时间。
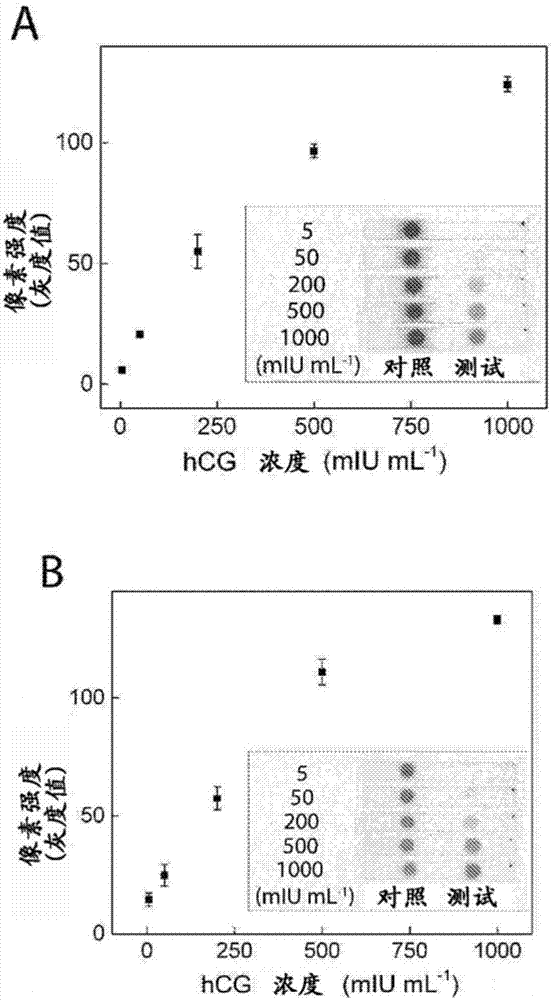
图2:使用(a)碱性磷酸酶和bcip/nbt以及(b)辣根过氧化物酶和tmb的纸基elisa的像素强度(灰度值)相对于人绒毛膜促性腺激素(hcg)浓度的图表。n=3。包括测试条的代表性图像作为插图。
图3:图示了经由组合的洗涤和底物添加步骤(即不需要单独的洗涤步骤)实现纸基elisa比色结果阵列的方法的示意图。第一步骤需要将样品与检测剂-酶缀合物混合以及点样到测试阵列201a上。在这之后进行第二步骤,即在底物垫102处添加酶底物302。在步骤1与步骤2之间不需要等待时间。
图4:经由组合的洗涤和底物添加步骤(即不需要单独的洗涤步骤)所获得的纸基elisa比色结果阵列的代表性图像。使用(a)碱性磷酸酶和bcip/nbt以及(b)辣根过氧化物酶和tmb获得的2×2和3×3阵列。使用1000miuml-1和50miuml-1hcg分别获得较深的结果和较浅的结果。
图5:(a)使用水溶性染料(在这个实施例中是蓝色食用色素)使测试点可视化。图像是使用组合的洗涤和底物添加步骤(即不需要单独的洗涤步骤)所获得的纸基elisa比色结果的代表性图像。ap和bcip/nbt系统连同hcg测定一起使用,15分钟的底物流动时间。n=3。(b)使用水不溶性染料使测试点可视化。所述测试点是使用与捕捉抗体缀合的3μm黄色羧化聚苯乙烯珠粒形成的。图像是使用组合的洗涤和底物添加步骤(即不需要单独的洗涤步骤)所获得的纸基elisa比色结果的代表性图像。ap和bcip/nbt系统连同促黄体激素测定一起使用,15分钟的底物流动时间。n=3。请注意:在图6a中,底物流动洗掉了可溶性染料,而在图6b中,黄色保留,这是因为聚苯乙烯珠粒仍被截留在测试点内。
图6:用于在测试条上进行纸基elisa的替代方法的示意图。
图7:(a)用于纸基elisa的聚丙烯酰胺-底物混合物的制剂。(b)展示了用于纸基elisa的聚丙烯酰胺-底物混合物的应用的图像。
图8:样品点样位置对经由组合的洗涤和底物添加步骤所获得的纸基elisa比色结果所具有的影响的图像。ap和bcip/nbt系统连同hcg测定一起使用,底物流动时间是15分钟。样品浓度=1000miuml-1。(a)将样品-检测剂混合物301a在测试点(由粒状点指示)的上游点样。(b)将样品-检测剂混合物301a在测试点(由粒状点指示)上点样。使用含有0.02%
图9:图示了经由组合的洗涤和底物添加步骤(即不需要单独的洗涤步骤)实现纸基elisa比色结果的现有技术的示意图。在这种情况下,检测剂-酶缀合物在多孔膜207上干燥。第一步骤需要仅将样品301引入到测试点201上,并且第二步骤包括在底物垫102处添加酶底物302。在步骤1与步骤2之间不需要等待时间。
图10:经由组合的洗涤和底物添加步骤的现有技术方法(即在这种情况下,在使用含0.02%
图11:描绘了缀合物垫104直接处于测试点/线201顶部上的装配的图示。请注意:故意将缀合物垫104与测试点/线201分开以露出测试点/线201。
图12:针对hbsag阳性和hbsag阴性“全血样品”所获得的比色结果的像素强度(灰度值)。所述结果是由使用作为缀合物垫并且被组装在测试点顶部上的rbc滤膜的纸基elisa获得的。n=3。
图13:描绘了在测试点/线201前面使用缀合物垫104的图示。
图14:针对hbsag阳性和hbsag阴性“全血样品”所获得的比色结果的像素强度(灰度值)。所述结果是由使用作为缀合物垫并且被组装在测试点上游的rbc滤膜的纸基elisa获得的。n=3。
具体实施方式
在一个方面,提供了一种用于纸基测定的测试条,所述测试条包括用于接收底物的底物添加区;以及测试区,所述测试区包括捕捉剂,其中所述底物添加区位于所述测试区的上游。
一般将了解的是,相对于液体通过和/或沿着所述测试条的流动方向,所述底物添加区位于所述测试区的上游。
在一些实施方案中,所述底物添加区和所述测试区间隔分开配置。间隔开一般将被理解成意指底物添加区和测试区可以被布置在测试条上的任何彼此分开的位置,同时维持底物添加区相对于测试区的上游位置。换句话说,测试区和底物添加区可以相对于彼此以任何间隔开的关系位于测试条上。举例来说,底物添加区可以位于测试条的一个末端或末端区域处并且测试区可以位于测试条的相对末端或末端区域处。底物添加区和测试区还可以位于测试条的中间区域中。
在一些实施方案中,所述底物添加区和所述测试区相邻配置。
在一些实施方案中,所述底物添加区和所述测试区直接相邻配置。
在一些实施方案中,所述底物添加区和所述测试区位于所述测试条上以使得流体流动可以从底物添加区直接到测试区。换句话说,从底物添加区到测试区的流体流动未插入有任何其它区域或化学品添加,如图1中所举例说明。
在其它实施方案中,底物添加区和测试区之间可以插入有检测剂区。
在一些实施方案中,可以将样品与检测剂预混合。应当了解的是,与检测剂预混合的样品可以在测试区处与测试条接触。
在一些实施方案中,可以将检测剂预干燥到检测剂区或测试区上。
在一些实施方案中,可以将检测剂预干燥到施用器上。一般将了解的是,预干燥指的是在使用测试条之前将检测剂干燥到测试条上的检测剂区或测试区或施用器上。可以在真空中或在大气压下对检测剂进行干燥。也可以在环境温度下或在高于或低于环境温度的温度下对检测剂进行干燥。还将了解的是,可以在各种水平的相对湿度下对检测剂进行干燥。举例来说,100%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、0%。一般将了解的是,检测剂干燥的时间长度将根据所使用的条件而变化。检测剂还可以与一种或多种另外的化合物一起干燥,所述化合物包括但不限于防腐剂、蛋白质和/或表面活性剂。防腐剂的实例包括但不限于蔗糖和海藻糖。可以与检测剂一起干燥的蛋白质的实例是牛血清白蛋白(bsa)。可以与检测剂一起干燥的表面活性剂的实例是聚山梨醇酯20。一般将了解的是,将检测剂与一种或多种另外的化合物一起干燥可以赋予长期储存期间的稳定性。
在一些实施方案中,可以将检测剂预干燥到施用器上。一般将了解的是,施用器可以是任何吸收性材料或多孔材料。举例来说,施用器可以是膜,如滤膜。还一般将了解的是,膜可以是单层膜或多层。施用器的实例包括但不限于来自whatmantm的fusion5、玻璃纤维、cytoseptm、对称和不对称的聚醚砜膜、以及纤维素滤膜。
在一个实施方案中,施用器可以是包含与酶缀合的检测剂的缀合物垫。
一般将了解的是,在添加检测剂之前,施用器可以是未经过处理的或经过处理的。施用器的预处理包括但不限于使用诸如防腐剂、蛋白质和/或表面活性剂的化合物洗涤施用器。防腐剂的实例包括但不限于蔗糖和海藻糖。蛋白质的实例包括但不限于牛血清白蛋白(bsa)。表面活性剂的实例包括但不限于聚山梨醇酯20。
还将了解的是,施用器可以在使用之前被切割成适当的尺寸。一般将了解的是,所使用的施用器的材料、厚度、层数以及尺寸是基于所考虑的测定而变化。在开始测定之前,施用器将被施用到测试区或检测剂区上。
在一些实施方案中,可以使样品在测试区处与测试条接触。在其它实施方案中,使样品在插入的检测剂区处与测试条接触。
在一些实施方案中,可以将样品施用到施用器上。
在一些实施方案中,可以将施用器施用到测试条上并且可以将样品施用到施用器上。
在一些实施方案中,可以在添加底物之前,但是在添加样品之后,将施用器从测试条去除。可以在1秒、5秒、10秒、20秒、30秒、45秒、1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟之后去除施用器。
在其它实施方案中,在添加底物之前可以不去除施用器。
检测剂可以选自由抗体、抗原、寡核苷酸以及肽组成的组。应当了解的是,检测剂可以与可检测的材料缀合,如有色剂、荧光剂、酶或化学发光剂。举例来说,检测剂可以与选自由以下各项组成的组的酶缀合:碱性磷酸酶、β-半乳糖苷酶、葡萄糖氧化酶、葡萄糖脱氢酶以及辣根过氧化物酶。应当了解的是,检测剂将结合所关注的分析物。还将了解的是,检测剂上所缀合的酶将与底物反应以发射信号。
在一个实施方案中,测试条是多孔膜。合适的多孔膜可以选自由以下各项组成的组:醋酸纤维素、纤维素纸、滤纸、薄页纸、书写纸、纸巾、布、或多孔聚合物膜、硝化纤维素膜、聚偏二氟乙烯(pvdf)膜以及滤纸。在一个实施方案中,所述多孔膜是硝化纤维素膜,如醋酸硝化纤维素。
在一个实施方案中,测试区被细分成两个或更多个区域,每一个区域包含相同的或不同的捕捉剂。在一些实施方案中,每一个区域可以包含一种或多于一种捕捉剂。在一些实施方案中,测试区可以占据从单个测试点到2×1、2×2、3×1,多达但不限于4×4测试点阵列的占有面积,从而覆盖多达4cm×4cm的面积。至少两个或更多个区域可以包含相同的或不同的捕捉剂。在一些实施方案中,测试条可以包括多于一个测试区。在其它实施方案中,测试条可以包括测试区的阵列,每一个测试区可以占据从单个测试点到2×1、2×2、3×1,多达但不限于4×4测试点阵列的占有面积,从而覆盖多达4cm×4cm的面积。
在一些实施方案中,捕捉剂可以选自由抗体、抗原、寡核苷酸以及肽组成的组。应当了解的是,捕捉剂特异性结合所关注的分析物并且使所关注的分析物保留在测试区上。在一个实施方案中,可以将所述捕捉剂或每一种捕捉剂与有色标记混合以有助于所述捕捉剂或每一种捕捉剂在所述测试条上的定位。颜色标记的实例包括但不限于染料和有色珠粒。应当了解的是,可以使用染料,如水染料、食用染料、广告颜料以及一般在多孔膜上吸收的颜料。还将了解的是,有色珠粒包括但不限于染色的聚苯乙烯珠粒、纳米颗粒,如金或银纳米颗粒以及铈纳米颗粒。
在另一个实施方案中,在膜制备阶段期间可以将有色珠粒与捕捉的抗体混合并且分配到测试区上。使用有色珠粒的优势是这些会产生浅的,但是可观测的颜色以使得使用者能够识别测试区。另一个优势是由于使用有色珠粒,因此在整个实验中颜色将持续存在。
在一个实施方案中,测试条进一步包括位于测试区内的一个或多个控制区或不位于测试区内的一个或多个控制区。相对于液体通过和/或沿着所述测试条的流动,控制区可以在测试区的下游或上游。控制区可以是测试区内测试点阵列中的一个或多个点。
在一个实施方案中,在测试条上标记测试区。标记测试区可以有助于使用者准确地将混合物分配到测试区上。在测试条上使用染料或轮廓线标记测试区。一般将了解的是,测试区可以由指示线或圆圈标记。染料可以是可洗染料。举例来说,水染料、食用染料、广告颜料以及一般在多孔膜上吸收的颜料。
在一些实施方案中,底物可以是酶底物。酶底物可以被转化成发射信号的产物。这样的底物的合适实例包括5-溴-4-氯-3-吲哚基磷酸盐(bcip)、硝基蓝四唑
在一个实施方案中,所述底物可以作为水溶液与测试条接触。在另一个实施方案中,所述底物可以作为聚合物溶液与测试条接触。一般将了解的是,聚合物溶液指的是在聚合物溶液凝固成凝胶之前的聚合物溶液。在又一个实施方案中,所述底物可以在聚合物凝胶中与测试条接触。一般将了解的是,可以在底物添加区上游添加底物。还将了解的是,可以经由测试条下方的腔体添加底物。还将了解的是,可以将底物添加到测试条上。
在一些实施方案中,底物在聚丙烯酰胺中聚合。在一些实施方案中,可以在流动之前将底物与预制的聚合物凝胶混合。聚合物凝胶的选择包括但不限于聚丙烯酰胺凝胶。向底物施用凝胶的优势是提高了底物与测试区之间的接触。此外,凝胶的固化可以消耗过量的未反应的底物以提高信号稳定性。
在一些实施方案中,可以将底物分配到测试条上。在其它实施方案中,可以将底物分配到测试条的底面上。举例来说,可以将包含底物的水溶液、聚合物溶液或聚合物凝胶分配到测试条上。在另一个实例中,可以将包含底物的水溶液、聚合物溶液或聚合物凝胶分配到测试条的底面上。在一些实施方案中,当将底物分配到测试条的底面上时,这一分配步骤是经由测试条下面的腔体进行的。
在一些实施方案中,使样品在测试区处与测试条直接接触。在一个实施方案中,将样品分配到所述测试区上。样品可以是含有合适的缓冲液或不含合适的缓冲液以及含有检测剂或不含检测剂的血液、尿液、唾液、汗液、鼻拭子中的一种、或含有合适的缓冲液或不含合适的缓冲液以及含有检测剂或不含检测剂的血液、尿液、唾液、汗液、鼻拭子中的至少两种的混合物。可以添加0.1μl至100μl范围的样品。举例来说,0.1μl至100μl、0.5μl至95μl、1μl至90μl、1.5μl至85μl、2μl至80μl、2.5μl至75μl、3μl至70μl、3.5μl至65μl、4μl至60μl、4.5μl至55μl、5μl至50μl、5.5μl至45μl、6μl至40μl、6.5μl至35μl、7μl至30μl、7.5μl至30μl、8μl至25μl、8.5μl至20μl、9μl至15μl、9.5μl至10μl。
在一个方面,提供了一种纸基酶测定,所述测定包括如本文所述的测试条。
在一个方面,提供了一种检测样品中分析物的存在的方法,所述方法包括以下步骤:a)使所述样品接触到如本文所述的测试条的所述测试区上,其中所述样品包含对所述分析物具有特异性的检测剂抗体;b)将底物分配到所述底物添加区上;以及c)检测来自所述测试区的发射信号以确认所述样品中存在或不存在所述分析物。
在一个方面,提供了一种检测样品中分析物的存在的方法,所述方法包括以下步骤:a)使所述样品接触到如本文所述的测试条的所述检测剂区上;b)将底物分配到所述底物添加区上;以及c)检测来自所述测试区的发射信号以确认所述样品中存在或不存在所述分析物。
在一些实施方案中,可以使样品直接接触到测试区或检测剂区上。
在一些实施方案中,可以经由位于测试区或检测剂区的施用器使样品接触到测试区或检测剂区上。
在一些实施方案中,可以将施用器施用到测试区上或与测试区接触。在其它实施方案中,可以将施用器施用到检测剂区上或与检测剂区接触。应当了解的是,样品可以在测试条上原位添加到施用器上或在使测试条与施用器接触之前样品可以添加到施用器上。
应当了解的是,可以在添加底物之前去除施用器。还将了解的是,可以在底物的前沿到达施用器所施用的区域之前的任何时间去除施用器。举例来说,测试区或检测剂区。举例来说,可以将施用器施用到测试区或检测剂区上,然后可以将样品添加到施用器上。然后可以在添加底物之前,或在添加底物之后,但是在底物的前沿到达施用器之前去除施用器。在另一个实例中,可以将施用器施用到测试区或检测剂区上。然后可以去除施用器并且可以将样品添加到被去除了施用器的区域上。随后,可以添加底物。
发射的信号可以借助于颜色变化、化学发光检测器,如电荷耦合器件(ccd)成像器或x射线或板读数器来检测。应当了解的是,可以使用本领域已知的其它检测方法。这些包括但不限于荧光、放射性、电化学发光以及电化学检测方法。
在一个实施方案中,步骤(b)可以紧随步骤(a)而在步骤(a)与步骤(b)之间没有等待时间。在另一个实施方案中,在步骤(a)之后可以是步骤(b)之前的孵育期。孵育期可以是1秒至10分钟。举例来说,10秒至10分钟、20秒至9分钟、30秒至8分钟、30秒至7分钟、40秒至6分钟、50秒至5分钟、1分钟至4分钟、2分钟至3分钟。在一些实施方案中,在步骤(a)之后孵育测试条容许样品与捕捉剂在测试区处相互作用并且增加信号。在其它实施方案中,在步骤(a)之后孵育测试条容许样品与检测剂在检测剂区处相互作用并且增加信号。一般将了解的是,孵育期可以根据所使用的样品和捕捉剂而变化。
在一个实施方案中,所述信号是比色信号。在另一个实施方案中,所述信号是荧光信号。在又一个实施方案中,所述信号是化学发光信号。在另一个实施方案中,所述信号是电化学发光信号。在另一个实施方案中,所述信号是电化学信号。
在一些实施方案中,可以在步骤(a)之后洗涤测试条。在其它实施方案中,可以在步骤(b)之后洗涤测试条。在另外的其它实施方案中,可以在步骤(a)之后和在步骤(b)之后洗涤测试条。
可以通过洗涤缓冲液的液滴将洗涤步骤引入到测试膜上,从而确保在测试区接触底物之前过量的未结合的样品或底物被洗涤到下游。所提到的液滴可以在10μl至500μl的范围。举例来说,15μl至450μl、20μl至400μl、25μl至350μl、30μl至350μl、35μl至300μl、40μl至250μl、45μl至200μl、50μl至150μl、55μl至100μl、60μl至100μl、70μl至90μl或80μl至90μl。
有利的是,本文所述的发明提供了改进的纸基测定结果,包括更清晰的信号读出、假阳性和/或假阴性的减少以及获得结果的效率提高。
本文说明性描述的发明可以在不存在本文没有具体公开的任何一个或多个要素、一个或多个限制条件的情况下被适当地实施。因此,举例来说,术语“包含”、“包括”、“含有”等应当被宽泛地并且不加限制地解读。此外,本文所用的术语和措辞已经被用作描述性术语而非限制性术语,并且并不意图在使用这些术语和措辞时排除所示的以及所述的特征或其部分的任何等同方案,但应当认识到的是,各种改动方案在要求保护的本发明的范围内是可能的。因此,应当了解的是,尽管已经通过优选的实施方案和任选的特征明确地公开了本发明,但是本文所公开的其中所体现的本发明的改动方案和变化方案可以由本领域技术人员所采取,并且这些改动方案和变化方案被认为落入本发明的范围内。
本发明已经在本文中被广泛地并且一般地描述。落入一般性公开内的较缩小内容和亚类分组中的每一个也形成本发明的一部分。这包括以从所述类中去除任何主题的附带条件或负面限制条件来一般性地说明本发明,不论所排除的内容是否在本文被具体地叙述。
其它实施方案落入下列权利要求书和非限制性实施例内。此外,在本发明的特征或方面以马库什组来描述的情况下,本领域技术人员将认识到的是,本发明也因此以马库什组的任何单个成员或成员的子组来描述。
实验部分
将通过参考具体实施例更详细地进一步描述包括最佳方式在内的本发明的非限制性实施例以及比较实施例,所述实施例不应当被视为以任何方式限制本发明的范围。
实施例1
进行纸基elisa的方法
材料和方法
使用硝化纤维素膜的纸基无洗涤elisa程序和比色结果。
在进行纸基无洗涤elisa之前,制备具有测试点/线201和对照点/线202的硝化纤维素膜条101(图1)。通过将抗β人绒毛膜促性腺激素(hcg)抗体(捕捉抗体)在硝化纤维素膜条的上游点样并且使用铅笔标定该点来形成测试点/线201。如果需要的话,除非另外指明,否则通过将抗小鼠抗体-酶(ap或hrp,ap=碱性磷酸酶,hrp=辣根过氧化物酶)在远离测试点/线201的下游点样来形成对照点/线202以确认测定的有效性。除非另外指明,否则将硝化纤维素膜条真空干燥,使用含有1%bsa、0.05%
为了开始elisa(图1),以所期望的浓度(优选地约2μgml-1)制备抗αhcg抗体缀合物-ap或抗αhcg抗体-hrp缀合物。将不同浓度(5miuml-1、50miuml-1、200miuml-1、500miuml-1、以及1000miuml-1)的hcgelisa标准品(作为样品)以1:1的比率添加到一抗αhcg抗体-ap缀合物或一抗αhcg抗体-hrp缀合物中以形成样品-检测剂混合物。将样品-检测剂混合物301a点样到测试点/线201上以与捕捉抗体形成检测复合物。随后,立即添加过量的5-溴-4-氯-3'-吲哚基磷酸盐/氯化硝基蓝四唑
结果与讨论
可以在测试点上,获得针对ap和bcip/nbt系统(图2a)以及hrp和tmb系统(图2b)的不同的比色结果。对于这两种酶系统,可以在较低的浓度下观测到着色结果的强度与hcg浓度之间的比例关系,并且结果似乎在较高的浓度下达到平稳期。
实施例2
进行纸基elisa阵列的方法
材料和方法
使用硝化纤维素膜的纸基无洗涤elisa阵列程序和比色结果。
在进行纸基无洗涤elisa阵列之前,制备具有测试点201a的阵列和对照点/线202的硝化纤维素膜条101(图3)。通过将抗β人绒毛膜促性腺激素(hcg)抗体(捕捉抗体)在硝化纤维素膜条的上游点样并且使用铅笔标定所述点来形成测试点201a的阵列。如果需要的话,除非另外指明,否则通过将抗小鼠抗体-酶(ap或hrp)在远离测试点201a的下游点样来形成对照点/线202以确认测定的有效性。除非另外指明,否则将硝化纤维素膜条真空干燥,使用含有1%bsa、0.05%
为了开始elisa(图3),以所期望的浓度(优选地约2μgml-1)制备抗αhcg抗体-ap缀合物-或αhcg抗体-hrp缀合物(ap=碱性磷酸酶,hrp=辣根过氧化物酶)。将不同浓度(50miuml-1或1000miuml-1)的hcgelisa标准品(作为样品)以1:1的比率添加到一抗αhcg抗体-ap缀合物或αhcg抗体-hrp缀合物中以形成样品-检测剂混合物301a。将样品-检测剂混合物301a单独地点样到测试点201a上以与捕捉抗体形成检测复合物。随后,立即添加过量的5-溴-4-氯-3'-吲哚基磷酸盐/氯化硝基蓝四唑
结果与讨论
可以在测试点上,获得针对ap和bcip/nbt系统(图4a)以及hrp和tmb系统(图4b)的不同的比色结果。对于这两种酶系统,获得针对不同的2×2阵列和3×3阵列的比色结果。1000miuml-1样品产生较深色的点,而50miuml-1样品产生较浅色的点。在这个实施例中没有显示对照点的结果。
实施例3
使用染料使测试点可视化
可以使用水溶性染料或水不溶性染料实现测试点的可视化(图5)。可以将水溶性染料(例如食用染料)点样到测试点上(与捕捉抗体的点样一起或在捕捉抗体的点样之后)以指示应当引入样品-检测剂混合物的位置和/或应当等候结果的位置(图5a)。在引入底物时,底物流动将水溶性染料洗掉并且可以在测试点上观测到比色结果(取决于样品浓度)。
也可以将水不溶性染料点样到测试点上以指示应当引入样品-检测剂混合物的位置以及应当等候结果的位置(图5b)。在这个实施例中,使用与捕捉抗体缀合的3μm黄色羧化聚苯乙烯(ps)珠粒作为水不溶性“染料”(请注意:捕捉抗体可能不需要与所述珠粒缀合)。这些珠粒将测试点永久“染色”,这是因为所述珠粒被截留在多孔膜内(珠粒尺寸>孔径)。不同于先前的实施例,所述珠粒没有被底物流动洗掉,并且可以在测试点上观测到不同的颜色变化(在这个实施例中,是黄色变成棕色)(取决于样品浓度),尽管使用相同的酶-底物扩增系统。
实施例4
进行纸基elisa的替代方法
图6展示了一种进行纸基elisa的替代方法。首先将样品-检测剂混合物301a引入到测试点/线201或测试点201a上。随后,在区域204处引入洗涤缓冲液通过测试条101后,在上游引入比色底物,之后它流动到多孔测试膜下方和腔体205内。这在底物与混合物之间引入了分离,从而确保了在测试区201/201a接触底物之前,未结合的酶缀合物被洗涤到下游。所提到的洗涤缓冲液的液滴可以在2μl至500μl的范围。由于装置基底206的亲水性,因此底物在2秒内均匀地分布在整个测试点中。这确保了酶-底物反应在大约相同的时间开始。
在另一个实施方案中,将酶缀合物在区域207处或在测试区201/201a与区域203之间的任何位置干燥。这允许在进行最少的样品制备的情况下将生物样品301直接分配到测试区201/201a上。然后,在区域204处引入洗涤缓冲液通过测试条101后,在上游引入比色底物,之后它流动到多孔测试膜下方和腔体205内。
而在另一个实施方案中,可以在区域203,而不是测试区201/201a处分配样品301或样品-检测剂混合物301a。当测试需要大量的混合物流过测试区时,这一技术是有用的。混合物的量可以在5μl至400μl的范围。然后,在区域204处引入洗涤缓冲液通过测试条101后,在上游引入比色底物,之后它流动到多孔测试膜下方和腔体205内。
实施例5
使用预制聚合物凝胶-底物混合物实现纸基elisa比色结果。
如图6中所描绘,使底物在膜下方流动的基本原理是确保底物在最短的时间内均匀分布。在本文,提出了一种使底物在1分钟内聚合的方法。这确保了底物与测试区的始终如一的接触。
为了制备平台,在装置的基底206上涂覆1%的过硫酸铵(溶解在水中)并且使其干燥(图6)。使用环氧胶将一块吸收垫103和一块玻璃纤维膜分别粘合到硝化纤维素膜的下游和上游。在硝化纤维素膜上分配1μl碱性磷酸酶(1:500稀释)的3×3阵列。然后将该装置在真空烘箱中干燥1小时。
为了制备底物混合物,首先将丙烯酰胺和双丙烯酰胺溶液以19:1的比率混合,继而溶解在水中以获得30%的溶液(图7a)。随后,将1份该溶液与2份bcip/nbt混合,继而添加1μln,n,n',n'-四甲基乙二胺(temed)以获得最终的底物混合物。为了进行实验,将400μl洗涤缓冲液添加到玻璃纤维膜中。当硝化纤维素膜被润湿时,将800μl底物混合物分配到腔体205中。在5分钟内,在涂有碱性磷酸酶的区域中观测到蓝色比色信号(图7b)。实际上,洗涤缓冲液去除了未结合的分析物和酶缀合物,并且润湿硝化纤维素膜。润湿的硝化纤维素膜确保了底物缓慢地渗透通过膜,从而防止比色结果的污染。这是有利的,特别是如果底物在酶-底物反应时没有适当沉淀的话。
实施例6
现有技术的局限。
样品点样位置对比色结果的重要性。
图8a示出了通过将样品-检测剂混合物301a在测试点/线201上游点样所获得的比色结果。在重现本领域中的程序中选择这一点样位置。图8b突出了通过将样品-检测剂混合物301a直接点样到测试点/线201上所获得的比色结果。图8a中的结果突出了前一种方法的不一致性和不可靠性,其中将样品-检测剂混合物在测试点的上游点样。偶尔获得假阴性结果并且阳性结果内的着色不均匀分布。另一方面,图8b中所获得的比色结果似乎相对更一致和可靠。没有观测到假阴性结果,并且阳性结果内的着色更均匀分布。这提高了定量测量中的性能。直接点样到测试点上确保了有足够的时间可供用于捕捉抗体与样品之间的结合,并且在样品与捕捉抗体结合之前样品-检测剂混合物均匀分布。
浸渍式检测剂酶缀合物系统的使用
在进行纸基elisa之前,制备具有测试点/线201和对照点/线202的硝化纤维素膜,并且将具有干燥的检测剂抗体-ap缀合物的上游区域207浸渍(图9)。通过将抗βhcg抗体沿着测试条的中间部分点样来形成测试点/线201,并且使用铅笔标定这个点。通过将抗小鼠抗体-ap缀合物在远离测试点的下游点样来形成对照点/线202以确认测定的有效性。将测试条真空干燥,使用封闭缓冲液封闭,并且用于d.d.h2o中的5mmhna2o4p·2h2o(ph约7.6)洗涤。最终,将测试条再次真空干燥以允许完全去除水。在测试点(图9)的上游在区域207处施用含有1%bsa、5%蔗糖以及5%海藻糖的抗αhcg抗体-ap(约20μgml-1)的水溶液。将测试条再次真空干燥以允许完全去除水。随后,将底物垫102和吸收垫103与硝化纤维素膜充分重叠以确保连续流动。
为了开始elisa(图9),将不同浓度(5miuml-1、50miuml-1、200miuml-1、500miuml-1、以及1000miuml-1)的hcg标准品301(作为样品)直接点样(没有与检测剂抗体混合)到测试点/线201上,并且立即将过量的bcip/nbt底物302添加到底物垫102上(请注意:不需要预先等待或单独的洗涤步骤)。在底物流动15分钟之后,将测试条从测试装置取出并且用1×tbs、0.1%
结果与讨论
通过使用这组hcg浓度获得了比色结果(图10)。测试点的强度与hcg浓度之间观测到成正比的关系。测试点不均匀并且似乎比图2中的结果具有更低的强度。所述不均匀性和更低的比色强度可能分别是因为检测剂抗体-ap在膜内的不均匀流动特性和它与捕捉的hcg的更低的结合动力学。(在实施例1中,使检测剂抗体-酶和hcg在溶液相中相互作用,并且这具有更高的结合动力学。)在检测剂抗体-ap缀合物被干燥的区域207处所观测到的强烈着色是因为这些缀合物对膜的非特异性吸附。
实施例7
测试点/线顶部上的缀合物垫
缀合物垫的制备
首先将rbc滤膜(例如来自沃特曼公司(whatman)的fusion5)切割成所期望的直径以处理适当体积的全血样品。尽管它不是为测定起作用所必需的,但是可以进行滤膜(例如具有诸如聚山梨醇酯20的表面活性剂)的预处理来减少蛋白质吸附。随后,将所期望的检测剂-酶缀合物分配到这些rbc滤膜盘上并且干燥。可以在蔗糖和/或海藻糖存在下将所期望的检测剂-酶缀合物干燥以在长期储存期间保持它的稳定性。含有干燥的检测剂-酶的滤膜在本文被限定为缀合物垫104。
进行纸基elisa
用于将缀合物垫104与测试条组装的代表性方法图示于图11中。在这种方法中,将缀合物垫104直接组装在测试点/线201的顶部上并且与测试点/线201接触。(请注意:如果缀合物垫104部分重叠在测试点/线201顶部上的话,所述测定也将起作用。)纸平台测试条由重叠的多孔材料组成:反应基质101(例如硝化纤维素)、底物垫102(例如玻璃纤维)以及吸收垫103(例如纤维素),其中底物垫102被认为在反应基质101的上游并且吸收垫103被认为在反应基质101的下游。反应基质101用来形成测试点/线201和对照点/线202。通过分配能够捕捉样品301(例如全血、血清)中存在的所期望的分析物的所期望的捕捉剂(例如抗体、适体、肽、重组蛋白)来形成测试点/线201,而通过分配能够捕捉检测剂(例如抗体、适体、肽、重组蛋白)-酶(例如碱性磷酸酶、辣根过氧化物酶、β-半乳糖苷酶)缀合物的捕捉试剂(例如抗体、适体、肽、重组蛋白)来形成对照点/线202。底物垫102用来将酶底物302(例如5-溴-4-氯-3-吲哚基磷酸盐/硝基蓝四唑
在一个优选的实施方案中,经由将样品301直接引入到缀合物垫104上来开始进行纸基elisa,并且其中样品301将溶解干燥的检测剂-酶缀合物。样品301中存在的所关注的任何分析物将与该缀合物反应以形成分析物-检测剂抗体复合物。在缀合物垫104与测试点/线201直接接触时,来自样品301的溶液中的非颗粒组分(例如检测剂-酶缀合物和任何分析物-检测剂复合物)将被滤过缀合物垫104,并且被直接转移到测试点/线201上。存在的任何分析物-检测剂抗体复合物将与测试点/线201内的捕捉剂结合。在去除缀合物垫104之后,将酶底物302直接引入到底物垫102上,并且将沿着底物垫102和反应基质101迁移,之后到达吸收垫103。(请注意:去除缀合物垫104与反应基质101之间的接触对于防止反应基质101的非特异性比色污染是至关重要的。)由于酶底物302中组分的差异迁移,因此没有与测试点/线201结合的任何检测剂-酶缀合物将被洗涤到下游并且与对照点/线202中的捕捉剂结合,之后与酶底物302中存在的酶底物组分反应。如果在样品301中存在分析物,那么测试点/线201和对照点/线202这两者最终将显示比色结果;而如果在样品301中不存在分析物,那么只有对照点/线202最终将显示比色结果。
使用作为缀合物垫并且被组装在测试点顶部上的rbc滤膜的乙型肝炎表面抗原(hbsag)纸基elisa
简单地说,通过在测试条的上游分配抗乙型肝炎表面抗原(hbsag)抗体(捕捉抗体)来制备具有测试点的纸平台(硝化纤维素膜)测试条。将测试条真空干燥,使用含有2%bsa和0.02%
hbsag纸基elisa(使用作为缀合物垫并且被组装在测试点的顶部上的rbc滤膜)的结果示于图12中,其中由hbsag阳性“全血样品”获得的比色信号的像素强度显著高于由hbsag阴性“全血样品”获得的比色信号的像素强度。
实施例8
在测试点/线上游的缀合物垫
缀合物垫的制备
首先将rbc滤膜(例如来自沃特曼公司的fusion5)切割成所期望的直径以处理适当体积的全血样品。尽管它不是为测定起作用所必需的,但是可以进行滤膜(例如具有诸如聚山梨醇酯20的表面活性剂)的预处理来减少蛋白质吸附。随后,将所期望的检测剂-酶缀合物分配到这些rbc滤膜盘上并且干燥。可以在蔗糖和/或海藻糖存在下将所期望的检测剂-酶缀合物干燥以在长期储存期间保持它的稳定性。含有干燥的检测剂-酶的滤膜在本文被限定为缀合物垫104。
用于将缀合物垫104与测试条组装的替代性代表性方法图示于图13中。在这种方法中,将缀合物垫104组装在测试点/线201的上游(不重叠)。纸平台测试条由重叠的多孔材料组成:反应基质101(例如硝化纤维素)、底物垫102(例如玻璃纤维)以及吸收垫103(纤维素),其中底物垫102被认为在反应基质101的上游并且吸收垫103被认为在反应基质101的下游。反应基质101用来形成测试点/线201和对照点/线202。通过分配能够捕捉样品301(例如全血、血清)中存在的所期望的分析物的所期望的捕捉剂(例如抗体、适体、肽、重组蛋白)来形成测试点/线201,而通过分配能够捕捉检测剂(例如抗体、适体、肽、重组蛋白)-酶(例如碱性磷酸酶、辣根过氧化物酶、β-半乳糖苷酶)缀合物的捕捉试剂(例如抗体、适体、肽、重组蛋白)来形成对照点/线202。底物垫102用来将酶底物302(例如5-溴-4-氯-3-吲哚基磷酸盐/硝基蓝四唑
在一个优选的实施方案中,经由将样品301直接引入到缀合物垫104上来开始进行纸基elisa,并且其中样品301将溶解干燥的检测剂-酶缀合物。样品301中存在的所关注的任何分析物将与这一缀合物反应以形成分析物-检测剂抗体缀合物。在缀合物垫104与反应基质101直接接触时,来自样品301的溶液中的非颗粒组分(例如检测剂-酶缀合物和任何分析物-检测剂复合物)将滤过缀合物垫104,并且被直接转移到反应基质101上。在去除缀合物垫104之后,将酶底物302直接引入到底物垫102上,并且将沿着底物垫102和反应基质101迁移,之后到达吸收垫103。(请注意:去除缀合物垫104与反应基质101之间的接触对于防止反应基质101的非特异性比色污染是至关重要的。)由于酶底物302中组分的差异迁移,因此检测剂酶复合物或分析物-检测剂抗体缀合物将被洗涤到下游,之后与酶底物302中存在的酶底物组分反应。在向下游洗涤过程期间,分析物-检测剂抗体复合物(如果有的话)将与测试点/线201内的捕捉剂结合,而检测剂-酶缀合物将与对照点/线202中的捕捉剂结合。如果在样品301中存在分析物,那么测试点/线201和对照点/线202这两者最终将显示比色结果;而如果在样品301中不存在分析物,那么只有对照点/线202最终将显示比色结果。
使用作为缀合物垫并且被组装在测试点上游的rbc滤膜的乙型肝炎表面抗原(hbsag)纸基elisa
简单地说,通过在测试条的上游分配抗乙型肝炎表面抗原(hbsag)抗体(捕捉抗体)来制备具有测试点的纸平台(硝化纤维素膜)条。将测试条干燥,使用含有2%bsa和0.02%
通过将浓缩血红细胞与血清以1:1的体积比混合来获得“全血样品”。通过按照原样使用混合样品来获得乙型肝炎阴性“全血样品”。通过将重组hbsag以4300ng/ml的浓度掺入“全血样品”中来获得乙型肝炎阳性“全血样品”。将检测剂组分抗hbsag抗体-ap缀合物在血红细胞滤膜(例如fusion5)盘上干燥。所期望的浓度优选地是约1μg/ml,并且在含有2%蔗糖和0.2%bsa的1mmtris缓冲液(ph约7.4)中干燥。含有干燥的抗hbsag抗体-ap缀合物的血红细胞滤膜被称作缀合物垫。在开始hbsag纸基elisa之前,将这一缀合物垫组装在测试点的上游(但是在酶底物添加区的下游)。为了开始hbsag纸基elisa,首先将约5μl的“全血样品”抽吸到滴管中,之后分配到缀合物垫上。随后去除缀合物垫(当足够的血清样品已经被转移到纸平台条上时),并且立即在测试点的上游添加过量的bcip/nbt底物。在添加底物15分钟之后,用1×tris缓冲盐水、0.1%
hbsag纸基elisa(使用作为缀合物垫并且被组装在测试点的上游的rbc滤膜)的结果示于图14中,其中由hbsag阳性“全血样品”获得的比色信号的像素强度显著高于由hbsag阴性“全血样品”获得的比色信号的像素强度。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种高效吸附亚甲基蓝染料的改性纳米羟基磷灰石及其制备方法和应用
- 一种高效吸附亚甲基蓝染料的改性纳米羟基磷灰石及其制备方法和应用
- 一种选择性吸附亚甲基蓝的材料的制备方法
- 磷钨酸复合材料的制备及对亚甲基蓝吸附性能实验方法
- 一种快速测定半挥发性有机物吸附特性的装置及测定方法
- 尿中核黄素测定专用吸附柱的制作方法
- Fe<sup>2+</sup>-H<sub>2</sub>O<sub>2</sub>-亚甲基蓝化学发光体系测定绿原酸的方法
- V<sub>2</sub>O<sub>5</sub>/TiO<sub>2</sub>基催化剂对NH<sub>3</sub>吸附的测定装置的制作方法
- 一种高配基凹凸棒粘土吸附材料及制备方法
- 一种凹土基吸附材料及其制备方法