一种适用于家蚕微孢子虫免疫共沉淀的方法与流程
本发明属于分子生物实验技术领域,特别涉及一种适用于家蚕微孢子虫免疫共沉淀的方法。
背景技术:
家蚕微孢子虫(Nosema bombycis)是家蚕微粒子病的病原体,属于专性细胞内寄生的真核生物。因其能通过垂直传播对养蚕业造成巨大危害,因此被养蚕国家和地区列为蚕业生产法定检疫对象,但如何有效地解决微粒子病的检疫防控成了当今研究的难题。随着家蚕微孢子虫基因组测序数据的完成,使得微孢子虫的研究进入到了分子水平领域,并取得了一些重要的成果,研究表明,家蚕微孢子虫孢壁蛋白SWP、凝集素Serpin、Subtilisin、Septin等基因家族成员参与了微孢子虫粘附和入侵宿主家蚕的过程。但这些家族成员之间是如何相互作用的,它们的互作蛋白是什么,搞清楚这些问题对我们全面认识家蚕微孢子虫侵染寄生机制将会有重要的帮助。如何进行互作蛋白的研究也成了家蚕微孢子虫研究亟待解决的问题。
免疫共沉淀(Co-Immunoprecipitation,IP)是以抗体和抗原之间的特异性作用为基础的用于研究蛋白质相互作用的经典技术。是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。其作用原理是细胞裂解液中加入抗体,与抗原形成特异性免疫复合物,经过洗脱,收集免疫复合物然后进行SDS-PAGE或质谱等技术鉴定分离到的蛋白质。由于该方法方便简单,在生命科学研究领域运用较为广泛。
但这种经典的技术在家蚕微孢子虫互作蛋白的研究中却存在不足,主要表现在三个方面:第一,用于免疫共沉淀实验的孢子总蛋白较难提取,由于家蚕微孢子虫自身的孢壁较厚,普通的蛋白提取液无法深入到孢子内部,也无法对蛋白进行充分提取;第二,用于免疫共沉淀的免疫球珠由于重力的缘故反应过程中会自然沉底,导致堆积的球珠不能充分和蛋白液及抗体结合,影响实验结果;第三,用于免疫共沉淀实验的抗体多为自制的多克隆抗体,抗体的特异性效果不佳,常常会出现非特异条带,此外,抗体本身重链和轻链也会影响目的蛋白的检测。
技术实现要素:
有鉴于此,本发明的目的在于提供一种适用于家蚕微孢子虫免疫共沉淀的方法,所述方法的特异性、稳定性以及结果的可重复性相较于现有技术有提高。
为实现上述发明目的,本发明具体提供了如下的技术方案:
1、一种适用于家蚕微孢子虫免疫共沉淀的方法,包括如下步骤:
1)取家蚕微孢子虫孢子与PBS缓冲溶液混合,并加入直径为0.15~0.21mm的玻璃珠,在4℃的温度条件下于振荡器中剧烈振荡4h~6h,然后在12 000rpm条件下离心10min得上清液即为孢子细胞裂解蛋白;
2)取鼠源抗体并用PBS缓冲溶液稀释,加入Protein A+G球珠悬液,4℃轻摇过夜;然后在2 500rpm条件下离心5min,将上清液除尽留下沉淀,向沉淀中加入步骤1)制取的孢子细胞裂解蛋白,重悬后横放埋于冰内4℃下缓慢摇动7~8h,期间注意更换新鲜冰块,并且轻摇重悬,以保证蛋白能与结合抗体的珠子充分接触,得混合液;
3)将经步骤2)处理的混合液在4℃温度条件下,2 500rpm离心5min,吸出上清液并保证不吸出Protein A+G球珠,得沉淀;
4)用IP裂解液或PBS缓冲溶液洗涤经步骤3)处理后得到的沉淀5次,洗涤时的离心条件和吸除上清的要求同步骤3),完成最后一次洗涤后,吸尽上清液,加入3×SDS-PAGE电泳上样缓冲液重悬沉淀,沸水浴处理3~5min,取出后瞬时高速离心把样品离心到管底;
5)取样品用于SDS-PAGE电泳检测。
优选的,所述PBS缓冲溶液的pH值为7.2。
进一步优选的,具体步骤如下:
1)取1×109个家蚕微孢子虫孢子与0.01mol/L pH为7.2的PBS缓冲溶液混合,并加入0.4g直径为0.15~0.21mm的玻璃珠,在4℃的温度条件下于振荡器中剧烈振荡4h,然后在12 000rpm条件下离心10min得上清液即为孢子细胞裂解蛋白;
2)取2μL鼠源抗体并用pH为7.2的PBS缓冲溶液稀释至500μL,加入40μL Protein A+G球珠悬液,4℃轻摇过夜;然后在2 500rpm条件下离心5min,将上清液除尽留下沉淀,向沉淀中加入200μL步骤1)制取的孢子细胞裂解蛋白,重悬后横放埋于冰内4℃下缓慢摇动7~8h,期间注意更换新鲜冰块,并且轻摇重悬,以保证蛋白能与结合抗体的珠子充分接触,得混合液;
3)将经步骤2)处理的混合液在4℃温度条件下,2 500rpm离心5min,吸出上清液并保证不吸出Protein A+G球珠,得沉淀;
4)用IP裂解液或PBS缓冲溶液洗涤经步骤3)处理后得到的沉淀5次,裂解液或PBS的用量为0.5~1mL/次,洗涤时的离心条件和吸除上清的要求同步骤3),完成最后一次洗涤后,吸尽上清液,加入20~40μL 3×SDS-PAGE电泳上样缓冲液重悬沉淀,沸水浴处理3~5min,取出后瞬时高速离心把样品离心到管底;
5)取样品用于SDS-PAGE电泳检测。
本发明的有益效果在于:本发明提高了家蚕微孢子虫免疫共沉淀的特异性,稳定性高,且重复性好,为家蚕微孢子虫互作蛋白的研究提供了一种有效的方法。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图:
图1表示NbSLP2融合表达蛋白的检测及纯化;
图2表示免疫共沉淀样品的SDS-PAGE电泳图;
图3表示免疫共沉淀样品的SDS-PAGE电泳图。
具体实施方式
下面对本发明的优选实施例进行详细的描述。实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
本发明所用的鼠源抗体制备过程如下所示:
抗体制备过程
(1)目的蛋白表达:将验证正确的重组质粒转入大肠杆菌表达系统进行原核表达,原核表达的方法按萨姆布鲁克编写的《分子克隆实验指南》操作说明进行,得到目的蛋白,如图1A所示。
(2)目的蛋白纯化:此步中为了得到特异性较强抗体,制备抗体前必须对目的蛋白进行纯化,并且要保证目的蛋白的纯度,尽可能不出现其它杂蛋白的干扰,为此,我们在按照His·Bind purification Kit(Qigen)操作说明进行亲和柱纯化的基础上,又再一次对纯化的蛋白进行凝胶电泳切胶实验,即将亲和柱纯化的蛋白液进行SDS-PAGE,利用4℃预冷的KCl(0.3M)溶液进行染色,出现目的蛋白后利用干净的刀片切下蛋白所在的凝胶条带,并迅速将含有目的蛋白的凝胶条带放于准备好的5mL离心管中,随后加入适量的甲醇进行脱水处理,或者将其放入冻干机中进行低温冻干,最后将脱水冻干的胶条放于干净灭菌的研钵中,加入液氮进行研磨,研磨至胶条变为粉末状为止。该过程可在无菌环境下或超净工作台上进行,避免空气微生物的污染。最后,取少量的粉末用PBS溶解后加入3×上洋缓冲液进行SDS-PAGE检测,以验证目的蛋白的纯度,如图1B所示,验证无杂带,可将其作为后续制备抗体的抗原。
抗体制备:将纯化好的融合蛋白作为抗原免疫小鼠,采用皮下多点注射的方式,全程共免疫五次,前四次进行皮下注射免疫,最后一次进行腹腔免疫,具体免疫程序如下:
1、纯化切胶研磨的粉末(含目的蛋白)用PBS溶解后与等体积弗氏完全佐剂混匀,皮下注射小鼠,一免为0.1mg蛋白/只小鼠,对照注射相同体积混匀的PBS溶液和弗氏完全佐剂;
2、一周后进行二免,纯化切胶研磨的粉末(含目的蛋白)与等体积弗氏不完全佐剂混匀,皮下注射小鼠,0.1mg蛋白/只小鼠,对照注射相同体积混匀的PBS溶液和弗氏不完全佐剂;
3、三免和四免间隔的时间,免疫的方法及注射所需蛋白量同2;
4、四免结束后进行最后一次腹腔免疫,4天后进行眼球采血,将采集到的小鼠血液于37℃恒温箱中静置1h,之后于4℃冰箱中放置过夜,待血清析出后将其转移至新的离心管中,小量分装后,保存于-20℃待用,并标记为NbSLP2蛋白。以此同时取注射PBS溶液的小鼠血清作阴性对照。
实施例1
一种适用于家蚕微孢子虫免疫共沉淀的方法,具体步骤如下:
1)取1×109个家蚕微孢子虫孢子与0.01mol/L pH为7.2的PBS缓冲溶液混合,并加入0.4g直径为0.15~0.21mm的玻璃珠,在4℃的温度条件下于振荡器中剧烈振荡4h,然后在12 000rpm条件下离心10min得上清液即为孢子细胞裂解蛋白;
2)取2μL鼠源抗体并用pH为7.2的PBS缓冲溶液稀释至500μL,加入40μL Protein A+G球珠悬液,4℃轻摇过夜;然后在2 500rpm条件下离心5min,将上清液除尽留下沉淀,向沉淀中加入200μL步骤1)制取的孢子细胞裂解蛋白,重悬后横放埋于冰内4℃下缓慢摇动7~8h,期间注意更换新鲜冰块,并且轻摇重悬,以保证蛋白能与结合抗体的珠子充分接触,得混合液;
3)将经步骤2)处理的混合液在4℃温度条件下,2 500rpm离心5min,吸出上清液并保证不吸出Protein A+G球珠,得沉淀;
4)用IP裂解液或PBS缓冲溶液洗涤经步骤3)处理后得到的沉淀5次,裂解液或PBS的用量为0.5~1mL/次,洗涤时的离心条件和吸除上清的要求同步骤3),完成最后一次洗涤后,吸尽上清液,加入20~40μL 3×SDS-PAGE电泳上样缓冲液重悬沉淀,沸水浴处理3~5min,取出后瞬时高速离心把样品离心到管底;
5)取样品用于SDS-PAGE电泳检测。
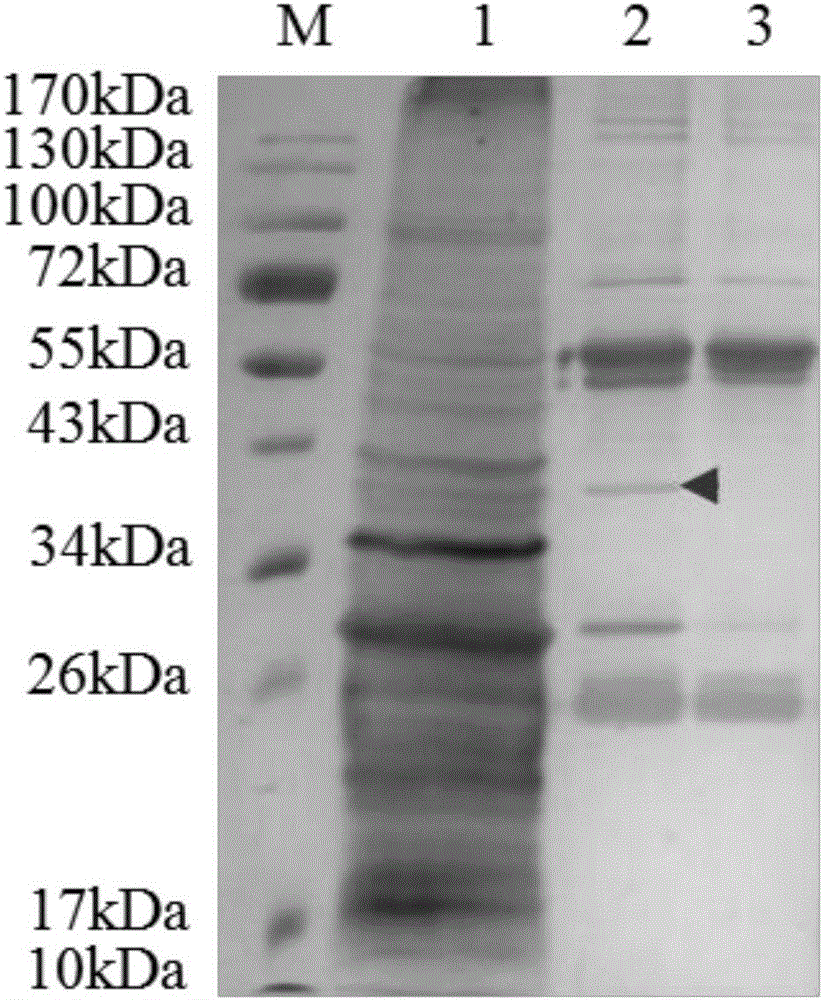
图2为免疫共沉淀样品的SDS-PAGE电泳图,其中M:预染蛋白质Marker;1:家蚕微孢子虫总蛋白;2:NbSLP2抗体与家蚕微孢子虫总蛋白的免疫共沉淀样品;3:阴性抗体与家蚕微孢子虫总蛋白的免疫共沉淀样品;
图3为免疫共沉淀样品的SDS-PAGE电泳,M:预染蛋白质Marker;1:家蚕微孢子虫总蛋白;2:NbSLP2抗体与家蚕微孢子虫总蛋白的免疫共沉淀样品(第二次重复);3:NbSLP2抗体与家蚕微孢子虫总蛋白的免疫共沉淀样品(第三次重复);4:阴性抗体与家蚕微孢子虫总蛋白的免疫共沉淀样品。
由图2、3可反映出本发明公开的适用于家蚕微孢子虫免疫共沉淀的方法是可行的,其提高了家蚕微孢子虫免疫共沉淀的特异性,稳定性高,且重复性好,为家蚕微孢子虫互作蛋白的研究提供了一种有效的方法。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!