用于分析离子通道的活性的方法与流程
本发明涉及一种用于分析离子通道的活性的方法,该方法可用于进行高通量筛选(hts)。
背景技术
离子通道是成孔膜蛋白,其允许离子流过细胞膜。离子通道存在于所有细胞的膜中并构成基本的药理学药物靶标,以特别地开发止痛药、抗惊厥药、抗心律失常药、抗癌药、癫痫治疗药、听力障碍治疗药、抗炎药和神经肌肉阻滞剂。它们通常特定于一种类型的离子。
开发用于测量离子通道的活性的第一种方法基于活细胞记录。这种方法通常需要过度表达感兴趣的离子通道,这改变了细胞生理状态,对通道活性产生不可预测的后果。这在许多情况下导致对细胞的毒性及其细胞凋亡。在这些方法中,主要通过膜片钳或荧光来测量离子通道的活性。
膜片钳系统涉及基于电生理学的测量。将电极浸入细胞中,参比电极在含有细胞的溶液的外部。当离子通过通道时,在膜上产生电流并通过电极进行测量。如果通道是非功能性的或被化合物阻塞,则将不会记录到电流。
基于荧光的系统使用离子特异性(或ph依赖性)荧光分子。然而,尚未对于所有离子均存在这种离子特异性荧光分子。
为了克服基于细胞的方法的缺点,还开发了基于膜片钳或荧光测量的无细胞方法。在这些无细胞方法中,离子通道在模型膜(例如液滴界面双层(dib)),可能地在微流体平台中(schlicht和zagnoni2015)表达、纯化和重构(bayley等2008;barriga等2014;villar等2011;wo2008/012552)。
这种dib尤其可以在由单层的两亲分子包围的液滴以及用单层的两亲分子覆盖的平面基底之间的界面处产生(us2012/0220481)或在由单层的两亲分子包围的两个液滴之间的界面处产生(us8,268,627;us8,293,339;us8,506,905)。必须仔细选择形成膜的脂质,以使通道正确折叠。
为了发现针对离子通道的新型药物化合物(如止痛药、抗惊厥药、抗心律失常药、抗癌药、癫痫药、听力障碍药、抗炎药或神经肌肉阻滞剂),能够通过自动化,高通量测定筛选多种化合物的化学库是有用的。
然而,现有技术已知的基于细胞的或无细胞的方法具有不利于高通量筛选(hts)的限制。实际上,大多数当前的hts方法涉及通常在微流体或毫流体设备中流动的化合物。因此,由于使用电极,这排除了膜片钳方法的使用。使用基于荧光的方法也是不方便的,因为在荧光化合物的流动下观察到荧光涂片,其基本上产生噪声并限制读出。
提高药物发现率的一个挑战是提供一种允许在高通量筛选方法中测量离子通过膜嵌入通道的方法。
因此,需要一种用于以高通量方式分析具有良好读出的离子通道活性的方法。
技术实现要素:
因此,本发明的发明人开发了一种电极和无荧光方法,其中通过简单光学检测装置(例如照相机,特别是在透射光或明场中)分析离子通道活性,从而克服了现有技术方法的问题,并因此允许在高通量筛选中使用该方法。
因此,本发明涉及一种分析离子通道(3)的活性的方法,所述方法包括以下步骤:
(i)在疏水介质(1)中提供水溶液as1的第一液滴d1,所述水溶液as1包含浓度c1的离子i,其中c1≥0,其中液滴d1被单层的两亲分子(2)包围,
(ii)在所述疏水介质(1)中提供水溶液as2的第二液滴d2,所述水溶液as2包含浓度c2的离子i,其中c2≥0且c2≠c1,其中液滴d2被单层的两亲分子(2)包围,所述单层的两亲分子(2)进一步包含待分析的离子通道(3),
(iii)将第一液滴d1和第二液滴d2接触以在接触区域中形成双层的两亲分子(2),其中双层的两亲分子(2)进一步包含待分析的离子通道(3),和
(iv)测量两个接触的液滴的尺寸或确定在平衡时产生的液滴的数量。
因此,液滴d1和d2保持接触直至达到平衡。当将液滴接触时,还测量两个接触的液滴的尺寸,从而能够在液滴接触(初始状态)和处于平衡(平衡状态)时比较液滴的尺寸/数量。
附图说明
将参考附图通过实施例来描述本发明。
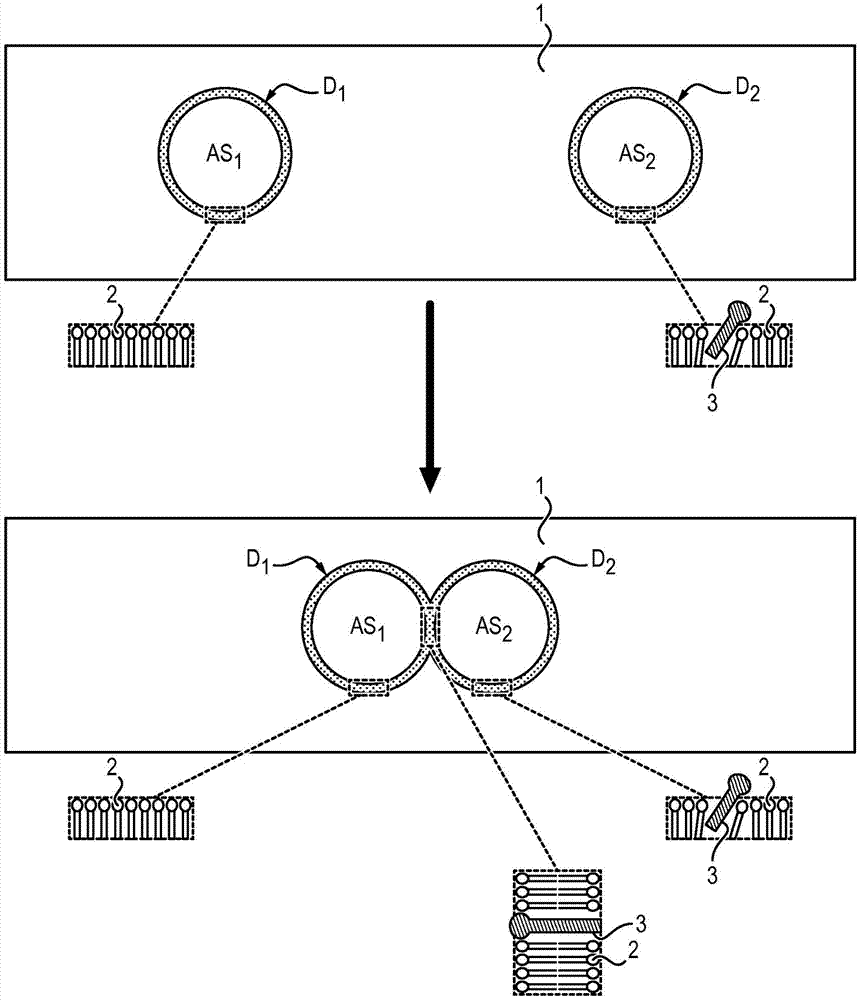
图1a示出了根据本发明的方法的步骤(iii),其涉及包含待测试的离子通道(3)的双层的两亲分子(2)的形成。
图1b示出了获得的双层的两亲分子(2),其包含在液滴d1和d2之间的离子通道(3)。
图2示出了根据本发明的整个方法,仅表示了液滴d1和液滴d2。
图3示出了在c2>c1和离子通道(3)为活性的情况下,水和离子i通过包含待测离子通道(3)的双层的两亲分子(2)的转移。
图4a示出了在离子通道(3)为非活性的情况下,液滴d1和液滴d2随时间(在5分钟的时间段上)的变化。起始浅灰色液滴不含离子i,而起始深灰色液滴含有离子i(例如k+)。
图4b示出了在离子通道(3)为非活性的情况下,v2/v0的平方随时间的变化,其中v2是液滴体积,v0是d2的初始液滴体积,其中c2>c1(即在t=0处)。水的渗透仅通过双层发生,这具有液滴体积的平方随时间线性增加的特征。
图5示出了使用液滴双层渗透率值,在非活性通道的情况下,液滴尺寸变化的一般和模拟情况。a曲线涉及具有较低浓度离子i的液滴,而b曲线涉及具有较高浓度离子i的液滴。
图6a、6b和6c示出了根据本发明的微流体分析系统(4)的各种实施方案,其可用于以高通量方式进行根据本发明的方法(意指可选地)。
图7示出了在使用kv1.5通道的情况下,由于微流体设备以连续方式形成d1/d2(c1<c2)液滴对。k+离子通过活性kv1.5通道从d2移动至d1,直到两个液滴达到等渗浓度。
图8a和8b示出了液滴d1和液滴d2随时间(即在实验开始时(图8a)和在达到平衡结束时(图8b))的变化。
具体实施方式
如下面的实施例所示,步骤(iii)中形成的双层的两亲分子(2)(参见图1a和1b)模拟细胞膜,因此对水是可渗透的,但对于只通过特定的离子通道(3)能够从液滴流动至另一个液滴的离子是不可渗透的。离子特定于离子通道(3)(参见图3)。
由于两个液滴之间的渗透压差异,在两个液滴接触后可观察到两种情形:
-如果离子通道(3)是非活性的(例如由于阻滞剂的存在)以及不允许输送离子i,则离子i不能流过离子通道(3),因此水将从具有较低浓度离子i的液滴穿过膜至具有较高浓度离子i的液滴中,以在两个液滴之间达到相同的渗透压,这将导致具有初始较低浓度离子i的液滴尺寸的减小,以及导致具有初始较高浓度离子i的液滴尺寸的增加,以及可能导致两个液滴的融合,从而在平衡时仅获得一个液滴(图2中的情况(a));
-如果离子通道(3)是活性的并允许输送离子i,则离子i也可以流过离子通道(3),以在两个液滴之间达到相同的渗透压;可以调节双层中的离子浓度和离子通道(3)的数量,使得通过离子通道的离子转移速率高于通过膜的水转移速率,因此平衡将主要归因于离子转移使得两个液滴的尺寸不会发生显著变化(图2中的情况(b))。
因此,如果在接触之前或接触时(初始状态)确定液滴的尺寸,在液滴接触之后和达到平衡状态时测量它们的尺寸或确定所产生的液滴的数量,则允许确定离子通道(3)是否是活性的。这种测量或确定可以通过简单光学检测装置(例如照相机,特别是在透射光或明场中,更具体地可以在液滴流动下以hts方法使用的明场高速照相机)来进行。
“平衡”在本发明中是指两个液滴的尺寸不再变化的状态。实际上,离子i和/或水通过双层膜的流动可能需要一些时间,通常是数分钟,然后达到平衡,如图5所示。因此,重要的是等待平衡状态,使得液滴的尺寸不再变化,以分析初始状态和平衡状态之间的液滴尺寸的差异。
根据本发明的方法可用于确定物质(例如化学化合物)是否具有活化离子通道(3)的能力。为此,该物质必须存在于水溶液as1和as2的一者中。因此可以筛选通道阻滞剂以及通道调节剂。
如果物质能够使离子通道(3)失活,则离子i将不能流过离子通道(3),从而仅发生水转移以平衡两个液滴之间的渗透压,以及在平衡时将观察到两个液滴的尺寸变化(可能是两个液滴的融合)。
相反地,如果物质不能使离子通道失活,则离子i将能够流过离子通道(3),使得两个液滴的尺寸在平衡时不会发生显著变化。
这种方法也可用于例如分析离子通道(3),以确定哪种离子可以流过该离子通道(3)。
然而,该方法主要用于确定与离子通道(3)相关的物质(作为阻滞剂或调节剂)的活性。
用于评估液滴尺寸的参数是其半径(参见图1b,其中r1表示d1液滴的半径,r2表示d2液滴的半径),其可以例如通过明场高速照相机测量。因此,在本发明的框架中,可以通过测量其半径来进行测量液滴的尺寸。
根据一个实施方案,如果在平衡状态下仅获得一个液滴或者如果液滴的尺寸发生显著变化(例如收缩的是具有初始较低浓度离子i的液滴),以及更特别地,如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异为至少10%,特别地至少20%,优选至少30%,则认为离子通道(3)是非活性的。这意味着iri-reix100/ri应高于10%,特别地高于20%,优选高于30%。
根据另一个实施方案,如果液滴的尺寸没有显著变化,以及更特别地,如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异小于10%,特别地小于5%,优选小于3%,则认为离子通道(3)是活性的。这意味着iri-reix100/ri应低于10%,特别地低于5%,优选低于3%。
根据另一个实施方案,如果在平衡状态下仅获得一个液滴或者如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异至少为10%,则认为离子通道(3)是非活性的,以及如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异小于10%,则认为离子通道(3)是活性的。
离子通道(3):
“离子通道”(3)是成孔膜蛋白,其允许离子流过细胞膜。离子通道(3)对于离子可以是选择性的或非选择性的,所述离子通常为na+、k+、ca2+、h+或cl-。
在根据本发明的方法中,可以使用任何离子通道(3)。它可以特别地为钠通道、钾通道(例如kv1.1至kv1.5通道)、钙通道、质子通道或氯通道或孔蛋白(porine)(例如α-溶血素)。
因此,离子i特别地为na+、k+、ca2+、h+或cl-,更特别地为k+或cl-。更特别地,离子i能够通过待分析的离子通道(3),即na+将与钠通道一起使用、k+将与钾通道一起使用、ca2+将与钙通道一起使用、h+将与质子通道一起使用、cl-将与氯通道一起使用。然而,如果不知道哪种离子能够通过离子通道(3),则可以使用根据本发明的方法来测试各种离子并确定能够通过离子通道(3)的离子。
还可以在相同的测试中使用几种不同的离子通道(3)来进行该方法。
疏水介质(1):
根据本发明的“疏水介质”(1)是不与水混溶的介质,特别是不与前述水溶液as1和as2混溶的介质。
有利地,疏水介质(1)可以是油,例如植物油(例如豆油或矿物油);甘油三酯;硅油;烃;角鲨烯或其混合物。
“甘油三酯”(也称为tg,三酰基甘油,tag或三酰基甘油酯)是衍生自甘油和三种脂肪酸(其可以相同或不同,特别地相同)的酯。甘油三酯更具体地具有下式(i):
其中a1、a2和a3,相同或不同,特别地相同,为脂肪酸的烃链。用于本发明的甘油三酯可以是各种甘油三酯(例如存在于植物油(例如豆油)中的甘油三酯)的混合物形式。
在本发明的上下文中,“脂肪酸”是指包含4至30个,例如6至30个,特别地8至28个,特别是10至24个,例如12至22个碳原子(包括羧酸官能团的碳原子)的直链、饱和的或不饱和的羧酸(rco2h)。尤其可以是月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、肉豆蔻脑酸、9e-十四碳烯酸(myristelaidicacid)、棕榈油酸、棕榈反油酸、油酸、反油酸、亚油酸、亚麻酸、二十碳烯酸或花生四烯酸。
在本发明的上下文中,“脂肪酸的烃链”是指与脂肪酸(rco2h)的酸官能团连接的烃链(r)。因此,r表示包含3至29个,例如5至29个,特别地7至27个,特别是9至23个,例如11至21个碳原子的直链,饱和的或不饱和的烃链。尤其可以是月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、肉豆蔻脑酸,9e-十四碳烯酸、棕榈油酸、棕榈反油酸、油酸、反油酸、亚油酸、亚麻酸、二十碳烯酸或花生四烯酸的烃链。
在本发明中,“不饱和的”是指链包含一个或数个(特别是一至四个,例如一个、两个或三个)双键c=c。
甘油三酯特别地可以是式(i)的甘油三酯,其中a1,a2和a3相同或不同,表示包含3至23个,特别地5至19个碳原子的直链、饱和的或不饱和的烃链。甘油三酯可以以各种甘油三酯(例如存在于植物油(例如豆油)中的那些)的混合物的形式存在。
烃可以是直链的或支链的,饱和的或不饱和的(即含有一个或数个双键c=c)。有利地,烃将含有至少5个碳原子,特别地至少10个碳原子,特别是5至40个碳原子,例如10至30个碳原子,前提是烃在该方法进行的温度下是液体,通常是室温(即15至40℃,优选20至30℃)。它可以特别地是戊烷、癸烷、十六烷或角鲨烯,特别是角鲨烯。它也可以是烃的混合物的形式,例如矿物油。
优选地,疏水介质(1)将包含甘油三酯(特别是存在于植物油(例如豆油)中)和烃(例如角鲨烯)的混合物,优选在该混合物中烃(例如角鲨烯)的量为至少15%w/w。这种疏水介质(1)允许改善液滴的稳定性并具有较高的接触角。具有较高的接触角是优选的,因为双层面积将会更高,因此水/离子转移速率也更高。例如,对于250μm大小的液滴,通过使用95°/2的接触角获得图5中用于全部水交换的几分钟时间规模的模拟。增加这个角度会加快交换速率。
两亲分子(2):
“两亲分子”(2)是包含亲水部分和疏水部分的分子。
用于本发明的两亲分子(2)特别地可以是脂质,例如通常存在于细胞膜中的脂质类型的磷脂、糖脂、胆固醇及其混合物。脂质可以具有天然源或合成源。更特别地,两亲分子(2)可以是任选与糖脂和/或胆固醇混合的磷脂。有利地,两亲分子(2)是任选与胆固醇混合的磷脂。优选地,两亲分子(2)是磷脂。
“磷脂”是两亲脂质,其包含磷酸单-或二-酯部分作为亲水部分。磷脂给液滴提供良好的稳定性,并因此给双层提供良好的稳定性,以及由于其带电的头基,使得更好地结合离子通道(3)。它们可以具有天然源或合成源。优选地,使用合成磷脂。它们可以是磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)、磷脂酰甘油(pg)、磷脂酰丝氨酸(ps)、磷脂酸(pa)、磷脂酰肌醇(pi)或其混合物。这些磷脂更具体地具有下式(ii):
其中:
-x+是抗衡离子,更特别地是单价阳离子,例如na+或nh4+,
-n为0(即不存在x+)或1(即存在x+),
-r1和r2,相同或不同,优选相同,为脂肪酸(如上限定的)的烃链,以及
-r3为:
■
■
■
■
■
■
这些磷脂可以从avantipolarlipids获得。
用具有至少12个碳原子的脂肪酸(即具有至少11个碳原子的烃链)形成的磷脂给液滴提供了更好的稳定性。优选的磷脂是包含c18脂肪酸(即包含17个碳原子的烃链)的那些,例如油酸。
特别地,磷脂是pc、pe、ps、pg或其混合物,例如dopc(二油酰磷脂酰胆碱)、dppc(二棕榈酰磷脂酰胆碱)、dope(二油酰磷脂酰乙醇胺)、dops(二油酰磷脂酰丝氨酸,特别是钠盐)、dopg(二油酰磷脂酰甘油酮,特别是钠盐)或其混合物。
根据特别的实施方案,根据本发明的两亲分子(2)是pc、pe或其混合物,例如dopc、dope或其混合物。可有利地使用dopc和dope的混合物,其中摩尔比dopc/dope范围为99/1至30/70。dopc和dope以摩尔比dopc/dope范围为70/30至50/50的混合物给液滴提供了特别好的稳定性。
液滴:
有利地,液滴的直径包含在0.5μm和1000μm之间,特别地包含在20μm和500μm之间,以及优选地包含在50μm和200μm之间。因此,液滴基本上呈球形。
液滴的直径可以通过明场高速照相机测量。
根据优选的实施方案,液滴d1和液滴d2具有基本相同的尺寸,即液滴d1的直径d1和液滴d2的直径d2应有利地满足以下等式:
id1-d2i/(d1+d2)≤0.9,特别地≤0.5,优选地≤0.2。
液滴d1和液滴d2的水溶液as1和as2分别有利地含有溶解在水中的离子i的盐,所述水溶液as1和as2分别具有如前限定的浓度c1或c2。
如前所述,离子i可以更特别地是na+、k+、ca2+、h+或cl-。这些离子i可以以盐的形式引入水溶液中,例如:
-对于na+:nacl或naoh,
-对于k+:kcl、koh、kch2cooh或kso4,
-对于ca2+:cacl2,或caoh2,
-对于h+:hcl,
-对于cl-:mgcl2、cacl2、kcl或nacl。
因此,与离子i相比,水溶液还含有具有相反电荷的抗衡离子c。抗衡离子c的性质取决于用于在水溶液中引入离子i的盐。
当c1和c2分别为0时,液滴水溶液as1和as2分别不含离子i(或仅痕量)。
当c1和c2不同于0时,它们有利地基本上不同,特别是如在以下等式中所限定的:
ic1-c2i/(c1+c2)>0.1,特别地≥0.5,优选地≥0.9。
根据优选的实施方案,较高浓度的c1和c2包含在1mm和1m之间,特别是在100mm和800mm之间,优选地在300mm和700mm之间。
根据另一个实施方案,浓度c1和c2中的一者为0,另一个不同于0,以及有利地包含在1mm和1m之间,特别地在100mm和800mm之间,优选地在300mm和700mm之间。特别地,c1=0。
有利地,水溶液as1和/或as2,优选as2,也可含有用于测试其离子通道(3)或阻断活性的物质(例如化学化合物)或染料物质(例如红罗丹明染料)以能够在视觉上将液滴as2与液滴as1区分开来。
图1b表示接触后的d1液滴和d2液滴,由此形成含有离子通道(3)的双层的两亲分子(2)。这对液滴的主要参数是:r1=d1/2,其是d1液滴的半径;r2=d2/2,其是d2液滴的半径;rp是双层区域的半径;θ是接触角,如下进行计算:
2θ=sin-1(rp/r1)+sin-1(rp/r2)。
各种半径(rp、r1和r2)可以通过明场高速照像机测量。
有利地,接触角θ包含在1°和90°之间,特别地在30°和90°之间,优选地在50°和90°之间。
如前所述,具有较高的接触角是有利的,因为双层面积将更高并因此水/离子转移速率也将更高。较高的接触角因此允许加快交换速率。
步骤(i):
由单层的两亲分子(2)包围的液滴d1可以通过在含有两亲分子(2)的疏水介质(1)中形成水溶液as1的液滴来提供。然后,两亲分子(2)自发地将其本身置于水性液滴和疏水介质(1)之间的界面处。
优选地,在该步骤中,疏水介质(1)的体积至少是用于形成液滴的水溶液as1的体积的两倍。
疏水介质(1)中的两亲分子(2)的浓度有利地为至少0.025%(w/w)。
步骤(ii):
提供由包含离子通道(3)的单层的两亲分子(2)包围的液滴d2的方法取决于离子通道(3)是否在脂质体中使用。实际上,如果离子通道(3)不溶于水溶液as2,则必须在脂质体中使用它。实际上,脂质体将保证蛋白质(离子通道)的安全运输而不会变性。此外,脂质体蛋白质含量可以在液滴与疏水介质的界面处重新定位到油/水表面中。
如果离子通道(3)不包含在脂质体中但被两亲分子包围,则它可溶于水溶液as2中。由包含待分析的离子通道(3)的单层的两亲分子(2)包围的d2液滴可以通过形成水溶液as2的液滴来提供,所述水溶液as2还含有疏水介质(1)中的离子通道(3),所述疏水介质(1)含有两亲分子(2)。然后,两亲分子(2)自发地将其本身置于水性液滴和疏水介质(1)之间的界面处,以在d2液滴周围形成单层的两亲分子(2)。在由单层的两亲分子(2)包围的d2液滴内,离子通道(3)倾向于迁移并与疏水介质(1)结合,形成单层的两亲分子(2)和围绕液滴的离子通道(3)。
如果离子通道(3)包含在脂质体中(由此形成蛋白质-脂质体),则在不含两亲分子(2)的疏水性介质(1)中将形成含有蛋白质-脂质体中的离子通道(3)的水溶液as2的液滴。然后摇动由此形成的液滴(特别是涡旋或通过在微流体中以z字形阵列使液滴d2流动),以便在水-疏水介质(1)界面上使蛋白质-脂质体破裂,从而在水-疏水介质(1)界面处放置离子通道(3)。然后将两亲分子(2)加入到疏水介质(1)中以自发地形成单层的两亲分子(2),所述单层的两亲分子还包含围绕液滴待分析的离子通道(3)。
优选地,在该步骤中,疏水介质(1)的体积至少是用于形成液滴的水溶液as2的体积的两倍。
疏水介质(1)中的两亲分子(2)的浓度有利地为至少0.025%(w/w)。
应有充足的离子通道(3)与围绕液滴d2的单层相关联,以允许它们在双层中的募集,同时保持它们的功能性,以及离子i通过这些离子通道(3)的足够流动。例如,围绕液滴d2形成的单层可含有至少一个离子通道(3),用于1亿,特别是8千万,优选5千万的两亲分子(2)。
步骤(iii)和(iv):
通过本领域中使用的任何方式(例如通过混合二元液滴或通过改变微流体中的流速)将两个液滴d1和液滴d2接触。通常地,在将分别含有液滴d1和液滴d2的两种疏水介质(1)合并在一起之前,在疏水介质(1)中分别形成液滴d1和液滴d2。
由于c1和c2之间的差异导致两个液滴之间存在渗透压差异,因此一旦两个液滴接触,就会发生水和/或离子i(如果在最后一种情况下离子通道(3)是活性的)的流出,以通过达到相同的渗透压来建立平衡。因此,可以观察到两种情形:
-如果离子通道(3)是非活性的(例如由于阻滞剂的存在)以及不允许输送离子i,则离子i不能流过离子通道(3),因此水将从具有较低浓度离子i的液滴穿过膜至具有较高浓度离子i的液滴中,以平衡两个液滴之间的渗透压,这将导致具有初始较低浓度离子i的液滴尺寸的减小,以及导致具有初始较高浓度离子i的液滴尺寸的增加,以及可能导致两个液滴的融合,最终仅获得一个液滴;
-如果离子通道(3)是活性的并允许输送离子i,则离子i将流过离子通道(3),以平衡两个液滴之间的渗透压,这不会改变两个液滴的尺寸。
因此,通过确定液滴轮廓变化来测量不同时间点或平衡时液滴的尺寸,或者在平衡时确定最终液滴(一个大液滴或两个液滴)的数量使得确定离子通道(3)是否是活性的。这种测量或确定可以通过光学检测系统(例如照相机,特别是在透射光或明场中,更具体地明场高速照像机),特别地通过测量液滴的半径来进行。
特别地,当两个液滴接触(初始状态)和在平衡状态时测量接触的液滴的尺寸(或者如果在平衡状态时仅保留一个液滴,确定液滴的数量),以及比较这两个测量。
根据一个实施方案,如果在平衡状态下仅获得一个液滴或者如果液滴的尺寸发生显著变化(例如收缩的是具有初始较低浓度离子i的液滴),以及更特别地,如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异为至少10%,特别地至少20%,优选至少30%,则认为离子通道(3)是非活性的。这意味着iri-reix100/ri应高于10%,特别地高于20%,优选高于30%。
根据另一个实施方案,如果液滴的尺寸没有显著变化,以及更特别地,如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异小于10%,特别地小于5%,优选小于3%,则认为离子通道(3)是活性的。这意味着iri-reix100/ri应低于10%,特别地低于5%,优选低于3%。
根据另一个实施方案,如果在平衡状态下仅获得一个液滴或者如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异为至少10%,则认为离子通道(3)是非活性的,以及如果至少一个液滴(特别是具有初始较低浓度离子i的液滴)在其初始状态(ri)和与其它液滴接触后达到其平衡状态(re)之间的半径差异小于10%,则认为离子通道(3)是活性的。
还根据另一个实施方案,如果我们选择浓度c1和c2的值非常不同(例如c2>>c1~0mm,差异越大,平衡时间越快;但是,如果差异太大,则双层可能不会足够稳定;浓度范围优选如前所述)从而当离子通道(3)非活性时,必然导致两个液滴在平衡状态下融合,则:
■在平衡时获得一个液滴,这意味着离子通道(3)是非活性的,而
■在平衡时获得两个液滴,这意味着离子通道(3)是活性的。
在这种情况下,可以通过光学检测系统(例如照相机,特别是在透射光或明场中,更特别地明场高速照相机)通过简单的二进制读出(在平衡时的一个大液滴或两个液滴)来确定待分析的离子通道(3)的活性。
达到平衡所需的时间取决于各种参数,例如液滴d1和液滴d2的初始尺寸、接触角、浓度c1和c2、待分析的离子通道(3)的性质、双层中离子通道(3)的数量等。然而,对于初始尺寸包含在100μm和1000μm之间的液滴,我们可以估计在1分钟至30分钟之后应达到平衡。
微流体设备:
由于通过光学检测系统(例如照相机,特别是在透射光或明场中,更特别地明场高速照相机,其可以容易地以自动化方式使用)确定离子通道(3)的活动的简单方式,根据本发明的方法可以在高通量,特别地在hts方法中进行。
可以通过使用微流体分析系统(4)来进行这种高通量方法。这种分析系统(4)可以包括:
-微流体设备(18),其包括:
■主微流体通道(5),其包括一个入口(6)和一个出口(7),液滴d1和液滴d2可以交替地通过该主微流体通道在疏水介质(1)中从通道的入口(6)流动至出口(7),
■至少两个出口(8a、8b),其连接至主微流体通道(5)的出口(7),以及其中:
微流体设备(18)的第一出口(8a)进一步连接至第一接收容器(9),所述第一接收容器(9)旨在接收分析为含有活性离子通道(3)的液滴,以及
微流体设备(18)的第二出口(8b)进一步连接至第二接收容器(10),所述第二接收容器(10)旨在接收分析为含有非活性离子通道(3)的液滴,
■至少四个入口(11a、11b、11c、11d),其连接至主微流体通道(5)的入口(6),以及其中:
微流体设备(18)的前两个入口(11a、11b)分别进一步连接至旨在容纳水溶液as1的储存器(12)和旨在容纳疏水介质(1)和两亲分子(2)的储存器(14),以及
后两个入口(11c、11d)分别进一步连接到至旨在容纳水溶液as2和任选存在于脂质体中的离子通道(3)的储存器(13)和旨在容纳脂疏水介质(1)和任选两亲分子(2)的储存器(14或15),
其中,当离子通道(3)存在于脂质体中的水溶液as2中时,微流体设备(18)包括连接至主微流体通道(5)的入口(6)和旨在容纳两亲分子(2)和任选疏水介质(1)的储存器(16)的第五入口(11e),
-至少三个储存器,其适于分别容纳(i)水溶液as1(储存器(12)),(ii)水溶液as2和任选存在于脂质体中的离子通道(3)(储存器(13),和(iii)疏水介质(1)和/或两亲分子(2)(储存器(14)、(15)、(16))(其中,根据实施方案,可以存在例如(a)一个储存器(14)用于混合物疏水介质(1)/两亲分子(2)(参见图6a);(b)两个储存器(14a、14b)用于混合物疏水介质(1)/两亲分子(2)(参见图6b);或(c)一个储存器(14)用于混合物疏水介质(1)/两亲分子(2),一个储存器(15)用于单独的疏水介质(1),和一个储存器(16)用于任选与疏水介质(1)混合的两亲分子(2)(参见图6c)),
-至少两个接收容器(9、10),其适于分别接收(i)分析为含有活性离子通道(3)(储存器(9))的液滴,和(ii)分析为含有非活性离子通道(3)的液滴(储存器(10))(在两种情况下,这些液滴都与周围的疏水介质(1)和两亲分子(2)一起收集),和
-检测设备(17)(例如照相机,特别是透射光或明场,更具体地明场高速照相机),其放置在主微流体通道(5)末端,。
在本发明中,“微流体通道”(5)是指横截面的尺寸在微米范围内的通道。通常,微流体通道(5)的宽度和深度包含在10μm和1000μm之间,特别地在10μm和400μm之间,特别是在10μm和250μm之间,优选地在10和100μm之间或在150和250μm之间。然而,微流体通道(5)的长度可以是厘米,分米或甚至米的范围。
通过任何方式从含有两亲分子(2)的疏水介质(1)和通过其前两个入口(11a、11b)进入微流体设备(18)的水溶液as1在微流体设备(18)中形成液滴d1。一旦形成,液滴d1在疏水介质(1)中流动,直至微流体通道(5)的入口(6)。液滴d1可以例如通过用两股含有两亲分子(2)的疏水介质(1)的流剪切水溶液as1的流来形成,这是本领域技术人员公知的方法。然后围绕液滴d1自发地形成单层的两亲分子(2)。
液滴d2以与液滴d2类似的方式形成。一旦形成,液滴d2在疏水介质(1)中流动,直至微流体通道(5)的入口(6)。
当离子通道(3)不存在于脂质体中时(因为它们在由两亲分子包围时可溶于水溶液as2中),液滴d2将通过任何方式从含有两亲分子(2)的疏水介质(1)和通过其后两个入口(11c、11d)进入微流体设备(18)的进一步含有离子通道(3)的水溶液as2在微流体设备(18)中形成。液滴d2还可以通过用两股含有两亲分子(2)的疏水介质(1)的流剪切进一步含有离子通道(3)的水溶液as2的流来形成,这是本领域技术人员公知的方法。然后围绕液滴d2自发地形成与离子通道(3)相关的单层的两亲分子(2)。
当离子通道(3)存在于脂质体中时,液滴d2将通过任何方式从疏水介质(1)(不含两亲分子(2))和通过两个入口(11c、11d)进入微流体设备(18)的进一步含有离子通道(3)的水溶液as2在微流体设备(18)中形成。特别地,通过用两股疏水介质(1)(不含两亲分子(2))的流剪切进一步含有离子通道(3)的水溶液as2的流,可以形成液滴d2。一旦形成液滴d2,就需要摇动它们以使含有离子通道(3)的脂质体在水-疏水介质界面上破裂,从而将离子通道(3)置于水-疏水介质界面处。为此,液滴d2可以以z字形阵列(特别是z字形微流体通道)流动。在该步骤之后,必须通过微流体设备的另一个入口(11e)将两亲分子(2)(任选与疏水介质(1)混合)加入至含有液滴d2的疏水介质(1)的流中。这使得与围绕液滴d2的离子通道(3)相关的单层的两亲分子(2)的自发形成。
有利地,液滴d1和液滴d2通过其入口(6)交替地进入主微流体通道(5)以及通过该主微流体通道(5)从其入口(6)流动至其出口(7)。液滴d1和液滴d2的对在该主微流体通道(5)中接触(例如通过改变微流体通道(5)中的压力/流速),从而形成含有离子通道(3)的双层的两亲分子(2)。有利地,主微流体通道(5)是线性的。
液滴d1和液滴d2的对将流过该主微流体通道(5),直至该微流体通道(5)的末端,其中通过检测设备(17)分析“液滴对”的尺寸或数量,优选数量。因此,主微流体通道(5)应该足够长,从而当“液滴对”到达主微流体通道(5)的末端,由检测设备(17)进行分析时达到平衡。由检测设备(17)控制的阀可以存在于主微流体通道(5)的末端。根据“液滴对”的尺寸或数量,检测设备(17)将移动阀门,使得含有活性离子通道(3)的液滴通过微流体设备(18)第一出口(8a)朝向第一接收容器(9)移动,而含有非活性离子通道(3)的液滴通过微流体设备(18)的第二出口(8b)朝向第二接收容器(10)移动。
检测设备(18)有利地包括光学检测系统,例如照相机,特别是在透射光或明场中,更具体地明场高速照相机。更具体地,它可以是理想地具有光学检测系统的基本分拣设备,例如照相机,特别是高速照相机,更具体地是明场高速照相机,以及能够分析液滴尺寸/数量的软件以提供二进制值,所述二进制值允许例如将阀门移动到所需位置,从而将“液滴对”引向至适当的接收容器(9、10)中。例如,我们将使用微流体阀门,该阀门只能及时打开以允许通过软件对离子通道活性积极的液滴进行分拣;例如,软件会向阀门发送消息1用于打开,消息0用于关闭;在阀门信号为1的阀门之后,将简单地收集经分拣的液滴。
这种微流体分析系统(4)将允许形成和测试多对液滴,并自动处理结果。为了进行hts,可以在水溶液s1和/或s2中引入待分析的各种物质。在第二出口(8b)处收集的含有非活性离子通道(3)的液滴将对应于含有能够阻塞离子通道(3)的物质的液滴。对这些液滴的分析,特别是通过质谱法(可在hplc之后分离各种物质),将允许鉴定活性物质。
将通过以下非限制性实施例说明本发明。
实施例
1.没有离子通道的实施例说明非活性离子通道的存在
在混合并涡旋之前,分别形成两个油包水乳液液滴(油/水(8/1,v/v))。
第一类水滴含有0mmkcl,并在含有来自avantipolarlipids的磷脂(dopc/dope(70/30mol/mol),相对于油0.2%w/w)的油相(豆油/角鲨烯(50/50w/w))中形成,所述第一类水滴装饰液滴界面。将氯仿中的磷脂(pl)置于玻璃小瓶中,从而在真空下蒸发氯仿;干燥后加入足够量的油以达到目标浓度;将混合物充分混合-例如干燥20μl25mg/ml的pl,然后加入250mg的油以达到0.2%。然后将不同的溶液(水相和油相)混合并涡旋(50μl水相+350μl油相)以产生液滴群d1。
含有0.5mkcl或0.25mmgcl2(和红色罗丹明染料(用于眼睛可视化)以及与d1类液滴区分开)的第二类水滴在没有磷脂的油(50μl水相+350μl油相)中形成(用0.5mkcl或0.25mmgcl2和0.01%w/w在水中的红色罗丹明染料代替水重复先前的液滴制备过程)以获得液滴群d2。
然后将两种乳液混合在一起。然后随时间跟踪形成dib的红色和白色液滴(即分别为d2液滴和d1液滴)的平衡。较低渗透压的白色液滴在接触30分钟后将其水含量完全转移至较高渗透压的红色液滴。
液滴d1和液滴d2随时间的变化由图8a(在实验开始时拍摄的照片)和图8b(在实验结束达到平衡时拍摄的照片)所示。
thiam等人2012还提出了在接触后在疏水介质(硅油+氯仿)中具有不同浓度离子i(k+)的两个水滴的行为,其内容通过引用并入本文。图4a和4b示出了液滴尺寸的变化。
与在thiam等人2012中使用硅油和氯仿的混合物相比,使用甘油三酯和烃(例如豆油/角鲨烯)的混合物作为疏水介质,使得在不使用氯仿的情况下,液滴具有更好的稳定性,所述氯仿在离子通道存在下可能是有害的。
2.具有活性离子通道的实施例
在dib中存在离子通道的情况下重复实施例1的实验,更具体地是以下离子通道:分别为kv1.5(0.01mg/ml)和α溶血素(0.02mg/ml)。
α溶血素可溶于水相,因此离子通道直接加入用于产生d2液滴的水相(用mgcl2形成的水相)中。
kv1.5通道不溶于水相,因此如下所述与dphpc(二植烷酰磷脂酰胆碱)脂质体结合。
人类kv1.5的合成和蛋白质-脂质体制备:
将人类kv1.5通道(基因id:nm_002234.3)1.843kbcdnas亚克隆至ncoi和xhoi限制性位点之间的pivex2.4a质粒(rocheappliedscience,germany)中。该构建体编码kv1.5通道,在第一甲硫氨酸上游具有6个组氨酸标签氨基酸。如schwartz等人2007所描述的,使用大肠杆菌的核糖体,16μg/ml质粒和0.9mm
然后将蛋白质-脂质体加入用于产生d2液滴的水相(用kcl形成的水相)中。在混合两种乳液之前,将含有蛋白质-脂质体的d2液滴在油溶液中充分涡旋;在微流体中,该步骤通过在油中形成液滴并使它们以z字形阵列流动来实现。该步骤允许将蛋白质-脂质体破裂至油-水界面并将蛋白质(离子通道)重新定位在油-水界面处。对于α溶血素,这一步不是必需的。
蛋白质(kv1.5或α溶血素离子通道)位于dib双层中,并允许k+(对于kv1.5)或cl-(对于α溶血素)离子流建立在与水流相反的方向上,水流从d1液滴转移至d2液滴。一小时后,我们假设达到平衡,d1-ds2粘附的液滴达到等渗透,以及仍然可见其初始尺寸没有显著变化。
3.使用微流体设备具有活性离子通道的实施例
图7示出了由于微流体设备以连续方式形成d1/d2液滴对(包括kv1.5通道)。在kv1.5通道的情况下,as1和as2水相和油相如上所述,除了油相(其中用as2水相形成液滴)不含磷脂。形成油相中的d2液滴(浅灰色)流和另一个油相中的d1液滴(深灰色)流,并在主通道(此处是线性通道)的入口处相遇,以允许d1液滴和d2液滴的交替进入,然后可使d1液滴和d2液滴接触,特别是通过改变压力。因此,在主通道中形成d1液滴和d2液滴的对,并通过光学读出在主通道的末端(当达到平衡时)进行分析。在该情况下,分析了液滴的数量:一个液滴意味着非活性通道并引向第一出口,而两个液滴意味着活性通道并引向第二出口。
参考文献:
barriga等“dropletinterfacebilayerreconstitutionandactivitymeasurementofthemechanosensitivechanneloflargeconductancefromescherichiacoli”2014,80(5),1-4.
bayley等“dropletinterfacebilayers”mol.biosyst.2008,1,1191-1208.
schwarz等“preparativescalecell-freeexpressionsystems:newtoolsforthelargescalepreparationofintegralmembraneproteinsforfunctionalandstructuralstudies.”methods2007,41,355-369.
schlicht和zagnoni“droplet-interface-bilayerassaysinmicrofluidicpassivenetworks”scientificreports2015,5,1-8.
thiam等“fromstabilitytopermeabilityofadhesiveemulsionbilayers”langmuir2012,28(15),6291–6298.
villar等“formationofdropletnetworksthatfunctioninaqueousenvironments”naturenanotechnology2011,6(12),803-808.
wo2008/012552
us2012/0220481
us8,268,627
us8,293,339
us8,506,905
- 还没有人留言评论。精彩留言会获得点赞!