一种利用光致氧化扩增效应的生物标记物高灵敏定量方法与流程
本发明涉及一种利用光致氧化扩增效应的生物标记物高灵敏定量方法,详细地说,本发明的利用光致氧化扩增效应的生物标记物高灵敏定量方法在标记于拟检测的生物标记物特异性抗体、适配体(Aptamer)、核酸等的酶与底物反应后,对产物持续曝光进行光致氧化扩增过程并且把基于时间的产物显色量、发光量、荧光量之类的变化情况予以指标化,能以高灵敏度把低浓度或微量生物标记物予以定量。
背景技术:
检测蛋白质、肽、遗传基因、激素、低分子化合物之类的生物标记物的方法通常可以利用拟检测的生物标记物特异性抗体、适配体、核酸等。
而且,针对利用生物标记物特异性抗体、适配体、核酸等检测出来的生物标记物的浓度进行定量的方法则可以采取酶联免疫吸附测定法(ELISA;enzyme-linked immunosorbent assay,EIA;enzyme-linked immunoassay)等。
酶联免疫吸附测定法是一种利用抗原-抗体或抗原-适配体的特异性结合的免疫测定法之一,可以视为蛋白质、肽、激素、低分子化合物之类的抗原的定量测量法。通常在抗原特异性抗体或适配体标记酶后利用其和底物的反应予以定量,针对标记于抗体或适配体的酶与底物的反应所致产物的显色量、发光量、荧光量等进行光学测量后把生物标记物予以定量。通常利用酶标仪(plate reader)、光谱仪(spectrometer)等仪器对待测试料的酶-底物反应的程度进行光学测量,再将其和基准试料的酶-底物反应程度测量值进行比较,然后把生物标记物的量予以定量化。
而且,酶联免疫吸附测定法还能应用于遗传基因生物标记物的检测。亦即,在能够和待测遗传基因生物标记物进行互补结合的核酸上标记酶并且利用和底物之间的反应予以定量,针对标记在核酸的酶与底物的反应所致产物的显色量、发光量、荧光量等进行光学测量并且将其和基准试料的酶-底物反应程度测量值进行比较而得以把生物标记物的量予以定量化。
但是,现有的酶联免疫吸附测定法中如果拟检测的生物标记物的量是微量或低浓度的话,就无法对标记于抗体、适配体、核酸等的酶与底物的反应所致产物的显色量、发光量、荧光量等进行检测,即使能够检测也无法通过极小的检测量准确地定量生物标记物。例如,如图1所示,如果标记抗体的酶的量是微量或低浓度的话,酶-底物反应后能够检测的产物的荧光量也是极小而无法准确地对微量或低浓度抗体进行定量。
技术实现要素:
技术问题
本发明旨在解决上述问题,本发明的目的是提供一种利用光致氧化扩增效应的生物标记物高灵敏定量方法,在标记于拟检测的生物标记物特异性抗体、适配体、核酸等的酶与底物反应后,对产物持续曝光进行光致氧化扩增过程并且把基于时间的产物显色量、发光量、荧光量之类的变化情况予以指标化,能以高灵敏度把低浓度或微量生物标记物予以定量。
技术方案
为了达到上述目的,本发明实施例的利用光致氧化扩增效应的生物标记物高灵敏定量方法包括下列步骤:对包含下列酶的待测试料进行酶-底物反应,该酶标记于选自特异性结合于生物标记物的抗体、适配体、核酸的某一个;上述酶-底物反应后,对产物持续曝光进行光致氧化扩增过程,与此同时,在光致氧化扩增过程中针对选自产物显色量、发光量、荧光量的某一个以上的光特性进行光学测量;针对所测量到的上述光特性把基于时间的变化情况予以指标化;及比较上述指标化步骤所提取的指标和基准试料的指标而把待测试料所含生物标记物的浓度予以定量。
有益效果
根据具备了如前所述技术特征的本发明,在标记于拟检测的生物标记物特异性抗体、适配体、核酸等的酶与底物反应后,对产物持续曝光进行光致氧化扩增过程并且把基于时间的产物显色量、发光量、荧光量之类的变化情况予以指标化,就能以高灵敏度更准确地把低浓度或微量生物标记物予以定量。
附图说明
图1是示出利用现有酶标仪的基于酶浓度的酶-底物反应产物的荧光检测量的曲线图。
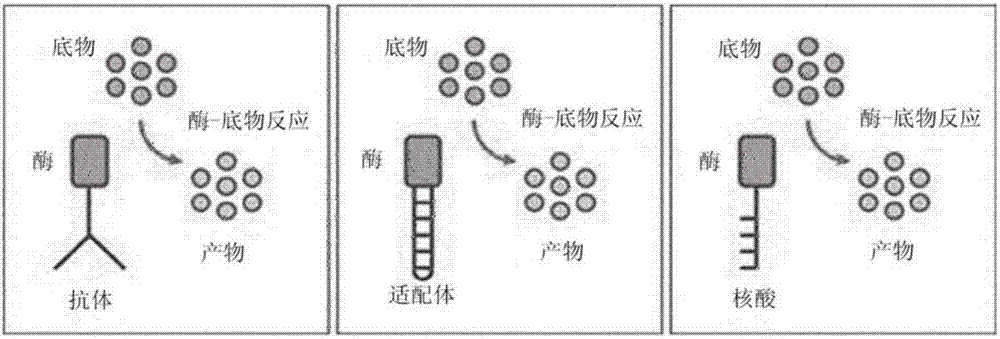
图2是用来说明本发明实施例的标记于特异性结合于生物标记物的抗体、适配体、核酸等的酶与底物的反应的概念图。
图3是用来说明本发明实施例的酶联免疫吸附测定法中酶(HRP;horseradish peroxidase)与底物(Amplex Red)反应的图形。
图4是用来说明本发明实施例的光致氧化扩增过程的概念图。
图5是以时间为轴示出本发明第一实施例的标记于抗体的酶的浓度和相应的光致氧化扩增情况的曲线图。
图6是示出本发明第一实施例的标记于抗体的酶的浓度和相应的光致氧化扩增情况的T50指标提取值的曲线图。
图7是示出本发明第一实施例的标记于抗体的酶的浓度和相应的光致氧化扩增情况的CTL(characteristic time length)指标提取值的曲线图。
图8是以时间为轴示出本发明第二实施例的蛋白质生物标记物浓度和相应的光致氧化扩增情况的曲线图。
图9是示出本发明第二实施例的蛋白质生物标记物浓度和相应的光致氧化扩增情况的T50指标提取值的曲线图。
图10是示出本发明第二实施例的蛋白质生物标记物浓度和相应的光致氧化扩增情况的CTL指标提取值的曲线图。
图11是示出本发明第二实施例的另一例的肽生物标记物的浓度和相应的光致氧化扩增情况的T50指标提取值的曲线图。
图12是示出本发明第二实施例的另一例的肽生物标记物的浓度和相应的光致氧化扩增情况的CTL指标提取值的曲线图。
具体实施方式
除非另外给予不同的定义,否则本说明书所使用的一切技术或科学术语的意义和本发明所属技术领域的熟练专家通常所理解的意义相同。一般来说,本说明书所使用的命名法是本技术领域中广为人知并且广泛使用者。
在整个本说明书中,当指称某一部分“包含”某一构成要素时,其指的是,除非特别记载了相反内容,否则其不排除其它构成要素而还能包含其它构成要素。
下面结合附图详细说明本发明的实施例。
图2是用来说明本发明实施例的标记于特异性结合于生物标记物的抗体、适配体、核酸等的酶与底物的反应的概念图。
请参阅图2,标记于特异性结合于生物标记物的抗体、适配体、核酸等的酶通过和底物的反应变成呈现颜色或荧光的产物,酶-底物反应进行一定时间后可以对产物的显色量、发光量、荧光量等进行光学测量并且分析酶-底物反应程度。分析该酶-底物反应程度就能分析标记于特异性结合于生物标记物的抗体、适配体、核酸等的酶的量,其结果,能凭此把拟检测的生物标记物的量予以定量。
图3是用来说明作为一例的本发明实施例的酶联免疫吸附测定法中酶(HRP;horseradish peroxidase)与底物(Amplex Red)反应的图形。
请参阅图3,无色及无荧光的底物(Amplex Red)通过酶(HRP)的作用变成呈现色及荧光的产物(Resorufin),利用酶标仪之类的仪器测量产物的荧光量就能分析酶-底物反应程度,凭此对标记于特异性结合于生物标记物的抗体、适配体、核酸等的酶的量或生物标记物的量进行定量。例如,在特异性结合于抗原的抗体标记过氧化物酶之类的酶后测量酶-底物反应程度就能对拟检测的抗原的量进行定量化。
但是,基于现有酶标仪或光谱仪等的酶-底物反应测量方法无法在待测试料所含生物标记物的量为微量或低浓度时针对标记于生物标记物特异性抗体、适配体、核酸等的酶与底物的反应所致产物的显色量、发光量、荧光量进行检测,即使能够进行检测也无法凭借极少的检测量准确地进行生物标记物的定量。
为了解决该问题,本发明在标记于特异性结合于生物标记物的抗体、适配体、核酸等的酶与底物反应后对产物持续曝光并且利用光致氧化扩增过程把产物的显色量、发光量、荧光量等扩增到可检测的量,然后将其变化情况予以指标化,能以高灵敏度更准确地把低浓度或微量生物标记物予以定量。
本发明为了利用光致氧化扩增效应以高灵敏度对拟检测的生物标记物进行定量,首先,在含有标记于选自特异性结合于生物标记物的抗体、适配体、核酸中的某一个的酶的待测试料进行酶-底物反应,在上述酶-底物反应后对产物持续曝光进行光致氧化扩增过程,与此同时,在光致氧化扩增过程中针对选自产物显色量、发光量、荧光量的某一个或多个光特性进行光学测量。
本发明的生物标记物可以选择蛋白质、肽、遗传基因、激素、低分子化合物中的某一个以上,作为一例,可以选择包括AFP,CA 125,CA 15-3,CA 19-9,CA 72-4,calcitonin,CEA,Cyfra 21-1,hCG,HE4,NSE,proGRP,PSA,SCCA,STN,thyroglobulin,TPA等的肿瘤(癌)标记物;包括troponin,myoglobin,N-terminal proBNP等的心脏病标记物;包括beta-amyloid,tau,alpha-synuclein,PrPSc,huntingtin等的退行性脑疾病标记物;包括Anti-HAV,Anti-HBc,Anti-HBe,HBeAg,Anti-HBs,HBsAg,Anti-HCV,CMV IgG,CMV IgM,HIV,HIV-Ag,HSV-Ag,HSV-1 IgG,HSV-2 IgG,RSV IgG,RSV IgM,Rubella IgG,Rubella IgM,Syphilis,Toxo IgG,Toxo IgM等的感染性疾病标记物;包括Anti-CCP,IgE,interleukin,procalcitonin,TNF,TGF,VEGF等的炎症性疾病标记物;包括ACTH,Anti-Tg,Anti-TPO,Anti-TSH-R,calcitonin,cortisol,C-peptide,FT3,FY4,hGH,insulin,PTH STAT,T3,T4,thyreoglobulin,TSH等的内分泌疾病标记物;包括Anti-β 2-GP1 IgG/IgM,Anti Cardiolipin IgG/IgM,Anti ds-DNA Ab IgG/IgM,Anti GD1b IgG/IgM,Anti GM1 IgG/IgM,Anti GQ1b IgG/IgM,Anti Phospholipid IgG/IgM,Anti ss-DNA IgG/IgM,RA Factor IgG,各种过敏性反应原因物质及IgE等的自体免疫性疾病及过敏性反应标记物;包括osteocalcin,P1NP,PTH,Vitamin D等的骨代谢标记物;Cyclosporine,Digitoxin,Sirolimus,Tacrolimus等的药物检查标记物;包括hCG,FSH,HE4,progesterone,testosterone等的妊娠/产前检查标记物;包括Cytomegalovirus,Hepatitis B,Hepatitis C,Herpes,Influenza A/B,Chlamydia trachomatis,Mycobacteria Tuberculosis,HIV-2,HCV,HBV,Hepatitis E,Strep A,BRAF,KRAS,EGFR等的遗传基因标记物等。而且,也可以选择此处没有罗列的肿瘤(癌)标记物、心脏病标记物、退行性脑疾病标记物、感染性疾病标记物、炎症性疾病标记物、内分泌疾病标记物、自体免疫性疾病及过敏性反应标记物、骨代谢标记物、药物检查标记物、妊娠/产前检查标记物、遗传基因标记物之类的生物标记物
本发明可以根据拟检测的生物标记物选择上述抗体、适配体、核酸中的某一个,在进行标记于上述抗体、适配体、核酸等的酶与底物的反应时,在包括HRP(horseradish peroxidase)的过氧化物酶(peroxidase)、包括β-Galactosidase的半乳糖苷酶(galactosidase)、包括AP(alkaline phosphatase)的磷酸酶(phosphatase)中选择某一个以上的酶标记于选自抗体、适配体、核酸的某一个,在标记了上述酶的待测试料混合选自ADHP(10-Acetyl-3,7-dihydroxyphenoxazine;Amplex Red)、RGP(resorufin-β-D-galactopyranoside)、MUP(4-methylumbelliferyl phosphate)的某一个以上的底物后进行酶-底物反应一定时间。
而且,进行上述酶-底物的反应时,也能选择此处没有罗列的其他种类的酶与底物。
本发明在上述酶-底物反应产物的显色量、发光量、荧光量中选择光特性,选择光特性时,可已根据标记于上述抗体、适配体、核酸等的酶或与其反应的底物而选择某一个或多个。
为了对上述光特性进行光学测量,用于光致氧化扩增的光可以选择宽波长的白色光、具备较窄波长的单色光、单一波长的激光中的某一个以上,一边对酶-底物反应产物持续曝光一边随着时间连续测量光致氧化扩增过程中的产物的光特性。连续或持续测量光特性的方法可以通过下列方式实现,通过持续曝光进行视频测量或者以较短的时间间距连续测量光特性或者通过以一定时间间隔进行的间歇式曝光实现的基于时间的光特性测量过程。
另一方面,在进行光致氧化扩增的期间或者扩增过程结束时刻为止把经过光学测量的上述光特性的基于时间的变化情况予以指标化。
本发明中“指标化”指的是针对基于时间的光特性测量值提取指标,该指标则是能以各种回归分析(regression analysis)准确表达测量值的指标,亦即,能够准确地表达出测量值的基于时间的变化情况的指标。
因此本发明的上述指标化能够凭借着针对所测量出来的产物的基于时间的光特性变化情况进行回归分析而提取各种形态的指标。
例如,可以提取选自下列群的一个以上的指标,而该群则包括上述光特性初始值回归分析估计值、上述光特性最大值回归分析估计值、抵达上述光特性最大值的1/2所需时间的回归分析估计值、上述光特性的基于时间的扩增率回归分析估计值。亦即,在上述指标中选择某一个以上并且将其个别地或复合组合后使用各种形态的指标。
待测试料所含生物标记物的浓度的定量则可以对上述指标化步骤所提取的指标和基准试料的指标进行比较后得到。而且,能够从含有以一定浓度为间距进行了稀释的生物标记物的试料的光致氧化扩增情况得到上述基准试料的指标。
图4是用来说明本发明实施例的光致氧化扩增过程的概念图。
请参阅图4,光致氧化扩增过程以一种自催化(autocatalysis)反应发生。亦即,对进行了酶-底物反应的试料持续曝光就能凭借自催化反应让酶-底物反应后产物的显色量、发光量、荧光量等扩增。凭此,根据光致氧化扩增时间对产物的显色量、发光量、荧光量等进行测量,就能图示光致氧化扩增情况。
光致氧化扩增过程是一种自催化反应,因此以时间为轴图示光致氧化扩增情况就能得到S曲线形态的曲线图。
而且,酶-底物反应时会随着酶的浓度而各自生成不同量的初始产物,光致氧化扩增速率则根据如此生成的初始产物的量而互不相同。
其结果,标记于抗体、适配体、核酸等的酶的浓度越高初始产物的生成量越多,因此催化反应的速率变快、光致氧化扩增也较块地进行而使得产物的荧光量较块地扩增。与此相反地,标记于抗体、适配体、核酸等的酶的浓度越低初始产物的生成量也越低,因此,自催化反应的速率较低、光致氧化扩增也较慢地进行而使得产物的荧光量相对较慢地扩增。
因此,能够通过产物显色量、发光量、荧光量之类光特性扩增的相对性的时间比较过程确认标记于抗体、适配体、核酸等的酶的浓度,把基于时间的光致氧化扩增情况予以指标化,能以高灵敏度更准确地把低浓度或微量酶的浓度予以定量。
如前所述,光致氧化扩增由自催化反应实现,因此把基于光致氧化扩增的产物显色量、发光量、荧光量之类光特性的变化情况随着时间予以图示就能呈现出S曲线形态,其如下述数学式1所示地能够通过自催化反应的反应速率式(rate equation)理解。
[数学式1]
AR+RSF→RSF+RSF
上述数学式1中,AR表示Amplex Red(底物),RSF表示resorufin(产物),[AR]表示AR的浓度,[RSF]表示RSF的浓度,k表示自催化反应的反应速率常数(reaction rate constant)或扩增率,t表示自催化反应的经过时间(历时时间),求解上述数学式1的自催化反应的反应速率式的话,就能如下述数学式2所示地得到能够表达出自催化反应的基于经过时间的RSF浓度变化情况的数学式。
[数学式2]
在上述数学式2中[AR]0表示初始Amplex Red的浓度而[RSF]0则表示初始resorufin的浓度,可以得知,把基于光致氧化扩增的产物显色量、发光量、荧光量之类的变化情况随着时间予以图示就能呈现出S曲线形态。
因此,把基于光致氧化扩增经过时间(历时)的产物(resorufin)荧光量测量值置于[RSF],按照上述数学式2把基于时间(t)的[RSF]的值予以回归分析就能导出诸如[AR]0、[RSF]0、k之类的回归分析估计值,可以利用所导出的估计值把光致氧化扩增情况予以指标化。
光致氧化扩增情况指标包括产物显色量、发光量、荧光量之类的光特性的初始值回归分析估计值、产物的光特性最大值回归分析估计值、抵达产物的光特性最大值的1/2所需时间的回归分析估计值、产物光特性的基于时间的扩增率回归分析估计值等,还能包括选择其中的一个以上并且将其个别地或复合组合后计算的指标。
例如,把抵达产物显色量、发光量、荧光量等的最大值的1/2时所需时间的回归分析估计值称为的T50指标时,可以如下述数学式3所示地导出的T50指标。
[数学式3]
作为再一个例,把针对产物显色量、发光量、荧光量之类的光特性的初始值回归分析估计值、产物的光特性最大值回归分析估计值、抵达产物光特性最大值的1/2所需时间的回归分析估计值、产物光特性的基于时间的扩增率回归分析估计值等进行复合计算的指标称为CTL(characteristic time length)指标时,可以如下述数学式4所示地导出CTL指标。
[数学式4]
光致氧化扩增情况指标可以利用上述数学式2对光致氧化扩增所致产物显色量、发光量、荧光量之类的变化情况进行回归分析后予以提取,用于回归分析的数学式可以包含如上述数学式2一样呈现出S曲线形态的其它形态的数学式,能够凭借用于回归分析的数学式导出各种形态的光致氧化扩增情况指标。
<实施例1>
本发明的第一实施例针对基于酶浓度的光致氧化扩增情况进行比较。
首先,备妥含有各种浓度的酶的试料后进行酶-底物反应。各种浓度的酶可以包括标记于抗体的酶、标记于适配体的酶、标记于核酸的酶等。
在本发明的第一实施例中,作为一例,备妥不含HRP酶的试料(Blank试料)与含有标记于抗体的HRP酶的试料,亦即,把标记于抗体的HRP和1X PBS缓冲剂(buffer)加以混合并且根据浓度准备多种试料,混合Amplex Red底物进行酶-底物反应一定时间。
接着,对上述各试料的酶-底物反应后产物(试卤灵;resorufin)持续曝光进行光致氧化扩增过程,与此同时,对光致氧化扩增过程里的产物的荧光量进行光学检测并且将其基于时间的变化情况予以指标化,比较基于标记于抗体的酶浓度的光致氧化扩增情况指标。
用于光致氧化扩增的光可以包含如白色光一样具备宽波长的光、如单色光一样具备窄波长的光、如激光一样具备单一波长的光等,本发明的第一实施例则使用510-550nm波长带的绿色光。
图5是以时间为轴示出本发明第一实施例的基于标记于抗体的酶浓度的光致氧化扩增情况的曲线图。
请参阅图5,可以得知光致氧化扩增情况随着标记于抗体的酶的浓度而变化。也就是说,酶-底物反应时会随着酶的浓度而各自生成不同量的初始产物,可以得知光致氧化扩增速率根据如此生成的初始产物的量而不同。
其结果,结合了抗体的酶的浓度越高初始试卤灵的生成量越多,因此自催化反应的速率变快、光致氧化扩增也较块地进行而使得荧光亮度值较块地变化。与此相反地,结合了抗体的酶的浓度越低初始试卤灵的生成量越少,因此自催化反应的速率较慢、光致氧化扩增较慢地进行而使得荧光亮度值较慢地变化。
因此,可以通过荧光亮度值变化的相对性的时间比较确认结合了抗体的酶的浓度,让各浓度的试料之间的差异更大地采样后保存的话,以包含低浓度或微量酶的试料也能更准确地具体分析酶-底物反应。
图6是示出本发明第一实施例的标记于抗体的酶的浓度和相应的光致氧化扩增情况的T50指标提取值的曲线图。
如图6所示,可以得知酶的浓度越低代表抵达产物显色量、发光量、荧光量等的最大值的1/2的时间的T50指标越大,凭此,能以高灵敏度更准确地把低浓度或微量酶的浓度予以定量。
而且,图7是示出本发明第一实施例的标记于抗体的酶的浓度和相应的光致氧化扩增情况的CTL(characteristic time length)指标提取值的曲线图。如图7所示,可以得知酶的浓度越低光致氧化扩增情况的CTL指标越大,凭此,能以高灵敏度更准确地把低浓度或微量酶的浓度予以定量。
<实施例2>
接着,本发明的第二实施例把基于生物标记物浓度的光致氧化扩增情况予以指标化后以高灵敏度把生物标记物的浓度予以定量。
首先,备妥含有各种浓度的生物标记物的试料,进行利用生物标记物特异性抗体、适配体、核酸等选择性地检测生物标记物的检测过程。生物标记物可以选择蛋白质、肽、遗传基因、激素、低分子化合物中的某一个以上,为了把检测出来的生物标记物的量予以定量,可以利用把酶标于生物标记物特异性抗体、适配体、核酸等的现有的酶联免疫吸附测定法等。
在本发明的第二实施例中,作为一例,以各种浓度备妥含有一种蛋白质生物标记物PSA(prostate specific antigen)的试料,进行现有的酶联免疫吸附测定法,该测定法则利用标记了HRP酶的PSA特异性抗体。
接着,在含有各种浓度的PSA-抗体-HRP复合体的试料混合Amplex Red底物并且进行酶-底物反应一定时间后,按照和上述第一实施例相同的过程进行光致氧化扩增过程。因此,第二实施例的光致氧化扩增过程的测量及光致氧化扩增情况的指标化方法将以第一实施例的说明代替。
图8是以时间为轴示出本发明第二实施例的蛋白质生物标记物浓度和相应的光致氧化扩增情况的曲线图,图9是示出蛋白质生物标记物浓度和相应的光致氧化扩增情况的T50指标提取值的曲线图,图10是示出光致氧化扩增情况的CTL指标提取值的曲线图。
如图8到图10所示,在利用含有各种浓度PSA的试料的酶联免疫吸附测定法中,在酶-底物反应后对产物持续曝光进行光致氧化扩增的话,可以得知PSA的浓度越低代表抵达产物显色量、发光量、荧光量等的最大值的1/2的时间的T50指标及CTL指标则越大,凭此能以高灵敏度更准确地把低浓度或微量的PSA浓度予以定量。亦即,把含有未知浓度的PSA的试料的T50指标或CTL指标和含有以一定浓度为间距进行了稀释的PSA的基准试料的浓度所对应的T50指标或CTL指标加以比较,就能以高灵敏度更准确地把待测试料所含PSA的浓度予以定量。
在本发明第二实施例中,作为另一例,以各种浓度备妥含有一种肽生物标记物Aβ 42(amyloid beta 42)的试料,进行现有的酶联免疫吸附测定法,该测定法则利用标记了HRP酶的Aβ 42特异性抗体。
接着,在含有各种浓度的Aβ 42-抗体-HRP复合体的试料混合Amplex Red底物并且进行酶-底物反应一定时间后,按照和上述第一实施例相同的过程进行光致氧化扩增过程。因此,第二实施例的其它例中的光致氧化扩增过程的测量及光致氧化扩增情况的指标化方法将以第一实施例的说明代替。
图11是示出本发明第二实施例的另一例的肽生物标记物的浓度和相应的光致氧化扩增情况的T50指标提取值的曲线图,图12是示出肽生物标记物的浓度和相应的光致氧化扩增情况的CTL指标提取值的曲线图。
如图11到图12所示,在利用包含各种浓度的Aβ 42的试料的酶联免疫吸附测定法中,在酶-底物反应后对产物持续曝光进行光致氧化扩增的话,可以得知Aβ 42浓度越低代表抵达产物显色量、发光量、荧光量等的最大值的1/2的时间的T50指标及CTL指标越大,凭此能以高灵敏度更准确地把低浓度或微量的Aβ 42浓度予以定量。亦即,把含有未知浓度的Aβ 42的试料的T50指标或CTL指标和含有以一定浓度为间距进行了稀释的Aβ 42的基准试料的浓度所对应的T50指标或CTL指标加以比较,就能以高灵敏度更准确地把待测试料所含Aβ 42的浓度予以定量。
如前所述,通过本发明的各种实施例改变生物标记物的种类、特异性结合于生物标记物的抗体、适配体、核酸等的种类、酶的种类、底物的种类、光致氧化扩增情况指标的种类等,就能以高灵敏度更准确地把拟检测的生物标记物的浓度予以定量。
亦即,根据拟检测的生物标记物的种类改变抗体、适配体、核酸等的种类并且按照和上述第二实施例相同的方式把光致氧化扩增情况予以指标化,将其和基准试料的光致氧化扩增情况指标比较,就能以高灵敏度更准确地把待测试料所含低浓度或微量生物标记物的浓度予以定量。
如前所述的本发明的利用光致氧化扩增效应的生物标记物高灵敏定量方法在标记于拟检测的生物标记物特异性抗体、适配体、核酸等的酶与底物反应后,对产物持续曝光进行光致氧化扩增过程。然后,把基于光致氧化扩增时间的产物显色量、发光量、荧光量之类的变化情况予以指标化并且将其和基准试料的指标比较,就能以高灵敏度更准确地把低浓度或微量生物标记物予以定量。
前文针对本发明之较佳实施例说明了本发明的技术特征,唯熟悉此项技术之人士当可在不脱离本发明之精神与原则下对本发明进行变更与修改,而该等变更与修改,皆应阐释为属于权利要求书所界定之范畴中。
- 还没有人留言评论。精彩留言会获得点赞!